Κιτρικό οξύ
| Κιτρικό Οξύ | |
|---|---|
| |
| Γενικά | |
| Όνομα | Κιτρικό Οξύ |
| Συνώνυμα | Β-υδρόξυ-τρικαρβαλλυλικό οξύ |
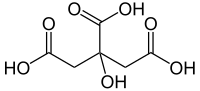
| Χημικός τύπος | C6H8O7 |
| SMILES | C(C(=O)O)C(CC(=O)O)(C (=O)O)O |
| Μοριακό βάρος | 192,12 g/mol |
| Εμφάνιση | Άχρωμοι ή λευκοί κρύσταλλοι |
| Αριθμός CAS | 77-92-9 |
| Αριθμός EC | 201-069-1 |
| Ιδιότητες | |
| Σημείο τήξης | 153 °C (426 K) |
| Σημείο βρασμού | Αποσυντίθεται στους 175 °C |
| Ειδικό βάρος | 1,665 |
| Διαλυτότητα στο νερό |
59,2 g / 100 ml (20 °C) |
| Οξύτητα (pKa) | 3,15 – 4,77 – 6,40 |
| Ασφάλεια | |
| Προσδιορισμός κινδύνων |
Ερεθιστικό για τα μάτια και το δέρμα |
| Σημείο ανάφλεξης | ?°C |
| Θερμοκρασία Αυτανάφλεξης |
?°C |
| Φράσεις R/S | R: 36,37,38 S: 26,37,39 |
| MSDS | Εξωτ. Σύνδεσμος MSDS |
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση εκτός αν σημειώνεται διαφορετικά | |
Το κιτρικό οξύ είναι ασθενές οργανικό τρικαρβοξυλικό οξύ. Είναι πολύ διαδεδομένο στο φυτικό βασίλειο, κυρίως στα λεμόνια και τα άλλα εσπεριδοειδή, το ακτινίδιο, τις φράουλες και πολλά άλλα φρούτα. Είναι εξαιρετικό φυσικό συντηρητικό, ενώ χρησιμοποιείται και ως ρυθμιστής οξύτητας και αρωματικό συστατικό. Είναι ενδιάμεσο ενός κύκλου μεταβολισμού των σακχάρων στους ζωντανούς οργανισμούς, μεγάλης βιολογικής σημασίας (κύκλος κιτρικού οξέος – κύκλος του Krebs), μέρος της διαδικασίας κατά την οποία οι ζωντανοί οργανισμοί μετατρέπουν την τροφή σε ενέργεια.
Ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Σε κανονικές συνθήκες είναι σε μορφή άχρωμης κρυσταλλικής σκόνης. Απαντάται είτε σε άνυδρη μορφή είτε σε ένυδρη, η οποία περιέχει ένα μόριο νερού για κάθε μόριο κιτρικού οξέος. Το άνυδρο κιτρικό οξύ κρυσταλλώνεται από διάλυμα με ζεστό νερό ενώ η ένυδρη μορφή από διάλυμα με κρύο νερό. Το τελευταίο μετατρέπεται στην άνυδρη μορφή με θέρμανση πάνω από τους 74 °C [1].
Διαλύεται εύκολα στο νερό, στην αλκοόλη και στον αιθέρα. Ανήκει στην οικογένεια των καρβοξυλικών οξέων και έχει τις χημικές ιδιότητες των καρβοξυλικών οξέων και των υδροξυενώσεων. Έχει σημείο τήξης 153 °C ενώ όταν θερμαίνεται πάνω από τους 175 °C αποσυντίθεται δίνοντας ως προϊόντα διοξείδιο του άνθρακα και νερό[2].
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η ανακάλυψη του κιτρικού οξέος αποδίδεται στον αλχημιστή Jabir Ibn Hayyan τον 8ο αιώνα [3]. Για πρώτη φορά απομονώθηκε το 1784 από τον Σουηδό χημικό Καρλ Βίλχελμ Σέελε (Carl Wilhelm Scheele) κατά τη διάρκεια ενός πειράματος με χυμό λεμονιού.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το κιτρικό οξύ παρασκευάζεται βιομηχανικά είτε από το χυμό των λεμονιών κατά την κατακρήμνιση με ανθρακικό ασβέστιο υπό μορφή αδιάλυτου κιτρικού ασβεστίου, είτε κυρίως κατά τη ζύμωση σακχάρων με ευρωτομύκητες ή κιτρομύκητες. Στη δεύτερη μέθοδο, το σάκχαρο υφίσταται ζύμωση μέχρι 50% προς κιτρικό οξύ. Στο φιλτραρισμένο αραιό διάλυμα κιτρικού οξέος προστίθεται υδροξείδιο του ασβεστίου οδηγώντας στην κατακρήμνιση αδιάλυτου κιτρικού ασβεστίου, το οποίο στη συνέχεια κατεργάζεται με θειικό οξύ για να δώσει κιτρικό οξύ και θειικό ασβέστιο ως παραπροϊόν [4].
Συνθετικά παρασκευάζεται από τη συμμετρική διχλωρο-ακετόνη με την παρακάτω πορεία [5]:

Στα βιολογικά συστήματα, το κιτρικό οξύ συντίθεται στην αρχή του κύκλου του Κρεμπς από το ένζυμο συνθάση του κιτρικού από το ακέτυλο-συνέζυμοΑ και το οξαλοξικό. Το ένζυμο αφαιρεί ένα πρωτόνιο από τη μεθυλική ομάδα του ακέτυλο-CoA. Το φορτισμένο αρνητικό CH2- που δημιουργήθηκε, συνδέεται με ένα άνθρακα της καρβονυλικής ομάδας του οξαλοξικού και το συνένζυμο Α απελευθερώνεται με υδρόλυση. Με την υδρόλυση απελευθερώνεται σημαντική ποσότητα ελεύθερης ενέργειας που προωθεί την αντίδραση.[6]
Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Το κιτρικό οξύ χρησιμοποιείται ως αρωματικό και συντηρητικό στις τροφές και τα ποτά, κυρίως τα μη αλκοολούχα (π.χ. λεμονάδες). Ως πρόσθετο τροφίμων επισημαίνεται με τον κωδικό Ε330.
Η ικανότητά του να σχηματίζει, χημικές ενώσεις με μέταλλα το καθιστά χρήσιμο σε σαπούνια και απορρυπαντικά πλυντηρίων. Ο λόγος είναι ότι με τη δράση του αυτή στο σκληρό νερό, αφήνει τα απορρυπαντικά ανεμπόδιστα να δράσουν χωρίς τη χρήση πρόσθετων αποσκληρυντικών. Επίσης χρησιμοποιείται στη βαφική και για την παρασκευή παραγώγων φαρμακολογικής σημασίας όπως ο κιτρικός σίδηρος, το μεθυλενοκιτρικό οξύ.
Τέλος, η ιδιότητα των τριών καρβοξυλικών ομάδων του να δίνουν πρωτόνια σε διάλυμα το καθιστά έναν εξαιρετικό ρυθμιστή του pH (buffer) σε όξινα διαλύματα. Επίσης χρησιμοποιείται στην οινοποίηση[7].
Τα τελευταία χρόνια, έρευνες έχουν αναδείξει τη σημασία του κιτρικού οξέος να συνεργεί με ενώσεις του φωσφόρου και του αργιλίου, για τη δημιουργία αντιπυρικών ενώσεων, κατάλληλων για υφάσματα και βαμβακερά[8][9], καθώς και για πολυμερή. Πρόσθετα, το κιτρικό οξύ είναι μια εξαιρετική χηλική ένωση.[10]
Κίνδυνοι για την υγεία
[Επεξεργασία | επεξεργασία κώδικα]Το κιτρικό οξύ θεωρείται ασφαλές για χρήση στα τρόφιμα και δεν είναι καρκινογόνο. Είναι κανονικό συστατικό των κυττάρων, αποικοδομείται και χρησιμοποιείται από το σώμα χωρίς παρενέργειες. Έχουν αναφερθεί ψευδοαλλεργικές αντιδράσεις (δυσανεξία), αλλά είναι σπάνιες[11] .
Επαφή με σκόνη κιτρικού οξέος ή πυκνού διαλύματος αυτού μπορεί να έχει σαν αποτέλεσμα ερεθισμό των ματιών και του δέρματος. Γι' αυτό το λόγο κατά τη διαχείρισή του είναι απαραίτητη η χρήση κατάλληλης προστατευτικής ενδυμασίας, γαντιών και προστατευτικών γυαλιών.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «Chemicalland21.com». Αρχειοθετήθηκε από το πρωτότυπο στις 15 Ιανουαρίου 2006. Ανακτήθηκε στις 12 Ιουνίου 2006.
- ↑ Ηλεκτρονική Εγκυκλοπαίδεια “Επιστήμη & Ζωή”
- ↑ «Jabir Ibn Haiyan». Αρχειοθετήθηκε από το πρωτότυπο στις 3 Ιουλίου 2006. Ανακτήθηκε στις 12 Ιουνίου 2006.
- ↑ «OECD SIDS documents published by UNEP Chemicals» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 11 Δεκεμβρίου 2006. Ανακτήθηκε στις 12 Ιουνίου 2006.
- ↑ 1.Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Άκυκλες Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- ↑ J. M. Berg· J. L. Tymoczko· G. J. Gatto· L. Stryer (2015). Βιοχημεία. Πανεπιστημιακές Εκδόσεις Κρήτης. σελ. 684.[νεκρός σύνδεσμος]
- ↑ «Κιτρικό Οξύ Άνυδρο». Scienceshop.gr. 31 Ιανουαρίου 2018.
- ↑ https://www.tandfonline.com/doi/abs/10.1080/15440478.2019.1710648?needAccess=true&journalCode=wjnf20
- ↑ https://onlinelibrary.wiley.com/doi/abs/10.1002/app.45315
- ↑ https://www.sciencedirect.com/science/article/abs/pii/025405849390061P
- ↑ Μία σελίδα με πληροφορίες για τα πρόσθετα τροφίμων
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]
| |||||||||||||||||||||||||||||||||||||||||||||||
|


