Κροτονικό οξύ
| Κροτονικό οξύ | |
|---|---|

| |

| |
| Γενικά | |
| Όνομα IUPAC | Κροτονικό οξύ[1] |
| Άλλες ονομασίες | 2-βουτενικό οξύ β-μεθυλακρυλικο οξύ |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C4H6O2 |
| Μοριακή μάζα | 86,09 amu |
| Σύντομος συντακτικός τύπος |
CH3CH=CHCOOH |
| Συντομογραφίες | MeCH=CHCOOH |
| Αριθμός CAS | 107-93-7 |
| SMILES | CC=CC(=O)O |
| InChI | 1/C4H6O2/c1-2-3-4(5)6/h2-3H,1H3,(H,5,6) |
| PubChem CID | 637090 |
| ChemSpider ID | 552744 |
| Ισομέρεια | |
| Ισομερή θέσης | >95 |
| Γεωμετρικά ισομερή | 2 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 70-73 °C |
| Σημείο βρασμού | 185-1891 °C |
| Πυκνότητα | 1020 kg/m3 |
| Χημικές ιδιότητες | |
| pKa | 4,69 |
| Ελάχιστη θερμοκρασία ανάφλεξης |
85,56 °C |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Το κροτονικό οξύ[2] (αγγλικά crotonic acid) είναι οργανική χημική ένωση με μοριακό τύπο C4H6O2, αν και συνηθέστερα παριστάνεται με τον ημισυντακτικό του τύπο, E-CH3CH=CHCO2H. Έχει ένα γεωμετρικό ισομερές, το ισοκροτονικό οξύ, που αποτελεί το Z-2-βουτενικό οξύ. Η ονομασία «κροτονικό οξύ» προέρχεται από το κροτονέλαιο, επειδή πιστεύονταν (εσφαλμένα) ότι αποτελεί προϊόν σαπωνοποίησής του. Όταν χρειάζεται, (ανα)κρυσταλλώνεται από θερμό νερό.
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ έχει ένα γεωμετρικό ισομερές, καθώς και πολλά ισομερή θέσης, από τα οποία τα σημαντικότερα είναι τα ακόλουθα:
- 2-βουτιν-1,4-διόλη, με ημισυντακτικό τύπο HOCH2C≡CCH2OH.
- γ-βουτυρολακτόνη, με γραμμικό τύπο
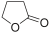 .
. - Ισοκροτονικό οξύ, με ημισυντακτικό τύπο Ζ-CH3CH=CHCOOH.
- Βουτανοδιόνη, με ημισυντακτικό τύπο CH3COCOCH3.
- Δι(οξιράνιο), με γραμμικό τύπο
 .
. - 1,4-διοξένιο, με γραμμικό τύπο
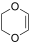 .
. - Μεθυλοπροπενικό οξύ, με ημισυντακτικό τύπο CH2=C(CH3)COOH.
- Προπενικός μεθυλεστέρας, με ημισυντακτικό τύπο CH2=CHCOOCH3.
- Βουτανοδιάλη, με ημισυντακτικό τύπο HCOCH2CH2CHO.
- Αιθανικός βινυλεστέρας, με ημισυντακτικό τύπο CH3COOCH=CH2.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Είναι ένα μέλος της ομόλογης σειράς των αλκενικών οξέων, δηλαδή των αλειφατικών μονοκαρβοξυλικών οξέων με ένα διπλό δεσμό. Ο διπλός δεσμός του κροτονικού οξέος βρίσκεται σε συζυγή θέση (δηλαδή με έναν απλό δεσμό ενδιάμεσα) με εκείνον του καρβονυλίου του καρβοξυλίου του.
| Δεσμοί[3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#4-H | σ | 2sp2-1s | 109 pm | 3% C- H+ |
| C#2,#3-H | σ | 2sp2-1s | 106 pm | 3% C- H+ |
| C#4-C#3 | σ | 2sp3-2sp2 | 151 pm | |
| C#3=C#2 | σ | 2sp2-2sp2 | 134 pm | |
| π | 2p-2p | |||
| C#2-C#1 | σ | 2sp2-2sp2 | 147 pm | |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Γωνίες | ||||
| HC#2,#3H | 120° | |||
| HC#2C#3 | 120° | |||
| CCO | 120° | |||
| COO | 120° | |||
| OCO | 120° | |||
| COH | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[4] | ||||
| Ο (OH) | -0,51 | |||
| Ο (=O) | -0.38 | |||
| C#4 | -0,09 | |||
| C#2,#3 | -0,03 | |||
| Η (HC) | +0,03 | |||
| Η (OH) | +0,32 | |||
| C#1 | +0,57 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ μπορεί να ληφθεί με αρκετές μεθόδους, μερικές από τις οποίες είναι οι ακόλουθες:
Με οξείδωση Ε-2-βουτενάλης
[Επεξεργασία | επεξεργασία κώδικα]Με οξείδωση Ε-2-βουτενάλης παράγεται κροτονικό οξύ:[5]
Με συμπύκνωση αιθανάλης και μαλονικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]Με συμπύκνωση αιθανάλης και μαλονικού οξέος, με τη χρήση πυριδίνης (Py) ως διαλύτη, παράγεται κροτονικό οξύ:[6]
Με υδρόλυση 3-βουτενυλονιτριλίου
[Επεξεργασία | επεξεργασία κώδικα]Με αλκαλική υδρόλυση 3-βουτενυλονιτριλίου παράγεται κροτονικό οξύ, μετά από ενδιάμεση μετάθεση του διπλού δεσμού:[7][8]
Με αφυδάτωση 3-υδροξυβουτανικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]Με αφυδάτωση 3-υδροξυβουτανικού οξέος, που πραγματοποιειται με απλή απόσταξη του τελευταίου, παράγεται κροτονικό οξύ:[9]
Κρυσταλλογραφικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ κρυσταλλώνεται στο μονοκλινές κρυσταλλικό σύστημα, στην ομάδα διαστήματος P21/a (ομάδα διαστήματος 14, θέση 3) με παραμέτρους πλέγματος a = 971 pm, b = 690 pm, c = 775 pm και β = 104.0°. Η μονάδα κελιού περιέχει τύπο 4 μονάδων.[10]
Αντιδράσεις και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Υδρογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ μετατρέπεται σε βουτυρικό οξύ με υδρογόνωση, για παράδειγμα με αναγωγή με ψευδάργυρο και θειικό οξύ:[11]
Αλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ, μετά από αλογόνωση με χλώριο ή βρώμιο, μετατρέπεται σε 2,3-διαλοβουτανικό οξύ:[11]
Υδραλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ, μετά από υδραλογόνωση με υδροβρώμιο, μετατρέπεται σε 3-βρωμοβουτανικό οξύ:[11][12]
Υδροξυαλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ, μετά από υδροξυαλογόνωση με υποχλωριώδες οξύ, μετατρέπεται σε 3-υδροξυ-2-χλωροβουτανικό οξύ:[13]
Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ μπορεί να οξειδωθεί με αλκαλικό διάλυμα υπερμαγγανικού καλίου, σχηματίζοντας 2,3-διυδροξυβουτανικό οξύ:[11]
Εστεροποίηση
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ, μετά από εστεροποίηση με κάποια αλκοόλη (ROH), σχηματίζει τον αντίστοιχο κροτονικό αλκυλεστέρα:[13]
Ανυδρίτης
[Επεξεργασία | επεξεργασία κώδικα]Το κροτονικό οξύ, μετά από συνθέρμανση με οξικό ανυδρίτη [(CH3CO)2O], σχηματίζει κροτονικό ανυδρίτη:[14]
Θρεονίνη
[Επεξεργασία | επεξεργασία κώδικα]Η ρακεμεική (DL-)θρεονίνη μπορεί να παραχθεί από το ρακεμεικό κροτονικό οξύ με α-ενεργοποίηση, χρησιμοποιώντας αμμωνία και οξικό υδράργυρο[15]
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Σε μέρος της βιβλιογραφίας έτσι αναφέρεται μόνο το trans- ισομερές. Σε ένα άλλο μέρος ο όρος γενικεύεται και για το βουτεν-3-ικό οξύ, με αποτέλεσμα να χρησιμοποιούνται τα προθέματα α- και β- για το διαχωρισμό.
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Τα δεδομένα προέρχονταιεν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart 1984, (ISBN 3-7776-0406-2), S. 230.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart 1984, (ISBN 3-7776-0406-2), S. 229–230.
- ↑ A. Rinne, B. Tollens: "Ueber das Allylcyanür oder Crotonitril", in: Justus Liebigs Annalen der Chemie, 1871, 159 (1), S. 105–109; .
- ↑ C. Pomeranz: "Ueber Allylcyanid und Allylsenföl", in: Justus Liebigs Annalen der Chemie, 1906, 351, S. 354–362; .
- ↑ F. Beilstein: "Handbuch der organischen Chemie", 3. Auflage, 1. Band. Verlag Leopold Voss, 1893. S. 506 (Volltext).
- ↑ Shimizu, S.; Kekka, S.; Kashino, S.; Haisa, M. (1974). «Topochemical Studies. III. The Crystal and Molecular Structures of Crotonic Acid, CH3CH=CHCO2H, and Crotonamide, CH3CH=CHCONH2». Bulletin of the Chemical Society of Japan 47 (7): 1627–1631. doi:. https://archive.org/details/sim_bulletin-of-the-chemical-society-of-japan_1974-07_47_7/page/1627.
- ↑ 11,0 11,1 11,2 11,3 Heilbron (1953). «Crotonic acid». Dictionary of Organic Compounds 1: 615. https://archive.org/stream/dictionaryoforga011095mbp#page/n633/mode/2up.
- ↑ Lovén, J. M.; Johansson, H. (1915). «Einige schwefelhaltige β-Substitutionsderivate der Buttersäure». Berichte der deutschen chemischen Gesellschaft 48 (2): 1254–1262. doi:. https://zenodo.org/record/1426589.
- ↑ 13,0 13,1 Beilstein, F. (1893). Handbuch der organischen Chemie (στα Γερμανικά). 1 (3rd έκδοση). Verlag Leopold Voss. σελ. 562.
- ↑ Clover, A. M.; Richmond, G. F. (1903). «The Hydrolysis of Organic Peroxides and Peracids». American Chemical Journal 29 (3): 179–203. https://archive.org/stream/americanchemical291903balt#page/178/mode/2up.
- ↑ Carter, H. E.; West, H. D. (1955), "dl-Threonine", Org. Synth.; Coll. Vol. 3: 813


![{\displaystyle \mathrm {CH_{3}CHO+HOCOCH_{2}CO_{2}H{\xrightarrow[{-H_{2}O}]{Py}}HOCOC(=CHCH_{3})CO_{2}H\xrightarrow {\triangle } CH_{3}CH=CHCO_{2}H+CO_{2}\uparrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/89c08124aebadf766fe173cb80759cbd8a697778)






![{\displaystyle \mathrm {CH_{3}CH=CHCO_{2}H+2|O|{\xrightarrow[{OH^{-}}]{KMnO_{4}}}CH_{3}CH(OH)CH(OH)CO_{2}H} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/26141c572b7993a12ed8c0db42dbea94f46d893e)


