Ιρίδιο: Διαφορά μεταξύ των αναθεωρήσεων
| Γραμμή 506: | Γραμμή 506: | ||
[[Αρχείο:Iridium pellet.jpg|thumb|150px|8.3 g ιριδίου καθαρότητας 99,98 %]] |
[[Αρχείο:Iridium pellet.jpg|thumb|150px|8.3 g ιριδίου καθαρότητας 99,98 %]] |
||
[[Αρχείο:Iridium foil.jpg|thumb|150px|Λεπτά φύλλα ιριδίου]] |
[[Αρχείο:Iridium foil.jpg|thumb|150px|Λεπτά φύλλα ιριδίου]] |
||
Το ιρίδιο, επειδή αντέχει σε θερμοκρασίες λειτουργίας μέχρι 2000°C, έχει χρησιμοποιηθεί για να εμπλουτίσει το [[καύσιμα|καύσιμο]] πλουτωνίου-238 στις θερμοηλεκτρικές γεννήτριες ραδιοϊσοτόπων μη επανδρωμένων διαστημικών οχημάτων, όπως τα Voyager, Viking, Pioneer, Cassini, Galileo και New Horizons. |
Το ιρίδιο, επειδή αντέχει σε θερμοκρασίες λειτουργίας μέχρι 2000°C, έχει χρησιμοποιηθεί για να εμπλουτίσει το [[καύσιμα|καύσιμο]] πλουτωνίου-238 στις θερμοηλεκτρικές γεννήτριες ραδιοϊσοτόπων μη επανδρωμένων διαστημικών οχημάτων, όπως τα Voyager, Viking, Pioneer, Cassini, Galileo και New Horizons<ref name="hunt"></ref>. |
||
Μια άλλη χρήση του ιριδίου είναι στην [[οπτική]] των [[ακτίνες-Χ|ακτίνων-Χ]] και ειδικότερα σε [[τηλεσκόπιο|τηλεσκόπια]] ακτίνων-Χ. Τα κάτοπτρα του παρατηρητηρίου ακτίνων-Χ Chandra, έχουν επικάλυψη με ένα στρώμα ιριδίου πάχους 60 nm (δισεκατομμυριοστά του μέτρου). Το ιρίδιο αποδείχθηκε ότι είναι η καλύτερη επιλογή για την [[ανάκλαση]] των ακτίνων-Χ μετά από δοκιμές που έγιναν στο [[νικέλιο]], στο [[Χρυσός|χρυσό]] και στο λευκόχρυσο. Το στρώμα ιριδίου, που έπρεπε να έχει πάχος λίγων ατόμων, δημιουργήθηκε με την εναπόθεση ατμών ιριδίου πάνω σε στρώμα βάσης από [[χρώμιο]] σε συνθήκες υψηλού κενού. |
Μια άλλη χρήση του ιριδίου είναι στην [[οπτική]] των [[ακτίνες-Χ|ακτίνων-Χ]] και ειδικότερα σε [[τηλεσκόπιο|τηλεσκόπια]] ακτίνων-Χ. Τα κάτοπτρα του παρατηρητηρίου ακτίνων-Χ Chandra, έχουν επικάλυψη με ένα στρώμα ιριδίου πάχους 60 nm (δισεκατομμυριοστά του μέτρου). Το ιρίδιο αποδείχθηκε ότι είναι η καλύτερη επιλογή για την [[ανάκλαση]] των ακτίνων-Χ μετά από δοκιμές που έγιναν στο [[νικέλιο]], στο [[Χρυσός|χρυσό]] και στο λευκόχρυσο. Το στρώμα ιριδίου, που έπρεπε να έχει πάχος λίγων ατόμων, δημιουργήθηκε με την εναπόθεση ατμών ιριδίου πάνω σε στρώμα βάσης από [[χρώμιο]] σε συνθήκες υψηλού κενού<ref>{{cite web|title=Face-to-Face with Jerry Johnston, CXC Program Manager & Bob Hahn, Chief Engineer at Optical Coating Laboratories, Inc., Santa Rosa, CA|publisher=Harvard-Smithsonian Center for Astrophysics; Chandra X-ray Center|url=http://chandra.harvard.edu/press/bios/johnston.html|accessdate=2008-09-24|year=1995}}</ref>. |
||
Το ιρίδιο χρησιμοποιείται στη σωματιδιακή φυσική για την παραγωγή αντιπρωτονίων, μιας μορφής αντιύλης. Αντιπρωτόνια παράγονται όταν μια δέσμη [[πρωτόνιο|πρωτονίων]] υψηλής ενέργειας προσπέσει σε έναν στόχο, κατασκευασμένο από υλικό πολύ μεγάλης [[πυκνότητα]]ς. Παρόλο που για την κατασκευή του στόχου μπορεί να χρησιμοποιηθεί [[βολφράμιο]], το ιρίδιο έχει το πλεονέκτημα της μεγαλύτερης σταθερότητας μετά την αύξηση της θερμοκρασίας που παρατηρείται λόγω της προσπίπτουσας δέσμης πρωτονίων. |
Το ιρίδιο χρησιμοποιείται στη σωματιδιακή φυσική για την παραγωγή αντιπρωτονίων, μιας μορφής αντιύλης. Αντιπρωτόνια παράγονται όταν μια δέσμη [[πρωτόνιο|πρωτονίων]] υψηλής ενέργειας προσπέσει σε έναν στόχο, κατασκευασμένο από υλικό πολύ μεγάλης [[πυκνότητα]]ς. Παρόλο που για την κατασκευή του στόχου μπορεί να χρησιμοποιηθεί [[βολφράμιο]], το ιρίδιο έχει το πλεονέκτημα της μεγαλύτερης σταθερότητας μετά την αύξηση της θερμοκρασίας που παρατηρείται λόγω της προσπίπτουσας δέσμης πρωτονίων<ref>{{cite journal|title = Production of low-energy antiprotons| journal =Zeitschrift Hyperfine Interactions| volume =109| year = 1997|doi = 10.1023/A:1012680728257| pages = 33–41| first = D.| last =Möhl}}</ref>. |
||
Οργανομεταλλικές ενώσεις ιριδίου χρησιμοποιήθηκαν με επιτυχία για πρώτη φορά το 1982 στην ενεργοποίηση και διάσπαση [[χημικός δεσμός|δεσμών]] άνθρακα-υδρογόνου σε [[αλκάνια|κορεσμένους υδρογονάνθρακες]]. Οι δεσμοί C-H είναι ιδιαίτερα ισχυροί και ανθεκτικοί στη διάσπαση, γιαυτό και τα αλκάνια θεωρούνται γενικά αδρανείς ενώσεις. |
Οργανομεταλλικές ενώσεις ιριδίου χρησιμοποιήθηκαν με επιτυχία για πρώτη φορά το 1982 στην ενεργοποίηση και διάσπαση [[χημικός δεσμός|δεσμών]] άνθρακα-υδρογόνου σε [[αλκάνια|κορεσμένους υδρογονάνθρακες]]. Οι δεσμοί C-H είναι ιδιαίτερα ισχυροί και ανθεκτικοί στη διάσπαση, γιαυτό και τα αλκάνια θεωρούνται γενικά αδρανείς ενώσεις<ref>Morrison R. T., Boyd R. N. "Οργανική Χημεία" Τόμοι 1ος, 2ος, 3ος Μετάφραση:Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991</ref>. |
||
Σύμπλοκα του ιριδίου χρησιμοποιούνται ως καταλύτες σε ασύμμετρες υδρογονώσεις<ref>{{cite journal|doi=10.1002/chem.200500755|year=2006|author=Källström, K; Munslow, I; Andersson, P. G.|title=Ir-catalysed asymmetric hydrogenation: Ligands, substrates and mechanism|volume=12|issue=12|pages=3194–3200|pmid=16304642|journal=Chemistry – A European Journal}}</ref>. Αυτοί οι καταλύτες χρησιμοποιούνται στη σύνθεση φυσικών προϊόντων επειδή έχουν την ικανότητα να επιτυγχάνουν υδρογονώσεις ορισμένων δύσκολων υποστρωμάτων, όπως είναι τα ασύμμετρα [[αλκένια]] και να δημιουργούν μια μόνο από τις δύο πιθανές εναντιομερείς μορφές. Είναι δηλ. καταλύτες απόλυτα στερεοεκλεκτικοί. |
|||
==Σημειώσεις== |
==Σημειώσεις== |
||
Έκδοση από την 18:54, 28 Απριλίου 2010
| Ιρίδιο | |
|---|---|
 | |
 | |
| Ταυτότητα του στοιχείου | |
| Όνομα, Σύμβολο, Ατομικός αριθμός |
Ιρίδιο, Ir 77 |
| Κατηγορία | στοιχείο μετάπτωσης |
| Ομάδα, Περίοδος, block | 9, 6, d |
| Σχετική ατομική μάζα (Ar) | 192,217 (g/mol) |
| Φυσική κατάσταση - Εμφάνιση | ασημόχρωμο στερεό |
| Ηλεκτρονική διαμόρφωση | [Xe] 64f145d76s2 |
| EINECS numb. | 231-095-9 |
| CAS numb. | 7439-88-5 |
| Ατομικές ιδιότητες | |
| Ατομική ακτίνα | 136 pm |
| Ομοιοπολική ακτίνα | 141±6 pm |
| Ηλεκτραρνητικότητα (Pauling) | 2,20 |
| Αριθμοί οξείδωσης | -3,-1, 0, 1, 2, 3, 4, 5, 6 |
| Ενέργειες ιονισμού | 1η: 880 kJ/mol |
| 2η: 1600 ΚJ/mol | |
| Φυσικά χαρακτηριστικά | |
| Κρυσταλλικό σύστημα πλέγμα |
κυβικό ολοεδρικά κεντρωμένο |
| Σημείο τήξης | 2466°C (4471°F) (2739 K) |
| Σημείο βρασμού | 4428°C (8002°F) (4701 K) |
| Πυκνότητα | 22,56 g/cm3 |
| Ενθαλπία τήξης | 41,12 KJ/mol |
| Ενθαλπία εξάτμισης | 563 KJ/mol |
| Ειδική θερμότητα | 25,10 J/mol·K |
| Μαγνητική συμπεριφορά | παραμαγνητικό |
| Ειδική Ηλεκτρική αντίσταση | 47,1 nΩ·m |
| Ειδική Ηλεκτρική αγωγιμότητα | 21,23 MS/m |
| Ειδική Θερμική αγωγιμότητα | (27°C) 147 W/(m K) |
| Σκληρότητα Mohs | 6,5 |
| Σκληρότητα Vickers | 1760 MPa |
| Σκληρότητα Brinell | 1670 MPa |
| Μέτρο ελαστικότητας (Young) (Ε) | 528 GPa |
| Μέτρο ολίσθησης (ή στρέψης) (G) | 210 GPa |
| Μέτρο ελαστικότητας όγκου (Κ) | 320 GPa |
| Λόγος Poisson (ν) | 0,26 |
| Ταχύτητα του ήχου | (20°C) 4825 m/s |
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |
Το χημικό στοιχείο ιρίδιο (αγγλικά : iridium) είναι μέταλλο με ατομικό αριθμό 77 και σχετική ατομική μάζα 192,217. Το χημικό του σύμβολο είναι "Ir" και ανήκει στην ομάδα 9 του περιοδικού πίνακα, στην περίοδο 6 και στο d-block. Έχει θερμοκρασία τήξης 2466°C και θερμοκρασία βρασμού 4428°C[1].
Πήρε το όνομά του από τα έντονα χρώματα που είχαν τα άλατά του, σε συνδυασμό και με την Ίριδα, τη θεά του ουράνιου τόξου των αρχαίων Ελλήνων.
Από άποψη ομοιότητας χημικής συμπεριφοράς, ανήκει στην "ομάδα του λευκόχρυσου" (ομάδα των PGMs Platinum Group Metals)[Σημ. 1], μαζί με τα συγγενή του στοιχεία ρόδιο (Rh)(που ανήκει επίσης στην Ομάδα 9), ρουθήνιο (Ru) και όσμιο (Os) (που ανήκουν στην Ομάδα 8) και λευκόχρυσο (Pt) και παλλάδιο (Pd) (που ανήκουν στην ομάδα 10).
Το ιρίδιο θεωρείται ευγενές μέταλλο μαζί με το ρουθήνιο, το ρόδιο, το παλλάδιο, τον άργυρο, το όσμιο, το λευκόχρυσο και το χρυσό.
Ανακαλύφθηκε το 1803 στο Λονδίνο από τον Άγγλο χημικό Τένναντ στα αδιάλυτα κατάλοιπα της κατεργασίας του λευκόχρυσου.
Τα μεγαλύτερα αποθέματά του βρίσκονται στη Νότια Αφρική, στη Ρωσία, και στον Καναδά. Μικρότερα αποθέματα βρίσκονται στις Ηνωμένες Πολιτείες.
Αν και είναι ένα από τα σπανιότερα στοιχεία του φλοιού της Γης, με ετήσια παραγωγή και κατανάλωση μόνο τρεις τόνους, παρουσιάζει ως μέταλλο εξαιρετικό ενδιαφέρον εξαιτίας των μηχανικών ιδιοτήτων του. Έτσι, χρησιμοποιείται ευρύτατα στην κατασκευή σκευών ανθεκτικών στις ψηλές θερμοκρασίες και στη διάβρωση όπως είναι τα μπουζί, τα πρότυπα μέτρα και σταθμά, τα χωνευτήρια, τα ηλεκτρόδια και στις θερμοηλεκτρικές γεννήτριες ραδιοϊσοτόπων σε μη επανδρωμένα διαστημόπλοια.
Οι πιο σημαντικές ενώσεις του ιριδίου είναι τα άλατά του με χλώριο και οι οργανομεταλλικές ενώσεις που χρησιμοποιούνται στους καταλύτες των οργανικών αντιδράσεων.
Ιρίδιο έχει βρεθεί και σε μετεωρίτες και μάλιστα σε περιεκτικότητα πολύ υψηλότερη από τον μέσο όρο της λιθόσφαιρας. Υπάρχει η σκέψη ότι το ποσό του ιριδίου σ' ολόκληρο τον πλανήτη είναι πολύ υψηλότερο από αυτό που παρατηρείται στη λιθόσφαιρα, αλλά λόγω της υψηλής πυκνότητας και του σιδηρόφιλου[Σημ. 2] χαρακτήρα του, το περισσότερο ιρίδιο κατέβηκε κάτω από το φλοιό και μέσα στον πυρήνα της Γης, όταν ο πλανήτης ήταν ακόμα νεαρής ηλικίας και δεν είχε στερεοποιηθεί πλήρως. Ασυνήθιστα μεγάλη περιεκτικότητα σε ιρίδιο έχει βρεθεί στο γεωλογικό "όριο Κ-Τ". Αυτή η ανακάλυψη αποτελεί ισχυρή ένδειξη της θεωρίας που υποστηρίζει ότι η εξαφάνιση των δεινοσαύρων πριν 65 εκατομμύρια χρόνια προκλήθηκε από την πτώση μεγάλου μετεωρίτη.
Το ιρίδιο έχει δύο σταθερά ισότοπα, το 191Ir και το 193Ir.
Ιστορία
Η ανακάλυψη του ιριδίου είναι συνυφασμένη με αυτήν του λευκόχρυσου και των άλλων PGMs. Κράματα μετάλλων της ομάδας του λευκόχρυσου ήταν ήδη γνωστά από το 700 π.Χ. Ισπανοί κατακτητές της Νότιας Αμερικής[2], το 17ο αιώνα έφεραν το αδιαχώριστο μίγμα των PGMs στην Ευρώπη με το όνομα "πλατίνα", που σημαίνει "μικρό ασήμι".
Όταν το 19ο αιώνα Ευρωπαίοι χημικοί που μελετούσαν την πλατίνα, τη διέλυσαν σε βασιλικό νερό για να φτιάξουν ευδιάλυτα άλατα, παρατήρησαν ότι έμενε πάντα μια μικρή ποσότητα από ένα σκούρο, αδιάλυτο υπόλειμμα[3]. Ο Ζοζέφ Προυστ (Joseph Louis Proust) to 1801 συμπέρανε ότι το υπόλειμμα αυτό ήταν γραφίτης. Το 1803, οι Γάλλοι χημικοί Βικτόρ Κολέ-Ντεκοτίλ (Victor Collet-Descotils), Αντουάν Φρανσουά (Antoine Franc,ois) και Λουί Νικολά Βωκλέν (Louis Nicolas Vauquelin) παρατήρησαν επίσης το μαύρο υπόλειμμα αλλά δεν συνέχισαν τα πειράματα[3]
Την ίδια χρονιά, ο Άγγλος χημικός Σμίθσον Τένναντ[Σημ. 3] (Smithson Tennant) ανέλυσε το μαύρο αδιάλυτο υπόλειμμα και κατέληξε στο συμπέρασμα ότι θα πρέπει να περιέχει ένα νέο μέταλλο. Ταυτόχρονα και ανεξάρτητα, ο Βωκλέν κατεργάστηκε τη μαύρη σκόνη με αλκάλια και οξέα[4] και πήρε ένα νέο πτητικό οξείδιο που νόμισε ότι αποτελούνταν από το νέο μέταλλο. Το ονόμασε μάλιστα ptene από την Ελληνική λέξη "πτηνό" (πτερωτό)[5]. Ο Τένναντ όμως που διέθετε μεγαλύτερη ποσότητα υπολείμματος, συνέχισε τις έρευνες. Με μια σειρά αντιδράσεων, απομόνωσε σκούρους κόκκινους κρυστάλλους (πιθανόν του τύπου Na2[IrCl6]·nH2O)[5] από τους οποίους με θέρμανση απομόνωσε μια πολύ δύστηκτη λευκή σκόνη[Σημ. 4] η οποία έπαιρνε διάφορα εντυπωσιακά χρώματα όταν διαλυόταν σε υδροχλωρικό οξύ.

Έδωσε στο νέο στοιχείο το όνομα "ιρίδιο" εξαιτίας των έντονων χρωμάτων που είχαν τα άλατα του μετάλλου και από την Ίριδα που ήταν η ιπτάμενη θεά του ουράνιου τόξου των Αρχαίων Ελλήνων. Ο Τένναντ ανακάλυψε ταυτόχρονα και το στοιχείο όσμιο στο ίδιο μαύρο κατάλοιπο της επεξεργασίας του λευκόχρυσου. Η ανακάλυψη των νέων στοιχείων δημοσιεύθηκε στις 21 Ιουνίου 1804[3]. Το σύμβολο για το νέο στοιχείο που πρότεινε ο Μπερζέλιους (Berzelius) ήταν Ι που άλλαξε αργότερα σε Ir.
Ο πρώτος που έλιωσε δείγμα ιριδίου ήταν ο Βρετανός χημικός, ορυκτολόγος και ζωολόγος Τζον Τζώρτζ Τσίλντρεν (John George Children) το 1813. Για το σκοπό αυτό, χρησιμοποίησε "τη μεγαλύτερη γαλβανική μπαταρία που είχε ποτέ κατασκευαστεί"[3] (μέχρι τότε).
Το 1842, ο Αμερικανός χημικός Ρόμπερτ Έιρ (Robert Hare) παρασκεύασε για πρώτη φορά ιρίδιο υψηλής καθαρότητας[6], υπολόγισε ότι η πυκνότητά του ήταν περίπου 21.8 g/cm3 και σημείωσε ότι επρόκειτο για μέταλλο, που ήταν σχεδόν αδύνατο να κατεργαστεί.
Η πρώτη τήξη σημαντικής ποσότητας ιριδίου, έγινε από τους Γάλλους χημικούς Ανρί Σαιντ-Κλαιρ Ντεβίλ (Henri Sainte-Claire Deville) και Ζυλ Ανρί Ντεμπρέ (Jules Henri Debray) το 1860. Αυτοί χρησιμοποίησαν για την τήξη πάνω από 300 L καθαρού οξυγόνου και υδρογόνου ανά κιλό ιριδίου[3].
Ο Άγγλος εφευρέτης Τζον Άϊζακ Χώκινς (John Isaac Hawkins) κατάφερε, παρά τις δυσκολίες κατεργασίας και χειρισμού του ιριδίου, να κατασκευάσει το 1834 ένα χρυσό στυλό με μύτη από ιρίδιο.
Το 1880, οι Αμερικανοί χημικοί Τζον Χόλλαντ (John Holland) και Ουίλλιαμ Λόφλαντ Ντάντλεϋ (William Lofland Dudley) κατοχύρωσαν ευρεσιτεχνία στην οποία περιέγραφαν την τεχνική τήξης ιριδίου με προσθήκη φωσφόρου. Αργότερα η Βρετανική χημική βιομηχανία Johnson Matthey υποστήριξε ότι χρησιμοποιούσε την ίδια τεχνική ήδη από το 1837[3].
Το 1889, κατασκευάστηκαν από κράμα 90 % λευκόχρυσου και 10 % ιριδίου τα πρότυπα μήκους και μάζας που σήμερα φυλάσσονται στο Διεθνές Γραφείο Μέτρων και Σταθμών κοντά στο Παρίσι.
Η πρώτη χρήση κράματος ιριδίου με ρουθήνιο σε θερμοστοιχεία[3], για τη μέτρηση θερμοκρασιών στον αέρα έως 2000°C, έγινε από τον Όττο Φόϋσσνερ (Otto Feussner) το 1933.
Το 1958 ο Γερμανός Ρούντολφ Μέσμπαουερ (Rudolf Ludwig Mössbauer)[7][Σημ. 5] ανακάλυψε την ελεύθερη ανάκρουση, εκπομπή και απορρόφηση των ακτίνων γ από άτομα σε στερεό δείγμα μετάλλου αποτελούμενο μόνο από 191Ir. Το φαινόμενο αυτό, που παρατηρείται και σε άλλους πυρήνες όπως είναι ο 57Fe, γνωστό ως "φαινόμενο Mössbauer" αξιοποιήθηκε στη "φασματοσκοπία Mössbauer" η οποία χρησιμοποιείται σήμερα ευρύτατα στη φυσική, στη χημεία, στη βιοχημεία, στη μεταλλουργία και στην ορυκτολογία.
Εμφανίσεις - Εξόρυξη - Απομόνωση του μετάλλου
Εμφανίσεις

Το ιρίδιο είναι από τα σπανιότερα χημικά στοιχεία στο φλοιό της Γης. Ο χρυσός είναι 4 φορές πιο άφθονος, ο λευκόχρυσος 10 φορές και ο άργυρος και ο υδράργυρος 80 φορές[8]. Το τελλούριο είναι περίπου όσο και το ιρίδιο, ενώ μόνο τρία φυσικά στοιχεία είναι πιo σπάνια: το ρήνιο, το ρουθήνιο και το ρόδιο. Το ιρίδιο βρίσκεται στους μετεωρίτες σε συγκεντρώσεις μέχρι και 1400 φορές μεγαλύτερες από τη λιθόσφαιρα[9]. Εκτιμάται ότι η συνολική συγκέντρωση του ιριδίου στη Γη είναι πολύ υψηλότερη από αυτή που παρατηρείται στους επιφανειακούς βράχους, αλλά λόγω της πυκνότητας και του σιδηρόφιλου χαρακτήρα του, κατέβηκε κάτω από τη λιθόσφαιρα προς τον πυρήνα της Γης, όταν ο πλανήτης ακόμα δεν είχε στερεοποιηθεί.
Το ιρίδιο βρίσκεται στη φύση ως ελεύθερο στοιχείο ή σε φυσικά κράματα, ιδιαίτερα μαζί με το στοιχείο όσμιο: το οσμιρίδιο (με περίπου 50 % ιρίδιο) και το ιριδόσμιο (με περίπου 70 % ιρίδιο)[10].
Τα "μέταλλα της ομάδας του λευκόχρυσου, PGMs" έχουν παρόμοια γεωχημική συμπεριφορά και έχουν τη τάση να συγκεντρώνονται μαζί στη φύση. Εμφανίζονται ως κράματα ή ενώσεις στις αποθέσεις μεταλλοφόρων κοιτασμάτων, που συνδέονται μερικές φορές με το χρυσό, το νικέλιο, το χαλκό και το χρώμιο. Σε αποθέσεις μεταλλευμάτων νικελίου και χαλκού, τα PGMs, εμφανίζονται ως σουλφίδια, τελλουρίδια, αντιμονίδια και αρσενίδια. Σε όλα αυτά τα ορυκτά του λευκόχρυσου, υπάρχουν πάντα μικρές ποσότητες ιριδίου και οσμίου[11].
Τα κοιτάσματα των PGMs είναι υγρομαγματικά (ορθομαγματικά), προέρχονται δηλ. κυρίως από κλασματική κρυστάλλωση υγρού μάγματος. Τα κοιτάσματα αυτά συναντώνται μέσα σε υπερβασικά πυριγενή πετρώματα και βρίσκονται μαζί με κοιτάσματα χρωμίτη και αδάμαντα.
Οι ενώσεις (κυρίως οξείδια) των PGMs επειδή είναι δυσδιάλυτες στο πυριτικό τήγμα, κρυσταλλώνονται πρώτες και βυθίζονται προς βαθύτερα σημεία λόγω της μεγαλύτερης πυκνότητας. Η διαφορά πυκνότητας τήγματος-μεταλλικών ορυκτών και το ιξώδες του τήγματος καθορίζουν τη μορφή του μεταλλεύματος (συμπαγής, ταινιωτή, διάσπαρτη κ.λ.π.)* [12]
| Περιεκτικότητα Ir σε διάφορα περιβάλλοντα[9] | ||
|---|---|---|
| Περιβάλλον | ppb κατά βάρος |
ppb κατά άτομο |
| Σύμπαν | 2 | 0,01 |
| Ήλιος | 2 | 0,01 |
| Μετεωρίτες | 550 | 60 |
| Λιθόσφαιρα | 0,4 | 0,05 |
Υπάρχουν όμως και ιζηματογενή κοιτάσματα PGMs που έχουν προκύψει από την αποσάθρωση συνεκτικών πετρωμάτων και τη μεταφορά και απόθεση των υλικών σε άλλες θέσεις. Τα προσχωματικά αυτά κοιτάσματα δημιουργούνται από τη μεταφορική δράση ρεμάτων και ποταμών[11].
Οι σπουδαιότερες χώρες παραγωγής είναι η Νότια Αφρική, οι Η.Π.Α., η Ρωσία και κατά δεύτερο λόγο ο Καναδάς και η Ζιμπάμπουε[13].
Οι μεγαλύτερες γνωστές πρωτογενείς αποθέσεις PGM βρίσκονται μέσα στα μεγαλύτερα κοιτάσματα χρωμίου στον κόσμο στο σύμπλεγμα Bushveld κοντά στο Ρούστενμπουργκ (Rustenburg) της Νότιας Αφρικής. Τα κοιτάσματα του χρωμίτη είναι στρωματόμορφα και εναλλάσσονται με βασικά και υπερβασικά πετρώματα, έχουν δε πάχος από λίγα εκατοστά έως 2 m[12].
Στις Η.Π.Α. εμφανίσεις PGMs υπάρχουν στο Στιλγουώτερ (Stillwater) της Νότιας Μοντάνα. Τα PGMs βρίσκονται μαζί με κοίτασμα στρωματόμορφου χρωμίτη τα στρώματα του οποίου είναι περίπου 14 με πάχος από λίγα εκατοστά έως 4 m[12].
Στη Ρωσία εκμετάλλευση των PGMs γίνεται στο Νοριλσκ (Noril'sk) κοντά στη χερσόνησο Ταιμύρ (Taimyr) και στη χερσόνησο Μόνχεγκορσκ (Monhegorsk). Τα PGM βρίσκονται μαζί με χρωμίτη μέσα σε γάββρους, νορίτες, πυροξενίτες και δουνίτες. Τα ορυκτά που έχουν εντοπιστεί είναι κοτουλσκίτης, ιρίδιο, αιματίτης, χρυσός, χρωμίτης, χαλκοπυρίτης κ.ά.[12]
Στον Καναδά έχουν εντοπιστεί PGMs στο Χωκ Ριτζ (Hawk Ridge) μαζί με κοιτάσματα χρωμίτη, χαλκού και νικελίου, καθώς και στη Μανιτόμπα (Manitoba)[12].
Άλλα μέρη στα οποία έχουν εντοπιστεί PGM είναι στη περιοχή Σέλους (Selous) στη Ζιμπάμπουε, στην Αυστραλία, στην Πολωνία, στη Σερβία, στη Φινλανδία, στην Κολομβία, στην Ιαπωνία, στην Ελλάδα κ.α.
Σύμφωνα με έρευνα που έγινε το 1992[14], τα PGMs που εξορύσσονταν στη Νότια Αφρική περιείχαν κατά μέσο όρο 47 % Pt, 32 % Pd, 11 % Ru, % Rh, 2 % Ir και 1 % Os, ενώ αυτά που εξορύσσονταν στην ΕΣΣΔ περιείχαν κατά μέσο όρο 25 % Pt, 67 % Pd, 2 % Ru, 3 % Rh, 2 % Ir και 1 % Os.
Το ιρίδιο στο "όριο Κ-Τ"

Το όριο Κ-Τ είναι γεωλογικό στρώμα που δημιουργήθηκε πριν 65 εκατομμύρια χρόνια και σηματοδοτεί το πέρασμα από την Κρητιδική (Κ) περίοδο του Μεσοζωικού Αιώνα (εποχή των ερπετών) στην Τριτογενή (Τ) γεωλογική περίοδο του Καινοζωικού Αιώνα (εποχή των θηλαστικών). Στο στρώμα αυτό βρέθηκαν αργιλικές αποθέσεις με ασυνήθιστα μεγάλες περιεκτικότητες σε ιρίδιο. Η ανακάλυψη αυτή οδήγησε το φυσικό Λούις Αλβαρέζ (Luis Alvarez)[Σημ. 6][15]να προτείνει το 1980, την επικρατέστερη μέχρι σήμερα θεωρία γνωστή ως "Υπόθεση Αλβαρέζ", για την ξαφνική εξαφάνιση των δεινοσαύρων στο τέλους του Μεσοζωικού Αιώνα.[16]
Σύμφωνα με την υπόθεση αυτή, η εξαφάνιση σχεδόν του 85 % των ειδών που κυριαρχούσαν στη Γη οφειλόταν σε έναν τεράστιο μετεωρίτη που έπεσε στη χερσόνησο Yucata'n στο Μεξικό δημιουργώντας τον κρατήρα Chicxulub και αναστατώνοντας σοβαρά το γήινο οικοσύστημα[17]. Ο Alvarez διετύπωσε τη θεωρία του όταν, με τη βοήθεια του γιου του Walter που είναι γεωλόγος, διαπίστωσε ασυνήθιστα μεγάλες ποσότητες ιριδίου, μέσα στους βράχους που χαρακτήριζαν το όριο μεταξύ της Κρητιδικής και της Τριτογενούς περιόδου. Το ιρίδιο είναι εξαιρετικά σπάνιο στο γήινο φλοιό, αλλά είναι πιο συνηθισμένο στους αστεροειδείς. Έτσι ο Alvarez υποστήριξε ότι αυτή η αυξημένη περιεκτικότητα σε ιρίδιο, ήταν απόδειξη για μια εξωγήινη σύγκρουση.
Πρόσφατες έρευνες έχουν δείξει ότι τηγμένα υλικά από το γήινο μανδύα, που έρχονται στην επιφάνεια κατά τη διάρκεια των ηφαιστειακών εκρήξεων, περιέχουν επίσης αυξημένες ποσότητες ιριδίου. Έτσι υποστηρίζεται η άποψη ότι η έντονη ηφαιστειακή δραστηριότητα του τέλους της Κρητιδικής εποχής (και όχι η πτώση μετεωρίτη) μπορεί να είναι υπεύθυνη για το αυξημένο ιρίδιο στο όριο Κ-Τ.
Άλλα γεωλογικά στοιχεία υποδεικνύουν ότι η αυξημένη περιεκτικότητα σε ιρίδιο του ορίου Κ-Τ δημιουργήθηκε σιγά-σιγά, όπως θα ήταν αναμενόμενο εξαιτίας μιας βαθμιαία αυξανόμενης ηφαιστειακής δραστηριότητας και όχι ως αιτία ξαφνικής πτώσης αστεροειδούς.[18]
Εξόρυξη
Η εξόρυξη των μετάλλων της ομάδας του λευκόχρυσου αποτελεί σημαντική πλουτοπαραγωγική πηγή για τις χώρες στις οποίες αυτά παράγονται. Συνήθως, απαιτούνται έως 3 μήνες για να ληφθούν 7 έως 12 τόννοι μεταλλεύματος[6] από τους οποίους θα εξαχθεί 1 ουγγιά (=31,135 g) λευκόχρυσου και μικρότερη ποσότητα ιριδίου.
Εφαρμόζονται διάφορες μέθοδοι εξόρυξης του μεταλλεύματος από το υπέδαφος[19] οι οποίες εξαρτώνται κυρίως από τη μορφή του εδάφους και τον προσανατολισμό των μεταλλοφόρων τμημάτων. Σε γενικές γραμμές, το μετάλλευμα εξάγεται από υπόγεια ορυχεία και σπανιότερα από επιφανειακές εμφανίσεις. Με δυνατή εμφύσηση εκτοξεύεται από το υπέδαφος στην επιφάνεια του εδάφους όπου συνθλίβεται, κατακερματίζεται σε μικρότερα κομμάτια βράχων, αλέθεται και ανακατεύεται με νερό και με κατάλληλα αντιδραστήρια, οπότε δημιουργείται ένας "αφρός επίπλευσης". Τα μικρά κομμάτια, πλούσια στα PGM, προσκολλώνται στις φυσαλίδες που δημιουργούνται από τη διαδικασία, επιπλέουν στην επιφάνεια και απομακρύνονται. Το υπόλοιπο υλικό περνάει από την ίδια διαδικασία για δεύτερη φορά. Στη συνέχεια, το εμπλουτισμένο μετάλλευμα ξηραίνεται σε θερμοκρασίες που μπορεί να είναι πάνω από 1500°C, οπότε το μίγμα των PGM διαχωρίζεται από ανεπιθύμητα ορυκτά, όπως του σιδήρου και του θείου, τα οποία απομακρύνονται με διοχέτευση ρευμάτων αέρα. Ακολουθεί μετά μια μακρά και περίπλοκη σειρά από χημικές διεργασίες που σκοπό έχουν να διαχωρίσουν μεταξύ τους τα PGM, για να ληφθούν αυτά σε καθαρή κατάσταση.
Απομόνωση
Στα μεταλλεύματα των PGM μπορεί να συνυπάρχουν και χρυσός (Au) ή/και άργυρος (Ag) που πρέπει επίσης να απομακρυνθούν. Μετά τη μηχανική πλύση του, το μετάλλευμα απαλλάσσεται από τα ελαφρότερα ορυκτά και μέταλλα. Το μίγμα ή και το κράμα των μετάλλων που παίρνεται τελικά, κατεργάζεται[20] με βασιλικό νερό στο οποίο διαλύονται ο λευκόχρυσος (Pt), το παλλάδιο (Pd) και ο Au. Τα άλλα μέταλλα δηλαδή ρουθήνιο (Ru), όσμιο (Os), ρόδιο (Rh), ιρίδιο (Ir) και Ag μένουν ως αδιάλυτα χλωριούχα σύμπλοκα. Στη συνέχεια αυτά τα αδιάλυτα διαλύονται σε τήγμα μολύβδου (Pb) και νιτρικό οξύ (HNO3) οπότε απομακρύνεται ο Ag και ο Pb με μορφή νιτρικού αργύρου (AgNO3) και μολύβδου (PbNO3). Τα αδιάλυτα που απομένουν είναι τα μέταλλα Ru, Os, Rh, Ir. Ακολουθεί σύντηξη με όξινο θειικό νάτριο (ΝaHSO4) και διάλυση στο νερό, οπότε απομονώνεται το διαλυτό θειικό ρόδιο(ΙΙΙ), Rh2(SO)3, ενώ τα άλλα μέταλλα (Ru, Os, Ir) μένουν αδιάλυτα, συντήκονται με υπεροξείδιο νατρίου (Na2O2) και πλένονται με νερό για να απομακρυνθούν τα μέταλλα Ru και Os ως ιόντα RuO42- και OsO42- αντίστοιχα. Το υπόλειμμα περιέχει οξείδιο του ιριδίου, IrO2, το οποίο διαλύεται σε βασιλικό νερό δίνοντας διάλυμα που περιέχει καθαρό χλωροϊριδικό αμμώνιο, (NH4)3IrCl6. Εξάτμιση μέχρι ξηρού και καύση κάτω από αέριο υδρογόνο δίνει καθαρό ιρίδιο[9].
Οικονομικά στοιχεία

Η ετήσια παραγωγή ιριδίου το 2000 ήταν περίπου 3 τόννοι[10] ή περίπου 100.000 ουγγιές (ozt)[Σημ. 7]. Η τιμή του ιριδίου (όπως και των άλλων εξωτικών PGMs : Ru, Os, Rh) κυμαίνεται σημαντικά και αυτές οι μεταβολές στην τιμή οφείλονται στο ότι το Ir είναι παραπροϊόν της εξόρυξης του λευκόχρυσου και του νικελίου και κάθε μέρα πωλούνται και αγοράζονται πολύ μικρές ποσότητες που δεν ανταποκρίνονται στις μεταβολές της ζήτησης. Αν η διαθέσιμη ποσότητα ενός συγκεκριμένου μετάλλου είναι μικρή, η τιμή του θα αυξηθεί δραματικά και θα πέσει εξίσου απότομα όταν χαλαρώσει η ζήτηση[22].
Η βιομηχανική παραγωγή και απομόνωσή του είναι δύσκολη και σύνθετη γιατί συνυπάρχει με άλλα μέταλλα όπως το ρόδιο, το παλλάδιο,ο άργυρος, ο λευκόχρυσος και ο χρυσός. Παρά τις δυσκολίες αυτές όμως, το ιρίδιο εξακολουθεί να εξάγεται διότι είναι αναντικατάστατο σε ορισμένους βιομηχανικούς καταλύτες και σε μερικές πολύ εξειδικευμένες εφαρμογές.
Ιδιότητες
Φυσικές
Είναι μέταλλο αργυρόλευκο. Είναι το μόνο μέταλλο που διατηρεί τις καλές του μηχανικές ιδιότητες στον αέρα ακόμα και σε θερμοκρασίες μεγαλύτερες των 1600°C. Το ιρίδιο έχει πολύ μεγάλη θερμοκρασία βρασμού (12ο στη σειρά του σημείου βρασμού των χημικών στοιχείων).
Εξαιτίας της σκληρότητας, του πολύ ψηλού σημείου τήξης του (το 8ο υψηλότερο όλων των χημικών στοιχείων) και της μεγάλης πυκνότητας, το στερεό ιρίδιο είναι πολύ δύσκολο να κατεργαστεί[8]. Παρόλες, όμως, τις δυσκολίες κατεργασίας και το ψηλό κόστος, το ιρίδιο χρησιμοποιείται σε αρκετές εφαρμογές τεχνολογιών αιχμής στις οποίες αξιοποιούνται οι μεταλλουργικές του ιδιότητες.
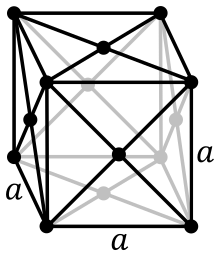
Το ιρίδιο είναι αγώγιμο παραμαγνητικό μέταλλο και κρυσταλλώνεται στο ολοεδρικά κεντρωμένο κυβικό σύστημα.
Η τάση των ατμών του είναι αμελητέα και μετρήσιμη μόνο σε υψηλές θερμοκρασίες : στους 2440°C είναι μόνο 10-5 Atm και φθάνει στην 1 Atm στους 4659°C.
- Σκληρότητα-Ελατότητα-Ολκιμότητα
Το ιρίδιο είναι το πιο σκληρό μέταλλο (1ο στην κατάταξη του μέτρου Young). Σε δοκιμές ολκιμότητας[Σημ. 8] η ελάχιστη ακτίνα καμπυλότητας[Σημ. 9] του ιριδίου, που ήταν πολύ μεγαλύτερη από των Pt,Pd,Rh, μειώθηκε εντυπωσιακά μεταξύ 200°C και 600°C καθιστώντας το Ir ακόμα πιο δύσκολο στην κατεργασία. Το μέτρο ελαστικότητας του ιριδίου ελαττώνεται ανεπαίσθητα από τους 0°C στους 1000°C και είναι το υψηλότερο όλων των μετάλλων μαζί με αυτό του οσμίου. Η πολύ μεγάλη του ακαμψία (5ο στη σειρά σκληρότητας μεταξύ όλων των χημικών στοιχείων) και ο πολύ μικρός λόγος Poisson[Σημ. 10], καθιστούν το ιρίδιο πολύ ανθεκτικό στη μορφοποίηση με αποτέλεσμα μεγάλες τεχνικές δυσκολίες στις διάφορες βιομηχανίες που κατεργάζονται υλικά.
- Θερμική αγωγιμότητα - Θερμική διαστολή
Το Ir έχει την 9η μεγαλύτερη θερμική αγωγιμότητα μεταξύ όλων των χημικών στοιχείων. Η θερμική του αγωγιμότητα παραμένει σχεδόν σταθερή μεταξύ 0°C και 100°C, περίπου 145 W/(m.K) σχεδόν ίδια με αυτήν του ροδίου και υψηλότερη από τις θερμικές αγωγιμότητες των άλλων PGM, που είναι κάτω από τα 100 W/(m.K). Ο γραμμικός συντελεστής θερμικής διαστολής[Σημ. 11] του Ir μεταβάλλεται και είναι 3,43×10–6 K-1 στους -198°C ενώ ανεβαίνει λίγο πάνω από 6×10–6 K-1 σε θερμοκρασίες πάνω από 0°C παραμένοντας πάντως πολύ χαμηλός[23]. Δεν υπάρχουν όμως αξιόπιστα στοιχεία για τη θερμική διαστολή του ιριδίου πάνω από τους 1077°C[24].
Ανακλαστικότητα
Ανακλά το ορατό φως από 70 % έως 76 % ενώ η ανακλαστικότητά του γίνεται 78 % για ακτινοβολία μήκους κύματος 1000 nm[9]. Είναι μέταλλο λιγότερο λαμπερό από το ρόδιο, το χρυσό και τον άργυρο αλλά περισσότερο από το λευκόχρυσο και το παλλάδιο.
Ηλεκτρική αγωγιμότητα
Όπως όλα τα μέταλλα, το ιρίδιο είναι πολύ καλός αγωγός του ηλεκτρικού ρεύματος και έχει τη 10η μεγαλύτερη ηλεκτρική αγωγιμότητα στη διέλευση του ρεύματος, μεταξύ όλων των χημικών στοιχείων στους 25° C. Σε όλες τις θερμοκρασίες έχει σχεδόν την ίδια αγωγιμότητα με του ροδίου που είναι και οι μεγαλύτερες μεταξύ των PGM. Το ιρίδιο γίνεται υπεραγωγός στους -273,04°C (0,11 Κ)[9], λίγο πιο πάνω από το απόλυτο μηδέν (-273,15°C).
Πυκνότητα
Υπάρχουν κάποιες αμφιβολίες σχετικά με το πιο μέταλλο έχει τη μεγαλύτερη πυκνότητα, το ιρίδιο ή το όσμιο, αφού η διαφορά που έχει μετρηθεί είναι πολύ μικρή [25][26]. Σήμερα γνωρίζουμε[5] ότι το όσμιο έχει πυκνότητα 22.587±0.009 g/cm3 και το ιρίδιο 22.562 ± 0.009 g/cm3. Σε υγρή κατάσταση το ιρίδιο έχει πυκνότητα 19 g/cm3.
Χημικές
Οι ενέργειες ιονισμού (σε KJ/mol) των σταδιακών μετατροπών του ιριδίου σε ιόντα από Ir+ έως Ir9+ καθώς και τα δυναμικά ημιαντιδράσεων αναγωγής διαφόρων ενώσεων και ιόντων του Ir, βρίσκονται στους "κρυμμένους" πίνακες που ακολουθούν :
| Ενέργειες ιονισμού και ημιαντιδράσεις αναγωγής ενώσεων του ιριδίου | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Ατομικός αριθμός (Ζ) |
Χημικό στοιχείο | Ηλεκτρόνια ανά στιβάδα |
|---|---|---|
| 27 | Κοβάλτιο | 2, 8, 15, 2 |
| 45 | Ρόδιο | 2, 8, 18, 16, 1 |
| 77 | Ιρίδιο | 2, 8, 18, 32, 15, 2 |
| 109 | Μαϊτνέριο | 2, 8, 18, 32, 32, 15, 2 |

Το ιρίδιο είναι το ανθεκτικότερο από όλα τα μέταλλα στη διάβρωση. Δε διαβρώνεται από το νερό, τα οξέα, το βασιλικό νερό, τις βάσεις, τα λιωμένα μέταλλα, τα αλογόνα, τις ενώσεις του πυριτίου[20].
Επίδραση οξέων
Το ιρίδιο δε διαβρώνεται από τα οξέα (αραιά ή πυκνά, ασθενή ή ισχυρά, οργανικά ή ανόργανα) ούτε από το βασιλικό νερό[20].
Επίδραση βάσεων
Το Ir γενικά δε διαβρώνεται από τις βάσεις σε φυσιολογικές συνθήκες[20]. Όταν επιδράσει λιωμένο NaOH σε πολύ δραστικές συνθήκες (1 ώρα, 410°C, ξηρό περιβάλλον, ατμόσφαιρα με 100 % Ο2), τότε από επιφάνεια 8 cm2 ιριδίου χάνεται περίπου 1 g υλικού, ενώ όταν επιδράσει λιωμένο ΚΟΗ στις ίδιες συνθήκες, υπάρχει απώλεια περίπου 66 g.[27]
Επίδραση αλάτων
Πάρα πολύ μικρή διάβρωση παρατηρείται κατά την επίδραση διαλύματος υποχλωριώδους νατρίου (NaOCl). Από την επίδραση λιωμένου κυανιούχου καλίου (ΚCN) στο ιρίδιο στους 700°C παρατηρείται επιφανειακή απώλεια 18 mg Ir/cm2 την ημέρα, ενώ από την επίδραση ανθρακικού νατρίου (Na2CO3) στους 920°C παρατηρείται επικάλυψη από οξείδιο μάζας 1,32 mg/cm2 την ημέρα. Άλλα λιωμένα άλατα έχουν αμελητέα επίδραση σε κομμάτια ιριδίου[27].
Αντιδράσεις του ιριδίου με το Ο2
Το ιρίδιο σχηματίζει οξείδια με αριθμό οξείδωσης +3 και +4 δηλ. το καφέ Ir2O3 και το μαύρο IrO2[9]. Για το πρώτο λίγα πράγματα είναι γνωστά και δεν παρασκευάζεται με απευθείας αντίδραση του Ir με O2. Αν σχηματιστεί, οξειδώνεται στους 500°C προς IrO2[26] :
- 2Ir2O3 → Ir + 3IrO2
Το IrO2 προκύπτει με απευθείας αντίδραση Ir και Ο2. Στους 1100°C διασπάται στα στοιχεία του:
- Ir + O2 → IrO2
Αντιδράσεις του ιριδίου με τα αλογόνα
Το μεταλλικό ιρίδιο αντιδρά απευθείας με το αέριο φθόριο και δίνει διάφορα προϊόντα ανάλογα ,με τη θερμοκρασία[26] :
Στους 240°C προκύπτει το εξαιρετικά διαβρωτικό κίτρινο στερεό φθοριούχο ιρίδιο(VI), IrF6 :
- Ir + 3F2 → IrF6
Το IrF6 μπορεί να αντιδράσει με το Ir σε πίεση 1 έως 15 Torr και να δώσει το καστανοκόκκινο φθοριούχο ιρίδιο(IV) :
- Ir + 2IrF6 → 3IrF4
το οποίο θερμαινόμενο στους 400°C μετατρέπεται στο μαύρο φθοριούχο ιρίδιο(ΙΙΙ), IrF3. Στους 350-380°C παράγεται το κιτρινοπράσινο φθοριούχο ιρίδιο(V), IrF5 :
- 2Ir + 5F2 → 2IrF5
Η αντίδραση του Ir απευθείας με Cl2 γίνεται στους 600°C και οδηγεί στο σχηματισμό της καφέ α-μορφής του χλωριούχου ιριδίου(ΙΙΙ) το οποίο σε κενό και στους 750°C μετατρέπεται στη βαθυκόκκινη β-μορφή[26] :
- 2Ir + 3Cl2 → 2α-IrCl3
- α-IrCl3 → β-IrCl3
Η αντίδραση του Ir απευθείας με Br2 γίνεται σε σφραγισμένους σωλήνες, στους 540°C, σε πίεση 8-9 Atm και οδηγεί στο σχηματισμό του κίτρινου βρωμιούχου ιριδίου(ΙΙΙ)[26] :
- 2Ir + 3Br2 → IrBr3
Ισότοπα
Το ιρίδιο έχει δύο σταθερά φυσικά ισότοπα, το 191Ir και το 193Ir με περιεκτικότητες αντίστοιχα 37,3 % και 62,7 %. Τουλάχιστον 34 άλλα ραδιοϊσότοπα με σχετικές ατομικές μάζες από 164 έως 199 είναι τεχνητά[28]. Το ισότοπο 192Ir, χρησιμοποιείται στην καταπολέμηση του καρκίνου και για τον ακτινογραφικό έλεγχο των συγκολλήσεων σε χαλύβδινους σωλήνες στην πετροχημική βιομηχανία και στη διανομή του φυσικού αερίου. Το ισότοπο 191Ir ήταν το πρώτο στο οποίο εντοπίστηκε το φαινόμενο Mössbauer. Όλα τα γνωστά ισότοπα του ιριδίου ανακαλύφθηκαν μεταξύ του 1934 και του 2001. Το νεώτερο που ανακαλύφθηκε είναι το 171Ir[29].
Περιβαλλοντικοί κίνδυνοι - Βιολογικός ρόλος - Προφυλάξεις
Το ιρίδιο στη μεταλλική του μορφή δεν παρουσιάζει βιολογικό ενδιαφέρον ούτε είναι επικίνδυνο διότι δεν αντιδρά με τους ιστούς[30]. Υπάρχουν μόνο περίπου 20 μέρη στο τρισεκατομμύριο (ppt) ιριδίου στους ανθρώπινους ιστούς[10]. Ωστόσο, η σκόνη ιριδίου μπορεί να είναι επικίνδυνη, ερεθιστική αλλά και εύκολα αναφλέξιμη κατά το χειρισμό της[31]. Πολύ λίγα είναι γνωστά για την τοξικότητα των ενώσεων του ιριδίου, διότι χρησιμοποιούνται σε πολύ μικρές ποσότητες, αλλά τα ευδιάλυτα άλατά του, όπως τα αλογονίδια, ενδέχεται να είναι επικίνδυνα[32] εξαιτίας των άλλων στοιχείων που περιέχουν αλλά και του ίδιου του ιριδίου. Ωστόσο, οι περισσότερες ενώσεις του ιριδίου είναι αδιάλυτες, γεγονός που καθιστά δύσκολη την απορρόφησή τους από τον οργανισμό[10]. Πειράματα σε αρουραίους έδειξαν ότι εισπνεόμενη σκόνη μεταλλικού ιριδίου αποβάλλεται γρήγορα κατά 95 % με το γαστρεντερολογικό σύστημα[33]. Οι μόνοι τραυματισμοί που έχουν αναφερθεί οφείλονται σε τυχαία υπερβολική έκθεση σε ακτινοβολία γ από το ραδιοϊσότοπο 192Ir που χρησιμοποιείται στην ιατρική. Εξωτερική έκθεση στο ισότοπο αυτό μπορεί να προκαλέσει εγκαύματα, δηλητηρίαση απο ακτινοβολία έως και θάνατο. Η κατάποση του Ir-192 μπορεί να καταστρέψει το στομάχι, τα έντερα αλλά και το συκώτι[33]. Τα ισότοπα 192mIr και 194mIr τείνουν να εναποθέτονται στο συκώτι και μπορούν να δημιουργήσουν κινδύνους από τη γ και β ακτινοβολία. Επειδή το ιρίδιο είναι πολύ σπάνιο μέταλλο, δεν έχει καταγραφεί καμιά τοξικότητά του στα τρόφιμα[34].
Ενώσεις του ιριδίου
Το ιρίδιο εμφανίζεται στις ενώσεις του με αριθμούς οξείδωσης από -1 έως και +6 εκτός από -2. Συνηθέστεροι είναι ο +3 και ο +4. Οι ενώσεις στις οποίες το ιρίδιο έχει μεγάλο αριθμό οξείδωσης είναι σπάνιες με τις πλέον αντιπροσωπευτικές το φθοριούχο ιρίδιο(VI), IrF6[8] και δύο μικτά οξείδια με στρόντιο-μαγνήσιο, Sr2MgIrO6 και στρόντιο-ασβέστιο, Sr2CaIrO6.
Είναι γνωστά τα σουλφίδια IrS2, Ir2S3, Ir3S8, IrS3, τα σεληνίδια IrSe2, Ir3Se8, το αρσενίδιο IrAs3, το αντιμονίδιο IrSb3, τα φωσφίδια Ir2P και IrP2 αλλά και το IrSi3.
Οι γνωστότερες δυαδικές ενώσεις του Ir+3 και του Ir+4 με αμέταλλα στοιχεία καθώς και τρισδιάστατες απεικονίσεις ορισμένων σημαντικών ενώσεων του ιριδίου, βρίσκονται στους "κρυμμένους" πίνακες που ακολουθούν :
| Δυαδικές ενώσεις του ιριδίου | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Στερεοχημικά μοντέλα ενώσεων του ιριδίου |
|---|
|
| Αριθμοί οξείδωσης του Ir σε ορισμένες ενώσεις του | |
|---|---|
| -3 | [Ir(CO)3]3- |
| -1 | [Ir(CO)3(PPh3)]- |
0 |
Ir4(CO)12 |
| +1 | IrH(CO)(PPh3)3 |
| +2 | IrCl2 |
| +3 | IrCl3 |
| +4 | IrO2 |
| +5 | Ir4F20 |
| +6 | IrF6 |
Το ιρίδιο σχηματίζει επίσης ιριδικά άλατα, όπως το K2IrO3 και το KIrO3.
Αν και δεν είναι γνωστές δυαδικές ενώσεις του ιριδίου με υδρογόνο (υδρίδια), της μορφής IrxHy, εντούτοις είναι γνωστά σύμπλοκα που περιέχουν IrH4-5 και IrH3-6, όπου το ιρίδιο έχει αριθμούς οξείδωσης +1 και +3, αντίστοιχα[20]. Το μικτό υδρίδιο Mg6Ir2H11 πιστεύεται ότι περιέχει τόσο το ανιόν IrH4-5 όσο και το ανιόν IrH5-4.
Το ιρίδιο σχηματίζει με όλα τα αλογόνα, αλογονούχες ενώσεις της μορφής IrX3 (X=F, Cl, Br, I), ενώ είναι άγνωστα μονο- ή δια-αλογονίδια[26]. Για αριθμούς οξείδωσης +4, +5 και +6 είναι γνωστές ενώσεις του ιριδίου μόνο με το φθόριο. Το φθοριούχο ιρίδιο(VI), IrF6, είναι ένα πτητικό, δραστικό κίτρινο στερεό αποτελούμενο από μόρια οκταεδρικής δομής. Αποσυντίθεται στο νερό και ανάγεται προς κρυσταλλικό στερεό φθοριούχο ιρίδιο(ΙV), IrF4[26]. Το φθοριούχο ιρίδιο(V), IrF5, έχει παρόμοιες ιδιότητες, πρόκειται όμως στην πραγματικότητα για τετραμερές του τύπου Ir4F20 ή (IrF5)4, αποτελούμενο από τέσσερα οκτάεδρα[26].
Σύμπλοκα του ιριδίου
Οι οργανοϊριδικές ενώσεις περιέχουν δεσμό ιριδίου-άνθρακα και το μέταλλο έχει συνήθως μικρό αριθμό οξείδωσης. Για παράδειγμα, στην πιο κοινή και σταθερότερη διμερή οργανομεταλλική ένωση, το δωδεκακαρβονυλικό ιρίδιο[35] , Ir4(CO)12, το Ir έχει αριθμό οξείδωσης 0[36]. Σ' αυτή την ένωση, κάθε ένα από τα άτομα ιριδίου είναι συνδεδεμένο με τα άλλα τρία, δημιουργώντας έτσι ένα τετραεδρικό σύμπλεγμα. Μια άλλη γνωστή οργανοϊριδική ένωση είναι το οκτακαρβονυλικό ιρίδιο, Ir2(CO)8.


Μερικές οργανομεταλλικές ενώσεις του Ir+ είναι γνωστές με το όνομα του ερευνητή που τις ανακάλυψε, όπως για παράδειγμα το "σύμπλοκο Vaska" [20](trans-καρβονυλο χλωρο δισ(τριφαινυλοφωσφινο) ιρίδιο(Ι)[35] , IrCl(CO)[P(C6H5)3]2), το οποίο είναι επίπεδο τετραγωνικό 16e και d8 σύμπλοκο, και έχει την ασυνήθιστη ιδιότητα να δεσμεύει μόρια οξυγόνου, O2 αλλά και να δίνει 18e και d6 οκταεδρικά διυδρίδια όταν προστίθεται σ' αυτό Η2[37] ή ο "καταλύτης Crabtree" που χρησιμοποιείται στις ομογενείς αντιδράσεις υδρογόνωσης. Και αυτή είναι επίπεδη τετραγωνική, ένωση d8, με 16 ηλεκτρόνια σθένους που είναι υπεύθυνα για τη μεγάλη της δραστικότητα. Το κατιόν Ir+ σχηματίζει και τετραγωνικά σύμπλοκα τύπου column (κιονοειδή) με δεσμό μετάλλου-μετάλλου π.χ. [IrCl(CO)3]n[20]. Το σύμπλοκο ιόν [IrCl6]2- έχει σκούρο καφέ χρώμα και μπορεί να αναχθεί προς το σύμπλοκο ιόν [IrCl6]3- και αντιστρόφως[20]. Το ιόν IrCl42- που είναι ουσία οξειδωτική και οξειδώνει διάφορες οργανικές ενώσεις, ανάγεται επίσης εύκολα προς το ιόν IrCl43-[20].
Ενώσεις του ιριδίου με βιομηχανική σημασία
Το χλωροϊριδικό(IV) οξύ, H2IrCl6 και το άλας του με αμμώνιο είναι οι πιο σημαντικές ενώσεις του ιριδίου από βιομηχανική σκοπιά. Χρησιμοποιούνται στον καθαρισμό του ιριδίου, ως πρόδρομες ουσίες για την παρασκευή των περισσοτέρων από τις άλλες ενώσεις του ιριδίου καθώς και στην προετοιμασία των επιχρισμάτων των ανοδικών ηλεκτροδίων. Το IrCl3 είναι συχνά πρόδρομη ένωση για την παραγωγή ενώσεων του Ir(III). Μπορεί να παραληφθεί σε άνυδρες συνθήκες ή σε ένυδρη μορφή με διάλυση του Ir2O3 σε υδροχλωρικό οξύ. Μία άλλη ένωση που χρησιμοποιείται ως πρώτη ύλη είναι το χλωροϊριδικό (ΙΙΙ) αμμώνιο, (NH4)3IrCl6. Τα σύμπλοκα του Ir+3 είναι διαμαγνητικά (χαμηλού spin) και γενικά έχουν οκταεδρική συμμετρία[36].
Ξεχωριστό βιομηχανικό ενδιαφέρον παρουσιάζει η διαδικασία Cativa[38] με την οποία παράγεται οξικό οξύ, CH3COOH, από καρβονυλίωση της μεθανόλης, CH3OH. Η μέθοδος αναπτύχθηκε από τη βιομηχανία BP και στηρίζεται στη δράση καταλύτη που περιέχει ιρίδιο όπως το ανιόν δικαρβονυλο-διιωδο ιρίδιο, [Ir(CO)2I2]–.
Χρήσεις - Εφαρμογές

Τα κράματα ιριδίου-οσμίου χρησιμοποιήθηκαν παλιότερα για την κατασκευή της άκρης της μύτης σε πένες. Η πρώτη σημαντική χρήση έγινε το 1834 σε μύτες πενών από χρυσό[3]. Από το 1944, η διάσημη πένα "Parker 51" είναι εφοδιασμένη με μύτη από κράμα ρουθηνίου-ιριδίου (με 3,8 % ιρίδιο). Σήμερα, Το υλικό της άκρης στις σύγχρονες πένες εξακολουθεί συμβατικά να αποκαλείται "ιρίδιο", αν και έχει αντικατασταθεί προ πολλού από άλλα μέταλλα όπως το βολφράμιο[39].

Το 1889 χρησιμοποιήθηκε κράμα 90% πλατίνας και 10% ιριδίου για την κατασκευή[40] του Διεθνούς Πρωτότυπου Μέτρου και Χιλιόγραμμου μάζας, που διατηρούνται μέχρι σήμερα στο Διεθνές Γραφείο Μέτρων και Σταθμών στις Se`vres.[Σημ. 12] Παρόλο που το μέτρο αντικαταστάθηκε από τον ορισμό της θεμελιώδους μονάδας μήκους το 1960, το πρωτότυπο χιλιόγραμμο παραμένει ως διεθνές πρότυπο μάζας. Κράμα ιριδίου-πλατίνας είχε χρησιμοποιηθεί για τις οπές εξαερισμού ή για τμήματα κανονιών. Σύμφωνα με μια αναφορά της "Έκθεσης του Παρισιού" του 1867, ένα από τα κομμάτια που εκθέτονταν από την εταιρεία Johnson Matthey και "είχε χρησιμοποιηθεί σε πυροβόλο όπλο Withworth για πάνω από 3000 κανονιοβολισμούς, μόλις και μετά βίας έδειχνε κάποια σημάδια φθοράς. Όσοι γνώριζαν τα προβλήματα και μεγάλα έξοδα τα οποία προέκυπταν από την φθορά των αεραγωγών του κανονιού, όταν αυτό ήταν σε ενεργό υπηρεσία, θα εκτιμούσαν το σημαντικό αυτό γεγονός".
| Ζήτηση Ir ανά εφαρμογή 2006-2007 (σε ουγγιές) | ||
|---|---|---|
| Εφαρμογές | 2006 | 2007 |
| Χημικές | 33.000 | 24.000 |
| Ηλεκτροχημικές | 34.000 | 34.000 |
| Ηλεκτρικές | 28.000 | 25.000 |
| Άλλες | 36.000 | 36.000 |
| Συνολική ζήτηση | 131.000 | 119.000 |
Η μαύρη χρωστική, "μαύρο ιρίδιο" η οποία αποτελούνταν από εξαιρετικά λεπτή σκόνη του μετάλλου, χρησιμοποιήθηκε παλιότερα στη ζωγραφική πάνω σε πορσελάνη μετά την ανάμιξή της με άλλα συστατικά όπως χλωριούχο νάτριο. Η γκρι χρωστική, "γκρι ιρίδιο", που περιείχε οξείδια ιριδίου και ψευδαργύρου καθώς μόλυβδο, χρησιμοποιήθηκε επίσης στη ζωγραφική.[41]
Η παγκόσμια ζήτηση για το ιρίδιο, το 2006 και το 2007 φαίνεται στο διπλανό πίνακα. Στα επόμενα χρόνια, οι τάσεις ζήτησης δεν άλλαξαν σημαντικά και η μεγαλύτερη ζήτηση παραμένει για ηλεκτροχημικές εφαρμογές. Το υψηλό σημείο τήξης, η σκληρότητα και η αντοχή στη διάβρωση του ιριδίου και των κραμάτων του, καθορίζουν τις περισσότερες από τις εφαρμογές. Το 1908 ο Sir William Crookes χρησιμοποίησε για πρώτη φορά το ιρίδιο για χωνευτήρια και για άλλες συσκευές ανθεκτικές σε υψηλή θερμοκρασία.[20]
Βιομηχανία

Το ιρίδιο και ειδικά τα κράματα με όσμιο και λευκόχρυσο, χρησιμοποιούνται για την κατασκευή ανθεκτικών δοχείων στη βιομηχανία πολυμερών όπως του rayon. Το οσμιο-ιρίδιο χρησιμοποιείται στην κατασκευή πυξίδων και ζυγαριών[10]. Ορισμένα μέρη των κινητήρων των αεροσκαφών κατασκευάζονται από κράματα ιριδίου ενώ κράματα ιριδίου-τιτανίου χρησιμοποιούνται για την κατασκευή βαλβίδων σωληνώσεων σε μεγάλα βάθη στη θάλασσα, λόγω της αντοχής τους στη διάβρωση[10]. Το ιρίδιο χρησιμοποιείται επίσης ως μέσο σκλήρυνση στα κράματα πλατίνας. Η σκληρότητα Vickers του καθαρού λευκόχρυσου είναι 56 HV, ενώ το κράμα λευκόχρυσου με 50 % ιρίδιο, μπορεί να φτάσει πάνω από 400 HV[42].
Συσκευές που πρέπει να αντέχουν σε πολύ υψηλές θερμοκρασίες συχνά κατασκευάζονται από ιρίδιο. Για παράδειγμα, από ιρίδιο φτιάχνονται πυριαντήρια που χρησιμοποιούνται στη διαδικασία Czochralski για την παραγωγή συνθετικών πολύτιμων λίθων (όπως ζαφείρια) που χρησιμοποιούνται στη βιομηχανία ημιαγωγών και λέιζερ στερεάς κατάστασης[43]. Επίσης κρύσταλλοι από γαδολίνιο, γρανάτη, ύττριο, γάλλιο φτιάχνονται σε έντονα οξειδωτικές συνθήκες σε θερμοκρασίες μέχρι 2100°C[3] μέσα σε συσκευές από ιρίδιο. Τα κράματα ιριδίου είναι ιδανικά για τις ηλεκτρικές επαφές των μπουζί[43] επειδή αντέχουν στη θερμοκρασία που παράγεται κατά την καύση σε μηχανές εσωτερικής καύσης. Ενώσεις του ιριδίου χρησιμοποιούνται επίσης ως καταλύτες στη διαδικασία Cativa για παραγωγή οξικού οξέος από καρβονυλίωση μεθανόλης[44]. Το μεταλλικό ιρίδιο χρησιμοποιείται ως καταλύτης σε ένα συγκεκριμένο τύπο κινητήρα αυτοκινήτου που παρουσιάστηκε το 1996 και ονομάστηκε "κινητήρας άμεσης ανάφλεξης"[10]. Το ραδιοϊσότοπο ιρίδιο-192 είναι μια από τις δύο πιο σημαντικές πηγές ενέργειας για χρήση σε βιομηχανικές ακτινογραφίες-γ για έλεγχο της ακεραιότητας των κραμάτων των μετάλλων και κυρίως του χάλυβα[45].
Ιατρική
Το 192Ir χρησιμοποιείται ως πηγή ακτινοβολίας γ για τη θεραπεία του καρκίνου με χρήση βραχυθεραπείας, μιας μορφής ακτινοθεραπείας, στην οποία μια σφραγισμένη πηγή ραδιενέργειας είναι τοποθετημένη μέσα ή δίπλα στην περιοχή που πρέπει να θεραπευτεί. Το ραδιοϊσότοπο αυτό χρησιμοποιείται επίσης σε ειδικές θεραπείες κακοήθων όγκων του προστάτη ή του τραχήλου της μήτρας[46].
Επιστήμες


Το ιρίδιο, επειδή αντέχει σε θερμοκρασίες λειτουργίας μέχρι 2000°C, έχει χρησιμοποιηθεί για να εμπλουτίσει το καύσιμο πλουτωνίου-238 στις θερμοηλεκτρικές γεννήτριες ραδιοϊσοτόπων μη επανδρωμένων διαστημικών οχημάτων, όπως τα Voyager, Viking, Pioneer, Cassini, Galileo και New Horizons[3].
Μια άλλη χρήση του ιριδίου είναι στην οπτική των ακτίνων-Χ και ειδικότερα σε τηλεσκόπια ακτίνων-Χ. Τα κάτοπτρα του παρατηρητηρίου ακτίνων-Χ Chandra, έχουν επικάλυψη με ένα στρώμα ιριδίου πάχους 60 nm (δισεκατομμυριοστά του μέτρου). Το ιρίδιο αποδείχθηκε ότι είναι η καλύτερη επιλογή για την ανάκλαση των ακτίνων-Χ μετά από δοκιμές που έγιναν στο νικέλιο, στο χρυσό και στο λευκόχρυσο. Το στρώμα ιριδίου, που έπρεπε να έχει πάχος λίγων ατόμων, δημιουργήθηκε με την εναπόθεση ατμών ιριδίου πάνω σε στρώμα βάσης από χρώμιο σε συνθήκες υψηλού κενού[47].
Το ιρίδιο χρησιμοποιείται στη σωματιδιακή φυσική για την παραγωγή αντιπρωτονίων, μιας μορφής αντιύλης. Αντιπρωτόνια παράγονται όταν μια δέσμη πρωτονίων υψηλής ενέργειας προσπέσει σε έναν στόχο, κατασκευασμένο από υλικό πολύ μεγάλης πυκνότητας. Παρόλο που για την κατασκευή του στόχου μπορεί να χρησιμοποιηθεί βολφράμιο, το ιρίδιο έχει το πλεονέκτημα της μεγαλύτερης σταθερότητας μετά την αύξηση της θερμοκρασίας που παρατηρείται λόγω της προσπίπτουσας δέσμης πρωτονίων[48].
Οργανομεταλλικές ενώσεις ιριδίου χρησιμοποιήθηκαν με επιτυχία για πρώτη φορά το 1982 στην ενεργοποίηση και διάσπαση δεσμών άνθρακα-υδρογόνου σε κορεσμένους υδρογονάνθρακες. Οι δεσμοί C-H είναι ιδιαίτερα ισχυροί και ανθεκτικοί στη διάσπαση, γιαυτό και τα αλκάνια θεωρούνται γενικά αδρανείς ενώσεις[49].
Σύμπλοκα του ιριδίου χρησιμοποιούνται ως καταλύτες σε ασύμμετρες υδρογονώσεις[50]. Αυτοί οι καταλύτες χρησιμοποιούνται στη σύνθεση φυσικών προϊόντων επειδή έχουν την ικανότητα να επιτυγχάνουν υδρογονώσεις ορισμένων δύσκολων υποστρωμάτων, όπως είναι τα ασύμμετρα αλκένια και να δημιουργούν μια μόνο από τις δύο πιθανές εναντιομερείς μορφές. Είναι δηλ. καταλύτες απόλυτα στερεοεκλεκτικοί.
Σημειώσεις
- ↑ Platinum Group Metals ή Elements. Πρόκειται για ομάδα έξι μετάλλων με παρόμοια δομή και ιδιότητες : Λευκόχρυσος, ιρίδιο, όσμιο, ρόδιο, ρουθήνιο, παλλάδιο.
- ↑ Σιδηρόφιλα στοιχεία είναι τα μεταβατικά μέταλλα μεγάλης πυκνότητα τα οποία δεσμεύουν το μεταλλικό σίδηρο σε στερεή ή τηγμένη κατάσταση. Σιδηρόφιλα μέταλλα είναι ο χρυσός, το κοβάλτιο, ο σίδηρος, το ιρίδιο, το μαγγάνιο, το μολυβδαίνιο, το νικέλιο, το όσμιο, το παλλάδιο, ο λευκόχρυσος, το ρήνιο, το ρόδιο και το ρουθήνιο
- ↑ Ο Smithson Tennant (1761-1815) ήταν Άγγλος χημικός. Το 1796 απέδειξε, με καύση, ότι το διαμάντι αποτελείται αποκλειστικά από άνθρακα. Το 1804 ανακοίνωσε την ανακάλυψη του οσμίου και του ιριδίου
- ↑ Ο Τένναντ αναφέρει στη δημοσίευσή του : "appeared of a white colour, and was not capable of being melted, by any degree of heat I could apply...I should incline to call this metal Iridium, from the striking variety of colours which it gives, while dissolving in marine acid..."
"εμφανίστηκε από το άσπρο χρώμα, και δεν ήταν δυνατό να λιώσει, με οποιοδήποτε βαθμό θερμότητας θα μπορούσα να εφαρμόσω... Τείνω να αποκαλέσω το μέταλλο αυτό ιρίδιο, από την εντυπωσιακή ποικιλία χρωμάτων που δίνει, όταν διαλύεται σε θαλάσσιο (υδροχλωρικό) οξύ ..." - ↑ Rudolf Ludwig Mössbauer. Γερμανός φυσικός. Μαζί με τον Αμερικανό Robert Hofstadter, κέρδισε το Βραβείο Νόμπελ το 1961 "για τις έρευνές του σχετικά με το συντονισμό της απορρόφησης της ακτινοβολίας γάμμα και της ανακάλυψης του φαινομένου που φέρει το όνομά του"
- ↑ Luis W. Alvarez (1911-1988). Αμερικανός πειραματικός φυσικός και εφευρέτης. Κέρδισε το Βραβείο Νόμπελ στη φυσική το 1968 για "την αποφασιστική του συνεισφορά στη Φυσική των στοιχειωδών σωματιδίων"
- ↑ Η ουγγιά (troy ounce) είναι η παραδοσιακή μονάδα μέτρησης της μάζας των ευγενών μετάλλων. 1 ουγγιά = 31,1035 g και 1 Κg = 32,1507 troy oz
- ↑ Η ολκιμότητα καθορίζει πόσο εύκολα ένα μέταλλο μπορεί να λυγίσει χωρίς να σπάσει. Όσο υψηλότερη είναι η ολκιμότητα ενός μετάλλου, τόσο περισσότερο αυτό μπορεί να λυγίσει ή να παραμορφωθεί χωρίς να σπάσει.
- ↑ Η ελάχιστη ακτίνα καμπυλότητας είναι η ακτίνα κάτω από την οποία ένα αντικείμενο δεν πρέπει να λυγίσει.
- ↑ Σχέση διατμητικής και πλευρικής πίεσης
- ↑ Ο συντελεστής αυτός μας δείχνει την εξάρτηση της επιμήκυνσης μιας ράβδου από το υλικό όταν αυτό θερμαίνεται ή ψύχεται
- ↑ Δημοτικό διαμέρισμα στο νοτιοδυτικό Παρίσι
Αναφορές
- ↑ Θερμοδυναμικά στοιχεία για το ιρίδιο
- ↑ McDonald, M. (959). «The Platinum of New Granada: Mining and Metallurgy in the Spanish Colonial Empire». Platinum Metals Review 3 (4): 140–145. http://www.platinummetalsreview.com/dynamic/article/view/pmr-v3-i4-140-145.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 Hunt, L. B. (1987). «A History of Iridium». Platinum Metals Review 31 (1): 32–41. http://www.platinummetalsreview.com/dynamic/article/view/pmr-v31-i1-032-041.
- ↑ John Emsley "Nature's building blocks: an A-Z guide to the elements", New York 2001
- ↑ 5,0 5,1 5,2 Griffith, W. P. (2004). «Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries». Platinum Metals Review 48 (4): 182–189.
- ↑ 6,0 6,1 International Platinum Group Metals Association (IPA)
- ↑ Βραβεία Νόμπελ Φυσικής 1961
- ↑ 8,0 8,1 8,2 Greenwood N. N., Earnshaw, A. "Chemistry of the Elements (2nd ed.)", Oxford 1997
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 webelements : iridium
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 John Emsley "Nature's building blocks: an A-Z guide to the elements", New York 2001
- ↑ 11,0 11,1 Μιχαηλίδης Κ. "Σημειώσεις Κοιτασματολογίας", Θεσσαλονίκη 1982
- ↑ 12,0 12,1 12,2 12,3 12,4 Καζακης Ν., Βαβελίδης Μ. "P.G.M. Μέταλλα της ομάδας του Λευκόχρυσου", Θεσσαλονίκη 2006
- ↑ PLATINUM TODAY Production
- ↑ Hartman, H. L.; Britton, S. G., επιμ. (1992). SME mining engineering handbook. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. σελ. 69. ISBN 9780873351003.
- ↑ Βραβείo Νόμπελ Φυσικής 1968
- ↑ Alvarez L. W., Alvarez, W.; Asaro, F.; Michel, H. V. (1980). «Extraterrestrial cause for the Cretaceous–Tertiary extinction». Science 208 (4448): 1095– 1108. PMID 17783054.
- ↑ Hildebrand, A. R.; Penfield, Glen T.; Kring, David A.; Pilkington, Mark; Zanoguera, Antonio Camargo; Jacobsen, Stein B.; Boynton, William V. (1991). «Chicxulub Crater; a possible Cretaceous/Tertiary boundary impact crater on the Yucatan Peninsula, Mexico». Geology 19 (9): 867–871. doi:. http://geology.geoscienceworld.org/cgi/content/abstract/19/9/867.
- ↑ Toutain, J.-P.; Meyer, G. (1989). «Iridium-Bearing Sublimates at a Hot-Spot Volcano (Piton De La Fournaise, Indian Ocean)». Geophysical Research Letters 16 (12): 1391–1394. doi:.
- ↑ Stillwater Mining Company
- ↑ 20,00 20,01 20,02 20,03 20,04 20,05 20,06 20,07 20,08 20,09 Μανουσάκης Γ.Ε. "Γενική και Ανόργανη Χημεία", Τόμος 2ος, Θεσσαλονίκη 1981
- ↑ PLATINUM TODAY Price Charts
- ↑ Jollie D., "PLATINUM 2008" Published in May 2008 by Johnson Matthey, England
- ↑ G. K. White and A. T. Pawlowicz, J. (1970). «Crystallographic Properties of Iridium». Journal of Low Temperature Physics 2 (2): 631-639. http://dx.doi.org/10.1007/BF00628279.
- ↑ Arblaster, J. W. (2010). «Crystallographic Properties of Iridium». Platinum Metals Review 54 (2): 93-102. http://http://www.platinummetalsreview.com/dynamic/article/view/54-2-93-102#B25.
- ↑ Arblaster, J. W. (1995). «Osmium, the Densest Metal Known». Platinum Metals Review 39 (4): 164. http://www.platinummetalsreview.com/dynamic/article/view/pmr-v39-i4-164-164.
- ↑ 26,0 26,1 26,2 26,3 26,4 26,5 26,6 26,7 Cotton S.A., "Chemistry of Precious Metals", New York, 1997
- ↑ 27,0 27,1 The PGM database. Βάση δεδομένων για τα PGMs της εταιρείας "Johnson Matthey"
- ↑ Τεχνικά στοιχεία για το ιρίδιο
- ↑ Arblaster, J. W. (2003). «The discoverers of the iridium isotopes: the thirty-six known iridium isotopes found between 1934 and 2001». Platinum Metals Review 47 (4): 167–174. http://www.platinummetalsreview.com/dynamic/article/view/47-4-167-174.
- ↑ Environmental Chemistry
- ↑ SPI Supplies Division Structure Probe, Inc. "Material Safety Data Sheet : Iridium metal"
- ↑ IrCl3.6H2O MATERIAL SAFETY DATA SHEET
- ↑ 33,0 33,1 Mager Stellman, J. (1998). «Iridium». Encyclopaedia of Occupational Health and Safety. International Labour Organization. σελ. 63.19.
- ↑ Το ιρίδιο στα τρόφιμα
- ↑ 35,0 35,1 Μανουσάκης Γ.Ε. "Γενική και Ανόργανη Χημεία", Τόμος 1ος, Θεσσαλονίκη 1981
- ↑ 36,0 36,1 Τοσσίδης Ι. "Χημεία Ενώσεων Συναρμογής", Θεσσαλονίκη 1986
- ↑ Crabtree R.H., "The Organometallic Chemistry of the Transition Metals", Yale University, New Haven, Connecticut, 2005
- ↑ Παραγωγή οξικού οξέος από μεθανόλη (Μέθοδος Cativa)
- ↑ Mottishaw, J. (1999). «Notes from the Nib Works—Where's the Iridium?». The PENnant XIII (2). http://www.nibs.com/ArticleIndex.html.
- ↑ Comptes Rendus de la 1e CGPM (1889), 1890, 34
- ↑ Andrew Ure, M.D. (1808). A Dictionary of Art, Manufactures and Mines. 2, σελ. 910. http://books.google.gr/books?id=MAzLPjibkxkC&pg=PA910&lpg=PA910&dq=pigment+iridium+black&source=bl&ots=zYculI4sx-&sig=qJY3yFKfrqlGB3OxO4zHeZ7V4VY&hl=el&ei=_2vYS_89w5g4mezx2gY&sa=X&oi=book_result&ct=result&resnum=7&ved=0CDIQ6AEwBg#v=onepage&q=pigment%20iridium%20black&f=false.
- ↑ Darling, A. S. (1960). «Iridium Platinum Alloys» (PDF). Platinum Metals Review 4 (l): 23 fig. 6. http://www.platinummetalsreview.com/pdf/pmr-v4-i1-018-026.pdf.
- ↑ 43,0 43,1 Handley, J. R. (1986). «Increasing Applications for Iridium». Platinum Metals Review 30 (1): 12–13. http://www.platinummetalsreview.com/dynamic/article/view/pmr-v30-i1-012-013.
- ↑ Η μέθοδος Cativa για την παραγωγή οξικού οξέος με καρβονυλίωση μεθανόλης
- ↑ Halmshaw, R. (1954). «The use and scope of Iridium 192 for the radiography of steel». British Journal of Applied Physics 5: 238–243. doi:.
- ↑ Conill C, Sánchez-Reyes A, Molla M, Vilalta A. (2004). «Brachytherapy with 192Ir as treatment of carcinoma of the tarsal structure of the eyelid.». Int J Radiat Oncol Biol Phys. 59 (5): 1326-9. http://www.ncbi.nlm.nih.gov/pubmed/15275716.
- ↑ «Face-to-Face with Jerry Johnston, CXC Program Manager & Bob Hahn, Chief Engineer at Optical Coating Laboratories, Inc., Santa Rosa, CA». Harvard-Smithsonian Center for Astrophysics; Chandra X-ray Center. 1995. Ανακτήθηκε στις 24 Σεπτεμβρίου 2008.
- ↑ Möhl, D. (1997). «Production of low-energy antiprotons». Zeitschrift Hyperfine Interactions 109: 33–41. doi:.
- ↑ Morrison R. T., Boyd R. N. "Οργανική Χημεία" Τόμοι 1ος, 2ος, 3ος Μετάφραση:Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991
- ↑ Källström, K; Munslow, I; Andersson, P. G. (2006). «Ir-catalysed asymmetric hydrogenation: Ligands, substrates and mechanism». Chemistry – A European Journal 12 (12): 3194–3200. doi:. PMID 16304642.
Εξωτερικοί σύνδεσμοι
- Το "Όριο Κ-Τ" και η εξαφάνιση των δεινοσαύρων
- Υπόθεση Alvarez
- Εικόνες και φωτογραφίες από εφαρμογές του ιριδίου
- Φυσικές ιδιότητες του καθαρού ιριδίου σε υψηλή θερμοκρασία
- Αντιδράσεις μεταξύ ορισμένων αλκαλιμετάλλων και μετάλλων της ομάδας του λευκόχρυσου
- Κινητική ορισμένων αντιδράσεων του ιριδίου
- Ορυκτά που περιέχουν ιρίδιο
- Φαινόμενο Mo"ssbauer
- Κατεργασία του ιριδίου και των κραμάτων του
- Δημοσιεύσεις για τη "Βραχυθεραπεία"
- 3D μοντέλα ενώσεων του ιριδίου
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||




