Αραχνοτετραβοράνιο(10)
| Αραχνοτετραβοράνιο(10) | |||
|---|---|---|---|
| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Αραχνοτετραβοράνιο(10) | ||
| Άλλες ονομασίες | Δεκαϋδριδοτετραβόριο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | B4H10 | ||
| Μοριακή μάζα | 53,32 amu | ||
| Αριθμός CAS | 18283-93-7 | ||
| InChI | 1S/B4H10/c5-1-3(5)2(7-3)4(1,3,6-1)8-2/h3-4H,1-2H2 | ||
| ChemSpider ID | 21865171 | ||
| Δομή | |||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο βρασμού | 18°C | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το τετραβοράνιο(10)[1] [πλήρης συστηματική ονομασία αραχνοτετραβοράνιο(10) αγγλικά: arachno-tetraborane(10)] είναι ανόργανη δυαδική ένωση με μοριακό τύπο Β4Η10. Πιο συγκεκριμένα, ήταν το πρώτο υδρίδιο του βορίου, δηλαδή βοράνιο, που ταξινομήθηκε από τους Στοκ (Stock) και Μεσσενέζ (Messenez) το 1912 και πρωτοαπομονώθηκε από τον Άλφρεντ Στοκ (Alfred Stock). Έχει σχετικά χαμηλή θερμοκρασία βρασμού (18 °C) και επομένως είναι αέριο στη θερμοκρασία δωματίου (δηλαδή σε θερμοκρασία 20°C υπό 1 atm πίεση). Έχει αποκρουστική οσμή και είναι τοξικό.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
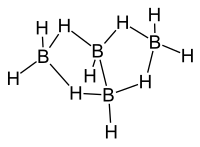
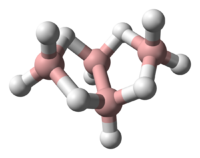
Η (δομή) της τάξης των βορανίων διευκρινίστηκε χρησιμοποιώντας ανάλυση με περίθλαση ακτίνων Χ από την ερευνητική ομάδα Λίπσκομπ (Lipscomb et Al) κατά τη δεκαετία του 1950. Τα δεδομένα της ανάλυσης έδειξαν την παρουσία πολυπυρηνικών (συνήθως τριπυρηνικών) δεσμών δύο ηλεκτρονίων. Αργότερα, η ανάλυση βασίστηκε σε δεδομένα υψηλής ευκρίνειας ακτίνων X για να επιτύχει ανάλυση υψηλής πυκνότητας ηλεκτρονιακού φορτίου.[2] Η σύγκριση των δεδομένων περίθλασης ακτίνων X και περίθλασης ηλεκτρονίων έδωσε τα ακόλουθα μήκη δεσμών και δεσμικές γωνίες: B1-B2: 184 pm, B1-B3: 171 pm, <B2B1B4: 98 ̊, Β-Η: 119 pm, Β1-Hμ: 133 pm, Β2-Ημ: 143 pm.[3]
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Η «μητρική» δομή των βορανίων αναφέρεται ως κλοσο- (closo), αλλά όταν η δεύτερη και η τρίτη κορυφή αφαιρείται η νέα δομή είναι B4H10 και αναφέρεται ως αραχνο- (arachno).
| Ονομασία δομής | Γενικός τύπος δομής | Σημειώσεις |
|---|---|---|
| κλοσο- (closo) | BvHv2- | Δεν είναι γνωστά ουδέτερα βοράνια με γενικό τύπο BvHv+2. Αν τυχόν υπήρχαν, για v = 4 θα είχαμε «κλοσοτετραβοράνιο(6)», με μοριακό τύπο B4H6. |
| νιντο- (nido) | BvHv+4 | Σε αυτήν τη δομή το αντίστοιχο τετραβοράνιο (v = 4) θα ήταν το «νιντοτετραβοράνιο(8)», με μοριακό τύπο B4H8 |
| αραχνο- (arachno) | BvHv+6 | Δομή του αραχνοτετραβορανίου(10), με μοριακό τύπο B4H10 |
| υφο- (hypho) | BvHv+8 | Μόνο σύμπλοκα αυτής της δομής έχουν βρεθεί. Σε αυτήν τη δομή το αντίστοιχο τετραβοράνιο (v = 4) θα ήταν το «υφοτετραβοράνιο(12)», με μοριακό τύπο B4H12 |
Το βόριο συχνά λέγεται ότι έχει «έλλειμμα ηλεκτρονίων», γιατί έχει τρία (3) ηλεκτρόνια σθένους, ενώ (για παράδειγμα) ο άνθρακας έχει τέσσερα (4). Στην πραγματικότητα, όμως, το βόριο είναι σταθερό και σε καμιά περίπτωση δεν έχει πραγματικό έλλειμμα ηλεκτρονίων. Η λύση της φύσης σε αυτό το «έλλειμμα» είναι ο σχηματισμός «γεφυρών υδρογόνου», δηλαδή ο σχηματισμός δεσμών τριών κέντρων και δύο ηλεκτρονίων με κάποια άτομα υδρογόνου, ή σχηματίζοντας πρωτονιωμένους διπλούς δεσμούς στη δομή κάποιων ενώσεών του.[4] Κάθε άτομο βορίου στο αραχνοτετραβοράνιο(10) βρίσκεται σε sp3 υβριδισμό, αφού η διαμόρφωση των τριών (3) ατόμων υδρογόνου που περιβάλλουν τα άτομα βορίου #1 και #3 είναι κατά προσέγγιση τριγωνική, προτείνοντας έτσι τον τετραεδρικό sp3 υβριδισμό για τα άτομα βορίου, αφού σε περίπτωση sp2 υβριδισμού θα προβλέπονταν δεσμικές γωνίες των 120 ̊. Ωστόσο η σχετική τοποθέτηση των ατόμων του βορίου μπορεί να θεωρηθεί ότι ταξινομείται τόσο ως τμήμα εικοσαέδρου, όσο και ως τμήμα οκταέδρου, γιατί οι δεσμικές γωνίες είναι στην πραγματικότητα μεταξύ 105 ̊ και 90 ̊. [5] Η δεσμολογία του μορίου παράγει γεωμετρία πεταλούδας στην αραχνο- δομή. Η (σχετική) θεωρία πολυεδρικής συντακτικής δομής ηλεκτρονιακών ζευγών (Polyhedral Skeletal Electron Pair Theory, PSEPT) αρχικά ανακαλύφθηκε από τον Κέννεθ Γουέντ (Kenneth Wade) και συχνά αναφέρεται επίσης ως «κανόνες Γουέντ» (Wade’s rules). Αυτοί οι κανόνες μπορούν να χρησιμοποιηθούν για να μετρηθούν ηλεκτρόνια σε δομές ενώσεων όπως τα υδρίδια του βορίου. [6]
Ισομέρεια[Επεξεργασία | επεξεργασία κώδικα]
Κάποιοι επιστήμονες εργάζονται για να παραγάγουν το δι(διβορανύλιο), ως δομικό ισομερές του αραχνοτετραβοράνιου. Το δι(διβορανύλιο) αναμένεται να έχει χαμηλότερη ενέργεια στο επίπεδο της μεθόδου Χαντρί-Φοκ (Hartree-Fock method, HF). Χρησιμοποιώντας την αντίδραση Βουλτζ (Wurtz reaction) για να ζευγαρωθεί το ιωδοδιβοράνιο(6) (B2H5I), παρουσία αμαγάλματος νατρίου (κατά αναλογία της παραγωγής βουτανίου με αντίστοιχη αντίδραση ιωδαιθανίου), οι συγκεκριμένοι επιστήμονες πιστεύουν ότι έχουν παραγάγει δι(διβορανύλιο). Εφόσον το ισομερές αυτό παράχθηκε, προσπάθησαν να ανακαλύψουν το μηχανισμό που θα μπορούσε να χρησιμοποιηθεί για τη μετατροπή του δι(διβορανυλίου) σε αραχνοτετραβοράνιο(10). Αντί, όμως, να ανακαλύψουν το μηχανισμό, δημιούργησαν τρεις (3) διαφορετικές παραγωγικές οδούς:
- Ενδιάμεσα διασπαστική παραγωγική οδός σε τριβοράνιο(7) και βοράνιο, που προτάθηκε από τον ΜακΚι (McKee).
- Συντονισμένη παραγωγική οδός με δυο μεταβατικές καταστάσεις, που διαχωρίζονται από ένα τοπικό ελάχιστο, και είναι διαφορετική από αυτές που πρότεινε ο ΜακΚι.
- Περιλαμβάνει πενταμερή ως ενδιάμεσα. Επίσης συντονισμένη παραγωγική οδός.
Οι παραγωγικές οδοί #2 και #3 είναι περισσότερο πιθανές, επειδή πλεονεκτούν ενεργειακά, με ενέργειες 33,1 kcal/mol και 22,7 kcal/mol, αντιστοίχως.[7]
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Το τετραβοράνιο μπορεί να παραχθεί με αντίδραση ανάμεσα σε οξύ και βοριούχο μαγνήσιο (Mg3B2). Εναλλακτικά χρησιμοποιούνται επίσης το βοριούχο αργίλιο (AlB) ή το βοριούχο βηρύλλιο (Be3B2). Επίσης, μπορεί να αξιοποιηθεί η υδρόλυση βοριούχου μαγνησίου. Η υδρογόνωση αλογονιδίων του βορίου (BX3) σε υψηλή θερμοκρασία και η πυρόλυση διβορανίου(6) δίνουν επίσης τετραβοράνιο. Η υδρόλυση βοριούχου μαγνησίου ήταν μια από τις πρώτες αντιδράσεις που χρησιμοποιήθηκαν για την παραγωγή τετραβορανίου και δίνει σχετικά υψηλή απόδοση, πιο συγκεκριμένα περί το 14%. Το φωσφορικό οξύ (H3PO4) αποδείχθηκε το πιο αποτελεσματικό οξύ για την παραγωγή τετραβορανίου από βοριούχο μαγνήσιο, τουλάχιστον σε σύγκριση με το υδροχλωρικό οξύ (HCl) και με το θειικό οξύ (H2SO4). Όπως προαναφέρθηκε, η αντίδραση αλογονιδίων του βορίου με υδρογόνο, παρουσία υδριδίων μετάλλων και σε υψηλές θερμοκρασίες, επίσης παράγει τετραβοράνιο.[8]
Ασφάλεια[Επεξεργασία | επεξεργασία κώδικα]
Επειδή η ένωση οξειδώνεται εύκολα, πρέπει να διατηρείται υπό κενό. Το τετραβοράνιο αναφλέγεται όταν έρθει σε επαφή με τον αέρα, το οξυγόνο ή το νιτρικό οξύ (HNO3). Τα βοράνια γενικά, που φυσικά συμπεριλαμβάνουν το τετραβοράνιο, έχουν αποδειχθεί πολύ τοξικά και καταστροφικά για τα βιολογικά συστήματα. Σταθερή μικρή έκθεση κουνελιών ή αρουραίων σε αυτά τα χημικά κατέληξε στο θάνατό τους.[9]
Παρηρήσεις, υποσημειώσεις και αναφορές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Σημείωση: Δείτε και τις εναλλακτικές ονομασίες στον πίνακα πληροφοριών.
- ↑ 5. Forster, Diana. et. Al. (2007). Inorg. Chem. “On the 2-Electron 3-Center B—H—B Bond: Charge Density Determination of Tetraborane(10).
- ↑ 6. Lipscomb, William N. Boron Hydrides. New York: W. A. Benjamin, 1963. Print.
- ↑ Grimes, Russel N. "Boron." Advanced Inorganic Chemistry. By F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo, and Manfred Bochmann. 6th ed. N.p.: n.p., 1999. 143-46. Print.
- ↑ Lipscomb, William N. Boron Hydrides. New York: W. A. Benjamin, 1963. Print.
- ↑ Grimes, Russel N. "Boron." Advanced Inorganic Chemistry. By F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo, and Manfred Bochmann. 6th ed. N.p.: n.p., 1999. 143-46. Print.
- ↑ Ramakrishna, Vinutha and Duke, Brian J. (2004). Inorg. Chem. “Can the Bis(diboranyl) Structure of B4H10 Be Observed? The Story Continues.”
- ↑ Dain, C. J.; Downs, A. J.; Laurenson, G. S.; Rankin, D. W. H. (1981). «The Molecular Structure of Tetraborane(10) in the Gas Phase as determined by a Joint Analysis of Electron-diffraction and Microwave Data». Journal of the Chemical Society, Dalton Transactions 1981 (2): 472–477. doi:.
- ↑ «Archived copy» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 27 Ιουλίου 2011. Ανακτήθηκε στις 11 Μαΐου 2011.
| ||||||||||||||||||||||||||||||||||||
