Αλδεΰδες
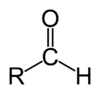
Οι αλδεΰδες είναι ένα υποσύνολο των οξυγονούχων οργανικών ενώσεων, που περιέχουν ως κύρια χαρακτηριστική ομάδα, μια τουλάχιστον «φορμυλομάδα» ή «αλδεϋδομάδα» (-CHO). Η φορμυλομάδα αποτελείται από ένα «καρβονύλιο» (C=O, δηλαδή άτομο άνθρακα συνδεμένο με διπλό δεσμό με ένα άτομο οξυγόνου) και ένα άτομο υδρογόνου[1]. Ο γενικός τους τύπος είναι, λοιπόν, RCHO, όπου R μονοσθενής ανθρακούχα ομάδα (που κανονικά όμως δεν πρέπει περιέχει «ανώτερες» από το φορμύλιο χαρακτηριστικές ομάδες) ή υδρογόνο.
Ως χαρακτηριστική ομάδα, η φορμυλομάδα έπεται, ως προς το χαρακτηρισμό «κύρια χαρακτηριστική ομάδα», του καρβοξυλίου με τύπο [(-COOH) και άλλων όξινων ομάδων, όπως για παράδειγμα της σουλφοξυομάδας (-SO3H) (καθώς και των παραγώγων τους όπως εστέρες, άλατα, αμίδια και αλογονίδια)] καθώς και κυανομάδας (-C≡Ν) των νιτριλίων, της ισοκυανομάδας [(-Ν=C:) καθώς επίσης και ανάλογων ομάδων με φωσφόρο, αρσενικό και αντιμόνιο]. Προηγείται, όμως, όλων των υπόλοιπων χαρακτηριστικών ομάδων. Οι ενώσεις που περιέχουν αλδεϋδομάδες ως δευτερεύουσες χαρακτηριστικές ομάδες έχουν ορισμένες ιδιότητες των αλδεϋδών και ενίοτε συγκατατάσσονται στις αλδεΰδες, από ορισμένους συγγραφείς.
Οι αλδεΰδες διαφέρουν, λοιπόν, από τις κετόνες ακριβώς στην παρουσία ενός ατόμου υδρογόνου, συνδεομένου με το καρβονύλιό τους. Στις αλδεΰδες ένα (1) καρβονύλιο βρίσκεται αναγκαστικά στο τέλος της κύριας ανθρακικής αλυσίδας της ένωσης.
Οι αλδεΰδες, αν και είναι περισσότερο δραστικές, έχουν παραπλήσιες χημικές ιδιότητες με τις κετόνες με ενδιαφέρουσες και ποικίλες χρήσεις στη βιομηχανία, αποτελώντας χημικά ενδιάμεσα που με διάφορες χημικές αντιδράσεις μετατρέπονται σε άλλες ενώσεις, χρήσιμες στη παραγωγή διαφόρων προϊόντων όπως αρωμάτων, πλαστικών, απορρυπαντικών και φαρμακευτικών προϊόντων. Επίσης, πολλές βιοχημικές ενώσεις περιέχουν αλδεϋδικές ομάδες (ομάδες αλδεϋδών), όπως τα σάκχαρα (συγκεκριμένα οι αλδόζες) και κάποιες στεροειδείς ορμόνες.
Δομή και δεσμολογία
[Επεξεργασία | επεξεργασία κώδικα]Οι αλδεΰδες περιέχουν ως κύρια χαρακτηριστική ομάδα το καρβονύλιο, το οποίο αποτελείται από ένα κεντρικό άτομο άνθρακα με sp² υβριδισμό, που σχηματίζει σε επίπεδο σχήμα, ένα διπλό δεσμό με το άτομο οξυγόνου (επίσης σε sp² υβριδισμό), και δύο (2) απλούς σ δεσμούς, έναν με το άτομο υδρογόνου και ένα με το πρώτο άτομο άνθρακα της μονοσθενούς ανθρακούχας ομάδας R (εξαιρείται βέβαια η μεθανάλη, όπου το καρβονύλιο συνδέεται με δύο (2) άτομα υδρογόνου). Η αλδεϋδομάδα είναι πολωμένη, αφού το οξυγόνο είναι πιο ηλεκτραρνητικό από τον άνθρακα [περίπου 3,5 έναντι 2,5 κατά Πόλινγκ (Pauling)]. Έτσι, το ανθρακοάτομο της αλδεϋδομάδας έχει (στατιστικό) θετικό ηλεκτρικό φορτίο και το οξυγονοάτομο αρνητικό. Το ίδιο το υδρογονοάτομο της φορμυλομάδας γενικά δεν είναι πρακτικά όξινο. Αλλά, εξαιτίας της μερικής σταθεροποίησης της συζυγούς βάσης, λόγω μεσομέρειας, αν υπάρχει άτομο υδρογόνου συνδεμένο στο α- άτομο άνθρακα της ομάδας R, η αλδεΰδη είναι πολύ πιο όξινη, με pKa συνήθως γύρω στο 17, σε σύγκριση με τον αντίστοιχο υδρογονάνθρακα, που συνήθως έχουν pKa γύρω στο 50[2]. Αυτή η σχετική αύξηση στην οξύτητα αποδίδεται στις ακόλουθες αιτίες:
- Στη σχετικά αυξημένη ηλεκτραρνητικότητα της φορμυλομάδας, που είναι κάπως πολική.
- Η συζυγής βάση είναι ένα ενολικό ανιόν (γενικού τύπου -C-=CHOH), που διασπείρει με μεσομέρεια το αρνητικό του φορτίο, σταθεροποιώντας το έτσι, σχετικά πάντα. Σημειώνεται ότι οι αλδεΰδες (με εξαίρεση αυτές που δεν διαθέτουν α-άτομο άνθρακα, όπως η μεθανάλη, η βενζαλδεΰδη και παράγωγα της τελευταίας) βρίσκονται σε χημική ισορροπία με τις ταυτομερείς τους ενόλες. Η ισορροπία αυτή καταλύεται από την παρουσία οξέων ή βάσεων. Συνήθως οι ενόλες αυτές αποτελούν ελάχιστη μειονότητα στο μείγμα, αλλά είναι πιο δραστικές, και έτσι, καθώς βρίσκονται σε χημική ισορροπία, με τυχούσα κατανάλωσή τους, παράγεται νέα ποσότητα.
- Και άτομα υδρογόνου που συνδέονται με άτομα άλλων χημικών στοιχείων που βρίσκονται σε α-θέση, δηλαδή σε δίπλα, σε αλδεϋδομάδα, επίσης είναι πιο όξινα σε σύγκριση με αντίστοιχες ενώσεις στις οποίες οι ίδιες ομάδες δεν βρίσκονται δίπλα σε αλδεϋδομάδα.
- Γενικά οι αλδεΰδες εξετάζονται συχνά μαζί με τις κετόνες, λόγω των πολλών ομοίων φυσικών και χημικών ιδιοτήτων αλλά και της παρασκευής των, που οφείλεται βεβαίως στη κοινή καρβονυλομάδα ή καρβονύλιο. Εξ αυτού του λόγου και οι δύο αυτές ομάδες χαρακτηρίζονται καρβονυλικές ενώσεις. Από την άλλη, υπάρχουν και αρκετές ιδιότητες στις οποίες διαφέρουν και έτσι δικαιολογείται η μεταξύ τους διάκριση.
Κατηγοριοποίηση
[Επεξεργασία | επεξεργασία κώδικα]Το πρώτο κριτήριο κατηγοριοποίησης των αλδεϋδών είναι η τυχούσα παρουσία και δευτερευόντων χαρακτηριστικών ομάδων. Έτσι έχουμε π.χ. τις αμιναλδεΰδες, αν έχουμε και αμινομάδες (-ΝR2), κ.τ.λ..
Το δεύτερο κριτήριο κατηγοριοποίησης των αλδεϋδών είναι η τυχόν παρουσία περισσότερων της μιας αλδεϋδομάδας. Έτσι έχουμε π.χ. τις διάλες, τριάλες, κ.τ.λ..
Ακόμη, ανάλογα με το είδος της ανθρακικής τους αλυσίδας, οι αλδεΰδες διακρίνονται σε τρεις επιμέρους κατηγορίες:
- Αλειφατικές αλδεΰδες: Σε αυτές περιλαμβάνονται οι αλδεΰδες που δεν περιέχουν δακτύλιο στην ανθρακική τους αλυσίδα.
- Αλεικυλικές αλδεΰδες: Σε αυτές περιλαμβάνονται οι μη αρωματικές και μη αντιαρωματικές αλδεΰδες που περιέχουν έναν τουλάχιστον δακτύλιο στην ανθρακική τους αλυσίδα.
- Αρωματικές αλδεΰδες: Σ΄αυτές περιλαμβάνονται οι αλδεΰδες που περιέχουν έναν τουλάχιστον αρωματικό δακτύλιο, όπως η βενζαλδεΰδη, η ανισαλδεΰδη και η βανιλίνη.
- Αντιαρωματικές αλδεΰδες: Σ΄αυτές περιλαμβάνονται οι αλδεΰδες που περιέχουν έναν τουλάχιστον αντιαρωματικό δακτύλιο, όπως η κυκλοβουταδιενοκαρβοξαλδεΰδη.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «aldehyde», από την οποία προήλθε και ο εξελληνισμένος όρος «αλδεΰδη», προέρχεται από τη φράση «alcohol dehydrogenatum», δηλαδή αφυδρογονωμένη αλκοόλη[3][4].
Η ονομασία κάθε αλδεΰδης προέρχεται από την ονομασία του υδρογονάνθρακα στον οποίο αντιστοιχεί η κύρια ανθρακική αλυσίδα της ένωσης, αλλά η κατάληξη «-ιο», αντικαθίσταται με την «-άλη», π.χ. μεθάνιο → μεθανάλη, αιθάνιο → αιθανάλη, προπάνιο → προπανάλη, βουτένιο → βουτενάλη, κ.τ.λ..
Η τυχούσα παρουσία και δεύτερης αλδεϋδομάδας σημειώνεται με ένα πρόθεμα -δι-. Π.χ. αιθανοδιάλη, προπανοδιάλη, κ.τ.λ.. Αν τυχόν υπάρχουν περισσότερες αλδεϋδομάδες ή αν είναι απαραίτητο για λόγους απλούστευσης της ονομασίας της ένωσης, οι αλδεϋδομάδας μπορούν να μπουν και ως υποκαταστάτες, με τον αύξοντα αριθμό του ανθρακοατόμου της κύριας αλυσίδας στο οποίο ενώνεται η φορμυλομάδα, με το πρόθεμα «φορμυλο-». Π.χ. 2-φορμυλοπεντανοδιάλη.
Αν συνυπάρχουν δευτερεύουσες χαρακτηριστικές ομάδες, αυτές μπαίνουν ως προθέματα μπροστά από το κυρίως όνομα της αλδεΰδης, με τους αριθμούς θέσης τους, αν είναι απαραίτητο. Π.χ. 2-αμιναιθανάλη.
Αλδεΰδες με εμπειρικές ονομασίες
[Επεξεργασία | επεξεργασία κώδικα]- Μεθανάλη ή φορμαλδεΰδη (HCHO).
- Αιθανάλη ή ακεταλδεΰδη (CH3CHO).
- Προπανάλη ή προπιοναλδεΰδη (C2H5CHO).
- Τριχλωραιθανάλη ή χλωράλη (CCl3CHO).
- Προπενάλη ή ακρολεΐνη (CH2=CHCHO).
- Αιθανοδιάλη ή γλυοξάλη (HCOCHO).
Αρωματικές αλδεΰδες
[Επεξεργασία | επεξεργασία κώδικα]- Βενζαλδεΰδη (PhCHO).
- Ανισαλδεΰδη (
 ).
). - Σαλικυλική αλδεΰδη (
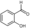 ).
). - Βανιλίνη (
).
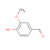
- Πιπερονάλη (
 ).
). - Φαινογλυοξάλη (
 ).
).
- Γλυκεριναλδεΰδη (HOCH2CHO).
- Ριβόζη (
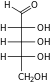 ).
). - Δεοξυριβόζη (
 ).
). - Αραβινόζη (
 ).
). - Γλυκόζη (
 ).
). - Γαλακτόζη (
 ).
).
Φυσική παρουσία αλδεϋδών
[Επεξεργασία | επεξεργασία κώδικα]Ίχνη πολλών αλδεϋδών βρίσκονται σε αιθέρια έλαια και συχνά συνεισφέρουν στις ευχάριστες οσμές τους. Παραδείγματα: κιναμαλδεΰδη, κίλαντρο (ένωση από το φυτό κόλιαντρο) και βανιλίνη. Πιθανότατα εξαιτίας της υψηλής δραστικότητας της αλδεϋδομάδας τους, οι αλδεΰδες δεν είναι συνηθισμένες σε αρκετές δομικές ομάδες που συμπεριλαμβάνουν τα αμινοξέα, τα νουκλεϊκά οξέα και τα λιπίδια. Ωστόσο, τα περισσότερα σάκχαρα είναι αλδόζες, δηλαδή τυπικά ανήκουν στις αλδεΰδες, αν και στην πρακτικά βρίσκονται στην ταυτομερή μορφή ημιακεταλών, που είναι μια μορφή «προστατευμένων» αλδεϋδών. Πάντως, σε υδατικά τους διαλύματα υπάρχουν, έστω και μειοψηφικά, και στη μορφή αλδεϋδών.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν αρκετές μέθοδοι για την παραγωγή αλδεϋδών[5], αλλά η περισσότερο χρησιμοποιούμενη από αυτές είναι η υδροφορμυλίωση. Παράδειγμα εφαρμογής της μεθόδου αυτής αποτελεί η παραγωγή βουτανάλης από προπένιο:
Οξειδωτικές παραγωγικοί οδοί
[Επεξεργασία | επεξεργασία κώδικα]Οι αλδεΰδες παράγονται συχνά με οξείδωση των αντιστοίχων πρωτοταγών αλκοολών:
Στη βιομηχανία, η μεθανάλη παράγεται σε μεγάλη κλίμακα με οξείδωση μεθανόλης[6]:
Σε αυτήν τη συγκεκριμένη περίπτωση ως οξειδωτικό μέσο επιλέγεται το οξυγόνο, γιατί συμβαίνει να είναι και «πράσινο» και οικονομικό:
Για παραγωγή αλδεϋδών σε εργαστηριακή κλίμακα χρησιμοποιούνται κατά περίπτωση πιο εξειδικευμένες οξειδωτικές μέθοδοι, αλλά γενικά τα οξειδωτικά αντιδραστήρια που βασίζονται στο CrVI, χρησιμοποιούνται περισσότερο. Πιο συγκεκριμένα, συνήθως η οξείδωση επιτυγχάνεται με επίδραση όξινου διαλύματος διχρωμικού καλίου σε πρωτοταγή αλκοόλη [7]
Χρειάζεται, όμως, προσοχή, γιατί τυχούσα περίσσεια διχρωμικού καλίου ή η χρήση ισχυρότερων οξειδωτικών μέσων οδηγεί στην παραγωγή του αντιστοίχου καρβοξυλικού οξέος (RCO2H). Γι' αυτό η αλδεΰδη πρέπει να αποστάζεται άμεσα καθώς παράγεται, αν είναι πτητική, ή να προτιμηθούν ηπιότερα οξειδωτικά μέσα για την παραγωγή της, όπως το χλωροχρωμικό πυριδινώνιο (PyCrClO3, PCC: Pyridinium ChloroChromate, όπου Py πυριδινώνιο, ![]() )[8]:
)[8]:
Άλλες μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση οργανομαγνησιακών ενώσεων σε φορμικούς εστέρες[9]:
2. Με αναγωγή ακυλαλογονιδίων[10]:
4. Με επίδραση υπεριωδικού οξέος (HIO4) σε δευτεροταγείς διόλες[11]:
- όπου R και R΄ μονοσθενείς ανθρακούχες ρίζες. Συνήθως προτιμάται R = R΄, ώστε να μην παράγεται μείγμα δύο (2) αλδεϋδών.
Παράγωγα αλδεϋδών
[Επεξεργασία | επεξεργασία κώδικα]Παράγωγα που δίνουν οι αλδεΰδες και όχι οι κετόνες
[Επεξεργασία | επεξεργασία κώδικα]1. Οξείδωση προς καρβοξυλικά οξέα:
- α. Με υπερμαγγανικό κάλιο (KMnO4):
- β. Με διχρωμικό κάλιο (K2Cr2O7):
- γ. Με διοξυγόνο (O2):
2. Προσθήκη αλκοολών και σχηματισμός ακεταλών:
(ημιακετάλη)
(ακετάλη)
3. Οξειδοαναγωγή Cannizzaro προς καρβοξυλικό οξύ και αλκοόλη. Πραγματοποιείται από αλδεΰδες που δεν έχουν υδρογονοάτομο στον άνθρακα #2, π.χ. από τις αλδεΰδες γενικού τύπου R3CCHO:
4. Πολυμερισμός:
- β. Πολυμερισμός μεθανάλης προς παραφορμαλδεΰδες:
παραφορμαλδεΰδη, όπου
- γ. Πολυμερισμός μεθανάλης προς πολυοξυμεθυλένια:
πολυοξυμεθυλένιο, όπου
- δ. Τριμερισμός αιθανάλης προς παραλδεΰδη[16]:
παραλδεΰδη
- Οι υπόλοιπες αλδεΰδες δίνουν ανάλογα πολυμερή παράγωγα.
Παράγωγα που δίνουν οι αλδεΰδες και οι κετόνες
[Επεξεργασία | επεξεργασία κώδικα]1. Ενολοποίηση:
2. Αναγωγή προς αλκοόλες:
- α. Με LiAlH4 ή NaBH4:
- β. Καταλυτική υδρογόνωση:
3. Αναγωγή προς υδρογονάνθρακες:
- Μέθοδος Wolff-Kishner:
4. Οξείδωση με διοξείδιο του σεληνίου (SeO2):
5. Αντιδράσεις προσθήκης:
- α. Προσθήκη ύδατος προς παραγωγή 1,1΄-διολών:
- β. Προσθήκη διολών. Π.χ. αιθανοδιόλης:
2-αλκυλο-1,3-διοξολάνιο
- γ. Προσθήκη διθειολών. Π.χ. αιθανοδιθειόλης:
2-αλκυλο-1,3-διθειολάνιο
- ε. Προσθήκη υδροξυλαμίνης προς σχηματισμός οξίμης:
- ζ. Προσθήκη φαινυλυδραζίνης προς σχηματισμό φαινυλυδραζόνης:
- η. Προσθήκη καρβαμιδουδραζίνης προς σχηματισμό καρβαμιδουδραζόνης:
Παραπομπές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ IUPAC Gold Book aldehydes
- ↑ Chemistry of Enols and Enolates - Acidity of alpha-hydrogens.
- ↑ J. Liebig (1835) "Sur les produits de l'oxidation de l'alcool" (On the products of the oxidation of alcohol), Annales de Chimie et de Physique, 59 : 289–327. From page 290: "Je le décrirai dans ce mémoire sous le nom d'aldehyde ; ce nom est formé de alcool dehydrogenatus." (I will describe it in this memoir by the name of aldehyde ; this name is formed from alcohol dehydrogenatus.)
- ↑ Crosland, Maurice P. (2004), Historical Studies in the Language of Chemistry, Courier Dover Publications.
- ↑ Bertleff, W.; Roeper, M. and Sava, X. (2003) "Carbonylation" in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim. doi:10.1002/14356007.a05_217.pub2
- ↑ Reuss, G.; Disteldorf, W.; Gamer, A. O. and Hilt, A. (2005) "Formaldehyde" in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a11_619.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.2.
- ↑ Ratcliffe, R. W. (1988), «Oxidation with the Chromium Trioxide-Pyridine Complex Prepared in situ: 1-Decanal», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv6p0373; Coll. Vol. 6: 373
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.6.
- ↑ Ταυτοποίηση ύπαρξης ή μη αλδεϋηδομάδας.
- ↑ Πρόκειται για αμμωνιακό διάλυμα AgNO3, που αντιστοιχεί σε AgOH.
- ↑ Ταυτοποίηση ύπαρξης ή μη αλδεϋδομάδας, γνωστό και ως "Φελίγγειο υγρό"
- ↑ Πρόκειται για διάλυμα CuSO4 (διάλυμα Fehling A) και διάλυμα NaOH (διάλυμα Fehling B), που το μείγμα τους αντιστοιχεί σε CuO + NaOH.
- ↑ Πρόκειται για το τριμεθυλοτριοξάνιο.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
| ||||||||||||||||||||||||||
| |||||||||||||||||||||||
|














![{\displaystyle \mathrm {RCH=CHR{\acute {}}+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}RCHO+R{\acute {\;}}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f4bae6a9f9a313707a36a7cf0086a7c17209283)















![{\displaystyle \mathrm {4RCHO+LiAlH_{4}{\xrightarrow {}}Li[Al(RCH_{2}O)_{4}]{\xrightarrow {+3H_{2}O}}4RCH_{2}OH+LiAlO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4fe51d9c3d7b1587d77af6062eec7867b816755)











