Γλυκίνη
| Γλυκίνη | |
|---|---|

| |

| |

| |

| |

| |
| Γενικά | |
| Όνομα IUPAC | 2-αμιναιθανικό οξύ |
| Άλλες ονομασίες | Γλυκίνη Αμινοοξικό οξύ Γλυκόκολλα |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C2H5NO2 |
| Μοριακή μάζα | 75,07 amu |
| Σύντομος συντακτικός τύπος |
H2NCH2COOH |
| Συντομογραφίες | gly, G |
| Αριθμός CAS | 56-40-6 |
| SMILES | NCC(=O)O |
| Αριθμός EINECS | 200-272-2 |
| Αριθμός RTECS | SJ3325000 |
| PubChem CID | 750 |
| ChemSpider ID | 730 |
| Κωδικός προσθέτου τροφίμων |
E640 |
| Ισομέρεια | |
| Ισομερή θέσης | 61 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 233 °C (διάσπαση) |
| Πυκνότητα | 1.160,7 kg/m3 |
| Διαλυτότητα στο νερό |
250 g/m3 |
| Εμφάνιση | λευκό κρυσταλλικό στερεό |
| Χημικές ιδιότητες | |
| pKa | 2,35 (COOH) 9,13 (NH2) |
| pI | 6,06[1] |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η γλυκίνη (αγγλικά: glycine) ή γλυκόκολλα, με διεθνή σύντμηση Gly ή G,[2] κατά τη συστηματική ονομασία (IUPAC) 2-αμιναιθανικό οξύ, είναι το απλούστερο αμινοξύ. Οι κωδικές τριπλέτες του γενετικού κώδικα που αντιστοιχούν σ' αυτό είναι οι ακόλουθες: GGU, GGC, GGA και GGG. Η γλυκίνη είναι ακόμη το μοναδικό μη χειρόμορφο πρωτεϊνογόνο αμινοξύ. Οι περισσότερες πρωτεΐνες το περιέχουν σε μικρά ποσοστά, αλλά το κολλαγόνο αποτελεί μια αξιόλογη εξαίρεση στον προηγούμενο κανόνα, αφού περιέχει 35% γλυκίνη.[3] Η χημικά καθαρή γλυκίνη, στις κανονικές συνθήκες περιβάλλοντος, είναι άχρωμο και γλυκό στη γεύση κρυσταλλικό στερεό. Παγκοσμίως παράγονται βιομηχανικά περίπου 15.000 τόννοι το χρόνο.[4]
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το μοριακό τύπο της, C2H5NO2, έχει τα ακόλουθα 61 ισομερή θέσης:
- Νιτροαιθάνιο με σύντομο συντακτικό τύπο: CH3CH2NO2
- Νιτρώδης αιθυλεστέρας με σύντομο συντακτικό τύπο: CH3CH2ONO (ο αιθυλεστέρας του νιτρώδους οξέος).
- 1-νιτρωδοαιθανόλη με σύντομο συντακτικό τύπο: CH3CH(NO)OH (σε δύο (2) οπτικά ισομερή).
- 2-νιτρωδοαιθανόλη με σύντομο συντακτικό τύπο: ONCH2CH2OH (σε δύο (2) οπτικά ισομερή).
- Αμινοαιθενοδιόλη-1,1 με σύντομο συντακτικό τύπο: H2NCH=C(OH)2.
- Αμινοαιθενοδιόλη-1,2 με σύντομο συντακτικό τύπο: HOCH=C(NH2)OH (σε δύο (2) γεωμετρικά ισομερή).
- 1-υδροξυαμινοαιθενόλη με σύντομο συντακτικό τύπο: CH2=C(OH)NHOH.
- 1-υδροξυαμινοαιθενόλη με σύντομο συντακτικό τύπο: HOCH=CHNHOH (σε δύο (2) γεωμετρικά ισομερή).
- Αιθενοδιυδροξυλαμίνη με σύντομο συντακτικό τύπο: CH2=CHN(OH)2.
- Ιμινοαιθανοδιόλη-1,1 με σύντομο συντακτικό τύπο: HN=CH2CH(OH)2.
- Ιμινοαιθανοδιόλη-1,2 με σύντομο συντακτικό τύπο: HOCH2C(=NH)OH.
- 1-υδροξιμινοαιθανόλη με σύντομο συντακτικό τύπο: CH3C(OH)=NOH.
- 1-υδροξιμινοαιθανόλη με σύντομο συντακτικό τύπο: HOCH2CH=NOH.
- Μεθυλιμινομεθανοδιόλη με σύντομο συντακτικό τύπο: CH3N=C(OH)2.
- Ν-υδροξυμεθυλιμινομεθανόλη με σύντομο συντακτικό τύπο: HOCH2N=CHOH.
- Μεθοξυϊμινομεθανόλη με σύντομο συντακτικό τύπο: HN=C(OCH3)OH.
- Μεθυλεναμινοξυμεθανόλη με σύντομο συντακτικό τύπο: HOCH2ON=CH2.
- 1-μεθοξυϊμινομεθανόλη με σύντομο συντακτικό τύπο: CH3OC(=NH)OH.
- N-μεθοξυϊμινομεθανόλη με σύντομο συντακτικό τύπο: CH3ON=CHOH.
- (Ιμινομεθοξυ)μεθανόλη με σύντομο συντακτικό τύπο: HN=CHOCH2OH.
- Μεθοξυμεθανοϋδροξυλιμίνη με σύντομο συντακτικό τύπο: CH3OCΗ=NOH.
- Αμινοϋδροξυαιθανάλη με σύντομο συντακτικό τύπο: HOCH(NH2)CHO (σε δύο (2) οπτικά ισομερή).
- (Υδροξυαμινο)αιθανάλη με σύντομο συντακτικό τύπο: HONHCH2CHO.
- Μεθυλοκαρβαμικό οξύ με σύντομο συντακτικό τύπο: CH3ΝΗCOOH.
- Καρβαμικός μεθυλεστέρας με σύντομο συντακτικό τύπο: H2NCOΟCH3.
- Μεθανικός αμινομεθυλεστέρας με σύντομο συντακτικό τύπο: HCOΟCH2NH2.
- Μεθανικός μεθυλαμινεστέρας με σύντομο συντακτικό τύπο: HCOΟNHCH2.
- 1-υδροξυαιθαναμίδιο με σύντομο συντακτικό τύπο: HOCH2CONH2.
- N-υδροξυαιθαναμίδιο με σύντομο συντακτικό τύπο: CH3CONHOH.
- (Υδροξυμεθυλο)μεθαναμίδιο με σύντομο συντακτικό τύπο: HCONHCH2OH.
- Μεθυλυδροξυμεθαναμίδιο με σύντομο συντακτικό τύπο: HCON(OH)CH3.
- 1,2,3-διοξαζολιδίνη με σύντομο συντακτικό τύπο:
 .
. - 1,2,4-διοξαζολιδίνη με σύντομο συντακτικό τύπο:
 .
. - 1,3,2-διοξαζολιδίνη με σύντομο συντακτικό τύπο:
 .
. - 1,4,2-διοξαζολιδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-αμινο-1,2-διοξετάνιο με σύντομο συντακτικό τύπο:
 .
. - 2-αμινο-1,3-διοξετάνιο με σύντομο συντακτικό τύπο:
 .
. - 3-υδροξυ-1,2-οξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - N-υδροξυ-1,2-οξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - 2-υδροξυ-1,3-οξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - N-υδροξυ-1,3-οξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - 4-μεθυλο-1,2,3-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - N-μεθυλο-1,2,3-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - 4-μεθυλο-1,3,2-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
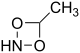 .
. - N-μεθυλο-1,3,3-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
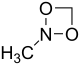 .
. - 2-αμινο-2-υδροξιράνιο με σύντομο συντακτικό τύπο:
 .
. - 3-αμινο-2-υδροξιράνιο με σύντομο συντακτικό τύπο:
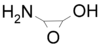 .
. - Υδροξυαμινοξιράνιο με σύντομο συντακτικό τύπο:
 .
. - 2,2-διυδροξυαζιριδίνη με σύντομο συντακτικό τύπο:
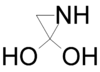 .
. - 2,3-διυδροξυαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - 2,N-διυδροξυαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-μεθυλο-3-υδροξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - N-μεθυλο-3-υδροξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-μεθυλο-N-υδροξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
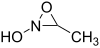 .
. - 3-μεθοξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - N-μεθοξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-υδροξυμεθυλοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - Ν-υδροξυμεθυλοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - Αμινομεθυλοδιοξιράνιο με σύντομο συντακτικό τύπο:
 .
. - Μεθυλαμινοδιοξιράνιο με σύντομο συντακτικό τύπο:
 .
. - Αιθυλοδιοξαζιριδίνη με σύντομο συντακτικό τύπο:
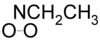 .
.
- Οι παραπάνω ενώσεις δεν είναι όλες σταθερές.
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκίνη, της οποίας ο ημισυντακτικός τύπος είναι H2NCH2COOH, πρωτοανακαλύφθηκε από τον Χενρί Μπρακονό σε προϊόντα υδρόλυσης ζελατίνης με θειικό οξύ,[5] εξ ου και η ονομασία της γλυκόκολλα. Ως οργανική ένωση απομονώθηκε το 1820. Ελεύθερη στη φύση εντοπίζεται σε κατώτερους ζωικούς οργανισμούς ενωμένη με χολικό και βενζοϊκό οξύ ως συστατικό της χολής και των ούρων.
Παρουσία στο διάστημα
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκίνη έχει ανιχνευθεί στο διαστρικό ενδιάμεσο.[6] Το 2008, γλυκινοειδή μόρια όπως το αμιναιθανονιτρίλιο (που με υδρόλυση δίνει γλυκίνη) ανακαλύφθηκαν στο Μεγάλο Μοριακό Χέιματ, ένα τεράστιο αεριώδες νεφέλωμα κοντά στο γαλαξιακό κέντρο στον Αστερισμό του Τοξότη, από το Ινστιτούτο του Μαξ Πλανκ για τη Ραδιοαστρονομία.[7] Το 2009 η γλυκίνη ανιχνεύθηκε επίσης στον κομήτη Άγριος 2 (Wild 2) από το διαστημόπλοιο «Αστρόσκονη» (Sturdust), ενισχύοντας τη θεωρία ότι είναι πιθανό η ζωή να έφθασε στη Γη από το διάστημα.[8] Το σκάφος επισκέφθηκε τον κομήτη και πήρε δείγμα από αυτόν στο οποίο ανιχνεύθηκε, μεταξύ άλλων υλικών, και το αμινοξύ. Ήταν η πρώτη φορά που ανιχνεύθηκε αμινοξύ σε κομήτη.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Είναι το απλούστερο πρωτεϊνικό αμινοξύ. Είναι ένα «αλειφατικό» (δεν περιέχει κανένα δακτύλιο) αμινοξύ. Η γλυκίνη σχεδόν ποτέ δε μετέχει στη λειτουργικότητα των πρωτεϊνών, στις οποίες συμμετέχει, δηλαδή αποτελεί (συνήθως) δομικό τμήμα τους, χωρίς να αποτελεί μέρος του «ενεργού κέντρου»[9] τους.
| Δεσμοί[10] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#2-C#1 | σ | 2sp3-2sp2 | 151 pm | |
| C-N | σ | 2sp3-2sp3 | 152 pm | 6% C+ Ν- |
| Ν-H | σ | 2sp3-1s | 101,7 pm | 17% N- H+ |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| -O | -0,51 | |||
| N | -0,40 | |||
| =O | -0,38 | |||
| C#2 | 0,00 | |||
| H(CH2) | +0,03 | |||
| H(NH2) | +0,17 | |||
| H(OH) | +0,32 | |||
| C#1 | +0,57 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]- Απαιτείται ρύθμιση του pH στο pI = 6,06 για να επιτευχθεί η κρυστάλλωσή της σε καθαρή μορφή.
Από αλογοναιθανικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]
όπου Χ : Cl , Br , I
2. Μέσω οργανομαγνησιακών ενώσεων και αλαμίνης με εστεροποίηση για «προστασία»[12] της καρβοξυλομάδας:[13]
3. Με φθαλιμιδικό κάλιο (σύνθεση Gabriel):[14]
Αντίδραση Strecker
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε μεθανάλη (HCHO):[15]
Από φορμυλομεθανικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αμμωνίας (NH3) σε φορμυλομεθανικό οξύ (HCOCOOH) παράγεται ιμιναιθανικό οξύ (HN=CHCOOH), που με υδρογόνωση δίνει γλυκίνη:[16]
Από νιτροαιθανικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Από νιτροαιθανικό οξύ με αναγωγή:[17]
Από κυανομεθανικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Από κυανομεθανικό οξύ με αναγωγή:[18]
Από μηλονικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Από μηλονικό οξύ με μετροπή σε μοναμίδιο και αποικοδόμηση - μετάθεση Hofmann:[19]
Βιοσύνθεση
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκίνη δεν ανήκει στα απαραίτητα για την ανθρώπινη διατροφή αμινοξέα. Μπορεί να παραχθεί από το σώμα από το αμινοξύ σερίνη. Στους περισσότερους οργανισμούς που μπορούν να εκτελέσουν αυτή τη βιοχημική αντίδραση χρησιμοποιείται το ένζυμο υδροξυμεθυλοτρανσφεράση της σερίνης:[3]
Ακόμη, στο συκώτι των σπονδυλωτών είναι διαθέσιμη και η ακόλουθη σύνθεση της γλυκίνης, με τη βοήθεια του ενζύμου συνθετάση της γλυκίνης:[3]
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Ιονισμός
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκίνη έχει αμφολυτική, δηλαδή οξεοβασική συμπεριφορά:
1. Ιονίζεται:[20]
- Η κεντρική πάνω κατάσταση ισχύει για αδιάλυτη (ή διαλυτή σε απρωτικούς διαλύτες) γλυκίνη.
- Σε υδατικά διαλύματα:
- Για pH<pI ιονίζεται η αμινομάδα (δεξιά).
- Για pH=pI ιονίζονται και η αμινομάδα και η καρβοξυλομάδα (κένρο κάτω).
- Για pH>pI ιονίζεται μόνο η καρβοξυλομάδα (αριστερά).
2. Παραγωγή αλάτων με οξέα και βάσεις. Π.χ.:
και
3. Εστεροποίηση:[21]
Άλλες αντιδράσεις αμινομάδας
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση αλκυλαλογονιδίου παράγεται αλκυλαμιναιθανικό οξύ.:[22]
2. Επίδραση ακυλαλογονιδίων παράγεται ακυλαμιναιθανικό οξύ.:[23]
3. Επίδραση νιτρώδους οξέος παράγεται υδροξυαιθανικό οξύ:[24]
Επίδραση καρβανίων
[Επεξεργασία | επεξεργασία κώδικα]Επίδραση καρβενίων. Π.χ. μεθυλενίου:[25]
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε;
- Παρεμβολή στους δύο (2) δεσμούς CH-H: 2 στατιστικές πιθανότητες. Παράγεται αλανίνη, δηλαδή ένα πρωτεϊνικό αμινοξύ.
- Παρεμβολή στους δύο (2) δεσμούς NH-H: 2 στατιστικές πιθανότητες. Παράγεται μεθυλαμινοαιθανικό οξύ, δηλαδή ένα μη πρωτεϊνικό αμινοξύ.
- Παρεμβολή στον έναν (1) δεσμό COO-H: 1 στατιστική πιθανότητα. Παράγεται αμινοαιθανικός μεθυλεστέρας, δηλαδή ο μεθυλεστέρας της γλυκίνης.
- Προσθήκη στον ένα (1) διπλό δεσμό C=O. 1 στατιστική πιθανότητα. Παράγεται 2-αμινομεθυλο-2-υδροξυοξιράνιο, δηλαδή ένα παράγωγο του οξιρανίου.
- Προκύπτει επομένως μίγμα ~33% αλανίνης, ~33% μεθυλαμινοαιθανικού οξέος, ~17% αμινοαιθανικού μεθυλεστέρα και ~17% 2-αμινομεθυλο-2-υδροξυοξιρανίου.
- Εκτός από την ίδια την αλανίνη, τα υπόλοιπα παράγωγα είναι ισομερή θέσης της αλανίνης.
Βιοαποικοδόμηση
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκίνη αποικοδομείται μέσω τριών (3) οδών:
1. Η κύρια οδός για τα ζώα προβλέπει την αντίστροφη από τη δεύτερη (βλέπετε παραπάνω) μέθοδο βιοσύνθεσής της. Στην περίπτωση της αποικοδόμησης εμπλέκεται το ένζυμο αποκαρβοξυλάση της γλυκίνης:[3]
2. Κατά τη δεύτερη οδό η γλυκίνη αποικοδομείται σε δυο στάδια:
- α. Η γλυκίνη μετατρέπεται σε σερίνη και πάλι με τη χρήση της υδροξυτρανσφεράσσης της σερίνης:
- β. Η σερίνη μετατρέπεται σε πυροσταφυλικό οξύ από τo ένζυμo αφυδατάση της σερίνης:[3]
3. Κατά την τρίτη οδό η γλυκίνη μετατρέπεται σε γλυοξυλικό οξύ με D-αμινοοξειδάση:[3]
Φυσιολογική λειτουργία
[Επεξεργασία | επεξεργασία κώδικα]Η κύρια λειτουργία της γλυκίνης είναι να αποτελεί ένα διαθέσιμο δομικό υλικό για τις πρωτεΐνες και για πολλά άλλα φυσικά προϊόντα.
Ως βιοσυνθετικό ενδιάμεσο
[Επεξεργασία | επεξεργασία κώδικα]Στα ανώτερα ευκαρυωτικά το D-αμινολεβουνικό οξύ, ένα ενδιάμεσο - κλειδί για τις πορφυρίνες, βιοσυντίθεται από τη γλυκίνη και το σουκκινυλ-CoA. Η γλυκίνη παρέχει την κεντρική ομάδα C2N σε όλες τις πουρίνες[3]:.
Ως νευροδιαβιβαστής
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκίνη είναι ένας χημικός νευροδιαβιβαστής στο κεντρικό νευρικό σύστημα, ιδιαίτερα στο νωτιαίο μυελό, στο εγκεφαλικό στέλεχος και στο οπτικό νεύρο. Όταν οι υποδοχείς γλυκίνης ενεργοποιηθούν, ανιόντα χλωρίου εισέρχονται στο νευρικό κύτταρο μέσο των ιονικών διαύλων. Η γλυκίνη είναι ένα απαραίτητο συναγωνιστικό μαζί με το γλουταμινικό οξύ για NMDA υποδοχείς. Αν χρησιμοποιηθεί υπερβολική δόση γλυκίνης γι' αυτό το σκοπό είναι δυνατό να προκληθεί ακόμη και θάνατος από υπερδιέγερση.[26]
Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Στις ΗΠΑ η γλυκίνη πωλείται τυπικά σε δυο βαθμίδες καθαρότητας:
- Φαρμακευτικού επιπέδου: Υψηλές προδιαγραφές καθαρότητας για φαρμακευτικές και διατροφικές χρήσεις, ακόμη και για ζωοτροφές. Περιλαμβάνει το 80-85% των πωλήσεων στη χώρα. Λόγω της γλυκιάς της γεύσης χρησιμοποιείται μεταξύ άλλων χρήσεων και ως γλυκαντικό (E640), δηλαδή ως υποκατάστατο της ζάχαρης.
- Τεχνικού επιπέδου. Χαμηλότερες προδιαγραφές καθαρότητας για άλλες χρήσεις, κυρίως ως πρώτη ύλη για άλλα προϊόντα σε διάφορες χημικές βιομηχανίες, όπου γενικά δεν επηρεάζουν σημαντικά οι τυχόν ξένες προσμείξεις. Είναι φυσικά και οικονομικότερη.[27]
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Προκύπτει ως μέσος όρος των pKa (βλέπε οξύτητα).
- ↑ "Nomenclature and symbolism for amino acids and peptides (IUPAC-IUB Recommendations 1983)", Pure Appl. Chem. 56 (5): 595–624, 1984, doi:10.1351/pac198456050595
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Nelson, David L.; Cox, Michael M. (2005), Principles of Biochemistry (4th ed.), New York: W. H. Freeman, pp. 127, 675–77, 844, 854, ISBN 0-7167-4339-6
- ↑ Karlheinz Drauz, Ian Grayson, Axel Kleemann, Hans-Peter Krimmer, Wolfgang Leuchtenberger, Christoph Weckbecker “Amino Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_057.pub2
- ↑ R.H.A. Plimmer (1912) [1908]. R.H.A. Plimmer & F.G. Hopkins, επιμ. The chemical composition of the proteins. Monographs on biochemistry. Part I. Analysis (2nd έκδοση). London: Longmans, Green and Co. σελ. 82. Ανακτήθηκε στις 18 Ιανουαρίου 2010.
- ↑ Snyder LE, Lovas FJ, Hollis JM, et al. (2005). «A rigorous attempt to verify interstellar glycine». Astrophys J 619 (2): 914–930. doi:.
- ↑ Staff. «Organic Molecule, Amino Acid-Like, Found In Constellation Sagittarius 27 March 2008 - Science Daily». Ανακτήθηκε στις 16 Σεπτεμβρίου 2008.
- ↑ Reuters. «Building block of life found on comet - Thomson Reuters 2009». Ανακτήθηκε στις 18 Αυγούστου 2009.
- ↑ Είναι το τμήμα της πρωτεΐνης που εκτελεί τη βιολογική της λειτουργία, όταν βέβαια η πρωτεΐνη δεν είναι απλά «δομική».
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34. Οι ηλεκτραρνητικότητες κατά Pauling, από τις οποίες υπολογίστηκε ο ιονισμός, προέρχονται από τους πίνακες δεδομένων των χημικών στοιχείων άνθρακας, υδρογόνο, οξυγόνο και άζωτο.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 243, §10.2Α.
- ↑ Προσωρινή κάλυψη χαρακτηριστικής ομάδας για την αποφυγή παραγωγής ανεπιθύμητων παραπροϊόντων.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 298, §13.3Α1, σελ. 243, §10.2B4 και σελ. 301. §13.4.αII.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 243, §10.2B2α.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 243, §10.2B2γ.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 298, §13.3Α1, σελ. 296, §13.2Αα, §13.2Γ1, σελ. 243, §10.2B3 και σελ. 301. §13.4.αII.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.3.2
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.3.3
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 330, §14.3.5β
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 330, §14.3.5α
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 330, §14.3.4α
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ «Safety (MSDS) data for glycine». The Physical and Theoretical Chemistry Laboratory Oxford University. 2005. Αρχειοθετήθηκε από το πρωτότυπο στις 20 Οκτωβρίου 2007. Ανακτήθηκε στις 1 Νοεμβρίου 2006.
- ↑ "Notice of Preliminary Determination of Sales at Less Than Fair Value: Glycine From India" Federal Register 72 (7 November 2007): 62827.
Πηγές πληροφόρησης
[Επεξεργασία | επεξεργασία κώδικα]- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ ΈκδοσηΘεσσαλονίκη 1991
- Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
- Διαδικτυακοί τόποι που αναφέρονται στις «Αναφορές και παρατηρήσεις».
| |||||||||||||||||























![{\displaystyle XC\mathrm {H_{2}COOH+ROH{\stackrel {-H_{2}O}{\rightleftharpoons }}XCH_{2}COOR{\xrightarrow[{|Et_{2}O|}]{+Mg}}XMgCH_{2}COOR{\xrightarrow[{-MgX_{2}}]{+NH_{2}X}}H_{2}NCH_{2}COOR{\stackrel {+H_{2}O}{\rightleftharpoons }}H_{2}NCH_{2}COOH+ROH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3f8843d7ae06be1313089bc4a02324ddb3ea63b)





![{\displaystyle \mathrm {HCOCOOH+NH_{3}{\xrightarrow {-H_{2}O}}HN=CHCOOH{\xrightarrow[{Ni}]{+2H_{2}}}H_{2}NCH_{2}COOH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/550effbaced84b6face4a9860f534ada8408b59c)























