Στρόντιο: Διαφορά μεταξύ των αναθεωρήσεων
Created by translating the section "Applications" from the page "Strontium" Ετικέτες: Επεξεργασία από κινητό Διαδικτυακή επεξεργασία από κινητό Προχωρημένη επεξεργασία από κινητό ΜετάφρασηΠεριεχόμενου ΜετάφρασηΕνότητας |
Created by translating the section "Biological role" from the page "Strontium" Ετικέτες: Επεξεργασία από κινητό Διαδικτυακή επεξεργασία από κινητό Προχωρημένη επεξεργασία από κινητό ΜετάφρασηΠεριεχόμενου ΜετάφρασηΕνότητας |
||
| Γραμμή 131: | Γραμμή 131: | ||
[[File:Soviet_RTG.jpg|μικρογραφία|RTG από φάρους της σοβιετικής εποχής]] |
[[File:Soviet_RTG.jpg|μικρογραφία|RTG από φάρους της σοβιετικής εποχής]] |
||
Το <sup>90</sup>Sr έχει χρησιμοποιηθεί ως πηγή ενέργειας για θερμοηλεκτρικές γεννήτριες ραδιοϊσοτόπων (RTG). Το <sup>90</sup>Sr παράγει περίπου 0,93 watt θερμότητας ανά γραμμάριο (είναι χαμηλότερο για τη μορφή <sup>90</sup>Sr που χρησιμοποιείται σε RTG, το οποίο είναι φθοριούχο στρόντιο). <ref>{{Cite web|url=http://www.qrg.northwestern.edu/projects/vss/docs/Power/3-what-are-the-fuels-for-rtgs.html|title=What are the fuels for radioisotope thermoelectric generators?|website=qrg.northwestern.edu}}</ref> Ωστόσο, το <sup>90</sup>Sr έχει το ένα τρίτο της διάρκειας ζωής και χαμηλότερη πυκνότητα από το [[Πλουτώνιο-238|<sup>238</sup>Pu]], ένα άλλο καύσιμο RTG. Το κύριο πλεονέκτημα του <sup>90</sup>Sr είναι ότι είναι φθηνότερο από <sup>238</sup>Pu και βρίσκεται στα [[πυρηνικά απόβλητα]]. Η [[Ένωση Σοβιετικών Σοσιαλιστικών Δημοκρατιών|Σοβιετική Ένωση]] ανέπτυξε σχεδόν 1000 από αυτούς τους RTG στη βόρεια ακτή της ως πηγή ενέργειας για φάρους και μετεωρολογικούς σταθμούς. <ref>{{Cite book|title=Nuclear safeguards, security and nonproliferation: achieving security with technology and policy|last=Doyle, James|isbn=978-0-7506-8673-0|date=30 June 2008|page=459|url=https://books.google.com/books?id=8WOza_y3IkQC&pg=PA459}}<cite class="citation book cs1" data-ve-ignore="true" id="CITEREFDoyle,_James2008">Doyle, James (30 June 2008). </cite></ref> <ref name="O'BrienAmbrosi2008">{{Cite journal|last=O'Brien|first=R. C.|last2=Ambrosi|first2=R. M.|last3=Bannister|first3=N. P.|last4=Howe|first4=S. D.|last5=Atkinson|first5=H. V.|title=Safe radioisotope thermoelectric generators and heat sources for space applications|journal=Journal of Nuclear Materials|volume=377|issue=3|year=2008|pages=506–21|doi=10.1016/j.jnucmat.2008.04.009|bibcode=2008JNuM..377..506O}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFO'BrienAmbrosiBannisterHowe2008">O'Brien, R. C.; Ambrosi, R. M.; Bannister, N. P.; Howe, S. D.; Atkinson, H. V. (2008). </cite></ref> |
Το <sup>90</sup>Sr έχει χρησιμοποιηθεί ως πηγή ενέργειας για θερμοηλεκτρικές γεννήτριες ραδιοϊσοτόπων (RTG). Το <sup>90</sup>Sr παράγει περίπου 0,93 watt θερμότητας ανά γραμμάριο (είναι χαμηλότερο για τη μορφή <sup>90</sup>Sr που χρησιμοποιείται σε RTG, το οποίο είναι φθοριούχο στρόντιο). <ref>{{Cite web|url=http://www.qrg.northwestern.edu/projects/vss/docs/Power/3-what-are-the-fuels-for-rtgs.html|title=What are the fuels for radioisotope thermoelectric generators?|website=qrg.northwestern.edu}}</ref> Ωστόσο, το <sup>90</sup>Sr έχει το ένα τρίτο της διάρκειας ζωής και χαμηλότερη πυκνότητα από το [[Πλουτώνιο-238|<sup>238</sup>Pu]], ένα άλλο καύσιμο RTG. Το κύριο πλεονέκτημα του <sup>90</sup>Sr είναι ότι είναι φθηνότερο από <sup>238</sup>Pu και βρίσκεται στα [[πυρηνικά απόβλητα]]. Η [[Ένωση Σοβιετικών Σοσιαλιστικών Δημοκρατιών|Σοβιετική Ένωση]] ανέπτυξε σχεδόν 1000 από αυτούς τους RTG στη βόρεια ακτή της ως πηγή ενέργειας για φάρους και μετεωρολογικούς σταθμούς. <ref>{{Cite book|title=Nuclear safeguards, security and nonproliferation: achieving security with technology and policy|last=Doyle, James|isbn=978-0-7506-8673-0|date=30 June 2008|page=459|url=https://books.google.com/books?id=8WOza_y3IkQC&pg=PA459}}<cite class="citation book cs1" data-ve-ignore="true" id="CITEREFDoyle,_James2008">Doyle, James (30 June 2008). </cite></ref> <ref name="O'BrienAmbrosi2008">{{Cite journal|last=O'Brien|first=R. C.|last2=Ambrosi|first2=R. M.|last3=Bannister|first3=N. P.|last4=Howe|first4=S. D.|last5=Atkinson|first5=H. V.|title=Safe radioisotope thermoelectric generators and heat sources for space applications|journal=Journal of Nuclear Materials|volume=377|issue=3|year=2008|pages=506–21|doi=10.1016/j.jnucmat.2008.04.009|bibcode=2008JNuM..377..506O}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFO'BrienAmbrosiBannisterHowe2008">O'Brien, R. C.; Ambrosi, R. M.; Bannister, N. P.; Howe, S. D.; Atkinson, H. V. (2008). </cite></ref> |
||
== Βιολογικός ρόλος == |
|||
Η [[Ακανθάρια|Acantharea]], μια σχετικά μεγάλη ομάδα θαλάσσιων [[Ακτινόζωα|ακτινολαρίων]] [[Πρωτόζωα|πρωτόζωων]], παράγει περίπλοκους ορυκτούς [[Ανθρώπινο ερειστικό σύστημα|σκελετούς]], που αποτελούνται από θειικό στρόντιο. <ref>{{Cite journal|doi=10.1023/B:HYDR.0000027333.02017.50|title=On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios|date=2004|last=De Deckker|first=Patrick|journal=Hydrobiologia|volume=517|issue=1–3|page=1}}</ref> Στα βιολογικά συστήματα, το ασβέστιο υποκαθίσταται σε μικρό βαθμό από το στρόντιο. <ref>{{Cite journal|doi=10.1016/j.bone.2004.04.026|title=The biological role of strontium|date=2004|last=Pors Nielsen|first=S.|journal=Bone|volume=35|issue=3|pages=583–88|pmid=15336592}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFPors_Nielsen2004">Pors Nielsen, S. (2004). </cite></ref>Στο ανθρώπινο σώμα, το μεγαλύτερο μέρος του απορροφούμενου στροντίου εναποτίθεται στα οστά. Η αναλογία στροντίου προς ασβέστιο στα ανθρώπινα οστά είναι μεταξύ 1:1000 και 1:2000, περίπου στο ίδιο εύρος όπως στον ορό του αίματος. <ref>{{Cite journal|doi=10.1359/jbmr.1999.14.5.661|title=Strontium and Bone|date=1999|last=Cabrera|first=Walter E.|last2=Schrooten|first2=Iris|last3=De Broe|first3=Marc E.|last4=d'Haese|first4=Patrick C.|journal=Journal of Bone and Mineral Research|volume=14|issue=5|pages=661–68|pmid=10320513}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFCabreraSchrootenDe_Broed'Haese1999">Cabrera, Walter E.; Schrooten, Iris; De Broe, Marc E.; d'Haese, Patrick C. (1999). </cite></ref> |
|||
=== Επίδραση στο ανθρώπινο σώμα === |
|||
Το ανθρώπινο σώμα απορροφά το στρόντιο, σαν να ήταν το ελαφρύτερο συγγενικό του ασβέστιο. Επειδή τα στοιχεία είναι χημικά πολύ παρόμοια, τα σταθερά [[ισότοπα στροντίου]] δεν αποτελούν σημαντική απειλή για την υγεία. Ο μέσος άνθρωπος λαμβάνει περίπου δύο χιλιοστόγραμμα στροντίου την ημέρα. <ref name="nbb">{{Cite book|title=Nature's building blocks: an A–Z guide to the elements|first=John|last=Emsley|publisher=Oxford University Press|isbn=978-0-19-960563-7|date=2011|page=507}}<cite class="citation book cs1" data-ve-ignore="true" id="CITEREFEmsley2011">Emsley, John (2011). </cite></ref> Στους ενήλικες, το στρόντιο που καταναλώνεται τείνει να προσκολλάται μόνο στην επιφάνεια των οστών, αλλά στα παιδιά, το στρόντιο μπορεί να αντικαταστήσει το ασβέστιο στο μέταλλο των αναπτυσσόμενων οστών, και έτσι να οδηγήσει σε προβλήματα ανάπτυξης των οστών. <ref>{{Cite web|url=https://www.atsdr.cdc.gov/phs/phs.asp?id=654&tid=120|title=ATSDR – Public Health Statement: Strontium|last=Agency for Toxic Substances and Disease Registry|ημερομηνία=21 January 2015|website=cdc.gov|publisher=Agency for Toxic Substances and Disease Registry|accessdate=17 November 2016}}</ref> |
|||
Ο βιολογικός χρόνος ημιζωής του στροντίου στον άνθρωπο έχει αναφερθεί ποικιλοτρόπως από 14 έως 600 ημέρες, <ref>{{Citation|chapter-url=http://hanford-site.pnnl.gov/envreport/2001/env01_45.pdf|title=Hanford Site 2001 Environmental Report|chapter=4.5 Fish and Wildlife Surveillance|last=Tiller|first=B. L.|publisher=DOE|year=2001|access-date=14 January 2014|archivedate=11 May 2013|archiveurl=https://web.archive.org/web/20130511040509/http://hanford-site.pnnl.gov/envreport/2001/env01_45.pdf}}</ref> <ref>{{Citation|url=http://www.osti.gov/bridge/servlets/purl/10136486-6sLptZ/native/10136486.pdf|title=Ecotoxicity Literature Review of Selected Hanford Site Contaminants|doi=10.2172/10136486|publisher=DOE|last=Driver|first=C. J.|year=1994|osti=10136486|access-date=14 January 2014}}</ref> 1.000 ημέρες, <ref>{{Cite web|url=http://www.areaivenvirothon.org/freshwaterecology.htm|title=Freshwater Ecology and Human Influence|publisher=Area IV Envirothon|archiveurl=https://web.archive.org/web/20140101063834/http://www.areaivenvirothon.org/freshwaterecology.htm|archivedate=1 January 2014|url-status=dead|accessdate=14 January 2014}}</ref> 18 χρόνια, <ref>{{Cite web|url=http://epi.alaska.gov/eh/radiation/RadioisotopesInFood.pdf|title=Radioisotopes That May Impact Food Resources|publisher=Epidemiology, Health and Social Services, State of Alaska|archiveurl=https://web.archive.org/web/20140821162026/http://epi.alaska.gov/eh/radiation/RadioisotopesInFood.pdf|archivedate=21 August 2014|url-status=bot: unknown|accessdate=14 January 2014}}</ref> 30 χρόνια <ref>{{Cite web|url=http://www.gsseser.com/FactSheet/Strontium.pdf|title=Human Health Fact Sheet: Strontium|ημερομηνία=October 2001|publisher=Argonne National Laboratory|archiveurl=https://web.archive.org/web/20140124000858/http://www.gsseser.com/FactSheet/Strontium.pdf|archivedate=24 January 2014|url-status=dead|accessdate=14 January 2014}}</ref> και 49 χρόνια, σ' ένα ανώτατο όριο. <ref>{{Cite web|url=http://hyperphysics.phy-astr.gsu.edu/hbase/nuclear/biohalf.html|title=Biological Half-life|publisher=HyperPhysics|accessdate=14 January 2014}}</ref> Τα ευρέως δημοσιευμένα στοιχεία βιολογικού χρόνου ημιζωής εξηγούνται απ' τον πολύπλοκο μεταβολισμό του στροντίου μέσα στο σώμα. Ωστόσο, με τον μέσο όρο όλων των μονοπατιών απέκκρισης, ο συνολικός βιολογικός χρόνος ημιζωής εκτιμάται ότι είναι περίπου 18 χρόνια. <ref>{{Cite book|title=The effects of Nuclear Weapons|first=Samuel|last=Glasstone|first2=Philip J.|last2=Dolan|year=1977|chapter=XII: Biological Effects|page=605|accessdate=14 January 2014}}<cite class="citation book cs1" data-ve-ignore="true" id="CITEREFGlasstoneDolan1977">Glasstone, Samuel; Dolan, Philip J. (1977). </cite></ref> Ο ρυθμός αποβολής του στροντίου επηρεάζεται έντονα απ' την ηλικία και το φύλο, λόγω των διαφορών στον μεταβολισμό των οστών. <ref name="ShaginaBougrov2006">{{Cite journal|last=Shagina|first=N. B.|last2=Bougrov|first2=N. G.|last3=Degteva|first3=M. O.|last4=Kozheurov|first4=V. P.|last5=Tolstykh|first5=E. I.|title=An application of in vivo whole body counting technique for studying strontium metabolism and internal dose reconstruction for the Techa River population|journal=Journal of Physics: Conference Series|volume=41|issue=1|year=2006|pages=433–40|doi=10.1088/1742-6596/41/1/048|bibcode=2006JPhCS..41..433S}}</ref> |
|||
Το φάρμακο ρανελικό στρόντιο βοηθά την ανάπτυξη [[Οστό|των οστών]], αυξάνει την οστική πυκνότητα και μειώνει τη συχνότητα των καταγμάτων των σπονδύλων, των περιφερικών και του [[Κάταγμα|ισχίου]]. <ref>{{Cite journal|last=Meunier P. J.|last2=Roux C.|last3=Seeman E.|title=The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis|journal=New England Journal of Medicine|volume=350|date=January 2004|pages=459–68|pmid=14749454|doi=10.1056/NEJMoa022436|last4=Ortolani|first4=S.|last5=Badurski|first5=J. E.|last6=Spector|first6=T. D.|last7=Cannata|first7=J.|last8=Balogh|first8=A.|last9=Lemmel|first9=E. M.|issue=5|url=http://espace.library.uq.edu.au/view/UQ:315180/UQ315180_OA.pdf}}</ref> <ref>{{Cite journal|last=Reginster JY|last2=Seeman E|last3=De Vernejoul MC|title=Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study|journal=The Journal of Clinical Endocrinology & Metabolism|volume=90|date=May 2005|pages=2816–22|pmid=15728210|doi=10.1210/jc.2004-1774|first4=S.|last4=Adami|first5=J.|last5=Compston|first6=C.|last6=Phenekos|first7=J. P.|last7=Devogelaer|first8=M.|last8=Diaz Curiel|first9=A.|last9=Sawicki|issue=5|url=http://orbi.ulg.ac.be/bitstream/2268/20123/1/Strontium%20ranelate%20reduces%20the%20risk%20of%20nonvertebral%20fractures%20in%20postmenopausal%20women%20with%20osteoporosis%20Treatment%20of%20Peripheral%20Osteoporosis%20%28TROPOS%29%20study.pdf}}</ref> Ωστόσο, το ρανελικό στρόντιο αυξάνει επίσης τον κίνδυνο [[Φλεβική θρομβοεμβολή|φλεβικής θρομβοεμβολής]], πνευμονικής εμβολής και σοβαρών καρδιαγγειακών διαταραχών, συμπεριλαμβανομένου του εμφράγματος του μυοκαρδίου. Επομένως, η χρήση του είναι πλέον περιορισμένη. <ref>{{Cite web|url=http://www.mhra.gov.uk/Safetyinformation/DrugSafetyUpdate/CON392870|title=Strontium ranelate: cardiovascular risk – restricted indication and new monitoring requirements|ημερομηνία=March 2014|publisher=Medicines and Healthcare products Regulatory Agency, UK}}<cite class="citation web cs1" data-ve-ignore="true">[http://www.mhra.gov.uk/Safetyinformation/DrugSafetyUpdate/CON392870 "Strontium ranelate: cardiovascular risk – restricted indication and new monitoring requirements"]. </cite></ref> Οι ευεργετικές του επιδράσεις είναι επίσης αμφισβητήσιμες, αφού η αυξημένη οστική πυκνότητα προκαλείται, εν μέρει, από την αυξημένη πυκνότητα του στροντίου, έναντι του ασβεστίου που αντικαθιστά. Το στρόντιο [[Βιοσυσσώρευση|βιοσυσσωρεύεται]] επίσης στο σώμα. <ref>{{Cite journal|last=Price|first=Charles T.|last2=Langford|first2=Joshua R.|last3=Liporace|first3=Frank A.|date=5 April 2012|title=Essential Nutrients for Bone Health and a Review of their Availability in the Average North American Diet|pmc=3330619|journal=Open Orthop. J.|volume=6|pages=143–49|doi=10.2174/1874325001206010143|pmid=22523525}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFPriceLangfordLiporace2012">Price, Charles T.; Langford, Joshua R.; Liporace, Frank A. (5 April 2012). </cite></ref> Παρά τους περιορισμούς στο ρανελικό στρόντιο, το στρόντιο εξακολουθεί να περιέχεται σε ορισμένα συμπληρώματα. <ref name="WebMD-Strontium">{{Cite web|url=https://www.webmd.com/vitamins-supplements/ingredientmono-1077-strontium.aspx?activeingredientid=1077&|title=Strontium|website=[[WebMD]]|accessdate=20 November 2017}}<cite class="citation web cs1" data-ve-ignore="true">[https://www.webmd.com/vitamins-supplements/ingredientmono-1077-strontium.aspx?activeingredientid=1077& "Strontium"]. </cite></ref> <ref name="WebMD-StrontiumOsteoporosis">{{Cite web|url=https://www.webmd.com/osteoporosis/guide/strontium-treatment-osteoporosis|title=Strontium for Osteoporosis|publisher=[[WebMD]]|accessdate=20 November 2017}}<cite class="citation web cs1" data-ve-ignore="true">[https://www.webmd.com/osteoporosis/guide/strontium-treatment-osteoporosis "Strontium for Osteoporosis"]. </cite></ref> Δεν υπάρχουν πολλά επιστημονικά στοιχεία σχετικά με τους κινδύνους του [[Χλωριούχο στρόντιο|χλωριούχου στροντίου]], όταν λαμβάνεται από το στόμα. Όσοι έχουν προσωπικό ή οικογενειακό ιστορικό διαταραχών πήξης του αίματος συνιστάται να αποφεύγουν το στρόντιο. <ref name="WebMD-Strontium" /> <ref name="WebMD-StrontiumOsteoporosis" /> |
|||
Το στρόντιο έχει αποδειχθεί ότι αναστέλλει τον αισθητηριακό ερεθισμό, όταν εφαρμόζεται τοπικά στο δέρμα. <ref>{{Cite journal|journal=Dermatologic Surgery|volume=25|issue=9|pages=689–94|last=Hahn, G.S.|date=1999|title=Strontium Is a Potent and Selective Inhibitor of Sensory Irritation|pmid=10491058|doi=10.1046/j.1524-4725.1999.99099.x|url=http://refinityskinscience.com/wp-content/themes/refinity/pdf/1_strontium_is_a_potent_selective_inhibitor.pdf|archiveurl=https://web.archive.org/web/20160531110553/http://refinityskinscience.com/wp-content/themes/refinity/pdf/1_strontium_is_a_potent_selective_inhibitor.pdf|archivedate=31 May 2016}}</ref> <ref>{{Cite book|title=Anti-irritants for Sensory Irritation|last=Hahn, G.S.|isbn=978-0-8247-0292-2|date=2001|page=285|url=https://books.google.com/books?id=3dzCrVrGuigC}}</ref> Εφαρμόζεται τοπικά, το στρόντιο έχει αποδειχθεί ότι επιταχύνει τον ρυθμό αποκατάστασης του φραγμού επιδερμικής διαπερατότητας (φραγμός δέρματος). <ref>{{Cite journal|url=http://210.101.116.107/kda/english/view.asp?year=2006&page=1309&vol=44&iss=11#|page=1309|last=Kim, Hyun Jeong|last2=Kim, Min Jung|last3=Jeong, Se Kyoo|title=The Effects of Strontium Ions on Epidermal Permeability Barrier|journal=The Korean Dermatological Association, Korean Journal of Dermatology|volume=44|date=2006}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFKim,_Hyun_JeongKim,_Min_JungJeong,_Se_Kyoo2006">Kim, Hyun Jeong; Kim, Min Jung; Jeong, Se Kyoo (2006). </cite></ref> |
|||
== Παραπομπές == |
== Παραπομπές == |
||
{{Παραπομπές}} |
{{Παραπομπές}} |
||
Έκδοση από την 17:57, 16 Νοεμβρίου 2022
| Στρόντιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Στρόντιο (Sr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | Μέταλλα | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
Αλκαλικές γαίες ,5, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
87.62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[ Kr ] 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 215 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 1,00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 1050 K, 777 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 1655 K, 1382 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | Παραγμανιτισμός | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το στρόντιο είναι ένα χημικό στοιχείο με χημικό σύμβολο Sr και ατομικό αριθμό 38. Ως ένα μέταλλο αλκαλικής γαίας, το στρόντιο είναι ένα μαλακό ασημί-λευκό κιτρινωπό μεταλλικό στοιχείο, όπου, χημικά, είναι εξαιρετικά αντιδραστικό.Το μέταλλο σχηματίζει ένα σκούρο στρώμα οξειδίου, όταν εκτεθεί στον αέρα. Το στρόντιο έχει φυσικές και χημικές ιδιότητες παρόμοιες με αυτές των δύο κάθετων γειτόνων του στον περιοδικό πίνακα, του ασβεστίου και του βαρίου. Εμφανίζεται φυσικά κυρίως στα ορυκτά σελεστίνη και στροντιανίτη, και εξορύσσεται κυρίως από αυτά.
Τόσο το στρόντιο όσο και ο στροντιανίτης έχουν πάρει το όνομά τους από το Strontian, ένα χωριό στη Σκωτία κοντά στο οποίο το ορυκτό ανακαλύφθηκε το 1790 από τους Adair Crawford και William Cruickshank. Αναγνωρίστηκε ως νέο στοιχείο τον επόμενο χρόνο, από το κατακόκκινο χρώμα της φλόγας. Το στρόντιο απομονώθηκε για πρώτη φορά ως μέταλλο το 1808 από τον Humphry Davy, χρησιμοποιώντας την τότε πρόσφατα ανακαλυφθείσα διαδικασία της ηλεκτρόλυσης. Κατά τον 19ο αιώνα, το στρόντιο χρησιμοποιήθηκε κυρίως για την παραγωγή ζάχαρης από ζαχαρότευτλα. Στο αποκορύφωμα της παραγωγής τηλεοπτικών σωλήνων καθοδικών ακτίνων, έως και το 75% της κατανάλωσης στροντίου στις Ηνωμένες Πολιτείες χρησιμοποιήθηκε για το γυαλί πρόσοψης.[1] Με την αντικατάσταση των καθοδικών λυχνιών με άλλες μεθόδους απεικόνισης, η κατανάλωση στροντίου έχει μειωθεί δραματικά. [1]
Ενώ το φυσικό στρόντιο (το οποίο είναι ως επί το πλείστον το ισότοπο στρόντιο-88) είναι σταθερό, το συνθετικό στρόντιο-90 είναι ραδιενεργό και είναι ένα από τα πιο επικίνδυνα συστατικά της πυρηνικής πτώσης, καθώς το στρόντιο απορροφάται από τον οργανισμό με παρόμοιο τρόπο με το ασβέστιο. Αντιθέτως, το φυσικό σταθερό στρόντιο δεν είναι επικίνδυνο για την υγεία.
Χαρακτηριστικά
Το στρόντιο είναι ένα δισθενές αργυρόχρωμο μέταλλο με ωχροκίτρινη απόχρωση, του οποίου οι ιδιότητες είναι ως επί το πλείστον ενδιάμεσες και παρόμοιες με εκείνες της ομάδας γειτονικών του ασβεστίου και βαρίου. [2] Είναι πιο μαλακό από το ασβέστιο και πιο σκληρό από το βάριο. Οι βαθμοί τήξης και βρασμού (777°C και 1377°C αντίστοιχα) είναι χαμηλότεροι από εκείνους του ασβεστίου (842°C και 1484°C αντίστοιχα). Το βάριο συνεχίζει αυτή την πτωτική τάση στο σημείο τήξης (727°C), αλλά όχι στο σημείο βρασμού (1900°C). Η πυκνότητα του στροντίου (2,64g/cm3) είναι ομοίως ενδιάμεσο μεταξύ εκείνων του ασβεστίου (1,54g/cm3) και βάριο (3.594g/cm3). Υπάρχουν τρία αλλότροπα μεταλλικού στροντίου, με σημεία μετάβασης στους 235°C και 540°C. [3]
Το τυπικό δυναμικό ηλεκτροδίου για το ζεύγος Sr2+/Sr είναι −2,89V, περίπου στη μέση μεταξύ εκείνων του Ca2+/Ca (−2,84V) και Ba2+/Ba (−2,92V) ζευγάρια και κοντά σε αυτά των γειτονικών αλκαλιμετάλλων. [4] Το στρόντιο είναι ενδιάμεσο μεταξύ ασβεστίου και βαρίου ως προς την αντιδραστικότητα του προς το νερό, με το οποίο αντιδρά κατά την επαφή για να παράγει υδροξείδιο του στροντίου και αέριο υδρογόνο. Το μέταλλο στροντίου καίγεται στον αέρα και παράγει τόσο οξείδιο του στροντίου όσο και νιτρίδιο του στροντίου, αλλά επειδή δεν αντιδρά με άζωτο κάτω από τους 380°C, σε θερμοκρασία δωματίου σχηματίζει μόνο το οξείδιο αυθόρμητα. Εκτός από το απλό οξείδιο SrO, το υπεροξείδιο SrO2 μπορεί να παραχθεί με άμεση οξείδωση μετάλλου στροντίου υπό υψηλή πίεση οξυγόνου και υπάρχουν κάποιες ενδείξεις για ένα κίτρινο υπεροξείδιο Sr(O2)2. [5] Το υδροξείδιο του στροντίου, Sr(OH)2, είναι μια ισχυρή βάση, αν και δεν είναι τόσο ισχυρή όσο τα υδροξείδια του βαρίου ή των αλκαλικών μετάλλων. [6] Και τα τέσσερα διαλογονίδια του στροντίου είναι γνωστά. [7]
Λόγω του μεγάλου μεγέθους των βαρέων στοιχείων s-block, συμπεριλαμβανομένου του στροντίου, είναι γνωστό ένα τεράστιο εύρος αριθμών συντονισμού, από 2, 3 ή 4 μέχρι το 22 ή το 24 στο SrCd11 και το SrZn13. Το ιόν Sr2+ είναι αρκετά μεγάλο, έτσι ώστε οι υψηλοί αριθμοί συντονισμού είναι ο κανόνας. [8] Το μεγάλο μέγεθος του στροντίου και του βαρίου παίζει σημαντικό ρόλο στη σταθεροποίηση των συμπλεγμάτων στροντίου με πολυοδοντικούς μακροκυκλικούς υποκαταστάτες όπως οι αιθέρες κορώνας: για παράδειγμα, ενώ το 18-crown-6 σχηματίζει σχετικά ασθενή σύμπλοκα με το ασβέστιο και τα αλκαλικά μέταλλα, τα σύμπλοκα στροντίου και βαρίου είναι πολύ πιο δυνατό. [9]
Οι ενώσεις οργανοστροντίου περιέχουν έναν ή περισσότερους δεσμούς στροντίου-άνθρακα. Έχουν αναφερθεί ως ενδιάμεσα σε αντιδράσεις τύπου Barbier. [10] [11] [12] Αν και το στρόντιο ανήκει στην ίδια ομάδα με το μαγνήσιο και οι οργανομαγνήσιες ενώσεις χρησιμοποιούνται πολύ συχνά σε όλη τη χημεία, οι ενώσεις οργανοστροντίου δεν είναι εξίσου διαδεδομένες επειδή είναι πιο δύσκολο να κατασκευαστούν και πιο αντιδραστικές. Οι ενώσεις οργανοστροντίου τείνουν να μοιάζουν περισσότερο με τις οργανικές ενώσεις του ευρωπίου ή οργανικού σαμαριού λόγω των παρόμοιων ιοντικών ακτίνων αυτών των στοιχείων (Sr2+ 118 pm, Eu2+ 117 pm και Sm2+ 122 pm). Οι περισσότερες από αυτές τις ενώσεις μπορούν να παρασκευαστούν μόνο σε χαμηλές θερμοκρασίες. Οι ογκώδεις συνδέτες τείνουν να ευνοούν τη σταθερότητα. Για παράδειγμα, το δικυκλοπενταδιενύλιο στρόντιο, Sr(C5H5)2, πρέπει να παρασκευάζεται με άμεση αντίδραση μετάλλου στροντίου με το υδροκένιο ή το ίδιο το κυκλοπενταδιένιο. Η αντικατάσταση του συνδέτη C5H5 με τον πιο ογκώδη συνδέτη C5(CH3)5 από την άλλη πλευρά αυξάνει τη διαλυτότητα, την πτητότητα και την κινητική σταθερότητα της ένωσης. [13]
Λόγω της εξαιρετικής αντιδραστικότητάς του με το οξυγόνο και το νερό, το στρόντιο εμφανίζεται φυσικά μόνο σε ενώσεις με άλλα στοιχεία, όπως στα ορυκτά στροντιανίτη και σελεστίνη. Διατηρείται κάτω από υγρό υδρογονάνθρακα όπως ορυκτέλαιο ή κηροζίνη για να αποφευχθεί η οξείδωση. Το πρόσφατα εκτεθειμένο μέταλλο στρόντιο παίρνει γρήγορα ένα κιτρινωπό χρώμα με το σχηματισμό του οξειδίου. Το λεπτόκοκκο μέταλλο στρόντιο είναι πυροφορικό, που σημαίνει ότι θα αναφλεγεί αυθόρμητα στον αέρα σε θερμοκρασία δωματίου. Τα πτητικά άλατα στροντίου προσδίδουν ένα έντονο κόκκινο χρώμα στις φλόγες και αυτά τα άλατα χρησιμοποιούνται στην πυροτεχνία και στην παραγωγή φωτοβολίδων. Όπως το ασβέστιο και το βάριο, καθώς και τα αλκαλιμέταλλα και οι δισθενείς λανθανίδες ευρώπιο και υττέρβιο, το μέταλλο στρόντιο διαλύεται απευθείας σε υγρή αμμωνία για να δώσει ένα σκούρο μπλε διάλυμα διαλυτωμένων ηλεκτρονίων. [2]
Ισότοπα
Το φυσικό στρόντιο είναι ένα μείγμα τεσσάρων σταθερών ισοτόπων: 84Sr, 86Sr, 87Sr και 88Sr. Η αφθονία τους αυξάνεται με τον αυξανόμενο αριθμό μάζας και το βαρύτερο, το 88Sr, αποτελεί περίπου το 82,6% όλου του φυσικού στροντίου, αν και η αφθονία ποικίλλει λόγω της παραγωγής του ραδιογενούς 87Sr ως θυγατρικό ισότοπο του μακρόβιου βήτα-διάσπασης 87Rb. [14] Αυτή είναι η βάση της χρονολόγησης ρουβιδίου-στροντίου. Από τα ασταθή ισότοπα, ο κύριος τρόπος διάσπασης των ισοτόπων ελαφρύτερων από 85Sr είναι η σύλληψη ηλεκτρονίων ή η εκπομπή ποζιτρονίων στα ισότοπα του ρουβιδίου και αυτός των ισοτόπων βαρύτερων από 88Sr είναι η εκπομπή ηλεκτρονίων σε ισότοπα υττρίου. Ιδιαίτερης σημασίας είναι τα 89Sr και 90Sr. Το πρώτο έχει χρόνο ημιζωής 50,6 ημέρες και χρησιμοποιείται για τη θεραπεία του καρκίνου των οστών λόγω της χημικής ομοιότητας του στροντίου και ως εκ τούτου της ικανότητας να αντικαθιστά το ασβέστιο. [15] [16] Ενώ είναι 90Sr (χρόνος ημιζωής 28,90 χρόνια) έχει χρησιμοποιηθεί με παρόμοιο τρόπο, είναι επίσης ένα ισότοπο ανησυχίας σε επιπτώσεις από πυρηνικά όπλα και πυρηνικά ατυχήματα λόγω της παραγωγής του ως προϊόν σχάσης. Η παρουσία του στα οστά μπορεί να προκαλέσει καρκίνο των οστών, καρκίνο των κοντινών ιστών και λευχαιμία. [17] Το πυρηνικό ατύχημα του Τσερνόμπιλ το 1986 μόλυναν περίπου 30.000km2 με μεγαλύτερο από 10kBq/m2 με 90Sr, που αντιπροσωπεύει περίπου το 5% των 90Sr που ήταν στον πυρήνα του αντιδραστήρα. [18]
Ιστορία

Το στρόντιο πήρε το όνομά του από το σκωτσέζικο χωριό Strontian (Gaelic Sròn an t-Sìthein), όπου ανακαλύφθηκε στα μεταλλεύματα των ορυχείων μολύβδου. [19]
Το 1790, ο Adair Crawford, ένας γιατρός που ασχολήθηκε με την παρασκευή βαρίου, και ο συνάδελφός του William Cruickshank, αναγνώρισαν ότι τα μεταλλεύματα του στροντίου παρουσίαζαν ιδιότητες που διέφεραν από εκείνες σε άλλες πηγές «βαριών σπάρων». [20] Ο γιατρός και συλλέκτης ορυκτών Friedrich Gabriel Sulzer ανέλυσε μαζί με τον Johann Friedrich Blumenbach το ορυκτό από το Strontian και το ονόμασε στροντιανίτη. Το 1793 ο Thomas Charles Hope, καθηγητής χημείας στο Πανεπιστήμιο της Γλασκώβης μελέτησε το ορυκτό [21] [22] και πρότεινε το όνομα strontites. [23] [24] [25] Το στοιχείο τελικά απομονώθηκε από τον Sir Humphry Davy το 1808 με την ηλεκτρόλυση ενός μείγματος που περιείχε χλωριούχο στρόντιο και οξείδιο του υδραργύρου, και ανακοινώθηκε από αυτόν σε μια διάλεξη στη Βασιλική Εταιρεία στις 30 Ιουνίου 1808. [26] Σύμφωνα με την ονομασία των άλλων αλκαλικών γαιών, άλλαξε το όνομα σε στρόντιο. [27] [28] [29] [30] [31]
Η πρώτη μεγάλης κλίμακας εφαρμογή του στροντίου ήταν στην παραγωγή ζάχαρης από ζαχαρότευτλα. Αν και μια διαδικασία κρυστάλλωσης με χρήση υδροξειδίου του στροντίου κατοχυρώθηκε με δίπλωμα ευρεσιτεχνίας από τον Augustin-Pierre Dubrunfaut το 1849 [32] η εισαγωγή σε μεγάλη κλίμακα ήρθε με τη βελτίωση της διαδικασίας στις αρχές της δεκαετίας του 1870. Η γερμανική βιομηχανία ζάχαρης χρησιμοποίησε τη διαδικασία μέχρι τον 20ο αιώνα. Πριν από Α΄ Παγκοσμίου Πολέμου, η βιομηχανία ζάχαρης τεύτλων χρησιμοποιούσε 100.000 έως 150.000 τόνους υδροξειδίου του στροντίου για αυτή τη διαδικασία ετησίως. [33] Το υδροξείδιο του στροντίου ανακυκλώθηκε στη διαδικασία, αλλά η ζήτηση για αντικατάσταση των απωλειών κατά την παραγωγή ήταν αρκετά υψηλή ώστε να δημιουργηθεί σημαντική ζήτηση, που ξεκίνησε την εξόρυξη στροντιανίτη στο Münsterland. Η εξόρυξη στροντιανίτη στη Γερμανία τελείωσε όταν ξεκίνησε η εξόρυξη των κοιτασμάτων σελεστίνης στο Gloucestershire. [34] Αυτά τα ορυχεία παρείχαν το μεγαλύτερο μέρος της παγκόσμιας προμήθειας στροντίου από το 1884 έως το 1941. Αν και τα κοιτάσματα ουρανού στη λεκάνη της Γρανάδας ήταν γνωστά για κάποιο χρονικό διάστημα, η εξόρυξη μεγάλης κλίμακας δεν ξεκίνησε πριν από τη δεκαετία του 1950. [35]
Κατά τη διάρκεια δοκιμών ατμοσφαιρικών πυρηνικών όπλων, παρατηρήθηκε ότι το στρόντιο-90 είναι ένα από τα προϊόντα πυρηνικής σχάσης με σχετικά υψηλή απόδοση. Η ομοιότητα με το ασβέστιο και η πιθανότητα εμπλουτισμού του στροντίου-90 στα οστά έκανε την έρευνα για τον μεταβολισμό του στροντίου ένα σημαντικό θέμα. [36] [37]
Εμφάνιση

Το στρόντιο εμφανίζεται συνήθως στη φύση, είναι το 15ο πιο άφθονο στοιχείο στη Γη (το βαρύτερο συγγενικό του βάριο είναι το 14ο), που υπολογίζεται κατά μέσο όρο σε περίπου 360 μέρη ανά εκατομμύριο στον φλοιό της Γης [38] και βρίσκεται κυρίως ως το θειικό ορυκτό κελεστίνη (SrSO4) και ο ανθρακικός στροντιανίτης (SrCO3). Από τα δύο, ο σελεστίνης εμφανίζεται πολύ πιο συχνά σε κοιτάσματα επαρκούς μεγέθους για εξόρυξη. Επειδή το στρόντιο χρησιμοποιείται συχνότερα σε ανθρακική μορφή, ο στροντιανίτης θα ήταν το πιο χρήσιμος από τα δύο κοινά ορυκτά, αλλά λίγα κοιτάσματα έχουν ανακαλυφθεί που είναι κατάλληλα για ανάπτυξη. [39] Λόγω του τρόπου με τον οποίο αντιδρά με τον αέρα και το νερό, το στρόντιο υπάρχει στη φύση, μόνο όταν συνδυάζεται για να σχηματίσει μέταλλα. Το στρόντιο που απαντάται στη φύση είναι σταθερό, αλλά το συνθετικό του ισότοπο 90Sr παράγεται μόνο από πυρηνική πτώση.
Στα υπόγεια ύδατα το στρόντιο συμπεριφέρεται χημικά όπως το ασβέστιο. Σε ενδιάμεσο έως όξινο pH το κατιόν Sr2+ είναι το κυρίαρχο είδος στροντίου. Με την παρουσία ιόντων ασβεστίου, το στρόντιο συνήθως σχηματίζει συγκαταβύθιση με μέταλλα ασβεστίου όπως ο ασβεστίτης και ο ανυδρίτης σε αυξημένο pH. Σε ενδιάμεσο έως όξινο pH, το διαλυμένο στρόντιο συνδέεται με τα σωματίδια του εδάφους μέσω ανταλλαγής κατιόντων. [40]
Η μέση περιεκτικότητα σε στρόντιο στο νερό των ωκεανών είναι 8 mg/L. [41] [42] Σε συγκέντρωση μεταξύ 82 και 90 μmol/L στροντίου, η συγκέντρωση είναι σημαντικά χαμηλότερη από τη συγκέντρωση ασβεστίου, η οποία είναι συνήθως μεταξύ 9,6 και 11,6 mmol/L. [43] [44] Ωστόσο, είναι πολύ υψηλότερο από αυτό του βαρίου, 13 μg/L.
Παραγωγή
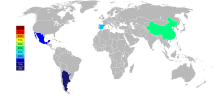
Οι τρεις κύριοι παραγωγοί στροντίου ως σελεστίνης από το 2015 είναι η Κίνα (150.000 t), Ισπανία (90.000 t), και το Μεξικό (70.000 t). Η Αργεντινή (10.000 t) και το Μαρόκο (2.500 t) είναι μικρότεροι παραγωγοί. Αν και τα κοιτάσματα στροντίου εμφανίζονται ευρέως στις Ηνωμένες Πολιτείες, δεν έχουν εξορυχθεί από το 1959.
Ένα μεγάλο ποσοστό εξορυσσόμενης σελεστίνης (SrSO4) μετατρέπεται σε ανθρακικό με δύο διαδικασίες. Είτε η σελεστίνη εκπλένεται απευθείας με διάλυμα ανθρακικού νατρίου, είτε η σελεστίνη καβουρδίζεται με άνθρακα, για να σχηματιστεί το σουλφίδιο. Το δεύτερο στάδιο παράγει ένα σκουρόχρωμο υλικό που περιέχει κυρίως θειούχο στρόντιο. Αυτή η λεγόμενη «μαύρη τέφρα» διαλύεται σε νερό και φιλτράρεται. Το ανθρακικό στρόντιο καθιζάνει από το διάλυμα θειούχου στροντίου με την εισαγωγή διοξειδίου του άνθρακα. [45] Το θειικό ανάγεται σε θειούχο με την καρβοθερμική αναγωγή:
- SrSO4 + 2 C → SrS + 2 CO2
Περίπου 300.000 τόνοι επεξεργάζονται με αυτόν τον τρόπο ετησίως.
Το μέταλλο παράγεται εμπορικά με αναγωγή του οξειδίου του στροντίου με αλουμίνιο. Το στρόντιο αποστάζεται από το μείγμα. Το μέταλλο στρόντιο μπορεί επίσης να παρασκευαστεί σε μικρή κλίμακα με ηλεκτρόλυση ενός διαλύματος χλωριούχου στροντίου σε τετηγμένο χλωριούχο κάλιο: [4]
- Sr2+ + 2e− → Sr
- 2 Cl− → Cl2 + 2 e−
Εφαρμογές

Καταναλώνοντας το 75% της παραγωγής, η κύρια χρήση του στροντίου ήταν στο γυαλί για σωλήνες καθόδου ακτίνων έγχρωμης τηλεόρασης, όπου εμπόδιζε την εκπομπή ακτίνων Χ. [46] [47] Αυτή η εφαρμογή για το στρόντιο έχει μειωθεί, επειδή οι CRT αντικαθίστανται από άλλες μεθόδους απεικόνισης. Αυτή η μείωση έχει σημαντική επίδραση στην εξόρυξη και τη διύλιση του στροντίου. [39] Όλα τα μέρη του CRT πρέπει να απορροφούν τις ακτίνες Χ. Στο λαιμό και στο χωνί του σωλήνα χρησιμοποιείται για το σκοπό αυτό γυαλί μολύβδου, αλλά αυτός ο τύπος γυαλιού εμφανίζει ένα καφετί αποτέλεσμα, λόγω της αλληλεπίδρασης των ακτίνων Χ με το γυαλί. Επομένως, το μπροστινό πάνελ είναι κατασκευασμένο από διαφορετικό μείγμα γυαλιού με στρόντιο και βάριο, για να απορροφά τις ακτίνες Χ. Οι μέσες τιμές για το μείγμα γυαλιού που καθορίστηκαν για μια μελέτη ανακύκλωσης το 2005 είναι 8,5% οξείδιο του στροντίου και 10% οξείδιο του βαρίου. [48]
Επειδή το στρόντιο είναι τόσο παρόμοιο με το ασβέστιο, ενσωματώνεται στα οστά. Και τα τέσσερα σταθερά ισότοπα ενσωματώνονται, στις ίδιες περίπου αναλογίες που βρίσκονται στη φύση. Ωστόσο, η πραγματική κατανομή των ισοτόπων τείνει να ποικίλλει πολύ από τη μία γεωγραφική τοποθεσία στην άλλη. Έτσι, η ανάλυση του οστού ενός ατόμου μπορεί να βοηθήσει στον προσδιορισμό της περιοχής, από την οποία προήλθε. [49] [50] Αυτή η προσέγγιση βοηθά στον εντοπισμό των αρχαίων προτύπων μετανάστευσης και της προέλευσης των αναμεμειγμένων ανθρώπινων υπολειμμάτων σε τοποθεσίες ταφής στο πεδίο της μάχης. [51]
Τα ισότοπα 87Sr/86Sr χρησιμοποιούνται συνήθως για τον προσδιορισμό των πιθανών περιοχών προέλευσης των ιζημάτων σε φυσικά συστήματα, ειδικά σε θαλάσσια και ποτάμια περιβάλλοντα. Ο Dasch (1969) έδειξε ότι τα επιφανειακά ιζήματα του Ατλαντικού εμφάνισαν αναλογίες 87Sr/86Sr που θα μπορούσαν να θεωρηθούν ως μαζικοί μέσοι όροι των αναλογιών 87Sr/86Sr των γεωλογικών εδαφών από γειτονικές χερσαίες μάζες. [52] Ένα καλό παράδειγμα ενός ποτάμιου-θαλάσσιου συστήματος στο οποίο έχουν χρησιμοποιηθεί επιτυχώς μελέτες προέλευσης ισοτόπων Sr είναι το σύστημα ποταμού Νείλου-Μεσογείου. [53] Λόγω των διαφορετικών ηλικιών των πετρωμάτων που αποτελούν την πλειοψηφία του Γαλάζιου και Λευκού Νείλου, οι λεκάνες απορροής της μεταβαλλόμενης προέλευσης των ιζημάτων, που φτάνουν στο Δέλτα του ποταμού Νείλου και στην Ανατολική Μεσόγειο, μπορούν να διακριθούν μέσω ισοτοπικών μελετών στροντίου. Τέτοιες αλλαγές ελέγχονται κλιματικά στην Ολόκαινος εποχή. [53]
Πιο πρόσφατα, αναλογίες 87Sr/86Sr χρησιμοποιήθηκαν επίσης για τον προσδιορισμό της πηγής αρχαίων αρχαιολογικών υλικών, όπως ξυλεία και καλαμπόκι στο Chaco Canyon, Νέο Μεξικό. [54] [55] Οι αναλογίες 87Sr/86Sr στα δόντια μπορούν επίσης να χρησιμοποιηθούν για την παρακολούθηση μεταναστεύσεων ζώων. [56] [57]
Το αργιλικό στρόντιο χρησιμοποιείται συχνά για λάμψη στα σκοτεινά παιχνίδια, καθώς είναι χημικά και βιολογικά αδρανές.

Το ανθρακικό στρόντιο και άλλα άλατα στροντίου προστίθενται στα πυροτεχνήματα, για να δώσουν ένα βαθύ κόκκινο χρώμα. [58] Αυτό το ίδιο αποτέλεσμα προσδιορίζει κατιόντα στροντίου στη δοκιμή φλόγας. Τα πυροτεχνήματα καταναλώνουν περίπου το 5% της παγκόσμιας παραγωγής. Το ανθρακικό στρόντιο χρησιμοποιείται στην κατασκευή μαγνητών σκληρού φερρίτη. [59] [60]
Το χλωριούχο στρόντιο χρησιμοποιείται μερικές φορές σε οδοντόκρεμες για ευαίσθητα δόντια. Μια δημοφιλής μάρκα περιλαμβάνει 10% ολικό εξαένυδρο χλωριούχο στρόντιο κατά βάρος. [61] Μικρές ποσότητες χρησιμοποιούνται στη διύλιση ψευδαργύρου, για την απομάκρυνση μικρών ποσοτήτων ακαθαρσιών μολύβδου.
Η εξαιρετικά στενή οπτική μετάβαση μεταξύ της ηλεκτρονικής βασικής κατάστασης [Kr]5s2 1S0 και της μετασταθερής [Kr]5s5p 3P0 διεγερμένης κατάστασης του 87Sr είναι ένας από τους κορυφαίους υποψηφίους για τον μελλοντικό επαναπροσδιορισμό του δευτερολέπτου στο όροι μιας οπτικής μετάβασης σε αντίθεση με τον τρέχοντα ορισμό που προέρχεται από μια μετάβαση μικροκυμάτων μεταξύ διαφορετικών υπερλεπτών θεμελιωδών καταστάσεων 133Cs. [62] Τα τρέχοντα οπτικά ατομικά ρολόγια που λειτουργούν σε αυτή τη μετάβαση ξεπερνούν ήδη την ακρίβεια και την ακρίβεια του τρέχοντος ορισμού του δευτερολέπτου.
Ραδιενεργό στρόντιο
Το 89Sr είναι το δραστικό συστατικό του Metastron, [63] ενός ραδιοφαρμάκου που χρησιμοποιείται για τον πόνο των οστών δευτερογενές σε μεταστατικό καρκίνο των οστών. Το στρόντιο επεξεργάζεται όπως το ασβέστιο από το σώμα, ενσωματώνοντάς το κατά προτίμηση στα οστά σε σημεία αυξημένης οστεογένεσης. Αυτός ο εντοπισμός εστιάζει την έκθεση στην ακτινοβολία στην καρκινική βλάβη. [16]

Το 90Sr έχει χρησιμοποιηθεί ως πηγή ενέργειας για θερμοηλεκτρικές γεννήτριες ραδιοϊσοτόπων (RTG). Το 90Sr παράγει περίπου 0,93 watt θερμότητας ανά γραμμάριο (είναι χαμηλότερο για τη μορφή 90Sr που χρησιμοποιείται σε RTG, το οποίο είναι φθοριούχο στρόντιο). [64] Ωστόσο, το 90Sr έχει το ένα τρίτο της διάρκειας ζωής και χαμηλότερη πυκνότητα από το 238Pu, ένα άλλο καύσιμο RTG. Το κύριο πλεονέκτημα του 90Sr είναι ότι είναι φθηνότερο από 238Pu και βρίσκεται στα πυρηνικά απόβλητα. Η Σοβιετική Ένωση ανέπτυξε σχεδόν 1000 από αυτούς τους RTG στη βόρεια ακτή της ως πηγή ενέργειας για φάρους και μετεωρολογικούς σταθμούς. [65] [66]
Βιολογικός ρόλος
Η Acantharea, μια σχετικά μεγάλη ομάδα θαλάσσιων ακτινολαρίων πρωτόζωων, παράγει περίπλοκους ορυκτούς σκελετούς, που αποτελούνται από θειικό στρόντιο. [67] Στα βιολογικά συστήματα, το ασβέστιο υποκαθίσταται σε μικρό βαθμό από το στρόντιο. [68]Στο ανθρώπινο σώμα, το μεγαλύτερο μέρος του απορροφούμενου στροντίου εναποτίθεται στα οστά. Η αναλογία στροντίου προς ασβέστιο στα ανθρώπινα οστά είναι μεταξύ 1:1000 και 1:2000, περίπου στο ίδιο εύρος όπως στον ορό του αίματος. [69]
Επίδραση στο ανθρώπινο σώμα
Το ανθρώπινο σώμα απορροφά το στρόντιο, σαν να ήταν το ελαφρύτερο συγγενικό του ασβέστιο. Επειδή τα στοιχεία είναι χημικά πολύ παρόμοια, τα σταθερά ισότοπα στροντίου δεν αποτελούν σημαντική απειλή για την υγεία. Ο μέσος άνθρωπος λαμβάνει περίπου δύο χιλιοστόγραμμα στροντίου την ημέρα. [70] Στους ενήλικες, το στρόντιο που καταναλώνεται τείνει να προσκολλάται μόνο στην επιφάνεια των οστών, αλλά στα παιδιά, το στρόντιο μπορεί να αντικαταστήσει το ασβέστιο στο μέταλλο των αναπτυσσόμενων οστών, και έτσι να οδηγήσει σε προβλήματα ανάπτυξης των οστών. [71]
Ο βιολογικός χρόνος ημιζωής του στροντίου στον άνθρωπο έχει αναφερθεί ποικιλοτρόπως από 14 έως 600 ημέρες, [72] [73] 1.000 ημέρες, [74] 18 χρόνια, [75] 30 χρόνια [76] και 49 χρόνια, σ' ένα ανώτατο όριο. [77] Τα ευρέως δημοσιευμένα στοιχεία βιολογικού χρόνου ημιζωής εξηγούνται απ' τον πολύπλοκο μεταβολισμό του στροντίου μέσα στο σώμα. Ωστόσο, με τον μέσο όρο όλων των μονοπατιών απέκκρισης, ο συνολικός βιολογικός χρόνος ημιζωής εκτιμάται ότι είναι περίπου 18 χρόνια. [78] Ο ρυθμός αποβολής του στροντίου επηρεάζεται έντονα απ' την ηλικία και το φύλο, λόγω των διαφορών στον μεταβολισμό των οστών. [79]
Το φάρμακο ρανελικό στρόντιο βοηθά την ανάπτυξη των οστών, αυξάνει την οστική πυκνότητα και μειώνει τη συχνότητα των καταγμάτων των σπονδύλων, των περιφερικών και του ισχίου. [80] [81] Ωστόσο, το ρανελικό στρόντιο αυξάνει επίσης τον κίνδυνο φλεβικής θρομβοεμβολής, πνευμονικής εμβολής και σοβαρών καρδιαγγειακών διαταραχών, συμπεριλαμβανομένου του εμφράγματος του μυοκαρδίου. Επομένως, η χρήση του είναι πλέον περιορισμένη. [82] Οι ευεργετικές του επιδράσεις είναι επίσης αμφισβητήσιμες, αφού η αυξημένη οστική πυκνότητα προκαλείται, εν μέρει, από την αυξημένη πυκνότητα του στροντίου, έναντι του ασβεστίου που αντικαθιστά. Το στρόντιο βιοσυσσωρεύεται επίσης στο σώμα. [83] Παρά τους περιορισμούς στο ρανελικό στρόντιο, το στρόντιο εξακολουθεί να περιέχεται σε ορισμένα συμπληρώματα. [84] [85] Δεν υπάρχουν πολλά επιστημονικά στοιχεία σχετικά με τους κινδύνους του χλωριούχου στροντίου, όταν λαμβάνεται από το στόμα. Όσοι έχουν προσωπικό ή οικογενειακό ιστορικό διαταραχών πήξης του αίματος συνιστάται να αποφεύγουν το στρόντιο. [84] [85]
Το στρόντιο έχει αποδειχθεί ότι αναστέλλει τον αισθητηριακό ερεθισμό, όταν εφαρμόζεται τοπικά στο δέρμα. [86] [87] Εφαρμόζεται τοπικά, το στρόντιο έχει αποδειχθεί ότι επιταχύνει τον ρυθμό αποκατάστασης του φραγμού επιδερμικής διαπερατότητας (φραγμός δέρματος). [88]
Παραπομπές
- ↑ 1,0 1,1 «Mineral Resource of the Month: Strontium». U.S. Geological Survey. 8 Δεκεμβρίου 2014. http://www.earthmagazine.org/article/mineral-resource-month-strontium.
- ↑ 2,0 2,1 Greenwood and Earnshaw, pp. 112–13
- ↑ Ropp, Richard C. (31 Δεκεμβρίου 2012). Encyclopedia of the Alkaline Earth Compounds. σελ. 16. ISBN 978-0-444-59553-9.
- ↑ 4,0 4,1 Greenwood and Earnshaw, p. 111
- ↑ Greenwood and Earnshaw, p. 119
- ↑ Greenwood and Earnshaw, p. 121
- ↑ Greenwood and Earnshaw, p. 117
- ↑ Greenwood and Earnshaw, p. 115
- ↑ Greenwood and Earnshaw, p. 124
- ↑ Miyoshi, N.; Kamiura, K.; Oka, H.; Kita, A.; Kuwata, R.; Ikehara, D.; Wada, M. (2004). «The Barbier-Type Alkylation of Aldehydes with Alkyl Halides in the Presence of Metallic Strontium». Bulletin of the Chemical Society of Japan 77 (2): 341. doi:.
- ↑ Miyoshi, N.; Ikehara, D.; Kohno, T.; Matsui, A.; Wada, M. (2005). «The Chemistry of Alkylstrontium Halide Analogues: Barbier-type Alkylation of Imines with Alkyl Halides». Chemistry Letters 34 (6): 760. doi:.
- ↑ Miyoshi, N.; Matsuo, T.; Wada, M. (2005). «The Chemistry of Alkylstrontium Halide Analogues, Part 2: Barbier-Type Dialkylation of Esters with Alkyl Halides». European Journal of Organic Chemistry 2005 (20): 4253. doi:.
- ↑ Greenwood and Earnshaw, pp. 136–37
- ↑ Greenwood and Earnshaw, p. 19
- ↑ Halperin, Edward C.· Perez, Carlos A. (2008). Perez and Brady's principles and practice of radiation oncology. Lippincott Williams & Wilkins. σελίδες 1997–. ISBN 978-0-7817-6369-1. Ανακτήθηκε στις 19 Ιουλίου 2011.
- ↑ 16,0 16,1 Bauman, Glenn; Charette, Manya; Reid, Robert; Sathya, Jinka (2005). «Radiopharmaceuticals for the palliation of painful bone metastases – a systematic review». Radiotherapy and Oncology 75 (3): 258.E1–258.E13. doi:. PMID 16299924. Σφάλμα αναφοράς: Μη έγκυρη ετικέτα
<ref>• όνομα " BaumanCharette2005 " ορίζεται πολλές φορές με διαφορετικό περιεχόμενο - ↑ «Strontium | Radiation Protection | US EPA». EPA. 24 Απριλίου 2012. Ανακτήθηκε στις 18 Ιουνίου 2012.
- ↑ «Chernobyl: Assessment of Radiological and Health Impact, 2002 update; Chapter I – The site and accident sequence» (PDF). OECD-NEA. 2002. Ανακτήθηκε στις 3 Ιουνίου 2015.
- ↑ Murray, W. H. (1977). The Companion Guide to the West Highlands of Scotland. London: Collins. ISBN 978-0-00-211135-5.
- ↑ Crawford, Adair (1790). «On the medicinal properties of the muriated barytes». Medical Communications 2: 301–59. https://books.google.com/books?id=bHI_AAAAcAAJ&pg=P301.
- ↑ «Thomas Charles Hope, MD, FRSE, FRS (1766-1844) - School of Chemistry». www.chem.ed.ac.uk.
- ↑ Doyle, W.P. «Thomas Charles Hope, MD, FRSE, FRS (1766–1844)». The University of Edinburgh. Αρχειοθετήθηκε από το πρωτότυπο στις 2 Ιουνίου 2013.
- ↑ Although Thomas C. Hope had investigated strontium ores since 1791, his research was published in: Hope, Thomas Charles (1798). «Account of a mineral from Strontian and of a particular species of earth which it contains». Transactions of the Royal Society of Edinburgh 4 (2): 3–39. doi:. https://books.google.com/books?id=5TEeAQAAMAAJ&pg=RA1-PA3.
- ↑ Murray, T. (1993). «Elementary Scots: The Discovery of Strontium». Scottish Medical Journal 38 (6): 188–89. doi:. PMID 8146640.
- ↑ Hope, Thomas Charles (1794). «Account of a mineral from Strontian and of a particular species of earth which it contains». Transactions of the Royal Society of Edinburgh 3 (2): 141–49. doi:. https://books.google.com/books?id=7StFAAAAcAAJ&pg=PA143.
- ↑ Davy, H. (1808). «Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia». Philosophical Transactions of the Royal Society of London 98: 333–70. doi:. Bibcode: 1808RSPT...98..333D. https://books.google.com/books?id=gpwEAAAAYAAJ&pg=102.
- ↑ Taylor, Stuart (19 Ιουνίου 2008). «Strontian gets set for anniversary». Lochaber News. Αρχειοθετήθηκε από το πρωτότυπο στις 13 Ιανουαρίου 2009.
- ↑ Weeks, Mary Elvira (1932). «The discovery of the elements: X. The alkaline earth metals and magnesium and cadmium». Journal of Chemical Education 9 (6): 1046–57. doi:. Bibcode: 1932JChEd...9.1046W.
- ↑ Partington, J. R. (1942). «The early history of strontium». Annals of Science 5 (2): 157. doi:.
- ↑ Partington, J. R. (1951). «The early history of strontium. Part II». Annals of Science 7: 95. doi:.
- ↑ Many other early investigators examined strontium ore, among them: (1) Martin Heinrich Klaproth, "Chemische Versuche über die Strontianerde" (Chemical experiments on strontian ore), Crell's Annalen (September 1793) no. ii, pp. 189–202 ; and "Nachtrag zu den Versuchen über die Strontianerde" (Addition to the Experiments on Strontian Ore), Crell's Annalen (February 1794) no. i, p. 99 ; also (2) Kirwan, Richard (1794). «Experiments on a new earth found near Stronthian in Scotland». The Transactions of the Royal Irish Academy 5: 243–56.
- ↑ Fachgruppe Geschichte Der Chemie, Gesellschaft Deutscher Chemiker (2005). Metalle in der Elektrochemie. σελίδες 158–62.
- ↑ Heriot, T. H. P (2008). «strontium saccharate process». Manufacture of Sugar from the Cane and Beet. ISBN 978-1-4437-2504-0.
- ↑ Börnchen, Martin. «Der Strontianitbergbau im Münsterland». Αρχειοθετήθηκε από το πρωτότυπο στις 11 Δεκεμβρίου 2014. Ανακτήθηκε στις 9 Νοεμβρίου 2010.
- ↑ Martin, Josèm; Ortega-Huertas, Miguel; Torres-Ruiz, Jose (1984). «Genesis and evolution of strontium deposits of the granada basin (Southeastern Spain): Evidence of diagenetic replacement of a stromatolite belt». Sedimentary Geology 39 (3–4): 281. doi:. Bibcode: 1984SedG...39..281M.
- ↑ «Chain Fission Yields». iaea.org.
- ↑ Nordin, B. E. (1968). «Strontium Comes of Age». British Medical Journal 1 (5591): 566. doi:.
- ↑ Turekian, K. K.; Wedepohl, K. H. (1961). «Distribution of the elements in some major units of the Earth's crust». Geological Society of America Bulletin 72 (2): 175–92. doi:. Bibcode: 1961GSAB...72..175T.
- ↑ 39,0 39,1 Ober, Joyce A. «Mineral Commodity Summaries 2010: Strontium» (PDF). United States Geological Survey. Ανακτήθηκε στις 14 Μαΐου 2010. Σφάλμα αναφοράς: Μη έγκυρη ετικέτα
<ref>• όνομα " usgs10 " ορίζεται πολλές φορές με διαφορετικό περιεχόμενο - ↑ Heuel-Fabianek, B. (2014). «Partition Coefficients (Kd) for the Modelling of Transport Processes of Radionuclides in Groundwater». Berichte des Forschungszentrums Jülich 4375. ISSN 0944-2952. http://juser.fz-juelich.de/record/154001/files/FZJ-2014-03430.pdf.
- ↑ Stringfield, V. T. (1966). «Strontium». Artesian water in Tertiary limestone in the southeastern States. Geological Survey Professional Paper. United States Government Printing Office. σελίδες 138–39.
- ↑ Angino, Ernest E.; Billings, Gale K.; Andersen, Neil (1966). «Observed variations in the strontium concentration of sea water». Chemical Geology 1: 145. doi:. Bibcode: 1966ChGeo...1..145A.
- ↑ Sun, Y.; Sun, M.; Lee, T.; Nie, B. (2005). «Influence of seawater Sr content on coral Sr/Ca and Sr thermometry». Coral Reefs 24: 23. doi:.
- ↑ Kogel, Jessica Elzea· Trivedi, Nikhil C. (5 Μαρτίου 2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses. ISBN 978-0-87335-233-8.
- ↑ Kemal, Mevlüt· Arslan, V. (1996). Production of SrCO3 by black ash process: Determination of reductive roasting parameters. σελ. 401. ISBN 978-90-5410-829-0.
- ↑ «Cathode Ray Tube Glass-To-Glass Recycling» (PDF). ICF Incorporated, USEP Agency. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 19 Δεκεμβρίου 2008. Ανακτήθηκε στις 7 Ιανουαρίου 2012.
- ↑ Ober, Joyce A.· Polyak, Désirée E. «Mineral Yearbook 2007: Strontium» (PDF). United States Geological Survey. Ανακτήθηκε στις 14 Οκτωβρίου 2008.
- ↑ Méar, F.; Yot, P.; Cambon, M.; Ribes, M. (2006). «The characterization of waste cathode-ray tube glass». Waste Management 26 (12): 1468–76. doi:. PMID 16427267.
- ↑ Price, T. Douglas; Schoeninger, Margaret J.; Armelagos, George J. (1985). «Bone chemistry and past behavior: an overview». Journal of Human Evolution 14 (5): 419–47. doi:.
- ↑ Steadman, Luville T.; Brudevold, Finn; Smith, Frank A. (1958). «Distribution of strontium in teeth from different geographic areas». The Journal of the American Dental Association 57 (3): 340–44. doi:. PMID 13575071.
- ↑ Schweissing, Matthew Mike; Grupe, Gisela (2003). «Stable strontium isotopes in human teeth and bone: a key to migration events of the late Roman period in Bavaria». Journal of Archaeological Science 30 (11): 1373–83. doi:.Schweissing, Matthew Mike; Grupe, Gisela (2003).
- ↑ Dasch, J. (1969). «Strontium isotopes in weathering profiles, deep-sea sediments, and sedimentary rocks». Geochimica et Cosmochimica Acta 33 (12): 1521–52. doi:. Bibcode: 1969GeCoA..33.1521D.
- ↑ 53,0 53,1 Krom, M. D.; Cliff, R.; Eijsink, L. M.; Herut, B.; Chester, R. (1999). «The characterisation of Saharan dusts and Nile particulate matter in surface sediments from the Levantine basin using Sr isotopes». Marine Geology 155 (3–4): 319–30. doi:. Bibcode: 1999MGeol.155..319K.
- ↑ Benson, L.; Cordell, L.; Vincent, K.; Taylor, H.; Stein, J.; Farmer, G.; Kiyoto, F. (2003). «Ancient maize from Chacoan great houses: where was it grown?». Proceedings of the National Academy of Sciences 100 (22): 13111–15. doi:. PMID 14563925. Bibcode: 2003PNAS..10013111B.
- ↑ English NB; Betancourt JL; Dean JS; Quade J. (October 2001). «Strontium isotopes reveal distant sources of architectural timber in Chaco Canyon, New Mexico». Proc Natl Acad Sci USA 98 (21): 11891–96. doi:. PMID 11572943. Bibcode: 2001PNAS...9811891E.
- ↑ Barnett-Johnson, Rachel; Grimes, Churchill B.; Royer, Chantell F.; Donohoe, Christopher J. (2007). «Identifying the contribution of wild and hatchery Chinook salmon (Oncorhynchus tshawytscha) to the ocean fishery using otolith microstructure as natural tags». Canadian Journal of Fisheries and Aquatic Sciences 64 (12): 1683–92. doi:. https://zenodo.org/record/1235897.
- ↑ Porder, S.; Paytan, A.; E.A. Hadly (2003). «Mapping the origin of faunal assemblages using strontium isotopes». Paleobiology 29 (2): 197–204. doi:.
- ↑ «Chemistry of Firework Colors – How Fireworks Are Colored». Chemistry.about.com. 10 Απριλίου 2012. Ανακτήθηκε στις 14 Απριλίου 2012.
- ↑ «Ferrite Permanent Magnets». Arnold Magnetic Technologies. Αρχειοθετήθηκε από το πρωτότυπο στις 14 Μαΐου 2012. Ανακτήθηκε στις 18 Ιανουαρίου 2014.
- ↑ «Barium Carbonate». Chemical Products Corporation. Αρχειοθετήθηκε από το πρωτότυπο στις 6 Οκτωβρίου 2014. Ανακτήθηκε στις 18 Ιανουαρίου 2014.
- ↑ Ghom (1 Δεκεμβρίου 2005). Textbook of Oral Medicine. σελ. 885. ISBN 978-81-8061-431-6.
- ↑ CartlidgeMar. 1, Edwin· 2018· Pm, 12:00 (28 Φεβρουαρίου 2018). «With better atomic clocks, scientists prepare to redefine the second». Science | AAAS (στα Αγγλικά). Ανακτήθηκε στις 10 Φεβρουαρίου 2019.
- ↑ «FDA ANDA Generic Drug Approvals». Food and Drug Administration.
- ↑ «What are the fuels for radioisotope thermoelectric generators?». qrg.northwestern.edu.
- ↑ Doyle, James (30 Ιουνίου 2008). Nuclear safeguards, security and nonproliferation: achieving security with technology and policy. σελ. 459. ISBN 978-0-7506-8673-0.Doyle, James (30 June 2008).
- ↑ O'Brien, R. C.; Ambrosi, R. M.; Bannister, N. P.; Howe, S. D.; Atkinson, H. V. (2008). «Safe radioisotope thermoelectric generators and heat sources for space applications». Journal of Nuclear Materials 377 (3): 506–21. doi:. Bibcode: 2008JNuM..377..506O.O'Brien, R. C.; Ambrosi, R. M.; Bannister, N. P.; Howe, S. D.; Atkinson, H. V. (2008).
- ↑ De Deckker, Patrick (2004). «On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios». Hydrobiologia 517 (1–3): 1. doi:.
- ↑ Pors Nielsen, S. (2004). «The biological role of strontium». Bone 35 (3): 583–88. doi:. PMID 15336592.Pors Nielsen, S. (2004).
- ↑ Cabrera, Walter E.; Schrooten, Iris; De Broe, Marc E.; d'Haese, Patrick C. (1999). «Strontium and Bone». Journal of Bone and Mineral Research 14 (5): 661–68. doi:. PMID 10320513.Cabrera, Walter E.; Schrooten, Iris; De Broe, Marc E.; d'Haese, Patrick C. (1999).
- ↑ Emsley, John (2011). Nature's building blocks: an A–Z guide to the elements. Oxford University Press. σελ. 507. ISBN 978-0-19-960563-7.Emsley, John (2011).
- ↑ Agency for Toxic Substances and Disease Registry (21 Ιανουαρίου 2015). «ATSDR – Public Health Statement: Strontium». cdc.gov. Agency for Toxic Substances and Disease Registry. Ανακτήθηκε στις 17 Νοεμβρίου 2016.
- ↑ Tiller, B. L. (2001), «4.5 Fish and Wildlife Surveillance», Hanford Site 2001 Environmental Report, DOE, http://hanford-site.pnnl.gov/envreport/2001/env01_45.pdf, ανακτήθηκε στις 14 January 2014
- ↑ Driver, C. J. (1994), Ecotoxicity Literature Review of Selected Hanford Site Contaminants, DOE, doi:, http://www.osti.gov/bridge/servlets/purl/10136486-6sLptZ/native/10136486.pdf, ανακτήθηκε στις 14 January 2014
- ↑ «Freshwater Ecology and Human Influence». Area IV Envirothon. Αρχειοθετήθηκε από το πρωτότυπο στις 1 Ιανουαρίου 2014. Ανακτήθηκε στις 14 Ιανουαρίου 2014.
- ↑ «Radioisotopes That May Impact Food Resources» (PDF). Epidemiology, Health and Social Services, State of Alaska. Αρχειοθετήθηκε από το πρωτότυπο στις 21 Αυγούστου 2014. Ανακτήθηκε στις 14 Ιανουαρίου 2014.
- ↑ «Human Health Fact Sheet: Strontium» (PDF). Argonne National Laboratory. Οκτωβρίου 2001. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 24 Ιανουαρίου 2014. Ανακτήθηκε στις 14 Ιανουαρίου 2014.
- ↑ «Biological Half-life». HyperPhysics. Ανακτήθηκε στις 14 Ιανουαρίου 2014.
- ↑ Glasstone, Samuel· Dolan, Philip J. (1977). «XII: Biological Effects». The effects of Nuclear Weapons. σελ. 605.
Η παράμετρος |access-date=χρειάζεται|url=(βοήθεια)Glasstone, Samuel; Dolan, Philip J. (1977). - ↑ Shagina, N. B.; Bougrov, N. G.; Degteva, M. O.; Kozheurov, V. P.; Tolstykh, E. I. (2006). «An application of in vivo whole body counting technique for studying strontium metabolism and internal dose reconstruction for the Techa River population». Journal of Physics: Conference Series 41 (1): 433–40. doi:. Bibcode: 2006JPhCS..41..433S.
- ↑ Meunier P. J.; Roux C.; Seeman E.; Ortolani, S.; Badurski, J. E.; Spector, T. D.; Cannata, J.; Balogh, A. και άλλοι. (January 2004). «The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis». New England Journal of Medicine 350 (5): 459–68. doi:. PMID 14749454. http://espace.library.uq.edu.au/view/UQ:315180/UQ315180_OA.pdf.
- ↑ Reginster JY; Seeman E; De Vernejoul MC; Adami, S.; Compston, J.; Phenekos, C.; Devogelaer, J. P.; Diaz Curiel, M. και άλλοι. (May 2005). «Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study». The Journal of Clinical Endocrinology & Metabolism 90 (5): 2816–22. doi:. PMID 15728210. http://orbi.ulg.ac.be/bitstream/2268/20123/1/Strontium%20ranelate%20reduces%20the%20risk%20of%20nonvertebral%20fractures%20in%20postmenopausal%20women%20with%20osteoporosis%20Treatment%20of%20Peripheral%20Osteoporosis%20%28TROPOS%29%20study.pdf.
- ↑ «Strontium ranelate: cardiovascular risk – restricted indication and new monitoring requirements». Medicines and Healthcare products Regulatory Agency, UK. Μαρτίου 2014."Strontium ranelate: cardiovascular risk – restricted indication and new monitoring requirements".
- ↑ Price, Charles T.; Langford, Joshua R.; Liporace, Frank A. (5 April 2012). «Essential Nutrients for Bone Health and a Review of their Availability in the Average North American Diet». Open Orthop. J. 6: 143–49. doi:. PMID 22523525.Price, Charles T.; Langford, Joshua R.; Liporace, Frank A. (5 April 2012).
- ↑ 84,0 84,1 «Strontium». WebMD. Ανακτήθηκε στις 20 Νοεμβρίου 2017."Strontium".
- ↑ 85,0 85,1 «Strontium for Osteoporosis». WebMD. Ανακτήθηκε στις 20 Νοεμβρίου 2017."Strontium for Osteoporosis".
- ↑ Hahn, G.S. (1999). «Strontium Is a Potent and Selective Inhibitor of Sensory Irritation». Dermatologic Surgery 25 (9): 689–94. doi:. PMID 10491058. Αρχειοθετήθηκε από το πρωτότυπο στις 31 May 2016. https://web.archive.org/web/20160531110553/http://refinityskinscience.com/wp-content/themes/refinity/pdf/1_strontium_is_a_potent_selective_inhibitor.pdf.
- ↑ Hahn, G.S. (2001). Anti-irritants for Sensory Irritation. σελ. 285. ISBN 978-0-8247-0292-2.
- ↑ Kim, Hyun Jeong; Kim, Min Jung; Jeong, Se Kyoo (2006). «The Effects of Strontium Ions on Epidermal Permeability Barrier». The Korean Dermatological Association, Korean Journal of Dermatology 44: 1309. http://210.101.116.107/kda/english/view.asp?year=2006&page=1309&vol=44&iss=11#.Kim, Hyun Jeong; Kim, Min Jung; Jeong, Se Kyoo (2006).
Εξωτερικοί σύνδεσμοι
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|
| Αυτό το λήμμα σχετικά με ένα χημικό στοιχείο χρειάζεται επέκταση. Μπορείτε να βοηθήσετε την Βικιπαίδεια επεκτείνοντάς το. |




