Βιοσύνθεση
Βιοσύνθεση ή αναβολισμός είναι μια διεργασία πολλών σταδίων που καταλύεται από ένζυμα, όπου τα υποστρώματα μετατρέπονται σε πιο περίπλοκα προϊόντα σε ζωντανούς οργανισμούς. Στη βιοσύνθεση, απλές χημικές ενώσεις τροποποιούνται, μετατρεπόμενες σε άλλες ενώσεις, ή ενώνονται μαζί για να σχηματίσουν μακρομόρια. Αυτή η διεργασία αποτελείται συχνά από μεταβολικές οδούς. Κάποιες από αυτές τις βιοσυνθετικές εντοπίζονται μέσα σε ένα μόνο κυτταρικό οργανίδιο, ενώ άλλες εμπλέκουν ένζυμα που βρίσκονται μέσα σε πολλά κυτταρικά οργανίδια. Παραδείγματα αυτών των βιοσυνθετικών οδών περιλαμβάνουν την παραγωγή των συστατικών της λιπιδικής μεμβράνης και των νουκλεοτιδίων.
Τα προαπαιτούμενα για τη βιοσύνθεση περιλαμβάνουν: πρόδρομες ενώσεις, χημική ενέργεια (π.χ. τριφωσφορική αδενοσίνη (ATP)) και καταλυτικά ένζυμα που μπορεί να χρειάζονται συνένζυμα (e.g.NADH, NADPH). Αυτές οι ενώσεις δημιουργούν μονομερή, τις δομικές μονάδες για τα μακρομόρια. Μερικά σημαντικά βιολογικά μακρομόρια περιλαμβάνουν: πρωτεΐνες, που αποτελούνται από μονομερή αμινοξέα ενωμένα με πεπτιδικούς δεσμούς και μόρια DNA , που αποτελούνται από νουκλεοτίδια ενωμένα με φωσφοδιεστερικούς δεσμούς.
Ιδιότητες των χημικών αντιδράσεων
[Επεξεργασία | επεξεργασία κώδικα]Η βιοσύνθεση λαμβάνει χώρα λόγω μιας σειράς χημικών αντιδράσεων. Για να γίνουν αυτές οι αντιδράσεις, είναι απαραίτητα τα παρακάτω:[1]
- Πρόδρομες ενώσεις: αυτές οι ενώσεις είναι τα αρχικά μόρια ή υποστρώματα σε μια αντίδραση. Αυτές μπορεί να θεωρηθούν ως τα αντιδρώντα σε μια δεδομένη χημική διεργασία.
- Χημική ενέργεια: η χημική ενέργεια μπορεί να βρεθεί με τη μορφή μορίων υψηλής ενέργειας. Αυτά τα μόρια απαιτούνται για μη ευνοϊκές αντιδράσεις από πλευράς ενέργειας. Επιπλέον, η υδρόλυση αυτών των ενώσεων προωθεί μια αντίδραση. Μόρια υψηλής ενέργειας, όπως τριφωσφορική αδενοσίνη, έχουν τρία φωσφορικά. Συχνά, το τελευταίο φωσφορικό σπάει κατά την υδρόλυση και μεταφέρεται σε ένα άλλο μόριο.
- Καταλυτικά ένζυμα: αυτά τα μόρια είναι ειδικές πρωτεΐνες που καταλύουν μια αντίδραση αυξάνοντας την ταχύτητα (ρυθμό) της αντίδρασης και μειώνοντας την ενέργεια ενεργοποίησης.
- Συνένζυμα ή συμπαράγοντες: οι συμπαράγοντες είναι μόρια που βοηθούν στις χημικές αντιδράσεις. Αυτοί μπορεί να είναι μεταλλικά ιόντα, παράγωγα βιταμινών όπως NADH και ακετυλοσυνένζυμο Α (acetyl CoA), ή μη βιταμινικά παράγωγα όπως ATP. Στην περίπτωση του NADH, το μόριο μεταφέρει υδρογόνο, ενώ το ακετυλοσυνένζυμο Α μεταφέρει ακετυλομάδα και το ATP μεταφέρει φωσφορική ομάδα.
Στην πιο απλή έννοια, οι αντιδράσεις που συμβαίνουν στη βιοσύνθεση έχουν την παρακάτω μορφή:[2]
Κάποιες παραλλαγές της βασικής εξίσωσης που θα συζητηθούν αργότερα πιο λεπτομερώς είναι οι παρακάτω:[3]
- Απλές ενώσεις που μετατρέπονται σε άλλες ενώσεις, συνήθως ως τμήμα πολλαπλής βηματικής οδού αντίδρασης. Δύο παραδείγματα αυτού του τύπου αντίδρασης λαμβάνουν χώρα κατά τη διάρκεια σχηματισμού των νουκλεϊκών οξέων και της φόρτωσης του νουκλεϊκού οξέος πριν τη μετάφραση. Για κάποια από αυτά τα βήματα, απαιτείται χημική ενέργεια:
- Απλές ενώσεις που μετατρέπονται σε άλλες ενώσεις με τη βοήθεια συμπαραγόντων. Παραδείγματος χάρη, η σύνθεση των φωσφολιπιδίων απαιτεί ακετυλοσυνένζυμο Α, ενώ η σύνθεση ενός άλλου συστατικού της μεμβράνης, των σφιγγολιπιδίων (s), απαιτεί NADH και FADH για τον σχηματισμό του σκελετού της σφιγγοσίνης (sphingosine). Η γενική εξίσωση αυτών των παραδειγμάτων είναι:
- Απλές ενώσεις που συνενώνονται για να δημιουργήσουν μακρομόριο. Παραδείγματος χάρη, λιπαρά οξέα συνενώνονται για να σχηματίσουν φωσφολιπίδια. Με τη σειρά τους, τα φωσφολιπίδια και η χοληστερόλη αλληλεπιδρούν μη ομοιοπολικά (noncovalently) για να σχηματίσουν λιπιδική διπλοστιβάδα (lipid bilayer). Αυτή η αντίδραση μπορεί να απεικονιστεί ως εξής:
Λιπίδια
[Επεξεργασία | επεξεργασία κώδικα]
Πολλά περίπλοκα μακρομόρια συντίθενται με μοτίβα απλών επαναλαμβανόμενων δομών.[4] Παραδείγματος χάρη, οι πιο απλές δομές των λιπιδίων είναι τα λιπαρά οξέα. Τα λιπαρά οξέα είναι παράγωγα υδρογονανθράκων· περιέχουν "κεφαλή" καρβοξυλικής ομάδας και "ουρά".[4] These fatty acids create larger components, which in turn incorporate noncovalent interactions to form the lipid bilayer.[4] Οι αλυσίδες των λιπαρών οξέων βρίσκονται σε δύο κύρια συστατικά των μεμβρανικών λιπιδίων: στα φωσφολιπίδια και στα σφιγγολιπίδια. Ένα τρίτο κύριο μεμβρανικό συστατικό, η χοληστερόλη, δεν περιέχει αυτές τις μονάδες λιπαρών οξέων.[5]
Φωσφολιπίδια
[Επεξεργασία | επεξεργασία κώδικα]Η βάση όλων των βιομεμβρανών αποτελείται από δομή διπλής στιβάδας των φωσφολιπιδίων.[6] Το μόριο του φωσφολιπιδίου είναι αμφιπαθές (amphipathic)· περιέχει υδρόφιλη πολική κεφαλή και υδρόφοβη μη πολική ουρά.[4] Οι κεφαλές των φωσφολιπιδίων αλληλεπιδρούν μεταξύ τους και με υδατικά μέσα, ενώ οι υδρογονικές ουρές προσανατολίζονται στο κέντρο, μακριά από το νερό.[7] Αυτές οι τελευταίες αλληλεπιδράσεις οδηγούς τη δομή διπλοστιβάδας που δρα ως φράγμα για ιόντα και μόρια. [8]
Υπάρχουν διαφορετικοί τύποι φωσφολιπιδίων και συνεπώς οι οδοί σύνθεσής τους διαφέρουν. Όμως, το πρώτο βήμα στη φωσφολιπιδική σύνθεση περιλαμβάνει τον σχηματισμό φωσφατιδικού ή 3-φωσφορικής διακυλογλυκερόλης στο ενδοπλασματικό δίκτυο και στην εξωτερική μεμβράνη του μιτοχονδρίου.[7] Η οδός της σύνθεσης βρίσκεται παρακάτω:

Η οδός ξεκινά με 3-φωσφατική γλυκερόλη, που μετατρέπεται σε φωσφολιπιδικό μέσω προσθήκης αλυσίδας λιπαρού οξέος που παρέχεται από το ακυλοσυνένζυμο Α.[9] Έπειτα, το λυσοφωσφατιδικό μετατρέπεται σε φωσφατιδικό μέσω της προσθήκης μιας άλλης αλυσίδας λιπαρού οξέος που δίνεται από ένα δεύτερο ακυλο-συνένζυμο Α· Όλα αυτά τα βήματα καταλύονται από το ένζυμο ακυλομεταφοράση της φωσφορικής γλυκερόλης.[9] Η φωσφολιπιδική σύνθεση συνεχίζεται στο ενδοπλασματικό δίκτυο και η οδός βιοσύνθεσης διαφοροποιείται ανάλογα με τα συστατικά του συγκεκριμένου φωσφολιπιδίου.[9]
Σφιγγολιπίδια
[Επεξεργασία | επεξεργασία κώδικα]Όπως και στα φωσφολιπίδια, αυτά τα παράγωγα λιπαρών οξέων έχουν πολική κεφαλή και μη μη πολικές ουρές.[5] Αντίθετα με τα φωσφολιπίδια, τα σφιγγολιπίδια έχουν σκελετό σφιγγοσίνης.[10] Τα σφιγγολιπίδια υπάρχουν σε ευκαρυωτικά κύτταρα και είναι ιδιαίτερα άφθονα στο κεντρικό νευρικό σύστημα.[7] Παραδείγματος χάρη, η σφιγγομυελίνη είναι τμήμα του ελύτρου μυελίνης των νευρικών ινών.[11]
Τα σφιγγολιπίδια σχηματίζονται από κεραμίδια (ceramides) που αποτελούνται από αλυσίδα λιπαρού οξέος συνδεμένης με την αμινομάδα του σκελετού της σφιγγοσίνης. Αυτά τα κεραμίδια συντίθενται από την ακυλίωση της σφιγγοσίνης.[11] Η βιοσυνθετική οδός της σφιγγοσίνης βρίσκεται παρακάτω:
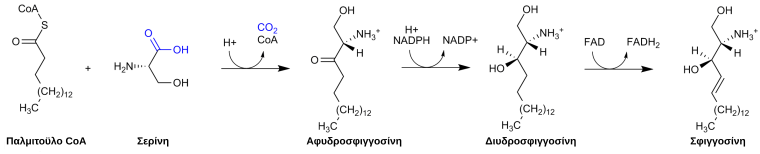
Όπως δείχνει η εικόνα, κατά τη σύνθεση της μυελίνης, το παλμιτοϋλο-συνένζυμο Α και η σερίνη υφίστανται αντίδραση συμπύκνωσης που καταλήγει στον σχηματισμό της αφυδροσφιγγοσίνης.[7] Αυτό το προϊόν ανάγεται στη συνέχεια για να σχηματίσει διυδροσφιγγοσίνη, που μετατρέπεται σε σφιγγοσίνη μέσω οξειδοαναγωγής από φλαβινοαδενινοδινουκλεοτίδιο (FAD).[7]
Χοληστερόλη
[Επεξεργασία | επεξεργασία κώδικα]Αυτό το λιπίδιο ανήκει σε μια τάξη μορίων που ονομάζονται στερόλες (sterols).[5] Οι στερόλες έχουν τέσσερις σύντηκτους δακτυλίους και υδροξύλιο.[5] Η χοληστερόλη είναι ιδιαίτερα σημαντικό μόριο. Όχι μόνο χρησιμεύει ως συστατικό της λιπιδικής μεμβράνης, αλλά είναι επίσης πρόδρομη ένωση σε αρκετές στεροειδείς ορμόνες, συμπεριλαμβανομένων της κορτιζόλης, της τεστοστερόνης και των οιστρογόνων.[12]
Η χοληστερόλη συντίθεται από το ακετυλο-συνένζυμο Α.[12] Η οδός δίνεται παρακάτω:

Πιο γενικά, αυτή η σύνθεση γίνεται σε τρία στάδια, με το πρώτο στάδιο να λαμβάνει χώρα στο κυτταρόπλασμα και τα άλλα δύο συμβαίνουν στο ενδοπλασματικό δίκτυο.[9] Τα στάδια έχουν ως εξής:[12]
- 1. Η σύνθεση του πυροφωσφορικού ισοπεντενυλίου (isopentenyl pyrophosphate), της "δομικής μονάδας" της χοληστερόλης.
- 2. Ο σχηματισμός του σκουαλενίου μέσω της συμπύκνωσης έξι μορίων φωσφορικού ισοπεντενυλίου.
- 3. Η μετατροπή του σκουαλενίου σε χοληστερόλη μέσω αρκετών ενζυμικών αντιδράσεων.
Νουκλεοτίδια
[Επεξεργασία | επεξεργασία κώδικα]Η βιοσύνθεση των νουκλεοτιδίων περιλαμβάνει ενζυμικά καταλυόμενες αντιδράσεις που μετατρέπουν τα υποστρώματα σε πιο περίπλοκα προϊόντα.[1] Τα νουκλεοτίδια είναι οι δομικοί λίθοι του DNA και του RNA. Τα νουκλεοτίδια αποτελούνται από πενταμελή δακτύλιο που σχηματίζεται από το σάκχαρο της ριβόζης στο RNA, και το σάκχαρο της δεοξυριβόζης στο DNA· αυτά τα σάκχαρα συνδέονται με βάση πουρίνης ή πυριμιδίνης με γλυκοζιτικό δεσμό (glycosidic bond) και φωσφορική ομάδα στη θέση 5' του ριβονουκλεοτιδίου του σακχάρου.[13]
Νουκλεοτίδια πουρίνης
[Επεξεργασία | επεξεργασία κώδικα]
Τα νουκλεοσίδια του DNA αδενοσίνη και γουανοσίνη (guanosine) αποτελούνται από βάση πουρίνης συνδεμένα με σάκχαρο ριβόζης με γλυκοζιτικό δεσμό. Στην περίπτωση των νουκλεοτιδίων του RNA δεοξυαδενοσίνης (deoxyadenosine) και δεοξυγουανοσίνης (deoxyguanosine), οι βάσεις της πουρίνης συνδέονται με σάκχαρο δεοξυριβόζης με γλυκοζιτικό δεσμό. Οι βάσεις πουρίνης σε νουκλεοτίδια DNA και RNA συντίθεται με έναν μηχανισμό αντίδρασης δώδεκα σταδίων που είναι παρών στους περισσότερους μονοκύτταρους οργανισμούς. Τα ανώτερα ευκαρυωτικά κύτταρα χρησιμοποιούν παρόμοιο μηχανισμό αντίδρασης σε μια αντίδραση δέκα βημάτων. Οι βάσεις πουρίνης συντίθενται με μετατροπή του πυροφωσφορικού φωσφοριβοσυλίου (phosphoribosyl pyrophosphate ή PRPP) σε μονοσφωφορική ινοσίνη (inosine monophosphate ή IMP), που είναι το πρώτο κύριο ενδιάμεσο προϊόν στη βιοσύνθεση βάσης πουρίνης.[14] Παραπέρα ενζυματική τροποποίηση της IMP παράγει τις βάσεις των νουκλεοτιδίων αδενοσίνη και γουανοσίνη.
- Το πρώτο στάδιο στη βιοσύνθεση πουρίνης είναι αντίδραση συμπύκνωσης, που εκτελείται από την αμιδοφωσφοριβοσυλομεταφοράση (amidophosphoribosyltransferase). Αυτό το ένζυμο μεταφέρει την αμινομάδα από τη γλουταμίνη στο PRPP, σχηματίζοντας 5-φωσφοριβοσυλαμίνη. Το επόμενο στάδιο απαιτεί την ενεργοποίηση της γλυκίνης με την προσθήκη φωσφορικής ομάδας από ATP.
- Η συνθετάση GAR [15] εκτελεί τη συμπύκνωση της ενεργοποιημένης γλυκίνης σε PRPP, σχηματίζοντας ριβονουκλεοτίδιο του γλυκιναμιδίου (glycineamide ribonucleotide ή GAR).
- Η τρανσφορμυλάση GAR (GAR transformylase) προσθέτει φορμυλομάδα στην αμινομάδα του GAR, σχηματίζοντας το ριβονουκλεοτίδιο φορμυλογλυκιναμίδιο (FGAR).
- Η αμιδομεταφοράση FGAR[16] καταλύει την προσθήκη μιας ομάδας αζώτου στο FGAR, σχηματίζοντας φορμυλογλυκιναμιδινοριβονουκλεοτίδιο (formylglycinamidine ribonucleotide ή FGAM).
- Η κυκλάση FGAM (FGAM cyclase) καταλύει το κλείσιμο του δακτυλίου, που περιλαμβάνει την αφαίρεση μορίου νερού, σχηματίζοντας τον πενταμελή δακτύλιο 5-αμινοϊμιδαζολοριβονουκλεοτίδιο (5-aminoimidazole ribonucleotide ή AIR).
- Η συνθετάση N5-CAIR μεταφέρει μια καρβοξυλομάδα, σχηματίζοντας το ενδιάμεσο Ν5-καρβοξυαμινοϊμιδαζολοριβονουκλεοτίδιο (N5-carboxyaminoimidazole ribonucleotide ή N5-CAIR).[17]
- Η μουτάση N5-CAIR (N5-CAIR mutase) αναδιατάσσει την καρβοξυλομάδα και την μεταφέρει στον ιμιδαζολικό δακτύλιο, σχηματίζοντας καρβοξυαμινοϊμιδαζολοριβονουκλεοτίδιο (carboxyamino- imidazole ribonucleotide ή CAIR). Ο μηχανισμός σχηματισμού δύο σταδίων του CAIR από AIR βρίσκεται κυρίως σε μονοκύτταρους οργανισμούς. Υψηλότεροι ευκαρυώτες περιέχουν το ένζυμο AIR καρβοξυλάσης, [18] που μεταφέρει μια καρβοξυλομάδα απευθείας στον ιμιδαζολικό δακτύλιο AIR, σχηματίζοντας CAIR.
- Η συνθετάση SAICAR (SAICAR synthetase) σχηματίζει πεπτιδικό δεσμό μεταξύ ασπαργανικού και της προστιθέμενης καρβοξυλομάδας του ιμιδαζολικού δακτυλίου, σχηματίζοντας Ν-ηλεκτρυλο-5-αμινοϊμιδαζολο-4-καρβοξαμιδοριβονουκλεοτίδιο (N-succinyl-5-aminoimidazole-4-carboxamide ribonucleotide ή SAICAR).
- Η λυάση SAICAR αφαιρεί τον ανθρακικό σκελετό του προστιθέμενου ασπαραγανικού, αφήνοντας την αμινομάδα και σχηματίζοντας 5-αμινοϊμιδαζολο-4-καρβοξαμιδοριβονουκλεοτίδιο (5-aminoimidazole-4-carboxamide ribonucleotide ή AICAR).
- Η τρανσφορμυλάση AICAR (transformylase AICAR) μεταφέρει μια καρβονυλομάδα στο AICAR, σχηματίζοντας N-φορμυλαμινοϊμιδαζολο-4-καρβοξαμιδοριβονουκλεοτίδιο(N-formylaminoimidazole- 4-carboxamide ribonucleotide ή FAICAR).
- Το τελικό στάδιο περιλαμβάνει το ένζυμο συνθάση IMP (inosine monophosphate synthase), που κλείνει τον πουρινικό δακτύλιο και σχηματίζει το ενδιάμεσο μονοφωσφορική ινοσίνη (inosine monophosphate ή IMP).[5]
Νουκλεοτίδια της πυριμιδίνης
[Επεξεργασία | επεξεργασία κώδικα]
Άλλες βάσεις νουκλεοτιδίων DNA και RNA που συνδέονται με το σάκχαρο της ριβόζης μέσω γλυκοζιδικού δεσμού είναι η θυμίνη, η κυτοσίνη και η ουρακίλη (που βρίσκεται μόνο στο RNA). Η βιοσύνθεση της μονοφωσφορικής ουριδίνης (Uridine monophosphate) περιλαμβάνει ένα ένζυμο που βρίσκεται στην εσωτερική μιτοχονδριακή μεμβράνη και πολυλειτουργικά ένζυμα που βρίσκονται στο κυτταρόλυμα ή κυτοσόλιο (cytosol).[19]
- Το πρώτο στάδιο περιλαμβάνει το ένζυμο συνθετάση του φωσφορικού καρβαμοϋλίου (carbamoyl phosphate synthase) που συνδυάζει την γλουταμίνη με το CO2 σε αντίδραση που εξαρτάται από το ATP για να σχηματίσει φωσφορικό καρβαμοΰλιο (carbamoyl phosphate).
- Η ασπαριγινική καρβαμοϋλοτρανσφεράση (Aspartate carbamoyltransferase) συμπυκνώνει το φωσφορικό καρβαμοΰλιο με ασπαργανικό για να σχηματίσει ουριδοηλεκτρικό (uridosuccinate).
- Η διυδροοροτάση (Dihydroorotase) εκτελεί κλείσιμο δακτυλίου (ring closure), μια αντίδραση που χάνει νερό, για να σχηματίσει διυδροοροτάση.
- Η διυδροοροτική αφυδρογονάση (Dihydroorotate dehydrogenase), που βρίσκεται μέσα στην εσωτερική μιτοχονδριακή μεμβράνη,[19] οξειδώνει το διυδροοροτικό (dihydroorotate) σε οροτικό.
- Η οροτική φωσφοριβοσυλική υδρολάση (Orotate phosphoribosyl hydrolase ή OMP pyrophosphorylase) συμπυκνώνει το οροτικό με PRPP για να σχηματίσει 5'-μονοφωσφορική οροτιδίνη (orotidine-5'-phosphate).
- Η αποκαρβοξυλάση OMP (OMP decarboxylase) καταλύει τη μετατροπή της 5'-φωσφορικής οροτιδίνης σε μονοφωσφορική ουριδίνη (Uridine monophosphateή UMP).[20]
Αφού συντεθεί η νουκλεοτιδική βάση της ουριδίνης, συντίθενται οι άλλες βάσεις κυτοσίνης και θυμίνης. Η βιοσύνθεση της κυτοσίνης είναι μια αντίδραση δύο σταδίων που περιλαμβάνει τη μετατροπή του UMP σε UTP. Η προσθήκη φωσφορικών σε UMP καταλύεται από το ένζυμο της κινάσης. Το ένζυμο συνθάση CTP καταλύει το επόμενο βήμα της αντίδρασης: τη μετατροπή του UTP σε τριφωσφορική κυτιδίνη (CTP) με μεταφορά μιας αμινομάδας από την γλουταμίνη στην ουριδίνη· αυτό σχηματίζει τη βάση της κυτοσίνης του CTP.[21] Ο μηχανισμός, που περιγράφει την αντίδραση UTP + ATP + γλουταμίνη ⇔ CTP + ADP + γλουταμινικό, είναι ο παρακάτω:
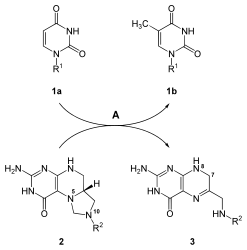

Η κυτοσίνη είναι ένα νουκλεοτίδιο που βρίσκεται και στο DNA και στο RNA. Όμως, η ουρακίλη βρίσκεται μόνο στο RNA. Συνεπώς, μετά τη σύνθεση του UTP, πρέπει να μετατραπεί σε μια δεοξυ μορφή για να ενσωματωθεί στο DNA. Αυτή η μετατροπή περιλαμβάνει το ένζυμο αναγωγάση του τριφωσφορικού ριβονουκλεοσιδίου (ribonucleoside triphosphate reductase). Αυτή η αντίδραση που αφαιρεί το 2'-OH του σακχάρου της ριβόζης για να δημιουργήσει δεοξυριβόζη δεν επηρεάζεται από τις προσαρτημένες βάσεις στο σάκχαρο. Αυτή η μη εξειδίκευση επιτρέπει στην αναγωγάση του τριφωσφορικού ριβονουκλεοσιδίου να μετατρέπει όλα τα τριφωσφορικά νουκλεοσίδια σε δεοξυριβονουκλεοτίδια με παρόμοιο μηχανισμό.[21]
Αντίθετα με την ουρακίλη, οι βάσεις θυμίνης βρίσκονται κυρίως στο DNA, όχι στο RNA. Τα κύτταρα δεν περιέχουν κανονικά βάσεις θυμίνης που είναι συνδεμένες με σάκχαρα ριβόζης σε RNA, συνεπώς αυτό δείχνει ότι τα κύτταρα συνθέτουν μόνο θυμίνη συνδεμένη με δεοξυριβόζη. Το ένζυμο θυμιδυλική συνθετάση είναι υπεύθυνο για τη σύνθεση υπολειμμάτων θυμίνης από από dUMP σε dTMP. Αυτή η αντίδραση μεταφέρει μια μεθυλομάδα στη βάση ουρακίλης του dUMP για να δημιουργήσει dTMP.[21] Η thymidylate synthase reaction, dUMP + 5,10-methylenetetrahydrofolate ⇔ dTMP + dihydrofolate, φαίνεται στα δεξιά.
DNA
[Επεξεργασία | επεξεργασία κώδικα]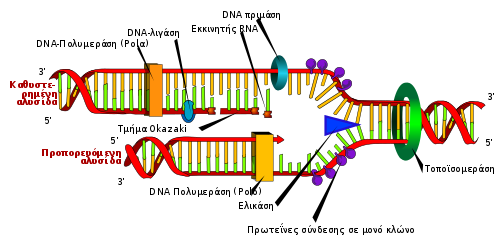
Αν και υπάρχουν διαφορές μεταξύ ευκαρυωτικής και προκαρυωτικής σύνθεσης DNA, η παρακάτω ενότητα δείχνει βασικά χαρακτηριστικά της αντιγραφής του DNA που είναι κοινή και στα δύο είδη οργανισμών.
Το DNA αποτελείται από νουκλεοτίδια που συνδέονται με φωσφοδιεστερικούς δεσμούς.[4] Η σύνθεση του DNA, που λαμβάνει χώρα στον πυρήνα, είναι ημισυντηρητική διεργασία, που σημαίνει ότι το τελικό μόριο του DNA περιέχει έναν αρχικό κλώνο από τη γονική δομή και έναν νέο κλώνο.[22] Η σύνθεση του DNA καταλύεται από μια οικογένεια πολυμερασών DNA που απαιτεί τέσσερα τριφωσφορικά δεοξυνουκλεοσίδια, μια αλυσίδα-εκμαγείο και έναν εκκινητή RNA με ελεύθερο 3'OH στο οποίο να ενσωματωθούν τα νουκλεοτίδια.[23]
Για να συμβεί η αντιγραφή του DNA, δημιουργείται μια διχάλα αντιγραφής από ένζυμα που ονομάζονται ελικάσες και ξετυλίγουν την έλικα του DNA.[23] Οι τοποϊσομεράσες στη διχάλα αντιγραφής αφαιρούν τις υπερσυστροφές DNA που προκαλείται από το ξετύλιγμα του DNA και οι πρωτεΐνες πρόσδεσης μονόκλωνου DNA διατηρούν τα δύο μονόκλωνα εκμαγεία DNA σταθεροποιημένα πριν την αντιγραφή.[13]
Η σύνθεση του DNA αρχικοποιείται από την πριμάση της RNA πολυμεράσης, που κάνει εκκινητή RNA με ελεύθερο 3'OH.[23] Αυτός ο εκκινητής συνδέεται με την μονόκλωνη μήτρα DNA και η πολυμεράση DNA επιμηκύνει την αλυσίδα ενσωματώνοντας νουκλεοτίδια· η πολυμέραση DNA επιδιορθώνει τον νεοσυντιθέμενο κλώνο του DNA.[23]
Κατά την αντίδραση πολυμερισμού που καταλύεται από την πολυμέραση DNA , λαμβάνει χώρα πυρηνόφιλη προσβολή από το 3'OH της αυξανόμενης αλυσίδας στο εσώτατο άτομο φωσφόρου ενός τριφωσφορικού δεοξυνουκλεοσιδίου· αυτό σχηματίζει φωσφοδιεστερική γέφυρα που προσαρτά ένα νέο νουκλεοτίδιο και απελευθερώνει πυροφωσφορικά.[9]
Οι δύο τύποι αλυσίδων δημιουργούνται ταυτόχρονα κατά την αντιγραφή: η προπορευόμενη αλυσίδα, που συντίθεται συνεχώς και αυξάνεται προς τη διχάλα αντιγραφής και η καθυστερημένη αλυσίδα, που δημιουργείται ασυνεχώς στα θραύσματα του Οκαζάκι και αυξάνεται μακριά από τη διχάλα αντιγραφής.[22] Τα θραύσματα Οκαζάκι είναι ομοιοπολικά ενωμένα με λιγάση DNA για να σχηματίσουν μια συνεχή αλυσίδα.[22] Στη συνέχεια, για να ολοκληρωθεί η αντιγραφή του DNA, αφαιρούνται οι εκκινητές RNA και τα παραγόμενα κενά αντικαθίστανται με DNA και ενώνονται μέσω λιγάσης DNA.[22]
Αμινοξέα
[Επεξεργασία | επεξεργασία κώδικα]Μια πρωτεΐνη είναι ένα πολυμερές που αποτελείται από αμινοξέα που συνδέονται με πεπτιδικούς δεσμούς. Υπάρχουν περισσότερα από 300 αμινοξέα που βρίσκονται στη φύση, από τα οποία μόνο είκοσι, γνωστά ως τυπικά αμινοξέα, είναι δομικές μονάδες για πρωτεΐνες.[24] Μόνο τα πράσινα φυτά και τα περισσότερα μικρόβια μπορούν να συνθέσουν αμινοξέα και τα 20 τυπικά αμινοξέα που απαιτούνται από όλα τα ζώντα είδη. Τα θηλαστικά μπορούν να συνθέσουν μόνο δέκα από τα είκοσι τυπικά αμινοξέα. Τα άλλα αμινοξέα, βαλίνη, μεθειονίνη, λευκίνη, ισολευκίνη, φαινυλαλανίνη, λυσίνη, θρεονίνη και τρυπτοφάνη για ενήλικες καθώς και ιστιδίνη και αργινίνη για μωρά λαμβάνονται από τη διατροφή.[25]
Βασική δομή αμινοξέων
[Επεξεργασία | επεξεργασία κώδικα]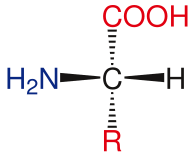
Η γενική δομή των τυπικών αμινοξέων περιλαμβάνει μια πρωτοταγή αμινομάδα, μια καρβοξυλομάδα και τη χαρακτηριστική ομάδα προσδεμένη στον άλφα άνθρακα. Τα διάφορα αμινοξέα ταυτοποιούνται από τη χαρακτηριστική ομάδα. Ως αποτέλεσμα των τριών διαφορετικών ομάδων που προσαρτώνται στον α-άνθρακα, τα αμινοξέα είναι ασύμμετρα μόρια. Για όλα τα τυπικά αμινοξέα, πλην της γλυκίνης, ο α-άνθρακας είναι ένα χειρόμορφο κέντρο. Στην περίπτωση της γλυκίνης, ο α-άνθρακας έχει δύο άτομα υδρογόνου, που προσθέτει συμμετρία σε αυτό το μόριο. Με την εξαίρεση της προλίνης, όλα τα αμινοξέα που βρίσκονται στη ζωή έχουν L-ισόμορφη διαμόρφωση. Η προλίνη έχει μια χαρακτηριστική ομάδα στον α-άνθρακα που σχηματίζει δακτύλιο με την αμινομάδα.[24]

Πηγή αζώτου
[Επεξεργασία | επεξεργασία κώδικα]Ένα βασικό βήμα στη βιοσύνθεση αμινοξέος περιλαμβάνει την ενσωμάτωση μιας αζωτομάδας στον α-άνθρακα. Στα κύτταρα, υπάρχουν δύο βασικές οδοί ενσωμάτωσης αζωτομάδων. Η μία οδός περιλαμβάνει το ένζυμο οξογλουταρική αμινομεταφοράση της γλουταμίνης (glutamine oxoglutarate aminotransferase)(GOGAT) που αφαιρεί την αμιδική αμινομάδα της γλουταμίνης και την μεταφέρει στο 2-οξογλουταρικό (2-oxoglutarate), παράγοντας δύο γλουταμινικά μόρια. Σε αυτήν την καταλυτική αντίδραση, η γλουταμίνη χρησιμεύει ως πηγή αζώτου. Μια εικόνα που απεικονίζει αυτήν την αντίδραση βρίσκεται στα δεξιά.
Η άλλη οδός ενσωμάτωσης του αζώτου στον α-άνθρακα των αμινοξέων περιλαμβάνει το ένζυμο αφυδρογονάση γλουταμινικού (glutamate dehydrogenase) (GDH). Η GDH μπορεί να μεταφέρει αμμωνία στο 2-οξογλουταρικό (2-oxoglutarate) και να σχηματίσει γλουταμινικό. Επιπλέον, το ένζυμο συνθετάση της γλουταμίνης (glutamine synthetase) (GS) μπορεί να μεταφέρει αμμωνία στο γλουταμινικό και να συνθέσει γλουταμίνη, παρέχοντας γλουταμίνη.[26]
Η γλουταμινική οικογένεια των αμινοξέων
[Επεξεργασία | επεξεργασία κώδικα]Η γλουταμινική (glutamate) οικογένεια των αμινοξέων περιλαμβάνει τα αμινοξέα που παράγονται από το γλουταμινικό αμινοξύ. Αυτή η οικογένεια περιλαμβάνει: το γλουταμινικό, την γλουταμίνη, την προλίνη και την αργινίνη. Αυτή η οικογένεια περιλαμβάνει επίσης το αμινοξύ λυσίνη, που παράγεται από το α-κετογλουταρικό (α-ketoglutarate).[27]
Η βιοσύνθεση του γλουταμινικού και της γλουταμίνης είναι ένα βασικό βήμα στην αφομοίωση του αζώτου που συζητήθηκε παραπάνω. Τα ένζυμα GOGAT και αφυδρογονάση γλουταμινικού (Glutamate dehydrogenase) καταλύουν τις αντιδράσεις αφομοίωσης αζώτου.
Στα βακτήρια, το ένζυμο γλουταμινική 5-κινάση (glutamate 5-kinase) αρχίζει τη βιοσύνθεση της προλίνης μεταφέροντας μια φωσφορική ομάδα από το ATP στο γλουταμινικό. Η επόμενη αντίδραση καταλύεται από το ένζυμο συνθάση 5-καρβοξυλικής πυρρολίνης (pyrroline-5-carboxylate synthase) (P5CS), που καταλύει την αναγωγή της ομάδας γ-καρβοξυλίου (ϒ-carboxyl) του 5-φωσφορικού L-γλουταμινικού (L-glutamate 5-phosphate). Αυτό καταλήγει στον σχηματισμό της γλουταμινικής ημιαλδεΰδης (glutamate semialdehyde), που αυθόρμητα κυκλοποιείται σε 5-καρβοξυλική πυρρολίνη (pyrroline-5-carboxylate), που ανάγεται παραπέρα από το ένζυμο αναγωγάση της 5-καρβοξυλικής πυρρολίνης (P5CR) για να παραγάγει ένα αμινοξύ προλίνης.[28]
Στο πρώτο στάδιο της βιοσύνθεσης της αργινίνης σε βακτήρια, το γλουταμινικό ακετυλιώνεται μεταφέροντας μια ακετυλομάδα από το ακετυλο-συνένζυμο Α στη θέση N-α· αυτό αποτρέπει την αυθόρμητη κυκλοποίηση. Το ένζυμο συνθάση του Ν-ακετυλογλουταμινικού (N-acetylglutamate synthase) (glutamate N-acetyltransferase) είναι υπεύθυνο για την κατάλυση του σταδίου της ακετυλίωσης. Τα επόμενα στάδια καταλύονται από τα ένζυμα Ν-ακετυλογλουταμινική κινάση (N-acetylglutamate kinase), αναγωγάση του Ν-ακετυλο-γάμμα-γλουταμυλοφωσφορικού (N-acetyl-gamma-glutamyl-phosphate reductase) και αμινομεταφοράση του ακετυλοορνιθο/ηλεκτρυλοδιάμινο πιμελικού (acetylornithine/succinyldiamino pimelate aminotransferase) και δίνουν την Ν-ακετυλο-L-ορνιθίνη (N-acetyl-L-ornithine). Η ακετυλομάδα της ακετυλοορνιθίνης αφαιρείται από το ένζυμο ακετυλοορνιθάση (acetylornithinase) (AO) ή την ακετυλομεταφοράση της ορνιθίνης (ornithine acetyltransferase) (OAT) και αυτό δίνει ορνιθίνη. Έπειτα, τα ένζυμα κιτρουλίνη (citrulline) και αργινοηλεκτρικό (argininosuccinate) μετατρέπουν την ορνιθίνη σε αργινίνη.[29]
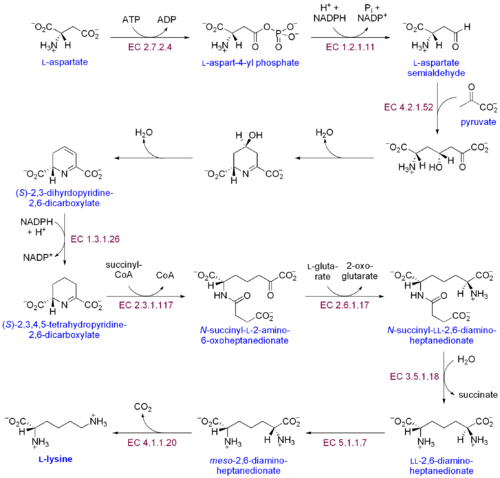
Υπάρχουν δύο διακριτές βιοσυνθετικές οδοί της λυσίνης: η οδός του διαμινοπιμελικού οξέος και η οδός του α-αμινοαδιπικού. Η πιο συνηθισμένη από τις δύο συνθετικές οδούς είναι η οδός του διαμινοπιμελικού οξέος· αποτελείται από πολλές ενζυματικές αντιδράσεις που προσθέτουν ανθρακικές ομάδες στο ασπαραγινικό για να δώσει λυσίνη:[30]
- Η ασπαραγινική κινάση (Aspartate kinase) εκκινεί την οδό του διαμινοπιμελικού οξέος με φωσφορυλίωση του ασπαραγινικού και δίνει φωσφορικό ασπαρτύλιο (aspartyl phosphate).
- Η αφυδρογονάση της ασπαραγανικής ημιαλδεΰδης (Aspartate semialdehyde dehydrogenase) καταλύει την αναγωγή φωσφορικού ασπαρτυλίου που εξαρτάται από το NADPH για να δώσει ασπαραγανική ημιαλδεΰδη.
- Η συνθάση του 4-υδροξυ-τετραϋδροπικολινικού (4-hydroxy-tetrahydrodipicolinate synthase) προσθέτει μια πυροσταφυλική (pyruvate) ομάδα στη β-ασπαρτυλο-4-ημιαλδεΰδη και αφαιρείται ένα μόριο νερού. Αυτό προκαλεί την κυκλοποίηση και οδηγεί σε (2S,4S)-4-υδροξυ-2,3,4,5-τετραϋδροδιπικολινικού.
- Η αναγωγάση του 4-υδροξυ-τετραϋδροδιπικολινικού (4-hydroxy-tetrahydrodipicolinate reductase) καταλύει την αναγωγή του (2S,4S)-4-υδροξυ-2,3,4,5-τετραϋδροδιπικολινικού από το NADPH για να δώσει 2,3,4,5-τετραϋδροδιπικολινικό (2,3,4,5-tetrahydrodipicolinate) και H2O.
- Η ακυλομεταφοράση του τετραϋδροδιπικολινικού (Tetrahydrodipicolinate acyltransferase) καταλύει την αντίδραση ακετυλίωσης που έχει ως αποτέλεσμα το άνοιγμα του δακτυλίου και την παραγωγή N-ακετυλο α-αμινο-ε-κετοπιμελικού.
- Η αμινομεταφοράση του Ν-ηλεκτρυλο-α-αμινο-ε-κετοπιμελικού-γλουταμινικού (N-succinyl-α-amino-ε-ketopimelate-glutamate aminotransaminase) καταλύει την αντίδραση της τρανσαμίνωσης που αφαιρεί την κετομάδα του N-ακετυλο α-αμινο-ε-κετοπιμελικού και την αντικαθιστά με αμινομάδα που παράγει N-ηλεκτρυλο-L-διαμινοπιμελικού.[31]
- Η απακυλάση του Ν-ακυλδιαμινοπιμελικού (N-acyldiaminopimelate deacylase) καταλύει την απακυλίωση του N-ηλεκτρυλο-L-διαμινοπιμελικού για να παραγάγει L,L-διαμινοπιμελικού.[32]
- Η επιμεράση DAP (DAP epimerase) καταλύει τη μετατροπή του L,L-διαμινοπιμελικού στη μεσομορφή του L,L-διαμινοπιμελικού.[33]
- Η αποκαρβοξυλάση του διαμινοπιμελικού (DAP decarboxylase) καταλύει την αφαίρεση της καρβοξυλομάδας, παράγοντας L-λυσίνη.
Η οικογένεια της σερίνης των αμινοξέων
[Επεξεργασία | επεξεργασία κώδικα]Η οικογένεια της σερίνης των αμινοξέων περιλαμβάνει: τη σερίνη, τη κυστεΐνη και τη γλυκίνη. Οι περισσότεροι μικροοργανισμοί και τα περισσότερα φυτά λαμβάνουν το θείο για τη σύνθεση της μεθειονίνης από το αμινοξύ της κυστεΐνης. Επιπλέον, η μετατροπή της σερίνης σε γλυκίνη παρέχει τους απαιτούμενους άνθρακες για τη βιοσύνθεση της μεθειονίνης και της ιστιδίνης.[27]
Κατά τη διάρκεια της βιοσύνθεσης της σερίνης,[34]το ένζυμο φωσφογλυκερική δεϋδρογονάση (phosphoglycerate dehydrogenase) καταλύει την αρχική αντίδραση που οξειδώνει το 3-φωσφο-D-γλυκερικό (3-phospho-D-glycerate) για να παραγάγει 3-φωσφονοοξυπυροσταφυλικό (3-phosphonooxypyruvate).[35] Η παρακάτω αντίδραση καταλύεται από το ένζυμο αμινομεταφοράση της φωσφοσερίνης (phosphoserine aminotransferase), που μεταφέρει μια αμινομάδα από γλουταμινικό σε 3-φωσφονοοξυπυροσταφυλικό για να παραχθεί L-φωσφοσερίνη.[36] Το τελικό βήμα καταλύεται από το ένζυμο φωσφατάση της φωσφοσερίνης (phosphoserine phosphatase), που αποφωσφορυλιώνει την L-φωσφοσερίνη για να παραχθεί L-σερίνη.[37]
Υπάρχουν δύο γνωστές διαδρομές για τη βιοσύνθεση της γλυκίνης. Οι οργανισμοί που χρησιμοποιούν αιθανόλη και οξικά ως την κύρια πηγή άνθρακα χρησιμοποιούν την οδό της γλυκογένεσης για να συνθέσουν γλυκίνη. Η άλλη οδός της βιοσύνθεσης της γλυκίνης είναι γνωστή ως η γλυκολυτική οδός. Αυτή η οδός μετατρέπει τη σερίνη που συντέθηκε από τα ενδιάμεσα τηςγλυκόλυσης σε γλυκίνη. Στην γλυκολυτική οδό, το ένζυμο υδροξυμεθυλμεταφοράση της σερίνης (serine hydroxymethyltransferase) καταλύει τη διάσπαση της σερίνης για να παραχθεί γλυκίνη και μεταφέρει την διασπασμένη ανθρακική ομάδα της σερίνης σε τετραϋδροφολικό, σχηματίζοντας 5,10-μεθυλενο-τετραϋδροφολικό (5,10-methylene-tetrahydrofolate).[38]
Η βιοσύνθεση της κυστεΐνης είναι μια αντίδραση δύο σταδίων που περιλαμβάνει την ενσωμάτωση του ανόργανου θείου. Σε μικροοργανισμούς και φυτά, το ένζυμο ακετυλομεταφοράση της σερίνης (serine acetyltransferase) καταλύει την μεταφορά της ακετυλομάδας από το ακετυλοσυνένζυμο-Α στην L-σερίνη για να παραχθεί Ο-ακετυλο-L-σερίνη (O-acetyl-L-serine).[39] Το παρακάτω στάδιο της αντίδρασης, που καταλύεται από το ένζυμο Ο-ακετυλο σερινη (θειολο) λυάση (O-acetyl serine (thiol) lyase), αντικαθιστά την ακετυλομάδα της O-ακετυλ-L-σερίνης με σουλφίδιο για να παραχθεί κυστεΐνη.[40]
Η ασπαραγινική οικογένεια των αμινοξέων
[Επεξεργασία | επεξεργασία κώδικα]Η ασπαραγινική οικογένεια των αμινοξέων περιλαμβάνει: τη θρεονίνη, τη λυσίνη, τη μεθειονίνη, την ισολευκίνη και την ασπαραγίνη. Η λυσίνη και η ισολευκίνη θεωρούνται τμήματα της ασπαραγινικής οικογένειας, παρόλο που τμήμα του ανθρακικού σκελετού τους παράγεται από πυροσταφυλικό οξύ. Στην περίπτωση της μεθειονίνης, ο μεθυλικός άνθρακας προέρχεται από σερίνη και τη θειομάδα, αλλά στους περισσότερους οργανισμούς, προέρχεται από κυστεΐνη.[27]
Η βιοσύνθεση του ασπαραγινικού είναι αντίδραση ενός σταδίου που καταλύεται από ένα μοναδικό ένζυμο. Το ένζυμο ασπαρτική αμινοτρανσφεράση καταλύει τη μεταφορά μιας αμινομάδας από ασπαραγινικό σε α-κετογλουταρικό (α-ketoglutarate) για να παραχθεί γλουταμινικό και οξαλοξικό οξύ.[41] Η ασπαραγίνη συντίθεται από την προσθήκη εξαρτώμενου ATP μιας αμινομάδας σε ασπαραγινικό· η ασπαραγινική συνθετάση καταλύει την προσθήκη αζώτου από γλουταμίνη ή διαλυτής αμμωνίας σε ασπαραγινικό για να παραχθεί ασπαραγίνη.[42]

Η βιοσυνθετική οδός του διαμινοπιμελικού οξέος της λυσίνης ανήκει στην ασπαραγινική οικογένεια των αμινοξέων. Αυτή η οδός περιλαμβάνει εννέα αντιδράσεις καταλυόμενες από ένζυμα που μετατρέπουν το ασπαραγινικό σε λυσίνη.[43]
- Η ασπαραγινική κινάση καταλύει το αρχικό στάδιο στην οδό του διαμινοπιμελικού οξέος μεταφέροντας φωσφορυλομάδα από το ATP στην καρβοξυλομάδα του ασπαραγινικού, που παράγει β-φωσφορικό ασπαρτύλιο.[44]
- Η δεϋδρογονάση της ασπαρτικής ημιαλδεΰδης (Aspartate-semialdehyde dehydrogenase) καταλύει την αντίδραση αναγωγής από την αποφωσφορυλίωση του β-φωσφορικού ασπαρτυλίου για να παραχθεί ασπαρτική β-ημιαλδεΰδη (aspartate-β-semialdehyde).[45]
- Η Η διϋδροδιπικολινική συνθάση (Dihydrodipicolinate synthase) καταλύει την αντίδραση της συμπύκνωσης της ασπαρτικής-β-ημιαλδεΰδης (aspartate-β-semialdehyde) με πυροσταφυλικό για να παραχθεί διϋδροδιπικολινικό οξύ.[46]
- Η 4-υδροξυ-τετραϋδροδιπικολινική αναγωγάση (4-hydroxy-tetrahydrodipicolinate reductase) καταλύει την αναγωγή του διϋδροδιπικολινικού οξέος για να παραγάγει τετραϋδροδιπικολινικό οξύ.[47]
- Η τετραϋδροδιπικολινική Ν-ηλεκτρυλομεταφοράση (Tetrahydrodipicolinate N-succinyltransferase) καταλύει τη μεταφορά ηλεκτρυλομάδας από ηλεκτρυλο-συνένζυμο Α στο τετραϋδροδιπικολινικό οξύ για την παραγωγή Ν-ηλεκτρυλο-L-2,6-διαμινοπεπτανοδιικό (N-succinyl-L-2,6-diaminoheptanedioate).[48]
- Η Ν-ηλεκτρυλοδιαμινοπιμελική αμινομεταφοράση (N-succinyldiaminopimelate aminotransferase) καταλύει τη μεταφορά αμινομάδας από γλουταμινικό σε Ν-ηλεκτρυλο-L-2,6-διαμινοπεπτανοδιικό (N-succinyl-L-2,6-diaminoheptanedioate) προς παραγωγή Ν-ηλεκτρυλο-L,L-διαμινοπιμελικό οξύ (N-succinyl-L,L-diaminopimelic acid).[49]
- Η Η ηλεκτρυλο-διαμινοπεμελική αποηλεκτρυλάση (Succinyl-diaminopimelate desuccinylase) καταλύει την αφαίρεση ακυλομάδας από Ν-ηλεκτρυλο-L,L-διαμινοπιμελικό οξύ (N-succinyl-L,L-diaminopimelic acid) για να παραχθεί L,L-διαμινοπιμελικό οξύ (L,L-diaminopimelic acid).[50]
- Η διαμινοπιμελική επιμεράση (Diaminopimelate epimerase) καταλύει την αναστροφή του α-άνθρακα του L,L-διαμινοπιμελικού οξέος (L,L-diaminopimelic acid) για την παραγωγή μεσο-διαμινοπιμελικού οξέος.[51]
- Η διαμινοπιμελική αποκαρβοξυλάση (Diaminopimelate decarboxylase) καταλύει το τελικό στάδιο στη βιοσύνθεση της λυσίνης που αφαιρεί την ομάδα του διοξειδίου του άνθρακα από μεσο-διαμινοπιμελικό οξύ για να παραχθεί L-λυσίνη.[52]
Πρωτεΐνες
[Επεξεργασία | επεξεργασία κώδικα]

Η πρωτεϊνική σύνθεση συμβαίνει μέσω μιας διαδικασίας που λέγεται μετάφραση.[53] Κατά τη διάρκεια της μετάφρασης, γενετικό υλικό που ονομάζεται mRNA διαβάζεται από ριβοσώματα για τη δημιουργία πρωτεϊνικής πολυπεπτιδικής αλυσίδας.[53] Αυτή η διεργασία απαιτεί tRNA που χρησιμεύει ως προσαρμοστής συνδέοντας αμινοξέα στο ένα άκρο και αλληλεπιδρώντας με mRNA στο άλλο άκρο· η δεύτερη σύζευξη μεταξύ του tRNA και του mRNA διασφαλίζει ότι προστίθεται το σωστό αμινοξύ στην αλυσίδα.[53] Η πρωτεϊνοσύνθεση λαμβάνει χώρα σε τρεις φάσεις: έναρξη, επιμήκυνση και τερματισμός.[13] Η προκαρυωτική μετάφραση (Prokaryotic translation) διαφέρει από την ευκαρυωτική μετάφραση (eukaryotic translation)· όμως, αυτή η ενότητα θα εστιάσει κυρίως στις ομοιότητες μεταξύ των δύο οργανισμών.
Πρόσθετο υπόβαθρο
[Επεξεργασία | επεξεργασία κώδικα]Πριν να μπορέσει να ξεκινήσει η μετάφραση, πρέπει να λάβει χώρα η διεργασία της σύνδεσης ειδικού αμινοξέος με το αντίστοιχό του tRNA. Αυτή η αντίδραση, που λέγεται φόρτιση tRNA, καταλύεται από την αμινοακυλο-tRNA συνθετάση (aminoacyl tRNA synthetase).[54] Ειδική συνθετάση tRNA είναι υπεύθυνη για την αναγνώριση και φόρτιση συγκεκριμένου αμινοξέος.[54] Επιπλέον, αυτό το ένζυμο έχει ειδικές περιοχές διευκρινιστή (discriminator) για να διασφαλίσει τη σωστή σύνδεση μεταξύ του tRNA και του συγγενικού αμινοξέος.[54] Το πρώτο βήμα σύνδεσης αμινοξέος με το αντίστοιχό του tRNA είναι ο σχηματισμός του αμινοακυλο-AMP:[54]
Αυτό ακολουθείται από τη μεταφορά της αμινοάκυλο ομάδας από το αμινοακυλο-AMP σε ένα μόριο tRNA. Το τελικό μόριο είναι αμινοακυλο-tRNA:[54]
Ο συνδυασμός αυτών των δύο βημάτων, που και τα δύο καταλύονται από την αμινοακυλο-tRNA συνθετάση, παράγει ένα φορτισμένο tRNA που είναι έτοιμο να προσθέσει αμινοξέα στην αυξανόμενη πολυπεπτιδική αλυσίδα.
Πέρα από τη σύνδεση με αμινοξύ, το tRNA έχει μια μονάδα τριών νουκλεοτιδίων που λέγεται αντικωδικόνιο που ζευγαρώνει τις βάσεις με συγκεκριμένες τριάδες στο mRNA που ονομάζονται κωδικόνια· τα κωδικόνια κωδικοποιούν ένα συγκεκριμένο αμινοξύ.[55] Αυτή η αλληλεπίδραση είναι δυνατή χάρις στο ριβόσωμα, που χρησιμεύει ως η θέση για την πρωτεϊνική σύνθεση. Το ριβόσωμα διαθέτει τρεις θέσεις πρόσδεσης του tRNA: την αμινοακυλική θέση (θέση A), την πεπτιδυλική θέση (θέση P) και τη θέση εξόδου (θέση E).[56]
Υπάρχουν πολυάριθμα κωδικόνια με μεταγράφημα mRNA και είναι πολύ συνηθισμένο ένα αμινοξύ να ορίζεται από περισσότερα από ένα κωδικόνια· το φαινόμενο ονομάζεται εκφυλισμός (degeneracy).[57] Συνολικά, υπάρχουν 64 κωδικόνια, 61 για κάθε κωδικό για καθένα από τα 20 αμινοξέα, ενώ τα υπόλοιπα κωδικόνια καθορίζουν τον τερματισμό της αλυσίδας.[57]
Η μετάφραση σε βήματα
[Επεξεργασία | επεξεργασία κώδικα]Όπως προαναφέρθηκε, η μετάφραση λαμβάνει χώρα σε τρεις φάσεις: έναρξη, επιμήκυνση και τερματισμός.

Βήμα 1: Έναρξη
[Επεξεργασία | επεξεργασία κώδικα]Η ολοκλήρωση της ενακτήριας φάσης εξαρτάται από τα παρακάτω τρία συμβάντα:[13]
1. Την ένταξη του ριβοσώματος στο mRNA
2. Τη πρόσδεση του φορτισμένου εκκινητή tRNA στη θέση P του ριβοσώματος
3. Την κατάλληλη στοίχιση του ριβοσώματος με το εναρκτήριο κωδικόνιο του mRNA
Στάδιο 2: Επιμήκυνση
[Επεξεργασία | επεξεργασία κώδικα]Μετά την έναρξη, η πολυπεπτιδική αλυσίδα επεκτείνεται μέσω αντικωδικονίου: οι αλληλεπιδράσεις του κωδικονίου με το ριβόσωμα προσθέτουν αμινοξέα στην πολυπεπτιδική αλυσίδα ένα τη φορά. Τα παρακάτω βήματα πρέπει να λάβουν χώρα για να εξασφαλίσουν τη σωστή προσθήκη των αμινοξέων:[58]
1. Η πρόσδεση του σωστού tRNA στη θέση A του ριβοσώματος
2. Ο σχηματισμός πεπτιδικού δεσμού μεταξύ του tRNA στη θέση A και της πολυπεπτιδικής αλυσίδας που ενώνεται με το tRNA στη θέση P
3. Η μετατόπιση ή η προώθηση του συμπλόκου tRNA-mRNA κατά τρία νουκλεοτίδια
Η μετατόπιση "κλωτσά" το tRNA στη θέση E και μετατοπίζει το tRNA από τη θέση A στη θέση P, αφήνοντας τη θέση A ελεύθερη για ένα εισερχόμενο tRNA να προσθέσει ένα άλλο αμινοξύ.
Βήμα 3: Τερματισμός
[Επεξεργασία | επεξεργασία κώδικα]Το τελευταίο στάδιο της μετάφρασης λαμβάνει χώρα όταν ένα κωδικόνιο τερματισμού (stop codon) μπαίνει στη θέση A.[1] Τότε, συμβαίνουν τα ακόλουθα βήματα:
1. Η αναγνώριση των κωδικονίων από παράγοντες απελευθέρωσης (release factors), που προκαλεί την υδρόλυση της πολυπεπτιδικής αλυσίδας από το tRNA που βρίσκεται στη θέση P[1]
2. Η απελευθέρωση της πολυπεπτιδικής αλυσίδας[57]
3. Η διάσπαση και "ανακύκλωση" του ριβοσώματος για μελλοντικές διεργασίες μετάφρασης[57]
Ένας συνοπτικός πίνακας των κύριων παικτών στη μετάφραση βρίσκεται παρακάτω:
| Βασικοί παράγοντες στη μετάφραση | Στάδιο μετάφρασης | Σκοπός |
|---|---|---|
| συνθετάση tRNA | πριν την έναρξη | Υπεύθυνη για τη φόρτωση του tRNA |
| mRNA | έναρξη, επιμήκυνση, τερματισμός | Πρότυπο για πρωτεϊνοσύνθεση· περιέχει περιοχές που ονομάζονται κωδικόνια και κωδικοποιούν αμινοξέα |
| tRNA | έναρξη, επιμήκυνση, τερματισμός | Προσδένει ριβοσώματα στις θέσεις A, P, E· η βάση του αντικωδικονίου ζευγαρώνει με το κωδικόνιο mRNA για να διασφαλίσει ότι το σωστό αμινοξύ ενσωματώνεται στην αυξανόμενη πολυπεπτιδική αλυσίδα |
| ριβόσωμα | έναρξη, επιμήκυνση, τερματισμός | Κατευθύνει την πρωτεϊνοσύνθεση και καταλύει τον σχηματισμό του πεπτιδικού δεσμού |
Νόσοι που συνδέονται με μακρομοριακές ανεπάρκειες
[Επεξεργασία | επεξεργασία κώδικα]
Σφάλματα στις βιοσυνθετικές οδούς μπορεί να έχουν επιβλαβείς συνέπειες συμπεριλαμβανομένης της παραμόρφωσης των μακρομορίων ή την ανεπαρκή παραγωγή λειτουργικών μορίων. Παρακάτω υπάρχουν παραδείγματα που δείχνουν τις διαταραχές που συμβαίνουν λόγω αυτών των ανεπαρκειών.
- Η οικογενής υπερχοληστεριναιμία (Familial hypercholesterolemia): αυτή η διαταραχή χαρακτηρίζεται από την έλλειψη των λειτουργικών υποδοχέων για την LDL.[59] Οι διαταραχές στον σχηματισμό των υποδοχέων του LDL μπορεί να προκαλέσουν εσφαλμένους υποδοχείς που διαταράσσουν την ενδοκυτταρική οδό, παρεμποδίζοντας την είσοδο του LDL στο ήπαρ και σε άλλα κελιά.[59] Αυτό προκαλεί τη συσσώρευση της LDL στο πλάσμα του αίματος, που καταλήγει σε αθηροσκληρωτικές πλάκες (atherosclerotic plaques) που στενεύουν τις αρτηρίες και αυξάνουν τον κίνδυνο εμφραγμάτων.[59]
- Το σύνδρομο Λες-Νίχαν (Lesch–Nyhan syndrome): αυτή η γενετική νόσος χαρακτηρίζεται από αυτοακρωτηριασμό (self- mutilation), πνευματική διαταραχή και ουρική νόσο (gout).[60] Προκαλείται από την απουσία της φωσφοριβοσυλομεταφοράσης της υποξανθίνης-γουανίνης (hypoxanthine-guanine phosphoribosyltransferase), που είναι απαραίτητο ένζυμο για τον σχηματισμό του νουκλεοτιδίου της πουρίνης.[60] Η έλλειψη του ενζύμου μειώνει το επίπεδο των απαραίτητων νουκλεοτιδίων και προκαλεί συσσώρευση της βιοσύνθεσης ενδιάμεσων προϊόντων, που καταλήγει στην προμνημονευθείσα ασυνήθιστη συμπεριφορά.[60]
- Η βαρεία συνδυασμένη ανοσοανεπάρκεια (Severe combined immunodeficiency (SCID)): Η SCID χαρακτηρίζεται από απώλεια κυττάρων Τ (T cells).[61] Η έλλειψη αυτών των συστατικών του ανοσοποιητικού συστήματος αυξάνει την ευπάθεια σε μολυσματικούς παράγοντες επειδή τα επηρεαζόμενα άτομα δεν μπορούν να αναπτύξουν ανοσολογική μνήμη.[61] Αυτή η ανοσολογική διαταραχή είναι αποτέλεσμα έλλειψης σε ενεργότητα της απαμινάσης της αδενοσίνης (adenosine deanimase), που προκαλεί τον σχηματισμό dATP. Αυτά τα μόρια του dATP παρεμποδίζουν τότε την αναγωγάση του ριβονουκλεοτιδίου, που αποτρέπει τη σύνθεση του DNA.[61]
- H νόσος του Χάντινγκτον: αυτή η νευρολογική νόσος προκαλείται από σφάλματα που συμβαίνουν κατά τη σύνθεση του DNA.[62] Αυτά τα σφάλματα ή μεταλλάξεις οδηγούν στην έκφραση μιας πρωτεΐνης μεταλλάγματος χαντιγκτίνης (huntingtin), που περιέχει επαναλαμβανόμενα υπολείμματα γλουταμίνης που κωδικοποιούνται επεκτείνοντας τις επαναλήψεις τρινουκλεοτιδίου CAG (CAG trinucleotide repeats) στο γονίδιο.[62] Η νόσος Huntington χαρακτηρίζεται από νευρώνια απώλεια και γλοίωση (gliosis). Τα συμπτώματα της νόσου περιλαμβάνουν: διαταραχές κίνησης, γνωστική απόκλιση και διαταραχή συμπεριφοράς.[63]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 1,3 Alberts, Bruce (2007). Molecular biology of the cell. New York: Garland Science. ISBN 978-0815341055.
- ↑ Zumdahl, Steven S. Zumdahl, Susan A. (2008). Chemistry (8th έκδοση). CA: Cengage Learning. ISBN 978-0547125329.
- ↑ Pratt, Donald Voet, Judith G. Voet, Charlotte W. (2013). Fundamentals of biochemistry : life at the molecular level (4th έκδοση). Hoboken, NJ: Wiley. ISBN 978-0470547847.
- ↑ 4,0 4,1 4,2 4,3 4,4 Lodish, Harvey· και άλλοι. (2007). Molecular cell biology
 (6th έκδοση). New York: W.H. Freeman. ISBN 978-0716743668.
(6th έκδοση). New York: W.H. Freeman. ISBN 978-0716743668.
- ↑ 5,0 5,1 5,2 5,3 5,4 Cox, David L. Nelson, Michael M. (2008). Lehninger principles of biochemistry
 (5th έκδοση). New York: W.H. Freeman. ISBN 9780716771081.
(5th έκδοση). New York: W.H. Freeman. ISBN 9780716771081.
- ↑ Hanin, Israel (2013). Phospholipids: Biochemical, Pharmaceutical, and Analytical Considerations. Springer. ISBN 1475713665.
- ↑ 7,0 7,1 7,2 7,3 7,4 Vance, Dennis E.· Vance, Jean E. (2008). Biochemistry of lipids, lipoproteins and membranes (5th έκδοση). Amsterdam: Elsevier. ISBN 978-0444532190.
- ↑ Katsaras, J.· και άλλοι. (2001). Lipid bilayers : structure and interactions ; with 6 tables. Berlin [u.a.]: Springer. ISBN 978-3540675556.
- ↑ 9,0 9,1 9,2 9,3 9,4 Stryer, Jeremy M. Berg; John L. Tymoczko; Lubert (2007). Biochemistry (6. ed., 3. print. έκδοση). New York: Freeman. ISBN 978-0716787242.
- ↑ Gault, CR; LM Obeid; YA Hannun (2010). «An Overview of sphingolipid metabolism: from synthesis to breakdown». Adv Exp Med Biol 688: 1–23. PMID 20919643. PMC 3069696. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3069696/pdf/nihms-283686.pdf.
- ↑ 11,0 11,1 Siegel, George J. (1999). Basic neurochemistry : molecular, cellular and medical aspects (6. έκδοση). Philadelphia, Pa. [u.a.]: Lippincott Williams & Wilkins. ISBN 978-0397518203.
- ↑ 12,0 12,1 12,2 Harris, J. Robin (2010). Cholesterol binding and cholesterol transport proteins : structure and function in health and disease. Dordrecht: Springer. ISBN 978-9048186211.
- ↑ 13,0 13,1 13,2 13,3 Watson, James D.· και άλλοι. (2007). Molecular biology of the gene (6th έκδοση). San Francisco, Calif.: Benjamin Cummings. ISBN 978-0805395921.
- ↑ Kappock, TJ; Ealick, SE; Stubbe, J (October 2000). «Modular evolution of the purine biosynthetic pathway.». Current Opinion in Chemical Biology 4 (5): 567–72. doi:. PMID 11006546.
- ↑ Sampei, G; Baba, S; Kanagawa, M; Yanai, H; Ishii, T; Kawai, H; Fukai, Y; Ebihara, A και άλλοι. (October 2010). «Crystal structures of glycinamide ribonucleotide synthetase, PurD, from thermophilic eubacteria.». Journal of Biochemistry 148 (4): 429–38. doi:. PMID 20716513.
- ↑ Hoskins, AA; Anand, R; Ealick, SE; Stubbe, J (Aug 17, 2004). «The formylglycinamide ribonucleotide amidotransferase complex from Bacillus subtilis: metabolite-mediated complex formation.». Biochemistry 43 (32): 10314–27. doi:. PMID 15301530.
- ↑ Mueller, EJ; Meyer, E; Rudolph, J; Davisson, VJ; Stubbe, J (Mar 1, 1994). «N5-carboxyaminoimidazole ribonucleotide: evidence for a new intermediate and two new enzymatic activities in the de novo purine biosynthetic pathway of Escherichia coli.». Biochemistry 33 (8): 2269–78. doi:. PMID 8117684.
- ↑ Firestine, SM; Poon, SW; Mueller, EJ; Stubbe, J; Davisson, VJ (Oct 4, 1994). «Reactions catalyzed by 5-aminoimidazole ribonucleotide carboxylases from Escherichia coli and Gallus gallus: a case for divergent catalytic mechanisms.». Biochemistry 33 (39): 11927–34. doi:. PMID 7918411.
- ↑ 19,0 19,1 Srere, PA (1987). «Complexes of sequential metabolic enzymes.». Annual Review of Biochemistry 56 (1): 89–124. doi:. PMID 2441660.
- ↑ Broach, edited by Jeffrey N. Strathern, Elizabeth W. Jones, James R. (1981). The Molecular biology of the yeast Saccharomyces. Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory. ISBN 0879691395.
- ↑ 21,0 21,1 21,2 O'Donovan, GA; Neuhard, J (September 1970). «Pyrimidine metabolism in microorganisms.». Bacteriological Reviews 34 (3): 278–343. PMID 4919542.
- ↑ 22,0 22,1 22,2 22,3 Geer, Gerald Karp ; responsible for the revision of chapter 15 Peter van der (2004). Cell and molecular biology : concepts and experiments (4th ed., Wiley International έκδοση). New York: J. Wiley & Sons. ISBN 978-0471656654.
- ↑ 23,0 23,1 23,2 23,3 Griffiths, Anthony J. F. (1999). Modern genetic analysis
 (2. print. έκδοση). New York: Freeman. ISBN 978-0716731184.
(2. print. έκδοση). New York: Freeman. ISBN 978-0716731184.
- ↑ 24,0 24,1 Wu, G (May 2009). «Amino acids: metabolism, functions, and nutrition.». Amino Acids 37 (1): 1–17. doi:. PMID 19301095.
- ↑ Mousdale, D. M.; Coggins, J. R. (1991). «Amino Acid Synthesis». Target Sites for Herbicide Action: 29–56. doi:. https://link.springer.com/chapter/10.1007/978-1-4899-2433-9_2. Ανακτήθηκε στις 26 November 2013.
- ↑ Miflin, B. J.; Lea, P. J. (1977). «Amino Acid Metabolism». Annual Review of Plant Physiology 28: 299–329. doi:. http://www.annualreviews.org/doi/pdf/10.1146/annurev.pp.28.060177.001503. Ανακτήθηκε στις 26 November 2013.
- ↑ 27,0 27,1 27,2 Umbarger, HE (1978). «Amino acid biosynthesis and its regulation.». Annual Review of Biochemistry 47 (1): 532–606. doi:. PMID 354503.
- ↑ Pérez-Arellano, I; Carmona-Alvarez, F; Martínez, AI; Rodríguez-Díaz, J; Cervera, J (March 2010). «Pyrroline-5-carboxylate synthase and proline biosynthesis: from osmotolerance to rare metabolic disease.». Protein Science 19 (3): 372–82. doi:. PMID 20091669.
- ↑ Xu, Y; Labedan, B; Glansdorff, N (March 2007). «Surprising arginine biosynthesis: a reappraisal of the enzymology and evolution of the pathway in microorganisms.». Microbiology and molecular biology reviews : MMBR 71 (1): 36–47. doi:. PMID 17347518.
- ↑ «MetaCyc: L-lysine biosynthesis I».
- ↑ PETERKOFSKY, B; GILVARG, C (May 1961). «N-Succinyl-L-diaminopimelic-glutamic transaminase.». The Journal of Biological Chemistry 236: 1432–8. PMID 13734750. https://archive.org/details/sim_journal-of-biological-chemistry_1961-05_236_5/page/1432.
- ↑ KINDLER, SH; GILVARG, C (December 1960). «N-Succinyl-L-2,6-diaminopimelic acid deacylase.». The Journal of Biological Chemistry 235: 3532–5. PMID 13756049. https://archive.org/details/sim_journal-of-biological-chemistry_1960-12_235_12/page/3532.
- ↑ Born, TL; Blanchard, JS (October 1999). «Structure/function studies on enzymes in the diaminopimelate pathway of bacterial cell wall biosynthesis.». Current Opinion in Chemical Biology 3 (5): 607–13. doi:. PMID 10508663.
- ↑ «Escherichia coli K-12 substr. MG1655». serine biosynthesis. SRI International. Ανακτήθηκε στις 12 Δεκεμβρίου 2013.
- ↑ Bell, JK; Grant, GA; Banaszak, LJ (Mar 30, 2004). «Multiconformational states in phosphoglycerate dehydrogenase.». Biochemistry 43 (12): 3450–8. doi:. PMID 15035616.
- ↑ Dubnovitsky, AP; Kapetaniou, EG; Papageorgiou, AC (January 2005). «Enzyme adaptation to alkaline pH: atomic resolution (1.08 A) structure of phosphoserine aminotransferase from Bacillus alcalophilus.». Protein Science 14 (1): 97–110. doi:. PMID 15608117.
- ↑ Wang, W; Kim, R; Jancarik, J; Yokota, H; Kim, SH (Jan 10, 2001). «Crystal structure of phosphoserine phosphatase from Methanococcus jannaschii, a hyperthermophile, at 1.8 A resolution.». Structure 9 (1): 65–71. doi:. PMID 11342136.
- ↑ Monschau, N; Stahmann, KP; Sahm, H; McNeil, JB; Bognar, AL (May 1, 1997). «Identification of Saccharomyces cerevisiae GLY1 as a threonine aldolase: a key enzyme in glycine biosynthesis.». FEMS microbiology letters 150 (1): 55–60. doi:. PMID 9163906.
- ↑ Pye, VE; Tingey, AP; Robson, RL; Moody, PC (Sep 24, 2004). «The structure and mechanism of serine acetyltransferase from Escherichia coli.». The Journal of Biological Chemistry 279 (39): 40729–36. doi:. PMID 15231846. https://archive.org/details/sim_journal-of-biological-chemistry_2004-09-24_279_39/page/40729.
- ↑ Huang, B; Vetting, MW; Roderick, SL (May 2005). «The active site of O-acetylserine sulfhydrylase is the anchor point for bienzyme complex formation with serine acetyltransferase.». Journal of Bacteriology 187 (9): 3201–5. doi:. PMID 15838047. PMC 1082839. https://archive.org/details/sim_journal-of-bacteriology_2005-05_187_9/page/3201.
- ↑ McPhalen, CA; Vincent, MG; Picot, D; Jansonius, JN; Lesk, AM; Chothia, C (Sep 5, 1992). «Domain closure in mitochondrial aspartate aminotransferase.». Journal of Molecular Biology 227 (1): 197–213. doi:. PMID 1522585.
- ↑ Larsen, TM; Boehlein, SK; Schuster, SM; Richards, NG; Thoden, JB; Holden, HM; Rayment, I (Dec 7, 1999). «Three-dimensional structure of Escherichia coli asparagine synthetase B: a short journey from substrate to product.». Biochemistry 38 (49): 16146–57. doi:. PMID 10587437.
- ↑ Velasco, AM; Leguina, JI; Lazcano, A (October 2002). «Molecular evolution of the lysine biosynthetic pathways.». Journal of Molecular Evolution 55 (4): 445–59. doi:. PMID 12355264. https://archive.org/details/sim_journal-of-molecular-evolution_2002-10_55_4/page/445.
- ↑ Kotaka, M; Ren, J; Lockyer, M; Hawkins, AR; Stammers, DK (Oct 20, 2006). «Structures of R- and T-state Escherichia coli aspartokinase III. Mechanisms of the allosteric transition and inhibition by lysine.». The Journal of Biological Chemistry 281 (42): 31544–52. doi:. PMID 16905770. https://archive.org/details/sim_journal-of-biological-chemistry_2006-10-20_281_42/page/31544.
- ↑ Hadfield, A; Kryger, G; Ouyang, J; Petsko, GA; Ringe, D; Viola, R (Jun 18, 1999). «Structure of aspartate-beta-semialdehyde dehydrogenase from Escherichia coli, a key enzyme in the aspartate family of amino acid biosynthesis.». Journal of Molecular Biology 289 (4): 991–1002. doi:. PMID 10369777.
- ↑ Mirwaldt, C; Korndörfer, I; Huber, R (Feb 10, 1995). «The crystal structure of dihydrodipicolinate synthase from Escherichia coli at 2.5 A resolution.». Journal of Molecular Biology 246 (1): 227–39. doi:. PMID 7853400.
- ↑ Cirilli, M; Zheng, R; Scapin, G; Blanchard, JS (Sep 16, 2003). «The three-dimensional structures of the Mycobacterium tuberculosis dihydrodipicolinate reductase-NADH-2,6-PDC and -NADPH-2,6-PDC complexes. Structural and mutagenic analysis of relaxed nucleotide specificity.». Biochemistry 42 (36): 10644–50. doi:. PMID 12962488.
- ↑ Beaman, TW; Binder, DA; Blanchard, JS; Roderick, SL (Jan 21, 1997). «Three-dimensional structure of tetrahydrodipicolinate N-succinyltransferase.». Biochemistry 36 (3): 489–94. doi:. PMID 9012664.
- ↑ Weyand, S; Kefala, G; Weiss, MS (Mar 30, 2007). «The three-dimensional structure of N-succinyldiaminopimelate aminotransferase from Mycobacterium tuberculosis.». Journal of Molecular Biology 367 (3): 825–38. doi:. PMID 17292400.
- ↑ Nocek, BP; Gillner, DM; Fan, Y; Holz, RC; Joachimiak, A (Apr 2, 2010). «Structural basis for catalysis by the mono- and dimetalated forms of the dapE-encoded N-succinyl-L,L-diaminopimelic acid desuccinylase.». Journal of Molecular Biology 397 (3): 617–26. doi:. PMID 20138056.
- ↑ Pillai, B; Cherney, M; Diaper, CM; Sutherland, A; Blanchard, JS; Vederas, JC; James, MN (Nov 23, 2007). «Dynamics of catalysis revealed from the crystal structures of mutants of diaminopimelate epimerase.». Biochemical and Biophysical Research Communications 363 (3): 547–53. doi:. PMID 17889830.
- ↑ Gokulan, K; Rupp, B; Pavelka MS, Jr; Jacobs WR, Jr; Sacchettini, JC (May 16, 2003). «Crystal structure of Mycobacterium tuberculosis diaminopimelate decarboxylase, an essential enzyme in bacterial lysine biosynthesis.». The Journal of Biological Chemistry 278 (20): 18588–96. doi:. PMID 12637582. https://archive.org/details/sim_journal-of-biological-chemistry_2003-05-16_278_20/page/18588.
- ↑ 53,0 53,1 53,2 Weaver, Robert F. (2005). Molecular biology
 (3rd έκδοση). Boston: McGraw-Hill Higher Education. ISBN 0-07-284611-9.
(3rd έκδοση). Boston: McGraw-Hill Higher Education. ISBN 0-07-284611-9.
- ↑ 54,0 54,1 54,2 54,3 54,4 Cooper, Geoffrey M. (2000). The cell : a molecular approach (2nd έκδοση). Washington (DC): ASM Press. ISBN 978-0878931064.
- ↑ Jackson, R.J. (February 2010). «The mechanism of eukaryotic translation initiation and principles of its regulation». Molecular Cell Biology 10: 113–127.
- ↑ Green, Rachel; Harry F. Noller (1997). «Ribosomes and Translation». Annu. Rev. Biochem. 66: 679–716. doi:. https://archive.org/details/sim_annual-review-of-biochemistry_1997_66/page/679.
- ↑ 57,0 57,1 57,2 57,3 Pestka (editors), Herbert Weissbach, Sidney (1977). Molecular Mechanisms of protein biosynthesis. New York: Academic Press. ISBN 0127442502.
- ↑ Frank, J; Haixiao Gao (September 2007). «The process of mRNA–tRNA translocation». PNAS 104 (50): 19671–19678. doi:. http://www.pnas.org/content/104/50/19671.long#sec-8. Ανακτήθηκε στις 26 November 2013.
- ↑ 59,0 59,1 59,2 Bandeali, Salman J.; Daye, Jad; Virani, Salim S. (30 November 2013). «Novel Therapies for Treating Familial Hypercholesterolemia». Current Atherosclerosis Reports 16 (1). doi:.
- ↑ 60,0 60,1 60,2 Kang, Tae Hyuk; Park, Yongjin; Bader, Joel S.; Friedmann, Theodore; Cooney, Austin John (9 October 2013). «The Housekeeping Gene Hypoxanthine Guanine Phosphoribosyltransferase (HPRT) Regulates Multiple Developmental and Metabolic Pathways of Murine Embryonic Stem Cell Neuronal Differentiation». PLoS ONE 8 (10): e74967. doi:. PMID 24130677.
- ↑ 61,0 61,1 61,2 Walport, Ken Murphy, Paul Travers, Mark (2011). Janeway's Immunobiology (8. έκδοση). Oxford: Taylor & Francis. ISBN 978-0815342434.
- ↑ 62,0 62,1 Hughes, edited by Donald C. Lo, Robert E. (2010). Neurobiology of Huntington's disease : applications to drug discovery (2nd έκδοση). Boca Raton: CRC Press/Taylor & Francis Group. ISBN 978-0849390005.
- ↑ Biglan, Kevin M.; Ross, Christopher A.; Langbehn, Douglas R.; Aylward, Elizabeth H.; Stout, Julie C.; Queller, Sarah; Carlozzi, Noelle E.; Duff, Kevin και άλλοι. (26 June 2009). «Motor abnormalities in premanifest persons with Huntington's disease: The PREDICT-HD study». Movement Disorders 24 (12): 1763–1772. doi:.
|

![{\displaystyle {\ce {\mathrm {A} \nu \tau \iota \delta \rho {\acute {\mathrm {o} }}\nu ->[]['\mathrm {E} \nu \zeta \upsilon \mu \mathrm {o} ]\Pi \rho \mathrm {o} {\ddot {\iota }}{\acute {\mathrm {o} }}\nu }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9218115d26d2fce65ea0f78539e74eaa957c1bb8)

![{\displaystyle {\ce {{\Pi \rho {\acute {\mathrm {o} }}\delta \rho \mathrm {o} \mu \mathrm {o} ~\mu {\acute {\mathrm {o} }}\rho \iota \mathrm {o} }+\Sigma \upsilon \mu \pi \alpha \rho {\acute {\alpha }}\gamma \mathrm {o} \nu \tau \alpha \varsigma ->[]['\mathrm {E} \nu \zeta \upsilon \mu \mathrm {o} ]\mu \alpha \kappa \rho \mathrm {o} \mu {\acute {\mathrm {o} }}\rho \iota \mathrm {o} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0576f1e3885819cbb0b6b9a71bbc431cdebbd093)


