Κυτταρική διαφοροποίηση


Κυτταρική διαφοροποίηση είναι η διαδικασία κατά την οποία ένα βλαστοκύτταρο αλλάζει από έναν τύπο σε διαφοροποιημένο.[2][3] Συνήθως, το κύτταρο αλλάζει σε πιο εξειδικευμένο τύπο. Η διαφοροποίηση συμβαίνει πολλές φορές κατά την ανάπτυξη ενός πολυκύτταρου οργανισμού καθώς αλλάζει από απλό ζυγωτό σε πολύπλοκο σύστημα ιστών και κυτταρικών τύπων. Η διαφοροποίηση συνεχίζεται στην ενήλικη ζωή καθώς τα ενήλικα βλαστοκύτταρα διαιρούνται και δημιουργούν πλήρως διαφοροποιημένα θυγατρικά κύτταρα κατά την επιδιόρθωση των ιστών και κατά τη διάρκεια της φυσιολογικής κυτταρικής ανανέωσης. Κάποια διαφοροποίηση εμφανίζεται ως απόκριση στην έκθεση σε αντιγόνο. Η διαφοροποίηση αλλάζει δραματικά το μέγεθος, το σχήμα, το δυναμικό μεμβράνης, τον μεταβολική δραστηριότητα και την ανταπόκριση ενός κυττάρου στα σήματα. Αυτές οι αλλαγές οφείλονται σε μεγάλο βαθμό σε εξαιρετικά ελεγχόμενες τροποποιήσεις στην γονιδιακή έκφραση και αποτελούν τη μελέτη της επιγενετικής. Με λίγες εξαιρέσεις, η κυτταρική διαφοροποίηση σχεδόν ποτέ δεν περιλαμβάνει αλλαγή στην ίδια την αλληλουχία DNA. Ωστόσο, η μεταβολική σύνθεση αλλάζει αρκετά δραματικά,[4] όπου τα βλαστοκύτταρα χαρακτηρίζονται από άφθονους μεταβολίτες με εξαιρετικά ακόρεστες δομές των οποίων τα επίπεδα μειώνονται κατά τη διαφοροποίηση. Έτσι, διαφορετικά κύτταρα μπορεί να έχουν πολύ διαφορετικά φυσικά χαρακτηριστικά παρόλο που έχουν το ίδιο γονιδίωμα.
Ένας εξειδικευμένος τύπος διαφοροποίησης, γνωστός ως τελική διαφοροποίηση, είναι σημαντικός σε ορισμένους ιστούς, συμπεριλαμβανομένου του νευρικού συστήματος των σπονδυλωτών, των γραμμωτών μυών, της επιδερμίδας και του εντέρου. Κατά τη διάρκεια της τελικής διαφοροποίησης, ένα πρόδρομο κύτταρο που προηγουμένως ήταν ικανό για κυτταρική διαίρεση εγκαταλείπει οριστικά τον κυτταρικό κύκλο, αποδιοργανώνει τον μηχανισμό του κυτταρικού κύκλου και συχνά εκφράζει μια σειρά γονιδίων χαρακτηριστικών της τελικής λειτουργίας του κυττάρου (π.χ. μυοσίνη και ακτίνη για ένα μυϊκό κύτταρο). Η διαφοροποίηση μπορεί να συνεχίσει να συμβαίνει μετά την τελική διαφοροποίηση, εάν η χωρητικότητα και οι λειτουργίες της κυψέλης υποστούν περαιτέρω αλλαγές.
Μεταξύ των διαιρούμενων κυττάρων, υπάρχουν πολλαπλά επίπεδα κυτταρικής ισχύος (cell potency), που είναι η ικανότητα του κυττάρου να διαφοροποιείται σε άλλους τύπους κυττάρων. Μια μεγαλύτερη ισχύς υποδηλώνει μεγαλύτερο αριθμό τύπων κυττάρων που μπορούν να προκύψουν. Ένα κύτταρο που μπορεί να διαφοροποιηθεί σε όλους τους τύπους κυττάρων, συμπεριλαμβανομένου του ιστού του πλακούντα, είναι γνωστό ως ολοδύναμο (totipotent). Στα θηλαστικά, μόνο ο ζυγώτης και τα επόμενα βλαστομερή είναι παντοδύναμα, ενώ στα φυτά, πολλά διαφοροποιημένα κύτταρα μπορούν να γίνουν παντοδύναμα με απλές εργαστηριακές τεχνικές. Ένα κύτταρο που μπορεί να διαφοροποιηθεί σε όλους τους τύπους κυττάρων του ενήλικου οργανισμού είναι γνωστό ως πολυδύναμο (pluripotent). Τέτοια κύτταρα ονομάζονται μεριστωματικά κύτταρα στα ανώτερα φυτά και εμβρυϊκά βλαστοκύτταρα στα ζώα, αν και ορισμένες ομάδες αναφέρουν την παρουσία ενηλίκων πολυδύναμων κυττάρων. Η ιογενώς επαγόμενη έκφραση τεσσάρων μεταγραφικών παραγόντων Oct4, Sox2, c-Myc και Klf4 (παράγοντες Yamanaka) είναι επαρκής για τη δημιουργία πολυδύναμων (iPS) κυττάρων από ενήλικα ινοβλάστεςς.[5] Ένα πλειοδύναμο (multipotent) κύτταρο είναι ένα κύτταρο που μπορεί να διαφοροποιηθεί σε πολλούς διαφορετικούς, αλλά στενά συνδεδεμένους τύπους κυττάρων.[6] Τα ολιγοδύναμα (Oligopotent) κύτταρα είναι πιο περιορισμένα από τα πλειοδύναμα (multipotent), αλλά μπορούν ακόμα να διαφοροποιηθούν σε μερικούς στενά συνδεδεμένους τύπους κυττάρων.[6] Τέλος, τα μονοδύναμα (unipotent) κύτταρα μπορούν να διαφοροποιηθούν σε έναν μόνο τύπο κυττάρου, αλλά είναι ικανά να αυτοανανεωθούν.[6] Στην κυτταροπαθολογία, το επίπεδο κυτταρικής διαφοροποίησης χρησιμοποιείται ως μέτρο της εξέλιξης του καρκίνου. Η αξιολόγηση ενός καρκίνου είναι ένας δείκτης του πόσο διαφοροποιημένο είναι ένα κύτταρο σε έναν όγκο.[7]
Τύποι κυττάρων θηλαστικών[Επεξεργασία | επεξεργασία κώδικα]
Τρεις βασικές κατηγορίες κυττάρων αποτελούν το σώμα των θηλαστικών: γεννητικά κύτταρα, σωματικά κύτταρα και βλαστοκύτταρα. Καθένα από τα περίπου 37,2 τρισεκατομμύρια (3,72x1013) κύτταρα σε έναν ενήλικα άνθρωπο έχει το δικό του αντίγραφο ή αντίγραφα του γονιδιώματος εκτός από ορισμένους τύπους κυττάρων, όπως τα ερυθροκύτταρα, που στερούνται πυρήνων στην πλήρως διαφοροποιημένη κατάστασή τους. Τα περισσότερα κύτταρα είναι διπλοειδή, δηλαδή έχουν δύο αντίγραφα από κάθε χρωμόσωμα. Τέτοια κύτταρα, που ονομάζονται σωματικά κύτταρα, αποτελούν το μεγαλύτερο μέρος του ανθρώπινου σώματος, όπως τα κύτταρα του δέρματος και των μυών. Τα κύτταρα διαφοροποιούνται για να εξειδικεύονται για διαφορετικές λειτουργίες.[8]
Τα κύτταρα γεννητικής γραμμής είναι οποιαδήποτε γραμμή κυττάρων που δημιουργούν γαμέτες—ωάρια και σπέρμα—και, επομένως, είναι συνεχείς για τις γενεές. Τα βλαστοκύτταρα, από την άλλη, έχουν την ικανότητα να διαιρούνται για αόριστες περιόδους και να δημιουργούν εξειδικευμένα κύτταρα. Περιγράφονται καλύτερα στο πλαίσιο της φυσιολογικής ανθρώπινης ανάπτυξης. Η ανάπτυξη ξεκινά όταν ένα σπερματοζωάριο γονιμοποιεί ένα ωάριο και δημιουργεί ένα μόνο κύτταρο που έχει τη δυνατότητα να σχηματίσει έναν ολόκληρο οργανισμό. Τις πρώτες ώρες μετά τη γονιμοποίηση, αυτό το κύτταρο διαιρείται σε πανομοιότυπα κύτταρα. Στους ανθρώπους, περίπου τέσσερις ημέρες μετά τη γονιμοποίηση και μετά από αρκετούς κύκλους κυτταρικής διαίρεσης, αυτά τα κύτταρα αρχίζουν να εξειδικεύονται, σχηματίζοντας μια κοίλη σφαίρα κυττάρων, που ονομάζεται βλαστοκύστη.[9] Η βλαστοκύστη έχει ένα εξωτερικό στρώμα κυττάρων, και μέσα σε αυτήν την κοίλη σφαίρα, υπάρχει ένα σύμπλεγμα κυττάρων που ονομάζεται εσωτερική κυτταρική μάζα. Τα κύτταρα της εσωτερικής κυτταρικής μάζας συνεχίζουν να σχηματίζουν σχεδόν όλους τους ιστούς του ανθρώπινου σώματος. Αν και τα κύτταρα της εσωτερικής κυτταρικής μάζας μπορούν να σχηματίσουν ουσιαστικά κάθε τύπο κυττάρου που βρίσκεται στο ανθρώπινο σώμα, δεν μπορούν να σχηματίσουν έναν οργανισμό. Αυτά τα κύτταρα αναφέρονται ως πολυδύναμα.[10]
Τα πολυδύναμα (Pluripotent) βλαστοκύτταρα υφίστανται περαιτέρω εξειδίκευση σε πλειοδύναμα (multipotent) προγονικά κύτταρα που στη συνέχεια δημιουργούν λειτουργικά κύτταρα. Παραδείγματα βλαστικών και προγονικών κυττάρων περιλαμβάνουν:
- Τα Ακτινογλοιακά κύτταρα (εμβρυϊκά νευρικά βλαστοκύτταρα) που δημιουργούν διεγερτικούς νευρώνες στον εμβρυϊκό εγκέφαλο μέσω της διαδικασίας της νευρογένεσης.[11][12][13]
- Αιμοποιητικά βλαστοκύτταρα (βλαστικά κύτταρα ενηλίκων) από τον μυελό των οστών που δημιουργούν ερυθροκύτταρα, λευκά αιμοσφαίρια και αιμοπετάλια.
- Μεσεγχυματικά βλαστοκύτταρα (βλαστικά κύτταρα ενηλίκων) από τον μυελό των οστών που δημιουργούν στρωματικά κύτταρα, λιποκύτταρα και τύπους οστικών κυττάρων.
- επιθηλιακά βλαστικά κύτταρα (προγονικά κύτταρα) που δημιουργούν τους διάφορους τύπους κυττάρων του δέρματος
- Μυϊκά δορυφορικά κύτταρα (προγονικά κύτταρα) που συμβάλλουν στον διαφοροποιημένο μυϊκός ιστός.
Μια οδός που καθοδηγείται από τα μόρια κυτταρικής προσκόλλησης που αποτελείται από τέσσερα αμινοξέα, αργινίνη, γλυκίνη, ασπαραγίνη και σερίνη, δημιουργείται καθώς το κυτταρικό βλαστομερές διαφοροποιείται από το μονοστρωματικό βλαστίδιο (blastula) στις τρεις κύριες στιβάδες γεννητικών κυττάρων στα θηλαστικά, δηλαδή το εξώδερμα, το μεσόδερμα και το ενδόδερμα (παρατίθεται από το πιο εξωτερικό προς το πιο εσωτερικό). Το εξώδερμα καταλήγει να σχηματίζει το δέρμα και το νευρικό σύστημα, το μεσόδερμα σχηματίζει τα οστά και τον μυϊκό ιστό και το ενδόδερμα σχηματίζει τους ιστούς των εσωτερικών οργάνων.
Αποδιαφοροποίηση[Επεξεργασία | επεξεργασία κώδικα]

Αποδιαφοροποίηση, ή ενσωμάτωση, είναι μια κυτταρική διαδικασία που παρατηρείται συχνά στις περισσότερες βασικές μορφές ζωής όπως στα σκουλήκια και αμφίβια, στις οποίες ένα μερικώς ή ολικώς διαφοροποιημένο κύτταρο επιστρέφει σε προγενέστερο αναπτυξιακό στάδιο, συνήθως ως μέρος μιας διαδικασίας αναγεννητική διαδικασία.[14][15] Η αποδιαφοροποίηση συμβαίνει επίσης στα φυτά.[16] Τα κύτταρα σε κυτταροκαλλιέργεια μπορεί να χάσουν τις ιδιότητες που είχαν αρχικά, όπως την έκφραση πρωτεΐνης ή να αλλάξουν σχήμα. Αυτή η διαδικασία ονομάζεται επίσης αποδιαφοροποίηση.[17]
Ορισμένοι πιστεύουν ότι η αποδιαφοροποίηση είναι μια εκτροπή του φυσιολογικού κύκλου ανάπτυξης που έχει ως αποτέλεσμα καρκίνο,[18] ενώ άλλοι πιστεύουν ότι είναι ένα φυσικό μέρος της ανοσολογικής απόκρισης που χάνεται από τους ανθρώπους κάποια στιγμή ως αποτέλεσμα της εξέλιξης.
Ένα μικρό μόριο με το όνομα reversine, ένα ανάλογο πουρίνης, έχει ανακαλυφθεί που έχει αποδειχθεί ότι προκαλεί αποδιαφοροποίηση σε μυοσωλήνες (myotubes). Αυτά τα αποδιαφοροποιημένα κύτταρα θα μπορούσαν στη συνέχεια να επαναδιαφοροποιηθούν σε οστεοβλάστες και λιποκύτταρα.[19]

Μηχανισμοί[Επεξεργασία | επεξεργασία κώδικα]

Κάθε εξειδικευμένος τύπος κυττάρων σε έναν οργανισμό εκφράζει ένα υποσύνολο όλων των γονιδίων που αποτελούν το γονιδίωμα αυτού του είδους. Κάθε τύπος κυττάρου ορίζεται από το ιδιαίτερο μοτίβο της ρυθμισμένης γονιδιακής έκφρασης. Η διαφοροποίηση των κυττάρων είναι επομένως μια μετάβαση ενός κυττάρου από έναν τύπο κυττάρου στον άλλο και περιλαμβάνει μια μετάβαση από ένα πρότυπο γονιδιακής έκφρασης σε ένα άλλο. Η κυτταρική διαφοροποίηση κατά την ανάπτυξη μπορεί να γίνει κατανοητή ως το αποτέλεσμα ενός γονιδιακού ρυθμιστικού δικτύου. Ένα ρυθμιστικό γονίδιο και οι ρυθμιστικές ενότητες cis του είναι κόμβοι σε ένα γονιδιακό ρυθμιστικό δίκτυο. Λαμβάνουν είσοδο και δημιουργούν έξοδο σε άλλα σημεία του δικτύου.[20] Η προσέγγιση της βιολογίας συστημάτων στην αναπτυξιακή βιολογία τονίζει τη σημασία της διερεύνησης του τρόπου με τον οποίο οι αναπτυξιακοί μηχανισμοί αλληλεπιδρούν για την παραγωγή προβλέψιμων προτύπων (μορφογένεση). Ωστόσο, πρόσφατα προτάθηκε μια εναλλακτική άποψη. Με βάση την στοχαστική έκφραση του γονιδίου, η κυτταρική διαφοροποίηση είναι το αποτέλεσμα μιας δαρβινικής επιλεκτικής διαδικασίας που συμβαίνει μεταξύ των κυττάρων. Σε αυτό το πλαίσιο, τα δίκτυα πρωτεϊνών και γονιδίων είναι το αποτέλεσμα κυτταρικών διεργασιών και όχι η αιτία τους.
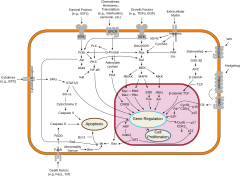
Ενώ οι εξελικτικά συντηρημένες μοριακές διεργασίες εμπλέκονται στους κυτταρικούς μηχανισμούς που βρίσκονται κάτω από αυτούς τους διακόπτες, στα ζωικά είδη είναι πολύ διαφορετικοί από τους καλά χαρακτηρισμένους ρυθμιστικούς μηχανισμούς γονιδίων των βακτηρίων, ακόμη και από εκείνους των πλησιέστερων μονοκυττάρων συγγενών των ζώων.[21] Συγκεκριμένα, η διαφοροποίηση των κυττάρων στα ζώα εξαρτάται σε μεγάλο βαθμό από τα βιομοριακά συμπυκνώματα των ρυθμιστικών πρωτεϊνών και τις ενισχυτικές αλληλουχίες DNA.
Η κυτταρική διαφοροποίηση συχνά ελέγχεται από κυτταρική σηματοδότηση. Πολλά από τα μόρια σήματος που μεταφέρουν πληροφορίες από κύτταρο σε κύτταρο κατά τον έλεγχο της κυτταρικής διαφοροποίησης ονομάζονται αυξητικοί παράγοντες. Αν και οι λεπτομέρειες των συγκεκριμένων οδών μετάδοση σήματος ποικίλλουν, αυτές οι οδοί συχνά μοιράζονται τα ακόλουθα γενικά βήματα. Ένας συνδέτης που παράγεται από ένα κύτταρο συνδέεται με έναν υποδοχέα στην εξωκυτταρική περιοχή ενός άλλου κυττάρου, προκαλώντας μια διαμορφωτική αλλαγή στον υποδοχέα. Το σχήμα της κυτταροπλασματικής περιοχής του υποδοχέα αλλάζει και ο υποδοχέας αποκτά ενζυματική δραστηριότητα. Ο υποδοχέας στη συνέχεια καταλύει αντιδράσεις που φωσφορυλιώνουν άλλες πρωτεΐνες, ενεργοποιώντας τις. Ένας καταρράκτης αντιδράσεων φωσφορυλίωσης ενεργοποιεί τελικά έναν αδρανή μεταγραφικό παράγοντα ή κυτταροσκελετική πρωτεΐνη, συμβάλλοντας έτσι στη διαδικασία διαφοροποίησης στο κύτταρο στόχο.[22] Τα κύτταρα και οι ιστοί μπορεί να διαφέρουν ως προς την ευχέρεια, την ικανότητά τους να ανταποκρίνονται σε εξωτερικά σήματα.[23]
Η επαγωγή σήματος αναφέρεται σε καταρράκτες σηματοδότησης συμβάντων, κατά τη διάρκεια των οποίων ένα κύτταρο ή ιστός σηματοδοτεί σε άλλο κύτταρο ή ιστό για να επηρεάσει την αναπτυξιακή του μοίρα.[23] Οι Γιαμαμότο και Τζέφρι [24] ερεύνησαν τον ρόλο του φακού στο σχηματισμό των ματιών σε ψάρια που κατοικούν σε σπήλαια και στην επιφάνεια, ένα εντυπωσιακό παράδειγμα επαγωγής.[23] Μέσω αμοιβαίων μεταμοσχεύσεων, οι Γιαμαμότο και Τζέφρι [24] διαπίστωσαν ότι το κυστίδιο φακού των ψαριών επιφάνειας μπορεί να προκαλέσει άλλα μέρη του ματιού να αναπτυχθούν σε ψάρια που κατοικούν σε σπήλαια και στην επιφάνεια, ενώ το κυστίδιο του φακού των ψαριών που ζουν σε σπήλαια δεν μπορεί.[23]
Άλλοι σημαντικοί μηχανισμοί εμπίπτουν στην κατηγορία των ασύμμετρων κυτταρικών διαιρέσεων, διαιρέσεις που δημιουργούν θυγατρικά κύτταρα με διακριτή αναπτυξιακή συμπεριφορά. Ασύμμετρες κυτταρικές διαιρέσεις μπορεί να προκύψουν λόγω ασύμμετρων μητρικών κυτταροπλασματικών καθοριστών ή λόγω σηματοδότησης.[23] Στον πρώτο μηχανισμό, δημιουργούνται διακριτά θυγατρικά κύτταρα κατά τη διάρκεια της κυτταροκίνησης λόγω μιας ανομοιόμορφης κατανομής των ρυθμιστικών μορίων στο γονικό κύτταρο. Το ξεχωριστό κυτταρόπλασμα που κληρονομεί κάθε θυγατρικό κύτταρο έχει ως αποτέλεσμα ένα ξεχωριστό πρότυπο διαφοροποίησης για κάθε θυγατρικό κύτταρο. Ένα καλά μελετημένο παράδειγμα σχηματισμού μοτίβων με ασύμμετρες διαιρέσεις είναι ο σχεδιασμός άξονα σώματος στη Drosophila. Τα μόρια RNA είναι ένας σημαντικός τύπος σήματος ελέγχου ενδοκυτταρικής διαφοροποίησης. Η μοριακή και γενετική βάση των ασύμμετρων κυτταρικών διαιρέσεων έχει επίσης μελετηθεί σε πράσινα φύκια του γένους Volvox, ένα μοντέλο συστήματος για τη μελέτη του τρόπου με τον οποίο οι μονοκύτταροι οργανισμοί μπορούν να εξελιχθούν σε πολυκύτταρους οργανισμούς.[23] Στο "Volvox carteri", τα 16 κύτταρα στο πρόσθιο ημισφαίριο ενός εμβρύου 32 κυττάρων διαιρούνται ασύμμετρα, παράγοντας το καθένα ένα μεγάλο και ένα μικρό θυγατρικό κύτταρο. Το μέγεθος του κυττάρου στο τέλος όλων των κυτταρικών διαιρέσεων καθορίζει αν θα γίνει εξειδικευμένο γενετικό ή σωματικό κύτταρο.[23][25]
Επιγενετικός έλεγχος[Επεξεργασία | επεξεργασία κώδικα]
Εφόσον κάθε κύτταρο, ανεξαρτήτως τύπου κυττάρου, διαθέτει το ίδιο γονιδίωμα, ο προσδιορισμός του κυτταρικού τύπου πρέπει να πραγματοποιείται στο επίπεδο της έκφρασης του γονιδίου. Ενώ η ρύθμιση της γονιδιακής έκφρασης μπορεί να συμβεί μέσω cis- και trans- ρυθμιστικών στοιχείων συμπεριλαμβανομένου του προαγωγέα ενός γονιδίου και ενισχυτών, προκύπτει το πρόβλημα ως προς τον τρόπο με τον οποίο αυτό το πρότυπο έκφρασης διατηρείται σε πολλές γενιές κυτταρικής διαίρεσης.[26] Όπως αποδεικνύεται, οι επιγενετικές διεργασίες διαδραματίζουν κρίσιμο ρόλο στη ρύθμιση της απόφασης για υιοθέτηση βλαστοκυττάρων, προγονικών ή ώριμων κυτταρικών μοιρών. Αυτή η ενότητα θα επικεντρωθεί κυρίως στα βλαστοκύτταρα των θηλαστικών.
Στη βιολογία συστημάτων και στη μαθηματική μοντελοποίηση των ρυθμιστικών δικτύων γονιδίων, ο προσδιορισμός της μοίρας των κυττάρων προβλέπεται να παρουσιάζει ορισμένες δυναμικές, όπως η σύγκλιση ελκυστή (ο ελκυστής μπορεί να είναι σημείο ισορροπίας, οριακός κύκλος ή παράξενος ελκυστής), ή ταλαντωτικός.[27]
Σημασία του επιγενετικού ελέγχου[Επεξεργασία | επεξεργασία κώδικα]
Το πρώτο ερώτημα που μπορεί να τεθεί είναι η έκταση και η πολυπλοκότητα του ρόλου των επιγενετικών διεργασιών στον προσδιορισμό της μοίρας των κυττάρων. Μια σαφής απάντηση σε αυτό το ερώτημα μπορεί να φανεί στην εργασία του 2011 από τον Lister R, και λοιπούς,[28] σχετικά με τον ανώμαλο επιγονιδιωματικό προγραμματισμό σε ανθρώπινα επαγόμενα πλειοδύναμα βλαστοκύτταρα. Καθώς τα επαγόμενα πλειοδύναμα βλαστοκύτταρα (induced pluripotent stem cells, iPSCs) πιστεύεται ότι μιμούνται εμβρυϊκά βλαστοκύτταρα στις πλειοδύναμες ιδιότητές τους, λίγες επιγενετικές διαφορές θα πρέπει να υπάρχουν μεταξύ τους. Για να δοκιμάσουν αυτήν την πρόβλεψη, οι συγγραφείς διεξήγαγαν κατατομές (προφίλ) ολόκληρου του γονιδιώματος των προτύπων μεθυλίωσης του DNA σε αρκετές σειρές ανθρώπινων εμβρυϊκών βλαστοκυττάρων (embryonic stem cell, ESC), iPSC και προγονικών γραμμών κυττάρων.
Τα θηλυκά λιπώδη κύτταρα, ινοβλάστες πνευμόνων και οι ινοβλάστες της ακροποσθίας επαναπρογραμματίστηκαν σε επαγόμενη πλειοδύναμη κατάσταση με τα γονίδια OCT4, SOX2, KLF4 και MYC. Συγκρίθηκαν πρότυπα μεθυλίωσης DNA σε ESC, iPSC, σωματικά κύτταρα. Οι Lister R, και λοιποί παρατήρησαν σημαντική ομοιότητα στα επίπεδα μεθυλίωσης μεταξύ των εμβρυϊκών και των επαγόμενων πλειοδύναμων κυττάρων. Περίπου το 80% των δινουκλεοτιδίων CG σε ESC και iPSC ήταν μεθυλιωμένα, το ίδιο ισχύει μόνο για το 60% των δινουκλεοτιδίων CG σε σωματικά κύτταρα. Επιπλέον, τα σωματικά κύτταρα διέθεταν ελάχιστα επίπεδα μεθυλίωσης κυτοσίνης σε δινουκλεοτίδια που δεν ήταν CG, ενώ τα επαγόμενα πλειοδύναμα κύτταρα είχαν παρόμοια επίπεδα μεθυλίωσης με τα εμβρυϊκά βλαστοκύτταρα, μεταξύ 0,5 και 1,5%. Έτσι, σύμφωνα με τις αντίστοιχες μεταγραφικές τους δραστηριότητες,[28] τα πρότυπα μεθυλίωσης του DNA, τουλάχιστον σε γονιδιωματικό επίπεδο, είναι παρόμοια μεταξύ των ESC και των iPSC.
Ωστόσο, κατά την πιο προσεκτική εξέταση των προτύπων μεθυλίωσης, οι συγγραφείς ανακάλυψαν 1175 περιοχές διαφορικής μεθυλίωσης δινουκλεοτιδίων CG μεταξύ τουλάχιστον μιας κυτταρικής σειράς ES ή iPS. Συγκρίνοντας αυτές τις περιοχές διαφορικής μεθυλίωσης με περιοχές μεθυλίωσης κυτοσίνης στα αρχικά σωματικά κύτταρα, το 44-49% των διαφορικά μεθυλιωμένων περιοχών αντανακλούσε πρότυπα μεθυλίωσης των αντίστοιχων προγονικών σωματικών κυττάρων, ενώ το 51-56% αυτών των περιοχών ήταν ανόμοια και με τα δύο προγονικά κύτταρα. και τις εμβρυϊκές κυτταρικές σειρές. Η διαφοροποίηση των γραμμών iPSC που προκλήθηκε In vitro έδειξε τη μετάδοση του 88% και του 46% υπερ- και υπομεθυλιωμένων διαφορικά μεθυλιωμένων περιοχών, αντίστοιχα.
Δύο συμπεράσματα προκύπτουν εύκολα από αυτή τη μελέτη. Πρώτον, οι επιγενετικές διεργασίες εμπλέκονται σε μεγάλο βαθμό στον προσδιορισμό της μοίρας των κυττάρων, όπως φαίνεται από τα παρόμοια επίπεδα μεθυλίωσης κυτοσίνης μεταξύ επαγόμενων πλειοδύναμων και εμβρυϊκών βλαστοκυττάρων, σύμφωνα με τα αντίστοιχα πρότυπα μεταγραφής. Δεύτερον, οι μηχανισμοί επαναπρογραμματισμού (και κατ' επέκταση, διαφοροποίησης) είναι πολύ περίπλοκοι και δεν μπορούν εύκολα να αναπαραχθούν, όπως φαίνεται από τον σημαντικό αριθμό διαφορικά μεθυλιωμένων περιοχών μεταξύ των κυτταρικών σειρών ES και iPS. Τώρα που αυτά τα δύο σημεία έχουν εδραιωθεί, μπορούμε να εξετάσουμε ορισμένους από τους επιγενετικούς μηχανισμούς που πιστεύεται ότι ρυθμίζουν την κυτταρική διαφοροποίηση.
Μηχανισμοί επιγενετικής ρύθμισης[Επεξεργασία | επεξεργασία κώδικα]
Πρωτοπόροι παράγοντες (Oct4, Sox2, Nanog)[Επεξεργασία | επεξεργασία κώδικα]
Τρεις μεταγραφικοί παράγοντες, OCT4, SOX2 και NANOG – οι δύο πρώτοι από τους οποίους χρησιμοποιούνται στον επαγόμενο επαναπρογραμματισμό πλειοδύναμων βλαστοκυττάρων (iPSC), μαζί με τα Klf4 και c-Myc – εκφράζονται σε μεγάλο βαθμό σε αδιαφοροποίητα εμβρυϊκά βλαστοκύτταρα και είναι απαραίτητα για τη διατήρηση της πλειοδύναμης τους.[29] Πιστεύεται ότι αυτό το επιτυγχάνουν μέσω αλλαγών στη δομή της χρωματίνης, όπως η τροποποίηση ιστόνης και η μεθυλίωση του DNA, για να περιορίσουν ή να επιτρέψουν τη μεταγραφή των γονιδίων-στόχων. Αν και είναι εξαιρετικά εκφρασμένα, τα επίπεδά τους απαιτούν μια ακριβή ισορροπία για να διατηρηθεί η πλειοδυναμικότητα, η διαταραχή της οποίας θα προωθήσει τη διαφοροποίηση προς διαφορετικές γενεαλογίες με βάση τον τρόπο με τον οποίο αλλάζουν τα επίπεδα γονιδιακής έκφρασης. Η διαφορική ρύθμιση των επιπέδων των Oct-4 και SOX2 έχει αποδειχθεί ότι προηγείται της επιλογής της τύχης του βλαστικού στρώματος.[30] Τα αυξημένα επίπεδα του Oct4 και τα μειωμένα επίπεδα του Sox2 προάγουν μια μεσενδοδερμική μοίρα, με το Oct4 να καταστέλλει ενεργά τα γονίδια που σχετίζονται με μια νευρική εξωδερμική τύχη. Ομοίως, τα αυξημένα επίπεδα του Sox2 και τα μειωμένα επίπεδα του Oct4 προάγουν τη διαφοροποίηση προς μια νευρική εξωδερμική μοίρα, με το Sox2 να αναστέλλει τη διαφοροποίηση προς μια μεσενδερματική μοίρα. Ανεξάρτητα από τη γενεαλογική διαφοροποίηση των κυττάρων, η καταστολή της NANOG έχει αναγνωριστεί ως απαραίτητη προϋπόθεση για τη διαφοροποίηση.[30]
Πολυκομβικό κατασταλτικό σύμπλεγμα (PRC2)[Επεξεργασία | επεξεργασία κώδικα]
Στο βασίλειο της γονιδιακής αποσιώπισης (gene silencing), το πολυκομβικό κατασταλτικό σύμπλεγμα 2 (Polycomb repressive complex 2, PRC2), μία από τις δύο τάξεις της οικογένειας πρωτεϊνών πολυκομβικής ομάδας (Polycomb group, PcG), καταλύει τη δι- και τριμεθυλίωση της ιστόνης Η3 λυσίνη 27 (H3K27me2/me3).[29][31][32] Με δέσμευση στο νουκλεόσωμα με επισήμανση H3K27me2/3, το PRC1 (επίσης ένα σύμπλεγμα πρωτεϊνών της οικογένειας PcG) καταλύει τη μονο-ουβικιτινυλίωση της ιστόνης H2A στη λυσίνη 119 (H2AK119Ub1), εμποδίζοντας τη δραστηριότητα της RNA πολυμεράσης II και καταλήγοντας σε μεταγραφική καταστολή .[29] Οι PcG αδρανοποιούν τα κύτταρα ES που δεν διαφοροποιούνται αποτελεσματικά στις τρεις βλαστικές στοιβάδες και η διαγραφή των γονιδίων PRC1 και PRC2 οδηγεί σε αυξημένη έκφραση γονιδίων που σχετίζονται με τη γενεαλογία και μη προγραμματισμένη διαφοροποίηση. [29] Προφανώς, τα σύμπλοκα PcG είναι υπεύθυνα για τη μεταγραφική καταστολή της διαφοροποίησης και των γονιδίων που προάγουν την ανάπτυξη.
Πρωτεΐνες ομάδας Trithorax (TrxG)[Επεξεργασία | επεξεργασία κώδικα]
Εναλλακτικά, κατά τη λήψη σημάτων διαφοροποίησης, οι πρωτεΐνες PcG στρατολογούνται σε προαγωγείς μεταγραφικών παραγόντων πλειοδυναμίας. Τα κύτταρα ES με έλλειψη PcG μπορούν να ξεκινήσουν τη διαφοροποίηση, αλλά δεν μπορούν να διατηρήσουν τον διαφοροποιημένο φαινότυπο.[29] Ταυτόχρονα, γονίδια διαφοροποίησης και προαγωγής της ανάπτυξης ενεργοποιούνται από τους ρυθμιστές χρωματίνης της ομάδας Trithorax (TrxG) και χάνουν την καταστολή τους.[29][32] Οι πρωτεΐνες TrxG στρατολογούνται σε περιοχές υψηλής μεταγραφικής δραστηριότητας, όπου καταλύουν την τριμεθυλίωση της ιστόνης Η3 λυσίνης 4 (H3K4me3) και προάγουν την ενεργοποίηση γονιδίων μέσω ακετυλίωσης της ιστόνης.[32] Τα σύμπλοκα PcG και TrxG εμπλέκονται σε άμεσο ανταγωνισμό και πιστεύεται ότι είναι λειτουργικά ανταγωνιστικά, δημιουργώντας σε τόπους διαφοροποίησης και προαγωγής της ανάπτυξης αυτό που ονομάζεται "δισθενής τομέας" και καθιστώντας αυτά τα γονίδια ευαίσθητα στην ταχεία επαγωγή ή καταστολή.[33]
Μεθυλίωση του DNA[Επεξεργασία | επεξεργασία κώδικα]
Η ρύθμιση της γονιδιακής έκφρασης επιτυγχάνεται περαιτέρω μέσω μεθυλίωσης του DNA, στην οποία η μεσολαβούμενη από μεθυλομεταφεράση του DNA μεθυλίωση των υπολειμμάτων κυτοσίνης στα δινουκλεοτίδια CpG διατηρεί κληρονομική καταστολή ελέγχοντας την προσβασιμότητα στο DNA.[33] Η πλειονότητα των θέσεων CpG σε εμβρυϊκά βλαστοκύτταρα είναι μη μεθυλιωμένα και φαίνεται να σχετίζονται με νουκλεοσώματα που φέρουν H3K4me3.[29] Κατά τη διαφοροποίηση, ένας μικρός αριθμός γονιδίων, συμπεριλαμβανομένων των OCT4 και NANOG,[33] μεθυλιώνονται και οι προαγωγείς τους καταστέλλονται για να αποτραπεί η περαιτέρω έκφρασή τους. Κατά συνέπεια, τα εμβρυϊκά βλαστοκύτταρα με έλλειψη μεθυλίωσης του DNA εισέρχονται γρήγορα σε απόπτωση κατά την in vitro διαφοροποίηση.[29]
Τοποθέτηση του νουκλεοσώματος[Επεξεργασία | επεξεργασία κώδικα]
Ενώ η αλληλουχία DNA των περισσότερων κυττάρων ενός οργανισμού είναι η ίδια, τα πρότυπα δέσμευσης των παραγόντων μεταγραφής και τα αντίστοιχα πρότυπα γονιδιακής έκφρασης είναι διαφορετικά. Σε μεγάλο βαθμό, οι διαφορές στη δέσμευση του μεταγραφικού παράγοντα καθορίζονται από την προσβασιμότητα στη χρωματίνη των θέσεων δέσμευσής τους μέσω τροποποίησης της ιστόνης ή/και πρωτοπόρων παραγόντων. Ειδικότερα, είναι σημαντικό να γνωρίζουμε εάν ένα νουκλεόσωμα καλύπτει μια δεδομένη θέση γονιδιωματικής δέσμευσης ή όχι. Αυτό μπορεί να προσδιοριστεί χρησιμοποιώντας μια δοκιμασία ανοσοκαθίζησης χρωματίνης (chromatin immunoprecipitation, ChIP).[34]
Ακετυλίωση και μεθυλίωση ιστόνης[Επεξεργασία | επεξεργασία κώδικα]
Οι αλληλεπιδράσεις DNA-νουκλεοσώματος χαρακτηρίζονται από δύο καταστάσεις: είτε στενά συνδεδεμένες από νουκλεοσώματα και μεταγραφικά ανενεργές, που ονομάζονται ετεροχρωματίνη, είτε χαλαρά συνδεδεμένες και συνήθως, αλλά όχι πάντα, μεταγραφικά ενεργές, που ονομάζεται ευχρωματίνη. Οι επιγενετικές διεργασίες μεθυλίωσης και ακετυλίωσης της ιστόνης και οι αντίστροφες απομεθυλίωση και αποακετυλίωση ευθύνονται κυρίως για αυτές τις αλλαγές. Τα αποτελέσματα της ακετυλίωσης και της αποακετυλίωσης είναι πιο προβλέψιμα. Μια ακετυλομάδα είτε προστίθεται, είτε αφαιρείται από τα θετικά φορτισμένα υπολείμματα λυσίνης στις ιστόνες από ένζυμα που ονομάζονται ακετυλομεταφεράσες ιστόνης ή αποακετυλάσες ιστόνης, αντίστοιχα. Η ακετυλομάδα αποτρέπει τη σύνδεση της λυσίνης με τον αρνητικά φορτισμένο σκελετό του DNA. Η μεθυλίωση δεν είναι τόσο απλή, καθώς ούτε η μεθυλίωση ούτε η απομεθυλίωση συσχετίζονται σταθερά με την ενεργοποίηση ή την καταστολή των γονιδίων. Ωστόσο, ορισμένες μεθυλώσεις έχει επανειλημμένα αποδειχθεί ότι είτε ενεργοποιούν είτε καταστέλλουν γονίδια. Η τριμεθυλίωση της λυσίνης 4 στην ιστόνη 3 (H3K4Me3) σχετίζεται με γονιδιακή ενεργοποίηση, ενώ η τριμεθυλίωση της λυσίνης 27 στην ιστόνη 3 καταστέλλει τα γονίδια[35][36][37]
Στα βλαστοκύτταρα[Επεξεργασία | επεξεργασία κώδικα]
Κατά τη διαφοροποίηση, τα βλαστοκύτταρα αλλάζουν τις κατατομές (προφίλ) της γονιδιακής τους έκφρασης. Πρόσφατες μελέτες έχουν εμπλέξει έναν ρόλο για την τοποθέτηση των νουκλεοσωμάτων και τις τροποποιήσεις ιστόνης κατά τη διάρκεια αυτής της διαδικασίας.[38] Υπάρχουν δύο συστατικά αυτής της διαδικασίας: η απενεργοποίηση της έκφρασης των γονιδίων των εμβρυϊκών βλαστοκυττάρων (embryonic stem cell, ESC) και η ενεργοποίηση των γονιδίων της μοίρας των κυττάρων. Η ειδική για τη λυσίνη απομεθυλάση 1 (KDM1A) πιστεύεται ότι εμποδίζει τη χρήση περιοχών του ενισχυτή γονιδίων πλειοδυναμίας, αναστέλλοντας έτσι τη μεταγραφή τους.[39] Αλληλεπιδρά με το σύμπλεγμα Mi-2/NuRD (αναδιαμόρφωση νουκλεοσώματος και αποακετυλάσης ιστόνης),[39] δίνοντας ένα παράδειγμα όπου η μεθυλίωση και η ακετυλίωση δεν είναι διακριτές και αλληλοαποκλειόμενες, αλλά αλληλένδετες διαδικασίες.
Ο ρόλος της σηματοδότησης στον επιγενετικό έλεγχο[Επεξεργασία | επεξεργασία κώδικα]
Ένα τελευταίο ερώτημα που πρέπει να τεθεί αφορά τον ρόλο της κυτταρικής σηματοδότησης στον επηρεασμό των επιγενετικών διεργασιών που διέπουν τη διαφοροποίηση. Ένας τέτοιος ρόλος θα πρέπει να υπάρχει, καθώς θα ήταν λογικό να πιστεύουμε ότι η εξωτερική σηματοδότηση μπορεί να οδηγήσει σε επιγενετική αναδιαμόρφωση, όπως μπορεί να οδηγήσει σε αλλαγές στη γονιδιακή έκφραση μέσω της ενεργοποίησης ή καταστολής διαφορετικών παραγόντων μεταγραφής. Ελάχιστα άμεσα δεδομένα είναι διαθέσιμα σχετικά με τα συγκεκριμένα σήματα που επηρεάζουν το επιγονιδίωμα και η πλειονότητα της τρέχουσας γνώσης για το θέμα αποτελείται από εικασίες για πιθανούς υποψήφιους ρυθμιστές της επιγενετικής αναδιαμόρφωσης.[40] Αρχικά θα συζητήσουμε αρκετούς σημαντικούς υποψηφίους που πιστεύεται ότι εμπλέκονται στην επαγωγή και διατήρηση τόσο των εμβρυϊκών βλαστοκυττάρων όσο και των διαφοροποιημένων απογόνων τους και στη συνέχεια θα στραφούμε σε ένα παράδειγμα συγκεκριμένων οδών σηματοδότησης στα οποία υπάρχουν πιο άμεσες ενδείξεις για το ρόλο της στην επιγενετική αλλαγή.
Ο πρώτος σημαντικός υποψήφιος είναι η οδός σηματοδότησης Wnt. Η οδός Wnt εμπλέκεται σε όλα τα στάδια διαφοροποίησης και ο συνδέτης Wnt3a μπορεί να υποκαταστήσει την υπερέκφραση του c-Myc στη δημιουργία επαγόμενων πλειοδύναμων βλαστοκυττάρων.[40] Από την άλλη πλευρά, η διακοπή της β-κατενίνης, ενός συστατικού της οδού σηματοδότησης Wnt, οδηγεί σε μειωμένο πολλαπλασιασμό των νευρικών προγόνων.
Οι αυξητικοί παράγοντες αποτελούν το δεύτερο σημαντικό σύνολο υποψηφίων επιγενετικών ρυθμιστών της κυτταρικής διαφοροποίησης. Αυτά τα μορφογόνα είναι ζωτικής σημασίας για την ανάπτυξη και περιλαμβάνουν μορφογενετικές πρωτεΐνες των οστών, μετασχηματιστικούς αυξητικούς παράγοντες (transforming growth factors, TGF) και αυξητικούς παράγοντες ινοβλαστών (fibroblast growth factors, FGFs). Τα TGF και τα FGFs έχουν αποδειχθεί ότι συντηρούν την έκφραση των OCT4, SOX2 και NANOG μέσω σηματοδότησης προς τα κάτω στις πρωτεΐνες Smad.[40] Η εξάντληση των αυξητικών παραγόντων προάγει τη διαφοροποίηση των ESCs, ενώ τα γονίδια με δισθενή χρωματίνη μπορεί να γίνουν είτε πιο περιοριστικά είτε ανεκτικά στη μεταγραφή τους.[40]
Αρκετές άλλες οδοί σηματοδότησης θεωρούνται επίσης ως κύριες υποψήφιες. Οι ανασταλτικοί παράγοντας λευχαιμίας κυτοκίνες σχετίζονται με τη διατήρηση των ESC ποντικών σε αδιαφοροποίητη κατάσταση. Αυτό επιτυγχάνεται μέσω της ενεργοποίησης της οδού Jak-STAT3, η οποία έχει αποδειχθεί απαραίτητη και επαρκής για τη διατήρηση της πλειοδυναμίας του ESC του ποντικιού.[41] Το ρετινοϊκό οξύ μπορεί να προκαλέσει διαφοροποίηση των ESCs ανθρώπου και του ποντικού, [40] και η σηματοδότηση Notch εμπλέκεται στον πολλαπλασιασμό και την αυτοανανέωση των βλαστοκυττάρων. Τέλος, η πρωτεΐνη Sonic hedgehog, εκτός από τον ρόλο της ως μορφογόνου, προάγει τη διαφοροποίηση των εμβρυϊκών βλαστοκυττάρων και την αυτοανανέωση των σωματικών βλαστοκυττάρων.[40]
Το πρόβλημα, φυσικά, είναι ότι η υποψηφιότητα αυτών των οδών σηματοδότησης συνάγεται κυρίως με βάση τον ρόλο τους στην ανάπτυξη και την κυτταρική διαφοροποίηση. Ενώ η επιγενετική ρύθμιση είναι απαραίτητη για την προώθηση της κυτταρικής διαφοροποίησης, σίγουρα δεν επαρκεί για αυτήν τη διαδικασία. Η άμεση τροποποίηση της γονιδιακής έκφρασης μέσω της τροποποίησης των μεταγραφικών παραγόντων διαδραματίζει βασικό ρόλο που πρέπει να διακρίνεται από τις κληρονομικές επιγενετικές αλλαγές που μπορούν να επιμείνουν ακόμη και απουσία των αρχικών περιβαλλοντικών σημάτων. Υπάρχουν επί του παρόντος μόνο μερικά παραδείγματα οδών σηματοδότησης που οδηγούν σε επιγενετικές αλλαγές που αλλάζουν τη μοίρα των κυττάρων και θα επικεντρωθούμε σε μία από αυτές.
Η έκφραση του Shh (Sonic hedgehog) ρυθμίζει προς τα πάνω την παραγωγή του BMI1, ενός συστατικού του συμπλέγματος PcG που αναγνωρίζει το H3K27me3. Αυτό συμβαίνει με τρόπο εξαρτώμενο από το Gli, καθώς τα Gli1 και Gli2 είναι τελεστές κατάντη της οδού σηματοδότησης Hedgehog. Στην καλλιέργεια, το Bmi1 μεσολαβεί στην ικανότητα της οδού Hedgehog να προάγει την αυτοανανέωση των ανθρώπινων μαστικών βλαστοκυττάρων.[42] Τόσο σε ανθρώπους όσο και σε ποντίκια, οι ερευνητές έδειξαν ότι το Bmi1 εκφράζεται σε μεγάλο βαθμό σε πολλαπλασιαζόμενα πρόδρομα ανώριμα κοκκώδη κύτταρα της παρεγκεφαλίδας. Όταν το Bmi1 αποκλείστηκε στα ποντίκια, προέκυψε διαταραχή της παρεγκεφαλιδικής ανάπτυξης, που οδήγησε σε σημαντικές μειώσεις στη μεταγεννητική εγκεφαλική μάζα μαζί με ανωμαλίες στον κινητικό έλεγχο και τη συμπεριφορά.[43] Μια ξεχωριστή μελέτη έδειξε σημαντική μείωση στον πολλαπλασιασμό νευρικών βλαστοκυττάρων μαζί με αυξημένο πολλαπλασιασμό αστροκυττάρων σε ποντίκια Bmi null.[44]
Ένα εναλλακτικό μοντέλο κυτταρικής διαφοροποίησης κατά τη διάρκεια της εμβρυογένεσης είναι ότι οι πληροφορίες θέσης βασίζονται στη μηχανική σηματοδότηση από τον κυτταροσκελετό χρησιμοποιώντας εμβρυϊκά κύματα διαφοροποίησης. Το μηχανικό σήμα στη συνέχεια μετατρέπεται επιγενετικά μέσω συστημάτων μεταγωγής σήματος (στα οποία συγκεκριμένα μόρια όπως το Wnt αποτελούν μέρος) για να οδηγήσει σε διαφορική έκφραση του γονιδίου.
Συνοπτικά, ο ρόλος της σηματοδότησης στον επιγενετικό έλεγχο της τύχης των κυττάρων στα θηλαστικά είναι σε μεγάλο βαθμό άγνωστος, αλλά υπάρχουν διακριτά παραδείγματα που υποδεικνύουν την πιθανή ύπαρξη περαιτέρω τέτοιων μηχανισμών.
Επίδραση ελαστικότητας μήτρας[Επεξεργασία | επεξεργασία κώδικα]
Προκειμένου να εκπληρωθεί ο σκοπός της αναγέννησης μιας ποικιλίας ιστών, τα ενήλικα στελέχη είναι γνωστό ότι μεταναστεύουν από τις κόγχες τους, προσκολλώνται σε νέες εξωκυτταρικές μήτρες (extracellular matrices, ECM) και διαφοροποιούνται. Η ολκιμότητα αυτών των μικροπεριβαλλόντων είναι μοναδική σε διαφορετικούς τύπους ιστών. Το ECM που περιβάλλει τους ιστούς του εγκεφάλου, των μυών και των οστών ποικίλλει από μαλακό έως άκαμπτο. Η μεταγωγή των βλαστοκυττάρων σε αυτούς τους τύπους κυττάρων δεν κατευθύνεται αποκλειστικά από τα σήματα χημειοκίνης και τη σηματοδότηση από κύτταρο σε κύτταρο. Η ελαστικότητα του μικροπεριβάλλοντος μπορεί επίσης να επηρεάσει τη διαφοροποίηση των μεσεγχυματικών βλαστοκυττάρων (MSCs που προέρχονται από τον μυελό των οστών). τύπους. Όταν τα MSC τοποθετούνται σε υποστρώματα της ίδιας ακαμψίας με το ECM εγκεφάλου, μυών και οστών, τα MSC αποκτούν τις ιδιότητες αυτών των αντίστοιχων τύπων κυττάρων.[45] Η ανίχνευση μήτρας απαιτεί από το κύτταρο να έλκεται στη μήτρα σε εστιακές προσκολλήσεις, κάτι που ενεργοποιεί έναν κυτταρικό μηχανο-μετατροπέα για να δημιουργήσει ένα σήμα για να πληροφορηθεί ποια δύναμη χρειάζεται για να παραμορφωθεί η μήτρα. Για τον προσδιορισμό των βασικών παικτών στην προδιαγραφή γενεαλογίας που βασίζεται στην ελαστικότητα της μήτρας στα MSCs, μιμήθηκαν διαφορετικά μικροπεριβάλλοντα μήτρας. Από αυτά τα πειράματα, βγήκε το συμπέρασμα ότι οι εστιακές προσκολλήσεις των MSC ήταν ο κυτταρικός μηχανο-μετατροπέας που ανιχνεύει τις διαφορές της ελαστικότητας της μήτρας. Οι μη μυϊκές ισόμορφες μυοσίνές IIa-c δημιουργούν τις δυνάμεις στο κύτταρο που οδηγούν σε σηματοδότηση πρώιμων δεικτών δέσμευσης. Η μη μυϊκή μυοσίνη IIa δημιουργεί τη λιγότερη δύναμη που αυξάνεται στη μη μυϊκή μυοσίνη IIc. Υπάρχουν επίσης παράγοντες στο κύτταρο που αναστέλλουν τη μη μυϊκή μυοσίνη II, όπως η blebbistatin. Αυτό καθιστά το κύτταρο αποτελεσματικά τυφλό στην περιβάλλουσα μήτρα.[45] Οι ερευνητές είχαν κάποια επιτυχία στην πρόκληση ιδιοτήτων που μοιάζουν με βλαστοκύτταρα σε κύτταρα HEK 239 παρέχοντας μια μαλακή μήτρα χωρίς τη χρήση παραγόντων διάχυσης.[46] Οι ιδιότητες των βλαστοκυττάρων φαίνεται να συνδέονται με την τάση στο δίκτυο ακτίνης των κυττάρων. Ένας αναγνωρισμένος μηχανισμός για τη διαφοροποίηση που προκαλείται από τη μήτρα είναι οι επαγόμενες από την τάση πρωτεΐνες, οι οποίες αναδιαμορφώνουν τη χρωματίνη ως απόκριση στη μηχανική διάταση.[47] Η οδός RhoA εμπλέκεται επίσης σε αυτή τη διαδικασία.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Kryven, I.; Röblitz, S.; Schütte, Ch. (2015). «Solution of the chemical master equation by radial basis functions approximation with interface tracking». BMC Systems Biology 9 (1): 67. doi:. PMID 26449665.

- ↑ Slack, J.M.W. (2013) Essential Developmental Biology. Wiley-Blackwell, Oxford.
- ↑ Slack, J.M.W. (2007). «Metaplasia and transdifferentiation: from pure biology to the clinic». Nature Reviews Molecular Cell Biology 8 (5): 369–378. doi:. PMID 17377526.
- ↑ Yanes, Oscar; Clark, Julie; Wong, Diana M.; Patti, Gary J.; Sánchez-Ruiz, Antonio; Benton, H. Paul; Trauger, Sunia A.; Desponts, Caroline και άλλοι. (June 2010). «Metabolic oxidation regulates embryonic stem cell differentiation» (στα αγγλικά). Nature Chemical Biology 6 (6): 411–417. doi:. ISSN 1552-4469. PMID 20436487.
- ↑ Takahashi, K; Yamanaka, S (2006). «Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors». Cell 126 (4): 663–76. doi:. PMID 16904174.
- ↑ 6,0 6,1 6,2 Schöler, Hans R. (2007). «The Potential of Stem Cells: An Inventory». Στο: Nikolaus Knoepffler· Dagmar Schipanski· Stefan Lorenz Sorgner. Humanbiotechnology as Social Challenge. Ashgate Publishing. σελ. 28. ISBN 978-0-7546-5755-2.
- ↑ «NCI Dictionary of Cancer Terms». National Cancer Institute. Ανακτήθηκε στις 1 Νοεμβρίου 2013.
- ↑ Lodish, Harvey (2000). Molecular Cell Biology
 (4th έκδοση). New York: W. H. Freeman. Section 14.2. ISBN 978-0-7167-3136-8.
(4th έκδοση). New York: W. H. Freeman. Section 14.2. ISBN 978-0-7167-3136-8.
- ↑ Kumar, Rani (2008). Textbook of Human Embryology. I.K. International Publishing House. σελ. 22. ISBN 9788190675710.
- ↑ D. Binder, Marc· Hirokawa, Nobutaka· Windhorst, Uwe (2009). Encyclopedia of Neuroscience. Springer. ISBN 978-3540237358.
- ↑ Rakic, P (October 2009). «Evolution of the neocortex: a perspective from developmental biology». Nature Reviews. Neuroscience 10 (10): 724–35. doi:. PMID 19763105.
- ↑ Lui, JH; Hansen, DV; Kriegstein, AR (8 July 2011). «Development and evolution of the human neocortex.». Cell 146 (1): 18–36. doi:. PMID 21729779.
- ↑ Rash, BG; Ackman, JB; Rakic, P (February 2016). «Bidirectional radial Ca(2+) activity regulates neurogenesis and migration during early cortical column formation.». Science Advances 2 (2): e1501733. doi:. PMID 26933693. Bibcode: 2016SciA....2E1733R.
- ↑ Stocum DL (2004). «Amphibian Regeneration and Stem Cells». Regeneration: Stem Cells and Beyond. Curr. Top. Microbiol. Immunol. Current Topics in Microbiology and Immunology. 280. σελίδες 1–70. doi:10.1007/978-3-642-18846-6_1. ISBN 978-3-540-02238-1. PMID 14594207.
- ↑ «Evidence for dedifferentiation and metaplasia in amphibian limb regeneration from inheritance of DNA methylation». Development 104 (4): 657–668. 1988-12-01. doi:. PMID 3268408. http://dev.biologists.org/cgi/content/abstract/104/4/657.
- ↑ Giles KL (1971). «Dedifferentiation and Regeneration in Bryophytes: A Selective Review». New Zealand Journal of Botany 9 (4): 689–94. doi:. http://www.rsnz.org/publish/nzjb/1971/47.php. Ανακτήθηκε στις 2008-01-01.
- ↑ «Dedifferentiation-associated changes in morphology and gene expression in primary human articular chondrocytes in cell culture». Osteoarthr. Cartil. 10 (1): 62–70. January 2002. doi:. PMID 11795984.
- ↑ Sell S (December 1993). «Cellular origin of cancer: dedifferentiation or stem cell maturation arrest?». Environ. Health Perspect. 101 (Suppl 5): 15–26. doi:. PMID 7516873.
- ↑ Tsonis PA (April 2004). «Stem cells from differentiated cells». Mol. Interv. 4 (2): 81–3. doi:. PMID 15087480. Αρχειοθετήθηκε από το πρωτότυπο στις 2016-05-23. http://arquivo.pt/wayback/20160523205221/http://molinterv.aspetjournals.org/cgi/pmidlookup?view=long&pmid=15087480. Ανακτήθηκε στις 2010-12-26.
- ↑ «Gene regulation: gene control network in development.». Annu Rev Biophys Biomol Struct 36 (191): 191–212. 2007. doi:. PMID 17291181. https://authors.library.caltech.edu/8735/1/LEOarbbs07.pdf.
- ↑ Newman, Stuart A. (2020). «Cell differentiation: what have we learned in 50 years?». Journal of Theoretical Biology 485: 110031. doi:. PMID 31568790. Bibcode: 2020JThBi.48510031N.
- ↑ Knisely, Karen· Gilbert, Scott F. (2009). Developmental Biology (8th έκδοση). Sunderland, Mass: Sinauer Associates. σελ. 147. ISBN 978-0-87893-371-6.
- ↑ 23,0 23,1 23,2 23,3 23,4 23,5 23,6 Rudel and Sommer; The evolution of developmental mechanisms. Developmental Biology 264, 15-37, 2003 Rudel, D.; Sommer, R. J. (2003). «The evolution of developmental mechanisms». Developmental Biology 264 (1): 15–37. doi:. PMID 14623229.
- ↑ 24,0 24,1 Yamamoto Y and WR Jeffery; Central role for the lens in cave fish eye degeneration. Science 289 (5479), 631-633, 2000 Yamamoto, Y.; Jeffery, W. R. (2000). «Central Role for the Lens in Cave Fish Eye Degeneration». Science 289 (5479): 631–633. doi:. PMID 10915628. Bibcode: 2000Sci...289..631Y.
- ↑ Kirk MM, A Ransick, SE Mcrae, DL Kirk; The relationship between cell size and cell fate in Volvox carteri. Journal of Cell Biology 123, 191-208, 1993 Kirk, M. M.; Ransick, A.; McRae, S. E.; Kirk, D. L. (1993). «The relationship between cell size and cell fate in Volvox carteri». Journal of Cell Biology 123 (1): 191–208. doi:. PMID 8408198. PMC 2119814. https://archive.org/details/sim_journal-of-cell-biology_1993-10_123_1/page/191.
- ↑ «Epigenetic and transcriptional regulations prime cell fate before division during human pluripotent stem cell differentiation». Nature Communications 14 (405): 405. January 25, 2023. doi:. PMID 36697417. PMC 9876972. Bibcode: 2023NatCo..14..405M. https://www.nature.com/articles/s41467-023-36116-9.pdf.
- ↑ «Branching and oscillations in the epigenetic landscape of cell-fate determination». Progress in Biophysics and Molecular Biology 117 (2–3): 240–9. January 30, 2015. doi:. PMID 25641423. https://www.biorxiv.org/content/biorxiv/early/2015/01/30/007831.full.pdf.
- ↑ 28,0 28,1 Lister R (2011). «Hotspots of aberrant epigenomic reprogramming in human induced pluripotent stem cells». Nature 471 (7336): 68–73. doi:. PMID 21289626. Bibcode: 2011Natur.471...68L.
- ↑ 29,0 29,1 29,2 29,3 29,4 29,5 29,6 29,7 «Epigenetic control of embryonic stem cell fate». J Exp Med 207 (11): 2287–95. 2010. doi:. PMID 20975044.
- ↑ 30,0 30,1 Thomson, M; Liu, S. J.; Zou, L. N.; Smith, Z; Meissner, A; Ramanathan, S (2011). «Pluripotency factors in embryonic stem cells regulate differentiation into germ layers». Cell 145 (6): 875–89. doi:. PMID 21663792.
- ↑ Zhu, J. (2013). «Genome-wide chromatin state transitions associated with developmental and environmental cues». Cell 152 (3): 642–654. doi:. PMID 23333102.
- ↑ 32,0 32,1 32,2 «Repressive Transcription». Science 329 (5988): 150–1. 2010. doi:. PMID 20616255. PMC 3006433. Bibcode: 2010Sci...329..150G. http://dspace.mit.edu/bitstream/1721.1/81257/1/Young_Repressive%20transcription.pdf.
- ↑ 33,0 33,1 33,2 Meissner A (2010). «Epigenetic modifications in pluripotent and differentiated cells». Nat Biotechnol 28 (10): 1079–88. doi:. PMID 20944600. https://archive.org/details/sim_nature-biotechnology_2010-10_28_10/page/1079.
- ↑ «Chromatin Immuprecipitation». www.bio.brandeis.edu. Αρχειοθετήθηκε από το πρωτότυπο στις 25 Νοεμβρίου 2017. Ανακτήθηκε στις 30 Δεκεμβρίου 2023.
- ↑ «The Paf1 complex is required for histone H3 methylation by COMPASS and Dot1p: linking transcriptional elongation to histone methylation». Molecular Cell 11 (3): 721–9. Mar 2003. doi:. PMID 12667454.
- ↑ «Targeted recruitment of Set1 histone methylase by elongating Pol II provides a localized mark and memory of recent transcriptional activity». Molecular Cell 11 (3): 709–19. Mar 2003. doi:. PMID 12667453.
- ↑ «Genomic maps and comparative analysis of histone modifications in human and mouse». Cell 120 (2): 169–81. Jan 2005. doi:. PMID 15680324.
- ↑ «Genome-wide nucleosome positioning during embryonic stem cell development». Nat Struct Mol Biol 19 (11): 1185–92. 2012. doi:. PMID 23085715.
- ↑ 39,0 39,1 Whyte, W. A.; Bilodeau, S; Orlando, D. A.; Hoke, H. A.; Frampton, G. M.; Foster, C. T.; Cowley, S. M.; Young, R. A. (2012). «Enhancer decommissioning by LSD1 during embryonic stem cell differentiation». Nature 482 (7384): 221–5. doi:. PMID 22297846. Bibcode: 2012Natur.482..221W.
- ↑ 40,0 40,1 40,2 40,3 40,4 40,5 «Linking cell signaling and the epigenetic machinery». Nat Biotechnol 28 (10): 1033–8. 2010. doi:. PMID 20944593. https://archive.org/details/sim_nature-biotechnology_2010-10_28_10/page/1033.
- ↑ «Self-renewal of pluripotent embryonic stem cells is mediated via activation of STAT3». Genes Dev 12 (13): 2048–60. 1998. doi:. PMID 9649508.
- ↑ Liu S (2006). «Hedgehog Signaling and Bmi-1 Regulate Self-renewal of Normal and Malignant Human Mammary Stem Cells». Cancer Res 66 (12): 6063–71. doi:. PMID 16778178.
- ↑ Leung C (2004). «Bmi1 is essential for cerebellar development and is overexpressed in human medulloblastomas». Nature 428 (6980): 337–41. doi:. PMID 15029199. Bibcode: 2004Natur.428..337L.
- ↑ Zencak D (2005). «Bmi1 loss produces an increase in astroglial cells and a decrease in neural stem cell population and proliferation». J Neurosci 25 (24): 5774–83. doi:. PMID 15958744.
- ↑ 45,0 45,1 Engler, AJ; Sen, S; Sweeney, HL; Discher, DE (August 2006). «Matrix Elasticity Directs Stem Cell Lineage Specification». Cell 126 (4): 677–689. doi:. PMID 16923388.
- ↑ Guo, Jun; Wang, Yuexiu; Sachs, Frederick; Meng, Fanjie (2014-12-09). «Actin stress in cell reprogramming» (στα αγγλικά). Proceedings of the National Academy of Sciences 111 (49): E5252–E5261. doi:. ISSN 0027-8424. PMID 25422450. Bibcode: 2014PNAS..111E5252G.
- ↑ Guilak, Farshid; Cohen, Daniel M.; Estes, Bradley T.; Gimble, Jeffrey M.; Liedtke, Wolfgang; Chen, Christopher S. (2009-07-02). «Control of Stem Cell Fate by Physical Interactions with the Extracellular Matrix». Cell Stem Cell 5 (1): 17–26. doi:. PMID 19570510.
|



