Γαλακτικό οξύ
| Γαλακτικό οξύ | |
|---|---|
| |

| |

| |
| Γενικά | |
| Όνομα IUPAC | 2-υδροξυπροπανικό οξύ |
| Άλλες ονομασίες | Γαλακτικό οξύ α-υδροξυπροπανικό οξύ |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C3H6O3 |
| Μοριακή μάζα | 90,08 amu |
| Σύντομος συντακτικός τύπος |
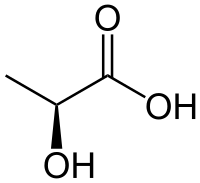
CH3CH(OH)COOH |
| Συντομογραφίες | MeCH(OH)COOH |
| Αριθμός CAS | 50-21-5, 79-33-4 (L) 10326-41-7 (D) 598-82-3 (DL) |
| SMILES | CC(O)C(=O)O |
| ChemSpider ID | 96860 |
| Κωδικός προσθέτου τροφίμων |
E270 |
| Ισομέρεια | |
| Ισομερή θέσης | 65 |
| Οπτικά ισομερή | 2 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 53°C (D) 53°C (L) 16,8°C (DL) |
| Σημείο βρασμού | 122°C (12 mmHg) |
| Πυκνότητα | 1.210 kg/m³ |
| Τάση ατμών | 10 Pa |
| Γωνία στροφής πολωμένου φωτός |
[α]D20 = -2,6 (D, H2O) [α]D15 = +3,82 (L, H2O) |
| Χημικές ιδιότητες | |
| pKa | 3,86 |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Το γαλακτικό οξύ[1] (αγγλικά: lactic acid) είναι οργανική χημική ένωση, με μοριακό τύπο C3H6O3, αν και συνηθέστερα παριστάνεται ως CH3CH(OH)CO2H. Το χημικά καθαρό γαλακτικό οξύ, στις κανονικές συνθήκες περιβάλλοντος, είναι λευκό στερεό, αναμείξιμο με το νερό.[2] Όταν διαλύεται στο τελευταίο (νερό) σχηματίζει ένα άχρωμο διάλυμα. Η παραγωγή του συμπεριλαμβάνει τόσο φυσικές όσο και τεχνητές μεθόδους. Το γαλακτικό οξύ είναι ένα α-υδροξυοξύ (AHA, A-HydroxyAcid), λόγω της παρουσίας υδροξυομάδας δίπλα ακριβώς από την καρβοξυλομάδα του. Χρησιμοποιήθηκε βιομηχανικά ως ενδιάμεσο συνθετικό σύνθεσης διαφόρων οργανικών και βιοχημικών προϊόντων. Η συζυγής βάση του γαλακτικού οξέος είναι το γαλακτικό ανιόν [CH3C(OH)CO2–].
Το γαλακτικό οξύ σε υδατικό διάλυμα διίσταται, σχηματίζοντας γαλακτικό ανιόν και υδροξώνιο (Η3Ο+). Σε σύγκριση με το οξικό οξύ, το γαλακτικό οξύ έχει pKa = 3,86 έναντι 4,756 του πρώτου (δηλαδή του οξικού οξέος), γεγονός που σημαίνει ότι το γαλακτικό οξύ είναι περίπου κατά 10 φορές ισχυρότερο οξύ από αυτό (δηλαδή το οξικό οξύ). Η υψηλότερη οξύτητά του είναι συνέπεια του ενδομοριακού δεσμού υδρογόνου μεταξύ του ατόμου υδρογόνου του υδροξυλίου και του ενός ατόμου οξυγόνου του καρβοξυλίου.
Το γαλακτικό οξύ είναι χειρόμορφο, αποτελούμενο από δυο εναντιομερή. Το ένα είναι γνωστό ως L-(+)- ή S- γαλακτικό οξύ, ενώ το άλλο, που όμοιο με κατοπτρική εικόνα του πρώτου, είναι γνωστό ως D-(-)- ή R- γαλακτικό οξύ. Ένα ισομοριακό μείγμα των δυο εναντιομερών ονομάζεται DL- ή ρακεμεικό γαλακτικό οξύ. Το DL-γαλακτικό οξύ είναι υγροσκοπικό και αναμείξιμο με το νερό, αλλά και με την αιθανόλη, πάνω από την κανονική θερμοκρασία τήξης του, που είναι 16,8 °C. Τα διαχωρισμένα εναντιομερή έχουν αρκετά υψηλότερη θερμοκρασία τήξης (53°C). Το γαλακτικό οξύ που παράγεται με ζύμωση γάλακτος είναι συχνά ρακεμεικό, παρόλο που υπάρχουν κάποια συγκεκριμένα είδη βακτηριδίων που παράγουν μόνο D-γαλακτικό οξύ. Από την άλλη, το γαλακτικό οξύ που παράγεται με αναερόβεια αναπνοή των ζωικών μυών είναι το L-γαλακτικό οξύ και γι' αυτόν το λόγο ενίοτε το εναντιομερές αυτό ονομάζεται «σαρκογαλακτικό οξύ», δηλαδή με πρόθεμα που προέρχεται από την ελληνική λέξη «σάρξ» (δηλαδή σάρκα).
Στα ζώα, το L-γαλακτικό οξύ παράγεται σταθερά από το πυροσταφυλικό οξύ, μέσω ενός ενζύμου που ονομάζεται γαλακτική δεϋδρογονάση (LDH, Lactate DeHydrogenase), σε μια διεργασία ζύμωσης που συμβαίνει κατά τον κανονικό μεταβολισμό και την άσκηση. Η συγκέντρωση του L-γαλακτικού οξέος δεν αυξάνεται, παρά μόνο αν ο ρυθμός παραγωγής του ξεπεράσει το ρυθμό αποσύνθεσής του, που ρυθμίζεται από έναν αριθμό παραμέτρων, που συμπεριλαμβάνουν μεταφορείς μονοκαρβοξυλικών, τη συγκέντρωση και τον ισοφορμισμό της LDH, καθώς και την οξειδωτική χωρητικότητα των ιστών.
Η συγκέντρωση του L-γαλακτικού οξέος στο αίμα είναι συνήθως 1-2 mM σε ηρεμία, αλλά μπορεί να ξεπεράσει τα 20 mM, κατά τη διάρκεια έντονης άσκησης, καθώς και τα 25 mM μετά την άσκηση.
Απομονώθηκε για πρώτη φορά το 1780, από το Σουηδό χημικό Καρλ Βίλχελμ Σέελε (Carl Wilhelm Scheele).
Στη βιομηχανία, η γαλακτική ζύμωση πραγματοποιείται από τα βακτήρια γαλακτικού οξέος (LAB), που μετατρέπουν γλυκόζη και σουκρόζη σε γαλακτικό οξύ. Αυτά τα βακτήρια μπορούν επίσης να αναπτυχθούν στο στόμα: Το γαλακτικό οξύ που παράγουν είναι υπεύθυνο για τη φθορά των δοντιών[3][4][5][6].
Στην ιατρική, το γαλακτικό οξύ είναι ένα από τα κύρια συστατικά του γαλακτικού διαλύματος Ρίνγκερ (lactated Ringer's solution) και του γαλακτικού διαλύματος Χάρτμανν (lactated Hartmann's solution). Αυτά τα ενδοφλέβια διαλύματα περιέχουν γαλακτικό οξύ, χλωριούχο νάτριο (NaCl) και χλωριούχο κάλιο (KCl) σε αποσταγμένο νερό, σε ισοτονικές με το ανθρώπινο αίμα συγκεντρώσεις, Η πιο συνηθισμένη χρήση αυτών των διαλυμάτων είναι η αντικατάσταση απωλειών σε υγρά του αίματος, μετά από αιμορραγία από τραύμα, εγχείρηση ή έγκαυμα.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Το γαλακτικό οξύ αποστάχθηκε για πρώτη φορά το 1780 από το Σουηδό χημικό Καρλ Βίλχελμ Σέελε από το ξυνόγαλο, από το οποίο προέκυψε και το εμπειρικό του όνομα «γαλακτικό οξύ». Το 1808 ο Τζονς Τζακόμπ Μπερζέλιους (Jöns Jacob Berzelius) ανακάλυψε ότι το γαλακτικό οξύ παράγεται επίσης από τους μύες κατά τη διάρκεια της σύσπασής τους. Η δομή του εξακριβώθηκε από τον Γιοχάνες Γουΐσκενους (Johannes Wislicenus ) το 1873.
Το 1856, ο Λουί Παστέρ (Louis Pasteur) ανακάλυψε το λακτοβάκιλλο, καθώς και τον ρόλο του στην παραγωγή 2-υδροξυπροπανικού οξέος. Το γαλακτικό οξύ άρχισε να παράγεται για εμπορικούς σκοπούς από τη Γερμανική φαρμακευτική εταιρεία Boehringer Ingelheim το 1895.
Δομή[Επεξεργασία | επεξεργασία κώδικα]
| Δεσμοί[7] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#2,#3-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#2-C#1 | σ | 2sp3-2sp2 | 151 pm | |
| C#3-C#2 | σ | 2sp3-2sp3 | 154 pm | |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C#1-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| C#2-O | σ | 2sp3-2sp3 | 150 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Γωνίες | ||||
| HCH | 109°28' | |||
| HCC | 109°28' | |||
| CCO | 120° | |||
| COO | 120° | |||
| OCO | 120° | |||
| COH | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[8] | ||||
| Ο (OH) | -0,51 | |||
| Ο (=O) | -0,38 | |||
| C#3 | -0,09 | |||
| Η (HC) | +0,03 | |||
| C#2 | +0,16 | |||
| Η (OH) | +0,32 | |||
| C#1 | +0,57 | |||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Το φυσικό L – γαλακτικό οξύ που ονομάζεται και κρεωγαλακτικό ή σαρκογαλακτικό οξύ, βρίσκεται ως κανονικό συστατικό των μυών. Σχηματίζεται κατά την ζύμωση του γλυκογόνου (γλυκόλυση).
Βιομηχανικά το ρακεμικό γαλακτικό οξύ παράγεται με ελεγχόμενη ζύμωση της γλυκόζης και άλλων σακχάρων από διάφορους μικροοργανισμούς. Η ζύμωση πραγματοποιείται στους 50 °C με προσθήκη διάφορων θρεπτικών υλών όπως αλβουμίνη και διάφορα ανόργανα άλατα (π.χ. ανθρακικό ασβέστιο, CaCO3). Το μόριο της γλυκόζης με τα έξι (6) άτομα άνθρακα διασπάται σε δύο (2) μόρια με τρία (3) άτομα άνθρακα το καθένα (γαλακτικό οξύ), κάτω από αναερόβιες συνθήκες[9].
Συνθετικά το γαλακτικό οξύ μπορεί να παρασκευασθεί με τις ακόλουθες μεθόδους:
Με υδρόλυση 2-αλoπροπανικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με υδρόλυση 2-αλοοπροπανικού οξέος από αραιό διάλυμα υδροξειδίου του νατρίου παράγεται γαλακτικό οξύ[10]:
Υδρόλυση 2-υδροξυπροπανονιτριλίου[Επεξεργασία | επεξεργασία κώδικα]
Με υδρόλυση 2-υδροξυπροπανονιτρίλιου παράγεται γαλακτικό οξύ[11]:
- To 2-υδροξυπροπανονιτρίλιο παράγεται εύκολα με προσθήκη υδροκυανίου σε αιθανάλη παράγεται γαλακτικό οξύ[12]:
Με αναγωγή οξοπροπανικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική υδρογόνωση οξοπροπανικού οξέος παράγεται γαλακτικό οξύ[13]
Με ενυδάτωση προπενικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση) σε προπενικό οξύ παράγεται γαλακτικό οξύ [14]:
Ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Το καθαρό (άνυδρο) γαλακτικό οξύ είναι στερεό, λευκό, άοσμο κρυσταλλικό σώμα που διαλύεται πολύ εύκολα στο νερό με το οποίο σχηματίζει ένα διαυγές έως υποκίτρινο υγρό. Είναι πολύ υγροσκοπικό (απορροφά υγρασία από την ατμόσφαιρα), γι' αυτό και στο εμπόριο διατίθεται ως διάλυμα σε νερό με περιεκτικότητα που κυμαίνεται από 22-90%.
Ανήκει στην οικογένεια των α-υδρόξυ καρβοξυλικών οξέων καθώς τόσο το υδροξύλιο όσο και το καρβοξύλιό του είναι ενωμένα με το ίδιο άτομο άνθρακα. Εξαιτίας αυτού του ασύμμετρου ατόμου άνθρακα, το γαλακτικό οξύ απαντά σε δύο οπτικούς αντίποδες (στέρεο-ισομερή) και σε ρακεμική μορφή ανάλογα με τη δομή που έχει στο χώρο η ένωση ή ανάλογα με το πως στρέφει το επίπεδο του πολωμένου φωτός. Έτσι υπάρχει το D(-)- γαλακτικό οξύ και το L(+)- γαλακτικό οξύ το οποίο είναι και το πιο σημαντικό από βιολογική σκοπιά. Στο εμπόριο συνήθως διατίθεται η ρακεμική του μορφή (D/L) η οποία είναι μείγμα των δύο παραπάνω ισομερών σε αναλογία 1 προς 1.
Βιολογική Σημασία[Επεξεργασία | επεξεργασία κώδικα]
Το γαλακτικό οξύ είναι γνωστό ότι σχηματίζεται στους μυς των ανθρώπων και των ζώων όταν εργάζονται, δηλαδή όταν οι απαιτήσεις του οργανισμού σε ενέργεια αυξάνονται.
Τα μυϊκά κύτταρα παράγουν έργο καταναλώνοντας τριφωσφορική αδενοσίνη (ATP). Η συγκεκριμένη ουσία παράγεται στα μιτοχόνδρια με την καύση της γλυκόζης και των λιπών και είναι εκείνη που κάνει τις μυϊκές ίνες να συστέλλονται. Η μετατροπή της γλυκόζης συντελείται σε δύο στάδια το αναερόβιο, που δεν απαιτεί οξυγόνο, και το αερόβιο. Το αερόβιο παράγει την μεγαλύτερη ποσότητα ATP και προσφέρει χάρη στην παρουσία του οξυγόνου τέλεια καύση με παράγωγα μόνο το διοξείδιο του άνθρακα και τη θερμότητα. Σε περίπτωση όμως έντονης εργασίας, κατά την οποία οι αυξημένες ανάγκες σε ενέργεια δεν καλύπτονται από τον αερόβιο μεταβολισμό, ενεργοποιείται ο αναερόβιος. Κατά τη διάρκεια αυτού του σταδίου παράγεται βιολογική ενέργεια με γλυκόλυση, κατά την οποία παράγεται ως παραπροϊόν πυροσταφυλικό οξύ και απομακρύνεται αντιδρώντας με το υδρογόνο και σχηματίζοντας γαλακτικό οξύ. Έτσι στον οργανισμό σχηματίζεται γαλακτικό οξύ, το οποίο έχει ως αποστολή του ν' απομακρύνει το υδρογόνο και να επιτρέψει έτσι στους μυς να συνεχίσουν το έργο τους, εφοδιάζοντας τον οργανισμό με επιπλέον ενέργεια. Από τους μυς το γαλακτικό οξύ περνά στο αίμα κι από κει στο ήπαρ. Όταν το επίπεδο του γαλακτικού οξέος ξεπερνά την ικανότητα της πέψης του οργανισμού, προκαλείται μυϊκή κόπωση και πόνος[15].
Εφαρμογή[Επεξεργασία | επεξεργασία κώδικα]
Το γαλακτικό οξύ και τα άλατά του χρησιμοποιούνται ως συντηρητικά (Ε270), κυρίως εναντίον των ζυμών και των μυκήτων, κάνει φιλικούς τους υδατάνθρακες του γιαουρτιού ακόμη και για όσους παρουσιάζουν δυσανεξία στο γάλα. Είναι αυτό που δίνει στο γιαούρτι τη χαρακτηριστική οσμή του και την υπόξινη γεύση του. Το σημαντικότερο όμως είναι ότι εμποδίζει την ανάπτυξη των παθογόνων μικροβίων μέσα στο γιαούρτι και το προστατεύει από επιμολύνσεις, στο διάστημα από την παραγωγή μέχρι την ημερομηνία λήξης του[16].
Επίσης χρησιμοποιείται στη βυρσοδεψία και τη βαφική, ως καταλύτης σε διάφορες χημικές διεργασίες, και ως πρώτη ύλη για την παραγωγή πλαστικών και διαλυτών. Δύο άτομα γαλακτικού οξέος μπορούν να αντιδράσουν δίνοντας μία κυκλική λακτόνη, η οποία στη συνέχεια με τη βοήθεια διάφορων καταλυτών πολυμερίζεται προς πολυγαλακτικό οξύ, ένας βιοδιασπώμενος πολυεστέρας με πολύτιμες θεραπευτικές ιδιότητες.
Κίνδυνοι για την υγεία[Επεξεργασία | επεξεργασία κώδικα]
Στο φυσικό γαλακτικό οξύ δεν έχουν βρεθεί παρενέργειες σε ενήλικες. Τα D - ή τα DL - άλατα του γαλακτικού οξέος (στερεοϊσομερή) δεν πρέπει να χορηγούνται σε βρέφη και μικρά παιδιά γιατί δεν έχουν αναπτύξει ακόμα τα απαραίτητα ένζυμα στο συκώτι για να μεταβολίσουν αυτές τις μορφές του γαλακτικού οξέος[17].
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημείας, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Πρότυπο:GESTIS
- ↑ Badet, C; Thebaud, NB (2008). "Ecology of Lactobacilli in the Oral Cavity: A Review of Literature". The open microbiology journal 2: 38–48. doi:10.2174/1874285800802010038. PMC 2593047. PMID 19088910.
- ↑ Nascimento, MM; Gordan, VV; Garvan, CW; Browngardt, CM; Burne, RA (2009). "Correlations of oral bacterial arginine and urea catabolism with caries experience". Oral microbiology and immunology 24 (2): 89–95. doi:10.1111/j.1399-302X.2008.00477.x. PMC 2742966. PMID 19239634.
- ↑ Aas, JA; Griffen, AL; Dardis, SR; Lee, AM; Olsen, I; Dewhirst, FE; Leys, EJ; Paster, BJ (2008). "Bacteria of Dental Caries in Primary and Permanent Teeth in Children and Young Adults". Journal of clinical microbiology 46 (4): 1407–17. doi:10.1128/JCM.01410-07. PMC 2292933. PMID 18216213.
- ↑ Caufield, PW; Li, Y; Dasanayake, A; Saxena, D (2007). "Diversity of Lactobacilli in the Oral Cavities of Young Women with Dental Caries". Caries Res. 41 (1): 2–8. doi:10.1159/000096099. PMC 2646165. PMID 17167253.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Ηλεκτρονική Εγκυκλοπαίδεια “Επιστήμη & Ζωή”
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ «Σελίδα από το περιοδικό FOCUS». Αρχειοθετήθηκε από το πρωτότυπο στις 5 Σεπτεμβρίου 2005. Ανακτήθηκε στις 15 Ιουλίου 2006.
- ↑ «Η σελίδα της ΦΑΓΕ και το γιαούρτι». Αρχειοθετήθηκε από το πρωτότυπο στις 30 Νοεμβρίου 2005. Ανακτήθηκε στις 15 Ιουλίου 2006.
- ↑ Μία σελίδα με πληροφορίες για τα πρόσθετα τροφίμων
| |||||||||||||||||||||||||||||||||||||||||||||||
|





