Νιτροαιθανικό οξύ
| Νιτροαιθανικό οξύ | |
|---|---|
| |
| Γενικά | |
| Όνομα IUPAC | Νιτροαιθανικό οξύ |
| Άλλες ονομασίες | Νιτροοξικό οξύ |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C2H3NO4 |
| Μοριακή μάζα | 105,05 amu |
| Σύντομος συντακτικός τύπος |
O2NCH2COOH |
| Αριθμός CAS | 625-75-2 |
| SMILES | CC(=O)([N+](=O)[O-])O |
| PubChem CID | 43581 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
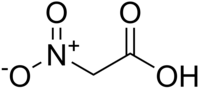
Το νιτροαιθανικό οξύ ή νιτροοξικό οξύ είναι ένα νιτροαλκανικό οξύ με σύντομο συντακτικό τύπο O2NCH2COOH. Οι κύριες χρήσεις του είναι ως καύσιμο σε ορισμένους αγώνες οχημάτων και ως αντιδραστήριο σε χημικές συνθέσεις.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με νίτρωση αλομεθανικών οξέων[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση νιτρώδους αργύρου (AgNO2) σε αλοαιθανικό οξύ (XCH2COOH) παράγεται νιτροαιθανικό οξύ[1]:
- Εναλλακτικά και με μικρότερη απόδοση μπορεί να χρησιμοποιηθεί ψυχρό και ελαφρά αλκαλικό διάλυμα νιτρώδους νατρίου (NaNO2):
Αν το διάλυμα του νιτρώδους νατρίου είναι περισσότερο αλκαλικό απ' ότι πρέπει, λαμβάνεται υδροξυαιθανικό νάτριο (HOCH2COONa):
Με οξείδωση γλυκίνης[Επεξεργασία | επεξεργασία κώδικα]
Με οξείδωση γλυκίνης με υπεροξείδιο του υδρογόνου (H2O2) ή υπεροξύ (RCO3H) παράγεται νιτροαιθανικό οξύ[2]:
ή
Με καρβοξυλίωση νιτρομεθυλαλαγονιδίων[Επεξεργασία | επεξεργασία κώδικα]
Με καρβοξυλίωση με διοξείδιο του άνθρακα (CO) νιτρομεθυλαλογονιδίων (O2NCH2X), μέσω αλομαγνησιακών ενώσεων (αντιδραστήρια Grignard) παράγεται νιτροαιθανικό οξύ[3]:
Με υδρόλυση νιτροαιθανονιτριλίου[Επεξεργασία | επεξεργασία κώδικα]
Με υδρόλυση νιτροαιθανονιτριλίου (O2NCH2CN) σε όξινο περιβάλλον παράγεται νιτροαιθανικό οξύ[4]:
Με οξείδωση 1,4-δινιτροβουτενίου-2, 2-νιτροαιθανόλης-1 ή νιτροαιθανάλης[Επεξεργασία | επεξεργασία κώδικα]
1. Με οξείδωση 1,4-δινιτροβουτενίου-2(O2NCH2CH=CHCH2NO2) παράγεται νιτροαιθανικό οξύ[5]:
2. Με οξείδωση 2-νιτροαιθανόλης (O2NCH2CH2OH) παράγεται νιτροαιθανικό οξύ[6]:
3. Με οξείδωση νιτροαιθανάλης (O2NCH2CHO) παράγεται νιτροαιθανικό οξύ[6]:
Από (νιτρομεθυλο)μηλονικό οξύ[Επεξεργασία | επεξεργασία κώδικα]
Από (νιτρομεθυλο)μηλονικό οξύ [HOOCCH(CH2NO2)COOH] παράγεται νιτροαιθανικό οξύ[7]:
Χημικές ιδιότητες και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
΄Οξινος χαρακτήρας και καρβονικά άλατα[Επεξεργασία | επεξεργασία κώδικα]
Το νιτροαιθανικό οξύ είναι ένα ασθενές μονοβασικό οξύ. Αντιδρά με ορισμένα μέταλλα και βάσεις σχηματίζοντας άλατα με σύγχρονη έκλυση υδρογόνου ή νερού αντίστοιχα:
(Αντίδραση διάστασης)
(Επίδραση μετάλλων ηλεκτροθετικότερων του υδρογόνου)
(Αντίδραση εξουδετέρωσης)
Αποκαρβοξυλίωση[Επεξεργασία | επεξεργασία κώδικα]
1. Με θέρμανση νιτροαιθανικού νατρίου παίρνουμε διοξείδιο του άνθρακα και νιτρομεθάνιο[8]::
2. Με ηλεκτρόλυση νιτροαιθανικού νατρίου (μέθοδος Kolbe), παράγονται διοξείδιο του άνθρακα και 1,2-δινιτροαιθάνιο[9]:
3. Με θέρμανση αλάτων του με ασβέστιο (ή βάριο) παράγεται 1,3-δινιτροπεοπανόνη[10]:
4. Με επίδραση βρωμίου σε νιτροαιθανικό άργυρο παράγεται νιτρομεθυλοβρωμίδιο - Αντίδραση Hunsdiecker[11]:
Αναγωγή[Επεξεργασία | επεξεργασία κώδικα]
1. Το νιτροαιθανικό οξύ ανάγεται με σίδηρο και υδροχλωρικό οξύ (HCl) προς γλυκίνη[12]:
2. Τo νιτροαιθανικό οξύ ανάγεται με λιθιοαργιλιοϋδρίδιο (LiAlH4) ή νατριοβοριοϋδρίδιο (NaBH4) προς 2-αμινοαιθανόλη[13]:
Οξείδωση[Επεξεργασία | επεξεργασία κώδικα]
Τo νιτροαιθανικό οξύ οξειδώνεται σε νιτροαιθανικό υπεροξύ από το υπεροξείδιο του υδρογόνου (H2O2), σε όξινο περιβάλλον[14]:
Εστεροποίηση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλκοολών παράγονται νιτροαιθανικοί εστέρες[15]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
1. Με επίδραση αλογόνων, πσρουσία ερυθρού φωσφόρου, παράγεται αλονιτροαιθανικό οξύ:
2. Με επίδραση αλογονωτικών μέσων παράγονται νιτροαιθανοϋλαλογονίδια[16]::
- α. Με SOCl2:
- β. Με PCl5:
- γ. Με PX3:
- Για το νιτροαιθανοϋλοφθορίδιο προτιμάται η υποκατάσταση σε νιτροαιθανοϋλοχλωρίδιο:
Επίδραση πυκνού θειικού ή υδροχλωρικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση πυκνού θειικού οξέος (H2SO4) ή πυκνού υδροχλωρικού οξέος (HCl) παράγεται αιθανοδιικό οξύ[17]::
Επίδραση καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση καρβενίων παράγεται ένα μίγμα προϊόντων. Π.χ. με μεθυλένιο έχουμε περίπου την παρακάτω στοιχειομετρική εξίσωση:
- Η παραπάνω στοιχειομετρική εξίσωση είναι άθροισμα κατά μέλη των ακόλουθων δράσεων:
- Παρεμβολή στους δύο (2) δεσμούς C2-H. Παράγεται 2-νιτροπροπανικό οξύ, ένα καρβονικό οξύ.
- Παρεμβολή στον ένα (1) δεσμό O-H. Παράγεται νιτροαιθανικός μεθυλεστέρας, ο μεθυλεστέρας του νιτροαιθανικού οξέος.
- Προσθήκη στον ένα (1) δεσμό C=O. Παράγεται 2-νιτρομεθυλο-2-υδροξυοξιράνιο, μια ετεροκυκλική αλκοόλη.
- Προσθήκη στον ένα (1) δεσμό N=O. Παράγεται N-καρβοξυμεθυλοαζα-2,4-διοξετιδίνη, ένα ετεροκυκλικό καρβονικό οξύ.
- Συνολικά δηλαδή πέντε (5) παράγωγα προϊόντα, που είναι πρακτικά ισοδύναμα (σ' αυτήν την περίπτωση) σε παραγωγή, εξαιτίας της μεγάλης δραστικότητας του μεθυλενίου, που ως δίριζα κάνει σχεδόν απόλυτα κινητικές (δηλαδή όχι εκλεκτικές) τις αντιδράσεις του.
Αναφορές και παρατηρήσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.244, §10.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.246, §10.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3α.
- ↑ 6,0 6,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 243, §10.2B2α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.247, §10.6.6.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
| |||||||||||||||||||||||||||||||||||||||||||||||



























![{\displaystyle \mathrm {O_{2}NCH_{2}COOH+H_{2}O{\xrightarrow[{\triangle }]{\pi .H_{2}SO_{4}\;{\acute {\eta }}\;\pi .HCl}}HOOCCOOH+NH_{2}OH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/413d1edcba7650cea266ddf8ae555c3c217eafa8)

