Προπιολικό οξύ
| Προπιολικό οξύ | |||
|---|---|---|---|
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Προπινικό οξύ | ||
| Άλλες ονομασίες | Προπιολικό οξύ | ||
| Χημικά αναγνωριστικά | |||
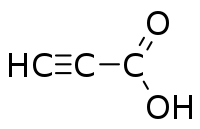
| Χημικός τύπος | C3H2O2 | ||
| Μοριακή μάζα | 70,05 amu | ||
| Σύντομος συντακτικός τύπος |
HC≡CCOOH | ||
| Αριθμός CAS | 471-25-0 | ||
| SMILES | C#CC(=O)O | ||
| Δομή | |||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 9°C | ||
| Σημείο βρασμού | 144°C (με διάσπαση) | ||
| Πυκνότητα | 1.132,5 kg/m³ | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
  
| |||
| Πολύ τοξικό (T+), εύφλεκτο (F) διαβρωτικό (C) | |||
| LD50 | 100 mg/kg | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το προπιολικό οξύ[1] (αγγλικά propynoic acid ή propiolic acid) είναι οργανική χημική ένωση, με μοριακό τύπο C3H2O2, αν και συνηθέστερα παριστάνεται με τον ημισυντακτικό τύπο HC≡CCO2H. Πιο συγκεκριμένα, αποτελεί το απλούστερο αλκινικό οξύ, δηλαδή αλειφατικό, ακόρεστο μονοκαρβοξυλικό οξύ με έναν τριπλό δεσμό. Δομικά, αποτελείται από μια αιθινυλική (HC≡C) απευθείας συνδεμένη με την τερματική καρβοξυλομάδα του (COOH). Το χημικά καθαρό προπιολικό οξύ, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο υγρό που κρυσταλλώνεται (με πήξη) δίνοντας μεταξοειδείς κρυστάλλους. Κοντά στην κανονική του θερμοκρασία βρασμού του διασπάται. Είναι διαλυτό στο νερό και έχει οσμή που μοιάζει με αυτήν του αιθανικού οξέος[2].
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Παράγεται για εμπορικούς σκοπούς με ηλεκτρολυτική οξείδωση προπαργυλικής αλκοόλης (HC≡CCH2OH), χρησιμοποιώντας μολύβδινο ηλεκτρόδιο[3]:
Εναλλακτικά, μπορεί να παραχθεί και με μερική αποκαρβοξυλίωση ακετυλενοδικαρβοξυλικού οξέος:
Χαρακτηριστικές αντιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Όταν εκτίθεται στο ηλιακό φως μετατρέπεται σε τριμεσικό οξύ (βενζο-1,3,5-τρικαρβοξυλικό οξύ):
Με επίδραση βρωμίου δίνει 2,3-διβρωμοπροπενικό οξύ:
Με υδροχλώριο σχηματίζει 2-χλωροπροπενικό οξύ:
Ο προπιολικός αιθυλεστέρας συμπυκνώνεται με υδραζίνη, σχηματίζοντας 3-πυραζολόνη:
Σχηματίζει χαρακτηριστικό εκρηκτικό στερεό με επίδρασή του σε υδατικό διάλυμα αμμωνίας και νιτρικού αργύρου. Ένα άμορφο και επίσης εκρηκτικό ίζημα σχηματίζεται και με υδατικό διάλυμα αμμωνίας και χλωριούχου χαλκού:
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
Aναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ ed, Susan Budavari, (1990). The Merck index an encyclopedia of chemicals, drugs, and biologicals (11. ed., 2. print. ed.). Rahway, NJ: Merck. pp. 7833,1911. ISBN 9780911910285.
- ↑ Wilhelm Riemenschneider “Carboxylic Acids, Aliphatic” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a05_235.
| |||||||||||||||||||||||||||||||||||||||||||||||

![{\displaystyle \mathrm {HC\equiv CCH_{2}OH+2|O|{\xrightarrow[{e^{-}}]{Pb}}HC\equiv CCO_{2}H+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/42a00cdcdd682b40989e897a30368abbc5979bbb)








