Αναστολέας ενζύμου

Ένας αναστολέας ενζύμου είναι ένα μόριο που δεσμεύεται σε ένα ένζυμο και εμποδίζει τη δραστικότητά του. Τα ένζυμα είναι πρωτεΐνες που επιταχύνουν τις απαραίτητες για τη ζωή χημικές αντιδράσεις, στις οποίες τα μόρια του υποστρώματος μετατρέπονται σε προϊόντα.[1] Ένα ένζυμο διευκολύνει μια συγκεκριμένη χημική αντίδραση δεσμεύοντας το υπόστρωμα στην ενεργή θέση του, μια εξειδικευμένη περιοχή στο ένζυμο που επιταχύνει το το πιο δύσκολο βήμα της αντίδρασης. Ένας αναστολέας ενζύμου σταματά ("αναστέλλει") αυτή τη διαδικασία, είτε δεσμεύοντας την ενεργή θέση του ενζύμου (που εμποδίζει έτσι τη δέσμευση του ίδιου του υποστρώματος), είτε δεσμεύοντας σε άλλη θέση του ενζύμου έτσι ώστε η κατάλυση του ενζύμου της αντίδρασης να παρεμποδίζεται. Οι αναστολείς ενζύμου μπορεί να δεσμεύονται αναστρέψιμα ή μη αναστρέψιμα. Οι μη αναστρέψιμοι αναστολείς σχηματίζουν ένα χημικός δεσμός με το ένζυμο έτσι ώστε το ένζυμο να αναστέλλεται μέχρι να σπάσει ο χημικός δεσμός. Αντίθετα, οι αναστρέψιμοι αναστολείς δεσμεύουν μη ομοιοπολικά και μπορεί να φύγουν αυθόρμητα από το ένζυμο, επιτρέποντας στο ένζυμο να επαναλάβει τη λειτουργία του. Οι αναστρέψιμοι αναστολείς παράγουν διαφορετικούς τύπους αναστολής ανάλογα με το εάν συνδέονται με το ένζυμο, το σύμπλεγμα ενζύμου-υποστρώματος ή και τα δύο. Οι αναστολείς ενζύμου παίζουν σημαντικό ρόλο σε όλα τα κύτταρα, καθώς είναι γενικά ειδικοί για ένα ένζυμο το καθένα και χρησιμεύουν για τον έλεγχο της δραστικότητας αυτού του ενζύμου. Για παράδειγμα, τα ένζυμα σε μια μεταβολική οδό μπορεί να αναστέλλονται από μόρια που παράγονται αργότερα στην οδό, περιορίζοντας έτσι την παραγωγή μορίων που δεν χρειάζονται πλέον. Αυτός ο τύπος αρνητικής ανατροφοδότησης είναι ένας σημαντικός τρόπος για να διατηρηθεί η ισορροπία σε ένα κύτταρο.[2] Οι αναστολείς ενζύμων ελέγχουν επίσης βασικά ένζυμα όπως πρωτεάσες ή νουκλεάσες που, εάν αφεθούν ανεξέλεγκτες, μπορεί να βλάψουν ένα κύτταρο. Πολλά δηλητήρια που παράγονται από ζώα ή φυτά είναι αναστολείς ενζύμων που εμποδίζουν τη δραστικότητα κρίσιμων ενζύμων στο θήραμα ή στους θηρευτές. Πολλά μόρια φαρμάκου είναι αναστολείς ενζύμου που αναστέλλουν ένα ανώμαλο ανθρώπινο ένζυμο, ή ένα ένζυμο κρίσιμο για την επιβίωση ενός παθογόνου όπως ένας ιός, βακτήριο ή παράσιτο . Τα παραδείγματα περιλαμβάνουν τη μεθοτρεξάτη (χρησιμοποιείται στη χημειοθεραπεία και στη θεραπεία της ρευματοειδούς αρθρίτιδας) και τους αναστολείς πρωτεάσης που χρησιμοποιούνται για τη θεραπεία του AIDS. Δεδομένου ότι οι αναστολείς αντιπαθογόνων στοχεύουν γενικά μόνο ένα ένζυμο, τέτοια φάρμακα είναι εξαιρετικά ειδικά και προκαλούν γενικά λίγες παρενέργειες στον άνθρωπο, υπό την προϋπόθεση ότι δεν υπάρχει ανάλογο ένζυμο στον άνθρωπο. (Αυτό συμβαίνει συχνά, αφού τέτοια παθογόνα και οι άνθρωποι είναι γενετικά απομακρυσμένοι). Οι αναστολείς φαρμακευτικών ενζύμων έχουν συχνά χαμηλές σταθερές διάστασης, που σημαίνει ότι απαιτείται μόνο μια μικρή ποσότητα του αναστολέα για την αναστολή του ενζύμου. Μια χαμηλή συγκέντρωση του αναστολέα του ενζύμου μειώνει τον κίνδυνο για το ήπαρ και νεφρική βλάβη και άλλες ανεπιθύμητες ενέργειες στους ανθρώπους. Ως εκ τούτου, η ανακάλυψη και η βελτίωση των αναστολέων ενζύμου είναι ένας ενεργός τομέας έρευνας στη βιοχημεία και τη φαρμακολογία.
Δομικές τάξεις
[Επεξεργασία | επεξεργασία κώδικα]Οι αναστολείς ενζύμων είναι ένα χημικά ποικίλο σύνολο ουσιών που κυμαίνονται σε μεγέθη από οργανικά μικρά μόρια έως μακρομοριακές πρωτεΐνες. Οι αναστολείς μικρών μορίων περιλαμβάνουν βασικούς πρωτογενείς μεταβολίτες που αναστέλλουν τα ανάντη ένζυμα που παράγουν αυτούς τους μεταβολίτες. Αυτό παρέχει έναν βρόχο αρνητικής ανάδρασης που εμποδίζει την υπερβολική παραγωγή μεταβολιτών και έτσι διατηρεί την κυτταρική ομοιόσταση (σταθερές εσωτερικές συνθήκες).[3][2] Οι μικρομοριακοί αναστολείς ενζύμων περιλαμβάνουν επίσης δευτερογενείς μεταβολίτες, που δεν είναι απαραίτητοι για τον οργανισμό που τους παράγει, αλλά παρέχουν στον οργανισμό ένα εξελικτικό πλεονέκτημα, καθώς μπορούν να χρησιμοποιηθούν για την απώθηση θηρευτών ή ανταγωνιστών οργανισμών ή την ακινητοποίηση του θηράματος.[4] Επιπλέον, πολλά φάρμακα είναι μικρομοριακοί αναστολείς ενζύμων που στοχεύουν είτε τα τροποποιητικά ένζυμα της νόσου στον ασθενή, [1]:5 ή ένζυμα σε παθογόνους μικροοργανισμούς που απαιτούνται για την ανάπτυξη και την αναπαραγωγή του παθογόνου.[5] Εκτός από τα μικρά μόρια, ορισμένες πρωτεΐνες δρουν ως αναστολείς ενζύμων. Το πιο χαρακτηριστικό παράδειγμα είναι οι αναστολείς σερινοπρωτεασών (σερπίνες) (serine protease inhibitors serpins) που παράγονται από ζώα για προστασία από ακατάλληλη ενεργοποίηση ενζύμων και από φυτά για την πρόληψη της θήρευσης.[6] Μια άλλη κατηγορία αναστολέων πρωτεϊνών είναι οι αναστολείς ριβονουκλεάσης, οι οποίες συνδέονται με τη ριβονουκλεάση σε μία από τις πιο γνωστές στενές αλληλεπιδράσεις πρωτεΐνης-πρωτεΐνης.[7] Μια ειδική περίπτωση αναστολέων πρωτεϊνικών ενζύμων είναι τα ζυμογόνα (zymogens) που περιέχουν ένα αυτοανασταλτικό πεπτίδιο με αμινοτελικό άκρο που συνδέεται με την ενεργή θέση του ενζύμου που ενδομοριακά εμποδίζει τη δραστηριότητά του ως προστατευτικός μηχανισμός ενάντια στην ανεξέλεγκτη κατάλυση. Το Ν‑άκρο του πεπτιδίου διασπάται (διαχωρίζεται) από το πρόδρομο του ενζύμου ζυμογόνου από άλλο ένζυμο για να απελευθερώσει ένα ενεργό ένζυμο.[8] Η θέση δέσμευσης των αναστολέων στα ένζυμα είναι συνήθως η ίδια θέση που δεσμεύει το υπόστρωμα (χημεία) του ενζύμου. Αυτοί οι αναστολείς ενεργού τόπου είναι γνωστοί ως ορθοστερικοί ("κανονικού" προσανατολισμού) αναστολείς.[9] Ο μηχανισμός της ορθοστερικής αναστολής είναι απλώς η αποτροπή της δέσμευσης του υποστρώματος στο ένζυμο μέσω άμεσου ανταγωνισμού, ο οποίος με τη σειρά του εμποδίζει το ένζυμο να καταλύει τη μετατροπή των υποστρωμάτων σε προϊόντα. Εναλλακτικά, ο αναστολέας μπορεί να συνδεθεί σε μια θέση απομακρυσμένη από την ενεργό θέση του ενζύμου. Αυτοί είναι γνωστοί ως αλλοστερικοί αναστολείς ("εναλλακτικός" προσανατολισμός).[9] Οι μηχανισμοί της αλλοστερικής αναστολής ποικίλλουν και περιλαμβάνουν την αλλαγή της διαμόρφωσης (σχήματος) του ενζύμου, έτσι ώστε να μην μπορεί πλέον να δεσμεύει το υπόστρωμα (κινητικά απαράλλακτος από την ανταγωνιστική ορθοστερική αναστολή),[10] ή εναλλακτικά σταθεροποίηση της δέσμευσης του υποστρώματος με το ένζυμο, αλλά κλείδωμα του ενζύμου σε μια διαμόρφωση που δεν είναι πλέον καταλυτικά ενεργή.[11]
Αναστρέψιμοι αναστολείς
[Επεξεργασία | επεξεργασία κώδικα]Οι αναστρέψιμοι αναστολείς προσκολλώνται σε ένζυμα με μη ομοιοπολικές αλληλεπιδράσεις όπως δεσμοί υδρογόνου, υδροφοβικές αλληλεπιδράσεις και ετεροπολικοί δεσμοί.[12] Πολλαπλοί ασθενείς δεσμοί μεταξύ του αναστολέα και της ενεργής θέσης του ενζύμου συνδυάζονται για να παράγουν ισχυρή και ειδική δέσμευση. Σε αντίθεση με τους μη αναστρέψιμους αναστολείς, οι αναστρέψιμοι αναστολείς δεν υφίστανται γενικά χημικές αντιδράσεις όταν συνδέονται με το ένζυμο και μπορούν εύκολα να αφαιρεθούν με αραίωση ή αιμοκάθαρση. Μια ειδική περίπτωση είναι οι ομοιοπολικοί αναστρέψιμοι αναστολείς που σχηματίζουν χημικό δεσμό με το ένζυμο, αλλά ο δεσμός μπορεί να διασπαστεί, ώστε η αναστολή να είναι πλήρως αναστρέψιμη.[13] Οι αναστρέψιμοι αναστολείς κατηγοριοποιούνται γενικά σε τέσσερις τύπους, όπως εισήχθησαν από τον Wallace Cleland το 1963.[14] Ταξινομούνται σύμφωνα με την επίδραση του αναστολέα στο Vmax (μέγιστος ρυθμός αντίδρασης που καταλύεται από το ένζυμο) και Km (η συγκέντρωση του υποστρώματος με αποτέλεσμα τη μισή μέγιστη ενζυμική δραστηριότητα) καθώς η συγκέντρωση του υποστρώματος του ενζύμου ποικίλλει.[15][16]
Συναγωνιστική
[Επεξεργασία | επεξεργασία κώδικα]Στη συναγωνιστική αναστολή το υπόστρωμα και ο αναστολέας δεν μπορούν να συνδεθούν με το ένζυμο ταυτόχρονα.[17]:134 Αυτό προκύπτει συνήθως από το ότι ο αναστολέας έχει μια συγγένεια για την ενεργή θέση ενός ενζύμου όπου δεσμεύεται επίσης το υπόστρωμα. Το υπόστρωμα και ο αναστολέας συναγωνίζονται για πρόσβαση στην ενεργή θέση του ενζύμου. Αυτός ο τύπος αναστολής μπορεί να ξεπεραστεί με επαρκώς υψηλές συγκεντρώσεις υποστρώματος (το Vmax παραμένει σταθερό), δηλ. υπερνικώντας τον αναστολέα.[17]:134–135 Ωστόσο, το φαινομενικό Km θα αυξηθεί καθώς χρειάζεται μεγαλύτερη συγκέντρωση του υποστρώματος για να φτάσει στο σημείο Km ή το μισό του 'Vmax'. Οι συναγωνιστικοί αναστολείς είναι συχνά παρόμοιοι στη δομή με το πραγματικό υπόστρωμα παραδείγματος χάρη μεθοτρεξάτη και φυλλικό οξύ στην ενότητα.[17]:134
Ανταγωνιστική (ή Ασυναγώνιστη) (Uncompetitive)
[Επεξεργασία | επεξεργασία κώδικα]Στην ανταγωνιστική (ασυναγώνιστη) αναστολή ο αναστολέας δεσμεύεται μόνο στο σύμπλεγμα ενζύμου-υποστρώματος.[17]:139 Αυτός ο τύπος αναστολής προκαλεί μείωση του Vmax (η μέγιστη ταχύτητα μειώνεται ως αποτέλεσμα της αφαίρεσης του ενεργοποιημένου συμπλέγματος) και του Km (λόγω της καλύτερης αποτελεσματικότητας δέσμευσης ως αποτέλεσμα της αρχής του Λε Σατελιέ και την αποτελεσματική εξάλειψη του συμπλέγματος ES μειώνοντας έτσι το Km που υποδηλώνει υψηλότερη συγγένεια δέσμευσης).[18] Η ανταγωνιστική αναστολή είναι σπάνια.[17]:139[19]
Μη συναγωνιστική (Non-competitive)
[Επεξεργασία | επεξεργασία κώδικα]Στη μη συναγωνιστική αναστολή η δέσμευση του αναστολέα με το ένζυμο μειώνει τη ενζυμική δραστικότητά του, αλλά δεν επηρεάζει τη δέσμευση του υποστρώματος.[16] Αυτός ο τύπος αναστολέα συνδέεται με ίση συγγένεια με το ελεύθερο ένζυμο όπως και με το σύμπλοκο ενζύμου-υποστρώματος. Μπορεί να θεωρηθεί ότι έχει την ικανότητα συναγωνιστικών και μη συναγωνιστικών αναστολέων, αλλά χωρίς προτίμηση σε κανέναν τύπο. Ως αποτέλεσμα, η έκταση της αναστολής εξαρτάται μόνο από τη συγκέντρωση του αναστολέα. Το Vmax θα μειωθεί λόγω της αδυναμίας της αντίδρασης να προχωρήσει εξίσου αποτελεσματικά, αλλά το Km θα παραμείνει το ίδιο με την ενεργή δέσμευση του υποστρώματος, εξ ορισμού, καθώς θα εξακολουθεί να λειτουργεί σωστά.[20]
Μικτή
[Επεξεργασία | επεξεργασία κώδικα]Στην μικτή αναστολή ο αναστολέας μπορεί να συνδεθεί με το ένζυμο είτε το υπόστρωμα έχει ήδη δεσμευτεί είτε όχι. Ως εκ τούτου, η μικτή αναστολή είναι ένας συνδυασμός συναγωνιστικής και ασυναγώνιστης (ανταγωνιστικής) αναστολής.[16] Επιπλέον, η συγγένεια του αναστολέα για το ελεύθερο ένζυμο και το σύμπλοκο ενζύμου-υποστρώματος μπορεί να διαφέρει.[17]:136–139 Με την αύξηση των συγκεντρώσεων του υποστρώματος [S], αυτός ο τύπος αναστολής μπορεί να μειωθεί (λόγω της συναγωνιστικής συνεισφοράς), αλλά όχι να ξεπεραστεί πλήρως (λόγω του μη συναγωνιστικού συστατικού).[21]:381–382 Αν και είναι δυνατό για αναστολείς μικτού τύπου να δεσμεύονται στη δραστική θέση, αυτός ο τύπος αναστολής προκύπτει γενικά από ένα αλλοστερικό αποτέλεσμα όπου ο αναστολέας δεσμεύεται σε διαφορετική θέση σε ένα ένζυμο. Η δέσμευση του αναστολέα σε αυτήν την αλλοστερική θέση αλλάζει τη διαμόρφωση (δηλαδή την τριτογενή δομή ή το τρισδιάστατο σχήμα) του ενζύμου, έτσι ώστε η συγγένεια του υποστρώματος για την ενεργή θέση να μειώνεται.[22] Αυτοί οι τέσσερις τύποι αναστολής μπορούν επίσης να διακριθούν από την επίδραση της αύξησης της συγκέντρωσης του υποστρώματος [S] στον βαθμό αναστολής που προκαλείται από μια δεδομένη ποσότητα αναστολέα. Για συναγωνιστική αναστολή ο βαθμός αναστολής μειώνεται αυξάνοντας το [S], για μη συναγωνιστική αναστολή ο βαθμός αναστολής παραμένει αμετάβλητος και για ανταγωνιστική (αποκαλούμενη επίσης αντισυναγωνιστική) αναστολή ο βαθμός αναστολής αυξάνεται με το [S].[23]
Ποσοτική περιγραφή
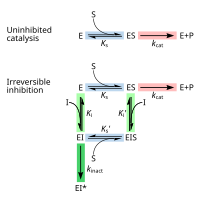
[Επεξεργασία | επεξεργασία κώδικα]Η αναστρέψιμη αναστολή μπορεί να περιγραφεί ποσοτικά ως προς τη σύνδεση του αναστολέα στο ένζυμο και στο σύμπλεγμα ενζύμου-υποστρώματος, καθώς και τις επιδράσεις του στις κινητικές σταθερές του ενζύμου.[24]:6 Στο κλασικό σχήμα κινητικής Michaelis-Menten (που φαίνεται στο διάγραμμα "σχηματικός μηχανισμός αναστολής"), ένα ένζυμο (Ε) συνδέεται με το υπόστρωμά του (S) για να σχηματίσει το σύμπλοκο ενζύμου-υποστρώματος ES. Κατά την κατάλυση, αυτό το σύμπλοκο διασπάται για να απελευθερώσει το προϊόν P και το ελεύθερο ένζυμο.[24]:55 Ο αναστολέας (I) μπορεί να συνδεθεί είτε στο E είτε στο ES με τις σταθερές διάστασης Ki ή Ki', αντίστοιχα.[24]:87
- Οι συναγωνιστικοί αναστολείς μπορούν να συνδεθούν με το E, αλλά όχι με το ES. Η συναγωνιστική αναστολή αυξάνει το Km (δηλαδή, ο αναστολέας παρεμβαίνει στη δέσμευση του υποστρώματος), αλλά δεν επηρεάζει το Vmax (ο αναστολέας δεν εμποδίζει κατάλυση σε ES επειδή δεν μπορεί να συνδεθεί με ES).[24]:102
- Ασυναγώνιστοι (ανταγωνιστικοί) αναστολείς δεσμεύονται στο ES. Η ανταγωνιστική αναστολή μειώνει τόσο το Km όσο και το Vmax. Ο αναστολέας επηρεάζει τη σύνδεση του υποστρώματος αυξάνοντας τη συγγένεια του ενζύμου για το υπόστρωμα (μειώνοντας το Km) καθώς και παρεμποδίζοντας την κατάλυση (μειώνει το Vmax).[24]:106
- Οι μη συναγωνιστικοί αναστολείς έχουν ταυτόσημες συγγένειες για το E και το ES (Ki = Ki'). Η μη συναγωνιστική αναστολή δεν αλλάζει το Km (δηλαδή, δεν επηρεάζει τη δέσμευση του υποστρώματος), αλλά μειώνει το Vmax (δηλαδή, η δέσμευση αναστολέα εμποδίζει την κατάλυση).[24]:97
- Οι αναστολείς μικτού τύπου δεσμεύονται τόσο στο E όσο και στο ES, αλλά οι συγγένειές τους για αυτές τις δύο μορφές του ενζύμου είναι διαφορετικές (Ki ≠ Ki'). Έτσι, οι αναστολείς μικτού τύπου επηρεάζουν τη δέσμευση του υποστρώματος (αύξηση ή μείωση Km) και παρεμποδίζουν την κατάλυση στο σύμπλεγμα ES (μείωση Vmax) .[25]:63–64
Όταν ένα ένζυμο έχει πολλαπλά υποστρώματα, οι αναστολείς μπορούν να εμφανίσουν διαφορετικούς τύπους αναστολής ανάλογα με το υπόστρωμα που λαμβάνεται υπόψη. Αυτό προκύπτει από το γεγονός ότι η ενεργή θέση περιέχει δύο διαφορετικές θέσεις δέσμευσης εντός της ενεργού θέσης, μία για κάθε υπόστρωμα. Για παράδειγμα, ένας αναστολέας μπορεί να συναγωνίζεται το υπόστρωμα Α για την πρώτη θέση δέσμευσης, αλλά να είναι ένας μη συναγωνιστικός αναστολέας σε σχέση με το υπόστρωμα Β στη δεύτερη θέση δέσμευσης.[26] Παραδοσιακά, οι αναστρέψιμοι αναστολείς ενζύμων έχουν ταξινομηθεί ως συναγωνιστικοί, ασυναγώνιστοι (ανταγωνιστικοί), ή μη συναγωνιστικοί, σύμφωνα με τις επιδράσεις τους στα Km και Vmax.[14] Αυτοί οι τρεις τύποι αναστολής προκύπτουν αντίστοιχα από τη δέσμευση του αναστολέα μόνο στο ένζυμο Ε απουσία υποστρώματος S, στο σύμπλεγμα ενζύμου-υποστρώματος ES ή και στα δύο. Η διαίρεση αυτών των κλάσεων προκύπτει από ένα πρόβλημα στην παραγωγή τους και έχει ως αποτέλεσμα την ανάγκη χρήσης δύο διαφορετικών σταθερών δέσμευσης για ένα συμβάν δέσμευσης.[27] Θεωρείται περαιτέρω ότι η δέσμευση του αναστολέα στο ένζυμο έχει ως αποτέλεσμα 100% αναστολή και αποτυγχάνει να εξετάσει την πιθανότητα μερικής αναστολής.[27] Η κοινή μορφή του ανασταλτικού όρου συσκοτίζει επίσης τη σχέση μεταξύ της δέσμευσης του αναστολέα στο ένζυμο και της σχέσης του με οποιονδήποτε άλλο όρο δέσμευσης, είτε είναι η εξίσωση Michaelis-Menten, είτε μια καμπύλη απόκρισης δόσης που σχετίζεται με τη δέσμευση υποδοχέα συνδέτη. Για να αποδειχθεί η σχέση μπορεί να γίνει η ακόλουθη αναδιάταξη:[28]:
Αυτή η αναδιάταξη δείχνει ότι, παρόμοια με την εξίσωση Michaelis-Menten, ο μέγιστος ρυθμός αντίδρασης εξαρτάται από την αναλογία του πληθυσμού του ενζύμου που αλληλεπιδρά με το υπόστρωμά του. κλάσμα του πληθυσμού των ενζύμων που δεσμεύεται από το υπόστρωμα
κλάσμα του πληθυσμού των ενζύμων που δεσμεύεται από αναστολέα
η επίδραση του αναστολέα είναι αποτέλεσμα του ποσοστού του πληθυσμού των ενζύμων που αλληλεπιδρά με τον αναστολέα. Το μόνο πρόβλημα με αυτήν την εξίσωση στην παρούσα μορφή της είναι ότι προϋποθέτει την απόλυτη αναστολή του ενζύμου με δέσμευση του αναστολέα, ενώ στην πραγματικότητα μπορεί να υπάρχει ένα ευρύ φάσμα επιδράσεων οπουδήποτε από 100% αναστολή της αναστροφής του υποστρώματος έως μη αναστολή. Για να εξηγηθεί αυτό, η εξίσωση μπορεί εύκολα να τροποποιηθεί ώστε να επιτρέπει διαφορετικούς βαθμούς αναστολής, συμπεριλαμβάνοντας έναν όρο δέλτα Vmax.[29]:361
ή
Αυτός ο όρος μπορεί στη συνέχεια να ορίσει την υπολειπόμενη ενζυματική δραστηριότητα που υπάρχει όταν ο αναστολέας αλληλεπιδρά με μεμονωμένα ένζυμα στον πληθυσμό. Ωστόσο, η συμπερίληψη αυτού του όρου έχει την προστιθέμενη αξία ότι επιτρέπει τη δυνατότητα ενεργοποίησης εάν ο δευτερεύων όρος Vmax αποδειχθεί υψηλότερος από τον αρχικό όρο. Για να ληφθεί υπόψη και η πιθανή ενεργοποίηση, η σημείωση μπορεί στη συνέχεια να ξαναγραφεί αντικαθιστώντας τον αναστολέα "I" με έναν τροποποιητικό όρο (διεγέρτης ή αναστολέας) που δηλώνεται εδώ ως "Χ".[28]:eq 13
Ενώ αυτή η ορολογία οδηγεί σε έναν απλοποιημένο τρόπο αντιμετώπισης των κινητικών επιδράσεων που σχετίζονται με τη μέγιστη ταχύτητα της εξίσωσης Michaelis–Menten, επισημαίνει πιθανά προβλήματα με τον όρο που χρησιμοποιείται για την περιγραφή των επιδράσεων που σχετίζονται με το Km. Το Km που σχετίζεται με τη συγγένεια του ενζύμου για το υπόστρωμα θα πρέπει στις περισσότερες περιπτώσεις να σχετίζεται με πιθανές αλλαγές στη θέση δέσμευσης του ενζύμου που θα προκύψουν άμεσα από τις αλληλεπιδράσεις του αναστολέα του ενζύμου. Ως εκ τούτου, ένας όρος παρόμοιος με τον όρο δέλτα Vmax που προτείνεται παραπάνω για τη διαμόρφωση του Vmax θα πρέπει να είναι κατάλληλος στις περισσότερες περιπτώσεις:[28]:eq 14
Σταθερές διάστασης
[Επεξεργασία | επεξεργασία κώδικα]![2Δ διαγράμματα συγκέντρωσης 1/[S] (άξονας x) και 1/V (άξονας y) που δείχνουν ότι καθώς η συγκέντρωση του αναστολέα αλλάζει, οι συναγωνιστικές γραμμές του αναστολέα τέμνονται σε ένα μόνο σημείο στον άξονα y, οι μη συναγωνιστικοί αναστολείς τέμνονται στον άξονα x και οι μικτοί αναστολείς τέμνουν ένα σημείο που δεν βρίσκεται σε κανέναν άξονα](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Inhibition_diagrams-1-.png/220px-Inhibition_diagrams-1-.png)
Ένας αναστολέας ενζύμου χαρακτηρίζεται από τη σταθερά διάστασης Ki, τη συγκέντρωση στην οποία ο αναστολέας καταλαμβάνει το ένζυμο κατά το ήμισυ. Σε μη συναγωνιστική αναστολή, ο αναστολέας μπορεί επίσης να συνδεθεί με το σύμπλεγμα ενζύμου-υποστρώματος και η παρουσία δεσμευμένου υποστρώματος μπορεί να αλλάξει τη συγγένεια του αναστολέα για το ένζυμο, με αποτέλεσμα μια δεύτερη σταθερά διάστασης Ki'. Ως εκ τούτου, τα Ki και Ki' είναι οι σταθερές διάστασης του αναστολέα για το ένζυμο και για το σύμπλοκο ενζύμου-υποστρώματος, αντίστοιχα.[30] Η σταθερά ενζύμου-αναστολέα Ki μπορεί να μετρηθεί απευθείας με διάφορες μεθόδους. Μια ιδιαίτερα ακριβής μέθοδος είναι η θερμιδομετρία ισοθερμικής τιτλοδότησης (isothermal titration calorimetry), στην οποία ο αναστολέας τιτλοδοτείται σε διάλυμα ενζύμου και μετράται η θερμότητα που απελευθερώνεται ή απορροφάται.[31] Ωστόσο, η άλλη σταθερά διάστασης Ki' είναι δύσκολο να μετρηθεί άμεσα, καθώς το σύμπλεγμα ενζύμου-υποστρώματος είναι βραχύβιο και υφίσταται χημική αντίδραση για να σχηματιστεί το προϊόν. Ως εκ τούτου, το Ki' συνήθως μετριέται έμμεσα, παρατηρώντας την ενζυμική δραστικότητα κάτω από διάφορες συγκεντρώσεις υποστρώματος και αναστολέα και προσαρμόζοντας τα δεδομένα μέσω μη γραμμικής παλινδρόμησης[32] σε μια τροποποιημένη εξίσωση Michaelis–Menten.[21]
όπου οι τροποποιητικοί παράγοντες α και α' ορίζονται από τη συγκέντρωση του αναστολέα και τις δύο σταθερές διάστασής του
Έτσι, παρουσία του αναστολέα, τα αποτελεσματικά Km και Vmax του ενζύμου γίνονται (α/α')Km και (1/α')Vmax, αντίστοιχα. Ωστόσο, η τροποποιημένη εξίσωση Michaelis-Menten υποθέτει ότι η δέσμευση του αναστολέα με το ένζυμο έχει φτάσει σε ισορροπία, κάτι που μπορεί να είναι μια πολύ αργή διαδικασία για αναστολείς με υπονανομοριακές σταθερές διάστασης. Σε αυτές τις περιπτώσεις η αναστολή γίνεται αποτελεσματικά μη αναστρέψιμη, επομένως είναι πιο πρακτικό να αντιμετωπίζονται τέτοιοι αναστολείς στενής δέσμευσης ως μη αναστρέψιμοι. Οι επιδράσεις διαφορετικών τύπων αναστρέψιμων ενζυμικών αναστολέων στην ενζυματική δραστηριότητα μπορούν να απεικονιστούν χρησιμοποιώντας γραφικές αναπαραστάσεις της εξίσωσης Michaelis–Menten, όπως τα διαγράμματα Lineweaver–Burk, Eadie-Hofstee ή Hanes-Woolf.[17]:140–144 Μια απεικόνιση παρέχεται από τα τρία διαγράμματα Lineweaver-Burk που απεικονίζονται στο σχήμα Διαγράμματα Lineweaver-Burk. Στο επάνω διάγραμμα οι γραμμές συναγωνιστικής αναστολής τέμνονται στον άξονα y, δείχνοντας ότι τέτοιοι αναστολείς δεν επηρεάζουν το Vmax. Στο κάτω διάγραμμα οι μη συναγωνιστικές γραμμές αναστολής τέμνονται στον άξονα x, δείχνοντας ότι αυτοί οι αναστολείς δεν επηρεάζουν το Km. Ωστόσο, δεδομένου ότι μπορεί να είναι δύσκολο να υπολογιστούν με ακρίβεια τα Ki και Ki' από τέτοια γραφήματα,[33] είναι σκόπιμο να εκτιμηθούν αυτές οι σταθερές χρησιμοποιώντας πιο αξιόπιστες μεθόδους μη γραμμικής παλινδρόμησης.[33]
Ειδικές περιπτώσεις
[Επεξεργασία | επεξεργασία κώδικα]Μερικώς συναγωνιστικοί αναστολείς
[Επεξεργασία | επεξεργασία κώδικα]Ο μηχανισμός της μερικής συναγωνιστικής αναστολής είναι παρόμοιος με αυτόν της μη συναγωνιστικής, με τη διαφορά ότι το σύμπλεγμα EIS έχει καταλυτική δραστικότητα, η οποία μπορεί να είναι χαμηλότερη ή και υψηλότερη (μερικώς συναγωνιστική ενεργοποίηση) από αυτή του συμπλόκου ενζύμου-υποστρώματος (ES). Αυτή η αναστολή εμφανίζει συνήθως μια χαμηλότερη τιμή Vmax, αλλά μια ανεπηρέαστη τιμή Km.[18]
Υπόστρωμα ή προϊόν
[Επεξεργασία | επεξεργασία κώδικα]Η αναστολή υποστρώματος ή προϊόντος είναι εκεί όπου είτε ένα υπόστρωμα ενζύμων, είτε ένα προϊόν ενεργεί επίσης ως αναστολέας. Αυτή η αναστολή μπορεί να ακολουθεί συναγωνιστικά, μη συναγωνιστικά ή μικτά πρότυπα. Στην αναστολή του υποστρώματος υπάρχει μια προοδευτική μείωση της δραστικότητας σε υψηλές συγκεντρώσεις υποστρώματος, πιθανώς από ένα ένζυμο που έχει δύο συναγωνιστικές θέσεις δέσμευσης υποστρώματος. Σε χαμηλό υπόστρωμα, η θέση υψηλής συγγένειας καταλαμβάνεται και ακολουθείται η κανονική κινητική. Ωστόσο, σε υψηλότερες συγκεντρώσεις, η δεύτερη ανασταλτική θέση καταλαμβάνεται, αναστέλλοντας το ένζυμο.[34] Η αναστολή προϊόντος (είτε το προϊόν του ίδιου του ενζύμου, είτε ένα προϊόν σε ένα ένζυμο κατάντη στη μεταβολική του οδό) είναι συχνά ένα ρυθμιστικό χαρακτηριστικό στον μεταβολισμό και μπορεί να είναι μια μορφή αρνητικής ανάδρασης.[2]
Αργός-Σφιχτός
[Επεξεργασία | επεξεργασία κώδικα]Η αργή-σφιχτή αναστολή συμβαίνει όταν το αρχικό σύμπλεγμα ενζύμου-αναστολέα ΕΙ υφίσταται διαμορφωτική ισομέρεια (αλλαγή σχήματος) σε ένα δεύτερο πιο σφιχτά συγκρατημένο σύμπλοκο, το ΕΙ*, αλλά η συνολική διαδικασία αναστολής είναι αναστρέψιμη. Αυτό εκδηλώνεται ως αργά αυξανόμενη αναστολή ενζύμου. Υπό αυτές τις συνθήκες, η παραδοσιακή κινητική Michaelis–Menten δίνει μια ψευδή τιμή για το Ki, η οποία εξαρτάται από το χρόνο. Η πραγματική τιμή του Ki μπορεί να ληφθεί μέσω πιο περίπλοκης ανάλυσης των σταθερών ρυθμού on (kon) και του off (k off) για συσχέτιση αναστολέα με κινητικές παρόμοιες με μη αναστρέψιμη αναστολή.[17]:168
Ανάλογα πολλαπλών υποστρωμάτων
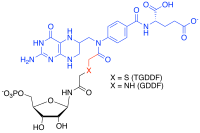
[Επεξεργασία | επεξεργασία κώδικα]Οι αναστολείς αναλόγων πολλαπλών υποστρωμάτων είναι εκλεκτικοί αναστολείς υψηλής συγγένειας που μπορούν να παρασκευαστούν για ένζυμα που καταλύουν αντιδράσεις με περισσότερα από ένα υπόστρωμα δεσμεύοντας την ενέργεια δέσμευσης καθενός από αυτά τα υποστρώματα σε ένα μόριο.[35][36] Για παράδειγμα, στις αντιδράσεις μεταφοράς φορμυλίου στη βιοσύνθεση πουρίνης, παρασκευάστηκε συνθετικά ένας ισχυρός αναστολέας προσθήκης πολλαπλών υποστρωμάτων (Multi-substrate Adduct Inhibitor, MAI) στο ριβονουκλεοτίδιο γλυκιναμιδίου (GAR) της φωσφοριβοσυλγλυκιναμιδικής φορμυλμεταφοράσης (TFase) που συνδέει ανάλογα του υποστρώματος GAR και του Ν-10-φορμυλτετραϋδροφολικού συμπαράγοντα για την παραγωγή διδεαζαφολικού ριβονουκλεοτιδίου του θειογλυκιναμιδίου (thioglycinamide ribonucleotide dideazafolate, TGDDF),[37] ή ενζυματικά από το φυσικό υπόστρωμα GAR για να δώσει GDDF.[38] Εδώ η υπονανομοριακή σταθερά διάστασης (KD) του TGDDF ήταν μεγαλύτερη από ό,τι προβλεπόταν πιθανώς λόγω των εντροπικών πλεονεκτημάτων που αποκτήθηκαν και/ή των θετικών αλληλεπιδράσεων που αποκτήθηκαν μέσω των ατόμων που συνδέουν τα συστατικά. Τα MAI έχουν επίσης παρατηρηθεί ότι παράγονται σε κύτταρα από αντιδράσεις προφαρμάκων όπως ισονιαζίδη,[39] ή συνδέτες αναστολέα ενζύμου (για παράδειγμα, PTC124)[40] με κυτταρικούς συμπαράγοντες όπως το δινουκλεοτίδιο νικοτιναμίδης αδενίνης (NADH) και η τριφωσφορική αδενοσίνη (ATP) αντίστοιχα.[41]
Παραδείγματα
[Επεξεργασία | επεξεργασία κώδικα]Καθώς τα ένζυμα έχουν εξελιχθεί για να δεσμεύουν τα υποστρώματά τους σφιχτά, και οι περισσότεροι αναστρέψιμοι αναστολείς συνδέονται στην ενεργό θέση των ενζύμων, δεν προκαλεί έκπληξη το γεγονός ότι ορισμένοι από αυτούς τους αναστολείς είναι εντυπωσιακά παρόμοια στη δομή με τα υποστρώματα των στόχων τους. Οι αναστολείς της διυδροφολικής αναγωγάσης (dihydrofolate reductase, DHFR) είναι εξέχοντα παραδείγματα.[42] Άλλα παραδείγματα αυτών των μιμητών υποστρώματος είναι οι αναστολείς πρωτεάσης, μια θεραπευτικά αποτελεσματική κατηγορία αντιρετροϊκών φαρμάκων που χρησιμοποιούνται για τη θεραπεία του AIDS.[43][44] Η δομή της ριτοναβίρης, ενός πεπτιδομιμητικού αναστολέα πρωτεάσης που περιέχει τρεις πεπτιδικούς δεσμούς, όπως φαίνεται στην παραπάνω εικόνα "συναγωνιστικής αναστολής". Καθώς αυτό το φάρμακο μοιάζει με το πεπτίδιο που είναι το υπόστρωμα της πρωτεάσης HIV, ανταγωνίζεται το υπόστρωμα στην ενεργό θέση του ενζύμου.[45] Οι αναστολείς ενζύμου είναι συχνά σχεδιασμένοι να μιμούνται την μεταβατική κατάσταση ή το ενδιάμεσο μιας αντίδρασης που καταλύεται από ένζυμα.[46] Αυτό διασφαλίζει ότι ο αναστολέας εκμεταλλεύεται το αποτέλεσμα σταθεροποίησης της μεταβατικής κατάστασης του ενζύμου, με συνέπεια την καλύτερη συγγένεια δέσμευσης (χαμηλότερη Ki) από τα σχέδια που βασίζονται στο υπόστρωμα. Ένα παράδειγμα τέτοιου αναστολέα μεταβατικής κατάστασης είναι το αντιικό φάρμακο οσελταμιβίρη. Αυτό το φάρμακο μιμείται την επίπεδη φύση του δακτυλίου του ιόντος οξωνίου στην αντίδραση του ιικού ενζύμου νευραμινιδάση.[47] Ωστόσο, δεν βασίζονται όλοι οι αναστολείς στις δομές των υποστρωμάτων. Για παράδειγμα, η δομή ενός άλλου αναστολέα πρωτεάσης HIV της τιπραναβίρης δεν βασίζεται σε ένα πεπτίδιο και δεν έχει εμφανή δομική ομοιότητα με ένα πρωτεϊνικό υπόστρωμα. Αυτοί οι μη πεπτιδικοί αναστολείς μπορεί να είναι πιο σταθεροί από τους αναστολείς που περιέχουν πεπτιδικούς δεσμούς, επειδή δεν θα είναι υποστρώματα για πεπτιδάσες και είναι λιγότερο πιθανό να αποικοδομηθούν.[48] Στον σχεδιασμό του φαρμάκου είναι σημαντικό να λαμβάνονται υπόψη οι συγκεντρώσεις των υποστρωμάτων στις οποίες εκτίθενται τα ένζυμα στόχοι. Για παράδειγμα, ορισμένοι αναστολείς πρωτεϊνικής κινάσης έχουν χημικές δομές που είναι παρόμοιες με το ATP, ένα από τα υποστρώματα αυτών των ενζύμων.[49] Όμως, φάρμακα που είναι απλοί συναγωνιστικοί αναστολείς θα πρέπει να συναγωνιστούν τις υψηλές συγκεντρώσεις του ΑΤΡ στο κύτταρο. Οι πρωτεϊνικές κινάσες μπορούν επίσης να ανασταλούν από τον συναγωνισμό στις θέσεις δέσμευσης, όπου οι κινάσες αλληλεπιδρούν με τις πρωτεΐνες του υποστρώματος τους και οι περισσότερες πρωτεΐνες υπάρχουν μέσα στα κύτταρα σε συγκεντρώσεις πολύ χαμηλότερες από τη συγκέντρωση του ΑΤΡ. Κατά συνέπεια, εάν δύο αναστολείς πρωτεϊνικής κινάσης δεσμεύονται και οι δύο στη δραστική θέση με παρόμοια συγγένεια, αλλά μόνο ο ένας πρέπει να συναγωνιστεί το ΑΤΡ, τότε ο συναγωνιστικός αναστολέας στη θέση δέσμευσης πρωτεΐνης θα αναστέλλει το ένζυμο πιο αποτελεσματικά.[50]
Μη αναστρέψιμοι αναστολείς
[Επεξεργασία | επεξεργασία κώδικα]Τύποι
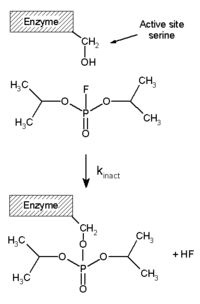
[Επεξεργασία | επεξεργασία κώδικα]Οι μη αναστρέψιμοι αναστολείς συνδέονται ομοιοπολικάμε ένα ένζυμο, και αυτός ο τύπος αναστολής δεν μπορεί επομένως να αναστραφεί εύκολα.[51] Οι μη αναστρέψιμοι αναστολείς περιέχουν συχνά δραστικές χαρακτηριστικές ομάδες όπως αζωτούχες μουστάρδες (nitrogen mustards), αλδεΰδες, αλκυλαλογονίδια, αλκένια, δέκτες Μίκαελ (Michael acceptors), σουλφονικούς φαινυλεστέρες ή φθοροφωσφονικά.[52] Αυτές οι ηλεκτρόφιλες ομάδες αντιδρούν με πλευρικές αλυσίδες αμινοξέων για να σχηματίσουν ομοιοπολικά πρόσδετα.[51] Τα υπολείμματα που τροποποιήθηκαν είναι εκείνα με πλευρικές αλυσίδες που περιέχουν πυρηνόφιλα όπως ομάδες υδροξυλίου ή σουλφυδρυλίου. Αυτά περιλαμβάνουν τα αμινοξέα σερίνη (που αντιδρά με το δισοπροπυλοφθοροφωσφορικό (DFP), βλέπε το διάγραμμα "αντίδραση DFP"), καθώς και κυστεΐνη, θρεονίνη ή τυροσίνη.[53] Η μη αναστρέψιμη αναστολή είναι διαφορετική από τη μη αναστρέψιμη αδρανοποίηση ενζύμων.[54] Οι μη αναστρέψιμοι αναστολείς είναι γενικά ειδικοί για μια κατηγορία ενζύμων και δεν απενεργοποιούν όλες τις πρωτεΐνες. Δεν λειτουργούν καταστρέφοντας την πρωτεϊνική δομή, αλλά μεταβάλλοντας συγκεκριμένα την ενεργή θέση του στόχου τους. Για παράδειγμα, τα ακραία pH ή θερμοκρασία προκαλούν συνήθως μετουσίωση όλης της δομής της πρωτεΐνης, αλλά αυτό είναι ένα μη ειδικό αποτέλεσμα. Ομοίως, ορισμένες μη ειδικές χημικές επεξεργασίες καταστρέφουν τη δομή της πρωτεΐνης: για παράδειγμα, η θέρμανση σε πυκνό υδροχλωρικό οξύ θα υδρολύσει τους πεπτιδικούς δεσμούς που συγκρατούν τις πρωτεΐνες μαζί, απελευθερώνοντας ελεύθερα αμινοξέα.[55] Οι μη αναστρέψιμοι αναστολείς εμφανίζουν αναστολή εξαρτώμενη από τον χρόνο και επομένως η ισχύς τους δεν μπορεί να χαρακτηριστεί από τιμή IC50. Αυτό συμβαίνει επειδή η ποσότητα του ενεργού ενζύμου σε μια δεδομένη συγκέντρωση μη αναστρέψιμου αναστολέα θα είναι διαφορετική ανάλογα με το πόσο καιρό προεπωάζεται ο αναστολέας με το ένζυμο. Αντίθετα, χρησιμοποιούνται τιμές kobs/[I],[56] όπου kobs είναι ο παρατηρούμενος ρυθμός ψευδο-πρώτης τάξης αδρανοποίησης (που λαμβάνεται με γραφική παράσταση του λογάριθμου της % ενεργότητας σε σχέση με το χρόνο) και [I] είναι η συγκέντρωση του αναστολέα. Η παράμετρος kobs/[I] είναι έγκυρη εφόσον ο αναστολέας δεν κορέσει τη δέσμευση με το ένζυμο (στην περίπτωση αυτή kobs = kανενεργό) όπου kανενεργό είναι ο ρυθμός αδρανοποίησης.
Μέτρηση
[Επεξεργασία | επεξεργασία κώδικα]Οι μη αναστρέψιμοι αναστολείς σχηματίζουν αρχικά ένα αναστρέψιμο μη ομοιοπολικό σύμπλοκο με το ένζυμο (EI ή ESI). Στη συνέχεια, λαμβάνει χώρα μια χημική αντίδραση μεταξύ του ενζύμου και του αναστολέα για να παραχθεί το ομοιοπολικά τροποποιημένο "σύμπλεγμα αδιεξόδου" ΕΙ* (ένα μη αναστρέψιμο ομοιοπολικό σύμπλοκο). Ο ρυθμός με τον οποίο σχηματίζεται το EI* ονομάζεται ρυθμός αδρανοποίησης ή kinact.[13] Εφόσον ο σχηματισμός του ΕΙ μπορεί να συναγωνίζεται το ES, η δέσμευση μη αναστρέψιμων αναστολέων μπορεί να αποτραπεί με συναγωνισμό είτε με υπόστρωμα είτε με δεύτερο, αναστρέψιμο αναστολέα. Αυτό το προστατευτικό αποτέλεσμα είναι καλή απόδειξη μιας ειδικής αντίδρασης του μη αναστρέψιμου αναστολέα με τη δραστική θέση. Τα στάδια δέσμευσης και αδρανοποίησης αυτής της αντίδρασης διερευνώνται με επώαση του ενζύμου με αναστολέα και προσδιορισμό της ποσότητας ενεργότητας που παραμένει με την πάροδο του χρόνου. Η ενεργότητα θα μειωθεί με τρόπο που εξαρτάται από το χρόνο, συνήθως μετά από εκθετική αποσύνθεση. Η προσαρμογή αυτών των δεδομένων στον νόμο της ταχύτητας δίνει το ρυθμό αδρανοποίησης σε αυτήν τη συγκέντρωση του αναστολέα. Αυτό γίνεται σε πολλές διαφορετικές συγκεντρώσεις αναστολέα. Εάν εμπλέκεται ένα αναστρέψιμο σύμπλεγμα EI, ο ρυθμός αδρανοποίησης θα είναι κορεσμένος και η προσαρμογή αυτής της καμπύλης θα δώσει το kinact και Ki.[57] Μια άλλη μέθοδος που χρησιμοποιείται ευρέως σε αυτές τις αναλύσεις είναι η φασματομετρία μάζας. Εδώ, η ακριβής μέτρηση της μάζας του μη τροποποιημένου φυσικού ενζύμου και του αδρανοποιημένου ενζύμου δίνει την αύξηση της μάζας που προκαλείται από την αντίδραση με τον αναστολέα και δείχνει τη στοιχειομετρία της αντίδρασης.[58] Αυτό γίνεται συνήθως χρησιμοποιώντας ένα φασματόμετρο μάζας MALDI-TOF.[59] Σε μια συμπληρωματική τεχνική, το δακτυλικό αποτύπωμα μάζας πεπτιδίου περιλαμβάνει την πέψη της φυσικής και της τροποποιημένης πρωτεΐνης με μια πεπτιδάση όπως η θρυψίνη. Αυτό θα παράγει ένα σύνολο από πεπτίδια που μπορούν να αναλυθούν χρησιμοποιώντας ένα φασματόμετρο μάζας. Το πεπτίδιο που αλλάζει σε μάζα μετά την αντίδραση με τον αναστολέα θα είναι αυτό που περιέχει τη θέση τροποποίησης.[60]
Αργή δέσμευση
[Επεξεργασία | επεξεργασία κώδικα]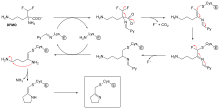
Δεν σχηματίζουν όλοι οι μη αναστρέψιμοι αναστολείς ομοιοπολικά προϊόντα πρόσδετων με τους ενζυμικούς στόχους τους. Μερικοί αναστρέψιμοι αναστολείς συνδέονται τόσο στενά με το ένζυμο στόχο τους που είναι ουσιαστικά μη αναστρέψιμοι. Αυτοί οι αναστολείς στενής δέσμευσης μπορεί να παρουσιάζουν κινητικές παρόμοιες με τους ομοιοπολικούς μη αναστρέψιμους αναστολείς. Σε αυτές τις περιπτώσεις, ορισμένοι από αυτούς τους αναστολείς συνδέονται γρήγορα με το ένζυμο σε ένα σύμπλοκο ΕΙ χαμηλής συγγένειας και αυτό στη συνέχεια υφίσταται μια πιο αργή αναδιάταξη σε ένα πολύ στενά δεσμευμένο σύμπλοκο ΕΙ* (βλέπε το διάγραμμα "μη αναστρέψιμου μηχανισμού αναστολής"). Αυτή η κινητική συμπεριφορά ονομάζεται βραδεία δέσμευση.[62] Αυτή η αργή αναδιάταξη μετά τη δέσμευση περιλαμβάνει συχνά μια διαμορφωτική αλλαγή καθώς το ένζυμο σφίγγει γύρω από το μόριο του αναστολέα. Παραδείγματα αναστολέων βραδείας δέσμευσης περιλαμβάνουν ορισμένα σημαντικά φάρμακα, όπως η μεθοτρεξάτη,[63] η αλλοπουρινόλη,[64] και η ενεργοποιημένη μορφή της ακυκλοβίρης.[65]
Μερικά παραδείγματα
[Επεξεργασία | επεξεργασία κώδικα]
Το φθοροφωσφορικό διισοπροπύλιο (Diisopropylfluorophosphate, DFP) είναι ένα παράδειγμα μη αναστρέψιμου αναστολέα πρωτεάσης (δείτε το διάγραμμα "αντίδραση DFP"). Το ένζυμο υδρολύει τον δεσμό φωσφόρου-φθορίου, αλλά το φωσφορικό υπόλειμμα παραμένει συνδεδεμένο με τη σερίνη στην ενεργή θέση, απενεργοποιώντας την.[67] Ομοίως, το DFP αντιδρά επίσης με την ενεργή θέση της εστεράσης της ακετυλοχολίνης στις συνάψεις των νευρώνων και, κατά συνέπεια, είναι μια ισχυρή νευροτοξίνη, με θανατηφόρα δόση μικρότερη από 100 mg.[68] Η αναστολή αυτοκτονίας είναι ένας ασυνήθιστος τύπος μη αναστρέψιμης αναστολής, όπου το ένζυμο μετατρέπει τον αναστολέα σε δραστική μορφή στην ενεργή του θέση.[69] Ένα παράδειγμα είναι ο αναστολέας της βιοσύνθεσης της πολυαμίνης, α-διφθορομεθυλορνιθίνη (α-difluoromethylornithine, DFMO), που είναι ανάλογος του αμινοξέος ορνιθίνη και χρησιμοποιείται για τη θεραπεία της αφρικανικής τρυπανοσωμίασης (ασθένεια του ύπνου). Η αποκαρβοξυλάση της ορνιθίνης μπορεί να καταλύσει την αποκαρβοξυλίωση του DFMO αντί της ορνιθίνης (δείτε το διάγραμμα "Μηχανισμός αναστολέα DFMO"). Όμως, αυτή η αντίδραση αποκαρβοξυλίωσης ακολουθείται από την εξάλειψη ενός ατόμου φθορίου, το οποίο μετατρέπει αυτό το καταλυτικό ενδιάμεσο σε συζευγμένη ιμίνη, ένα εξαιρετικά ηλεκτρόφιλο είδος. Αυτή η δραστική μορφή του DFMO στη συνέχεια αντιδρά είτε με ένα υπόλειμμα κυστεΐνης, είτε με λυσίνη στη δραστική θέση για να απενεργοποιήσει μη αναστρέψιμα το ένζυμο.[61] Δεδομένου ότι η μη αναστρέψιμη αναστολή περιλαμβάνει συχνά τον αρχικό σχηματισμό ενός συμπλόκου μη ομοιοπολικού αναστολέα ενζύμου (EI),[13] είναι μερικές φορές δυνατό ένας αναστολέας να συνδεθεί με ένα ένζυμο με περισσότερους από έναν τρόπους. Για παράδειγμα, στο σχήμα που δείχνει την αναγωγάση της τρυπανοθειόνης από το ανθρώπινο πρωτόζωο παράσιτο Trypanosoma cruzi, δύο μόρια ενός αναστολέα που ονομάζεται μουστάρδα κινακρίνης (quinacrine mustard) είναι συνδεδεμένα στην ενεργή του θέση. Το επάνω μόριο συνδέεται αναστρέψιμα, αλλά το κατώτερο συνδέεται ομοιοπολικά καθώς έχει αντιδράσει με ένα υπόλειμμα αμινοξέος μέσω της ομάδας της αζωτούχου μουστάρδας.[70]
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Οι αναστολείς ενζύμων βρίσκονται στη φύση [71] και παράγονται επίσης τεχνητά στο εργαστήριο.[72] Οι φυσικοί αναστολείς ενζύμων ρυθμίζουν πολλές μεταβολικές διεργασίες και είναι απαραίτητοι για τη ζωή.[3][1] Επιπλέον, τα φυσικά παραγόμενα δηλητήρια είναι συχνά αναστολείς ενζύμων που έχουν εξελιχθεί για χρήση ως τοξικοί παράγοντες κατά των θηρευτών, των θηραμάτων και των ανταγωνιστικών οργανισμών.[4] Αυτές οι φυσικές τοξίνες περιλαμβάνουν μερικές από τις πιο γνωστές δηλητηριώδεις ουσίες.[73] Οι τεχνητοί αναστολείς χρησιμοποιούνται συχνά ως φάρμακα, αλλά μπορεί επίσης να είναι εντομοκτόνα όπως μαλαθείο (malathion), ζιζανιοκτόνα όπως γλυφοσάτη,[74] ή απολυμαντικό όπως η τρικλοζάνη (triclosan). Άλλοι τεχνητοί αναστολείς ενζύμων μπλοκάρουν την ακετυλοχολινεστεράση, ένα ένζυμο που διασπά την ακετυλοχολίνη και χρησιμοποιείται ως νευροτοξικός παράγοντας στον χημικό πόλεμο.[75]
Μεταβολική ρύθμιση
[Επεξεργασία | επεξεργασία κώδικα]Η αναστολή των ενζύμων είναι ένα κοινό χαρακτηριστικό του ελέγχου της μεταβολικής οδού στα κύτταρα.[3]Η μεταβολική ροή μέσω μιας οδού ρυθμίζεται συχνά από μεταβολίτες μιας οδού που δρουν ως αναστολείς και ενισχυτές για τα ένζυμα στην ίδια οδό. Η γλυκολυτική οδός είναι ένα κλασικό παράδειγμα.[76] Αυτή η καταβολική οδός καταναλώνει γλυκόζη και παράγει ATP, νικοτιναμιδo-αδενινο-δινουκλεοτίδιο (NADH) και πυροσταφυλικό οξύ. Ένα βασικό βήμα για τη ρύθμιση της γλυκόλυσης είναι μια πρώιμη αντίδραση στην οδό που καταλύεται από τη φωσφοφρουκτοκινάση‑1 (Phosphofructokinase1, PFK1). Όταν τα επίπεδα ATP αυξάνονται, το ATP δεσμεύει μια αλλοστερική θέση στο PFK1 για να μειώσει τον ρυθμό της ενζυμικής αντίδρασης. Η γλυκόλυση αναστέλλεται και η παραγωγή ATP μειώνεται. Αυτός ο έλεγχος αρνητικής ανάδρασης βοηθά στη διατήρηση μιας σταθερής συγκέντρωσης ATP στο κύτταρο. Όμως, οι μεταβολικές οδοί δεν ρυθμίζονται μόνο μέσω της αναστολής, καθώς η ενεργοποίηση των ενζύμων είναι εξίσου σημαντική. Όσον αφορά το PFK1, η 2,6-διφωσφορική φρουκτόζη και η ADP είναι παραδείγματα μεταβολιτών που είναι αλλοστερικοί ενεργοποιητές.[77] Φυσιολογική αναστολή ενζύμου μπορεί επίσης να παραχθεί από ειδικούς αναστολείς πρωτεΐνης. Αυτός ο μηχανισμός εμφανίζεται στο πάγκρεας, το οποίο συνθέτει πολλά πεπτικά πρόδρομα ένζυμα γνωστά ως ζυμογόνα (zymogens). Πολλά από αυτά ενεργοποιούνται από την πρωτεάση θρυψίνη, επομένως είναι σημαντικό να αναστέλλεται η δραστηριότητα της θρυψίνης στο πάγκρεας για να αποτραπεί η πέψη του οργάνου. Ένας τρόπος με τον οποίο ελέγχεται η δραστηριότητα της θρυψίνης είναι η παραγωγή μιας ειδικής και ισχυρής πρωτεΐνης αναστολής θρυψίνης στο πάγκρεας. Αυτός ο αναστολέας συνδέεται στενά με τη θρυψίνη, αποτρέποντας τη δραστικότητα της θρυψίνης που διαφορετικά θα ήταν επιζήμια για το όργανο.[78] Αν και ο αναστολέας θρυψίνης είναι πρωτεΐνη, αποφεύγει να υδρολυθεί ως υπόστρωμα από την πρωτεάση αποκλείοντας το νερό από την ενεργή θέση της θρυψίνης και αποσταθεροποιώντας τη μεταβατική κατάσταση.[79] Άλλα παραδείγματα πρωτεϊνών αναστολέα φυσιολογικών ενζύμων περιλαμβάνουν τον αναστολέα barstar της βακτηριακής ριβονουκλεάσης barnase.[80]
Φυσικά δηλητήρια
[Επεξεργασία | επεξεργασία κώδικα]
Τα ζώα και τα φυτά έχουν εξελιχθεί για να συνθέτουν ένα τεράστιο φάσμα δηλητηριωδών προϊόντων, συμπεριλαμβανομένων των δευτερογενών μεταβολιτών,[81] πεπτιδίων και μεταβολιτών[82] που μπορούν να λειτουργήσουν ως αναστολείς. Οι φυσικές τοξίνες είναι συνήθως μικρά οργανικά μόρια και είναι τόσο διαφορετικές που πιθανώς υπάρχουν φυσικοί αναστολείς για τις περισσότερες μεταβολικές διεργασίες.[83] Οι μεταβολικές διεργασίες που στοχεύουν τα φυσικά δηλητήρια περιλαμβάνουν περισσότερα από τα ένζυμα στις μεταβολικές οδούς και μπορούν επίσης να περιλαμβάνουν την αναστολή των λειτουργιών των υποδοχέων, των καναλιών και των δομικών πρωτεϊνών σε ένα κύτταρο. Για παράδειγμα, η πακλιταξέλη (ταξόλη), ένα οργανικό μόριο που βρίσκεται στον τάξο του Ειρηνικού (Pacific yew), συνδέεται στενά με τα διμερή τουμπουλίνης και αναστέλλει τη σύνθεση τους σε μικροσωληνίσκους στον κυτταροσκελετό.[84] Πολλά φυσικά δηλητήρια δρουν ως νευροτοξίνες που μπορούν να προκαλέσουν παράλυση που οδηγεί σε θάνατο και λειτουργούν για την άμυνα έναντι των θηρευτών ή στο κυνήγι και τη σύλληψη θηραμάτων. Μερικοί από αυτούς τους φυσικούς αναστολείς,[85] παρά τις τοξικές τους ιδιότητες, είναι πολύτιμες για θεραπευτικές χρήσεις σε χαμηλότερες δόσεις.[86] Ένα παράδειγμα νευροτοξίνης είναι τα γλυκοαλκαλοειδή (glycoalkaloids), από τα είδη φυτών της οικογένειας στρυχνοειδή (Solanaceae) (περιλαμβάνει την πατάτα, την τομάτα και τη μελιτζάνα), που είναι αναστολείς ακετυλοχολινεστερασών. Η αναστολή αυτού του ενζύμου προκαλεί ανεξέλεγκτη αύξηση του νευροδιαβιβαστή της ακετυλοχολίνης, μυϊκή παράλυση και στη συνέχεια θάνατο. Νευροτοξικότητα μπορεί να προκύψει επίσης από την αναστολή των υποδοχέων, για παράδειγμα, η ατροπίνη από το θανατηφόρο νυχτολούλουδο (Άτροπος η ευθάλεια (Atropa belladonna)) που λειτουργεί ως συναγωνιστικός ανταγωνιστής (competitive antagonist) των μουσκαρινικοί υποδοχείς ακετυλοχολίνης.[87] Αν και πολλές φυσικές τοξίνες είναι δευτερογενείς μεταβολίτες, αυτά τα δηλητήρια περιλαμβάνουν επίσης πεπτίδια και πρωτεΐνες. Ένα παράδειγμα τοξικού πεπτιδίου είναι η α-Αμανιτίνη, το οποίο βρίσκεται σε συγγενείς του μανιταριού Αμανίτης ο φαλλοειδής. Αυτός είναι ένας ισχυρός αναστολέας ενζύμου, που σε αυτήν την περίπτωση εμποδίζει το ένζυμο RNA πολυμεράση II να μεταγράψει το DNA.[88] Η τοξίνη φυκών μικροκυστίνη είναι επίσης ένα πεπτίδιο και είναι αναστολέας των πρωτεϊνικών φωσφατασών.[89] Αυτή η τοξίνη μπορεί να μολύνει τα αποθέματα νερού μετά από άνθιση φυτοπλαγκτού και είναι γνωστό καρκινογόνο που μπορεί επίσης να προκαλέσει οξεία ηπατική αιμορραγία και θάνατο σε υψηλότερες δόσεις.[90] Οι πρωτεΐνες μπορεί επίσης να είναι φυσικά δηλητήρια ή αντιθρεπτικά (antinutrients), όπως οι αναστολείς θρυψίνης που βρίσκονται σε ορισμένα όσπρια.[91] Μια λιγότερο κοινή κατηγορία τοξινών είναι τα τοξικά ένζυμα: αυτά δρουν ως μη αναστρέψιμοι αναστολείς των ενζύμων-στόχων τους και λειτουργούν τροποποιώντας χημικά τα ένζυμα του υποστρώματος τους. Ένα παράδειγμα είναι η ρικίνη, μια εξαιρετικά ισχυρή πρωτεϊνική τοξίνη που βρίσκεται στο καστορέλαιου.[92] Αυτό το ένζυμο είναι μια γλυκοζιδάση που απενεργοποιεί τα ριβοσώματα.[93] Δεδομένου ότι η ρικίνη είναι ένας καταλυτικός μη αναστρέψιμος αναστολέας, αυτό επιτρέπει σε ένα μόνο μόριο ρικίνης να σκοτώσει ένα κύτταρο.[94]
Φάρμακα
[Επεξεργασία | επεξεργασία κώδικα]
Οι πιο κοινές χρήσεις των αναστολέων ενζύμου είναι ως φάρμακα για τη θεραπεία ασθενειών. Πολλοί από αυτούς τους αναστολείς στοχεύουν σε ένα ανθρώπινο ένζυμο και αποσκοπούν στη διόρθωση μιας παθολογικής κατάστασης. Για παράδειγμα, η ασπιρίνη είναι ένα ευρέως χρησιμοποιούμενο φάρμακο που δρα ως αναστολέας αυτοκτονίας του ενζύμου κυκλοοξυγενάση.[95] Αυτή η αναστολή με τη σειρά της καταστέλλει την παραγωγή προφλεγμονωδών προσταγλανδινών και επομένως η ασπιρίνη μπορούν να χρησιμοποιηθούν για τη μείωση του πόνου, του πυρετού και της φλεγμονής.[95] As of 2017[update] εκτιμάται ότι το 29% των εγκεκριμένων φαρμάκων είναι αναστολείς ενζύμων[96] εκ των οποίων περίπου το ένα πέμπτο είναι αναστολείς κινάσης.[96] Μια αξιοσημείωτη κατηγορία στόχων φαρμάκων κινάσης είναι οι υποδοχείς κινάσης τυροσίνης που είναι απαραίτητα ένζυμα που ρυθμίζουν την κυτταρική ανάπτυξη. Η υπερβολική ενεργοποίησή τους μπορεί να οδηγήσει σε καρκίνο. Ως εκ τούτου, οι αναστολείς κινάσης όπως η ιματινίμπη χρησιμοποιούνται συχνά για τη θεραπεία κακοηθειών.[97] Οι κινάσες Janus είναι ένα άλλο αξιοσημείωτο παράδειγμα στόχων ενζύμων φαρμάκων. Οι αναστολείς των κινασών Janus εμποδίζουν την παραγωγή φλεγμονωδών κυτοκινών και ως εκ τούτου αυτοί οι αναστολείς χρησιμοποιούνται για τη θεραπεία μιας ποικιλίας φλεγμονωδών νόσων, συμπεριλαμβανομένης της αρθρίτιδας, του άσθματος και της νόσου του Κρον.[98] Ένα παράδειγμα της δομικής ομοιότητας ορισμένων αναστολέων με τα υποστρώματα των ενζύμων που στοχεύουν φαίνεται στο σχήμα που συγκρίνει το φάρμακο μεθοτρεξάτη με το φολικό οξύ. Το φολικό οξύ είναι η οξειδωμένη μορφή του υποστρώματος της διυδροφολικής αναγωγάσης, ενός ενζύμου που αναστέλλεται ισχυρά από τη μεθοτρεξάτη. Η μεθοτρεξάτη αναστέλλει τη δράση της διυδροφολικής αναγωγάσης και έτσι σταματά τη βιοσύνθεση της θυμιδίνης.[42] Αυτή η παρεμπόδιση της βιοσύνθεσης του νουκλεοτιδίου είναι επιλεκτικά τοξική για τα ταχέως αναπτυσσόμενα κύτταρα, επομένως η μεθοτρεξάτη χρησιμοποιείται συχνά στη χημειοθεραπεία του καρκίνου.[99] Μια κοινή θεραπεία για τη στυτική δυσλειτουργία είναι η σιλδεναφίλη (βιάγκρα).[100] Αυτή η ένωση είναι ένας ισχυρός αναστολέας της ειδικής φωσφοδιεστεράσης του κυκλικού GMP τύπου 5, του ενζύμου που αποικοδομεί το μόριο σηματοδότησης της κυκλικής μονοφωσφορικής γουανοσίνης.[101] Αυτό το σηματοδοτικό μόριο ενεργοποιεί τη χαλάρωση των λείων μυών και επιτρέπει τη ροή του αίματος στο σηραγγώδη σώματα του πέους, το οποίο προκαλεί τη στύση. Δεδομένου ότι το φάρμακο μειώνει τη δραστηριότητα του ενζύμου που σταματά το σήμα, κάνει αυτό το σήμα να διαρκεί για μεγαλύτερο χρονικό διάστημα.
Αντιβιοτικά
[Επεξεργασία | επεξεργασία κώδικα]
]
Τα φάρμακα χρησιμοποιούνται επίσης για την αναστολή των ενζύμων που απαιτούνται για την επιβίωση των παθογόνων. Για παράδειγμα, τα βακτήρια περιβάλλονται από ένα παχύ κυτταρικό τοίχωμα κατασκευασμένο από ένα πολυμερές που μοιάζει με δίχτυ που ονομάζεται πεπτιδογλυκάνη. Πολλά αντιβιοτικά όπως η πενικιλλίνη και η βανκομυκίνη αναστέλλουν τα ένζυμα που παράγουν και στη συνέχεια διασυνδέουν τους κλώνους αυτού του πολυμερούς μεταξύ τους.[102][103] Αυτό κάνει το κυτταρικό τοίχωμα να χάσει τη δύναμη και τα βακτήρια να σκάσουν. Στο σχήμα, ένα μόριο πενικιλίνης (εμφανίζεται σε μορφή σφαίρας και ράβδου) φαίνεται συνδεδεμένο με τον στόχο του, την τρανσπεπτιδάση από το βακτήριο Streptomyces R61 (η πρωτεΐνη φαίνεται ως διάγραμμα κορδέλας). Ο σχεδιασμός φαρμάκου αντιβιοτικού διευκολύνεται όταν ένα ένζυμο που είναι απαραίτητο για την επιβίωση του παθογόνου απουσιάζει ή είναι πολύ διαφορετικό στους ανθρώπους.[104] Οι άνθρωποι δεν παράγουν πεπτιδογλυκάνη, επομένως τα αντιβιοτικά που αναστέλλουν αυτή τη διαδικασία είναι επιλεκτικά τοξικά για τα βακτήρια.[105] Η επιλεκτική τοξικότητα παράγεται επίσης στα αντιβιοτικά με την εκμετάλλευση των διαφορών στη δομή των ριβοσωμάτων στα βακτήρια,[106] ή πώς παράγουν λιπαρά οξέα.[107]
Αντιιικά
[Επεξεργασία | επεξεργασία κώδικα]Τα φάρμακα που αναστέλλουν τα ένζυμα που απαιτούνται για την αντιγραφή των ιών είναι αποτελεσματικά στη θεραπεία ιογενών λοιμώξεων.[108] Τα αντιιικά φάρμακα περιλαμβάνουν αναστολείς πρωτεάσης που χρησιμοποιούνται για τη θεραπεία του HIV/AIDS[109] και την ηπατίτιδα C,[110] οι αναστολείς της αντίστροφης μεταγραφάσης που στοχεύουν το HIV/AIDS,[111] οι αναστολείς της νευραμινιδάσης στοχεύουν τη γρίπη,[112] και αναστολείς της τερμινάσης που στοχεύουν τον ανθρώπινο κυτταρομεγαλοϊό.[113]
Φυτοφάρμακα
[Επεξεργασία | επεξεργασία κώδικα]Πολλά φυτοφάρμακα είναι αναστολείς ενζύμων.[114] Η ακετυλοχολινεστεράση (Acetylcholinesterase, AchE) είναι ένα ένζυμο που βρίσκεται σε ζώα, από έντομα έως ανθρώπους. Είναι απαραίτητο για τη λειτουργία των νευρικών κυττάρων μέσω του μηχανισμού διάσπασης του νευροδιαβιβαστή της ακετυλοχολίνης στα συστατικά του, οξικά ιόντα και χολίνη.[115] Αυτό είναι κάπως ασυνήθιστο μεταξύ των νευροδιαβιβαστών, καθώς οι περισσότεροι, συμπεριλαμβανομένων των σεροτονίνη, ντοπαμίνη και νορεπινεφρίνη, απορροφώνται από τη συναπτική σχισμή (synaptic cleft) αντί να διασπώνται. Ένας μεγάλος αριθμός αναστολέων AChE χρησιμοποιείται τόσο στην ιατρική όσο και στη γεωργία.[116] Αναστρέψιμοι συναγωνιστικοί αναστολείς, όπως εδροφόνιο (edrophonium), φυσοστιγμίνη (physostigmine) και νεοστιγμίνη, χρησιμοποιούνται στη θεραπεία της σοβαρής μυασθένειας[117] και στην αναισθησία για να αντιστρέψει τον μυϊκό αποκλεισμό.[118] Τα καρβαμιδικά φυτοφάρμακα είναι επίσης παραδείγματα αναστρέψιμων αναστολέων AChE. Τα οργανοφωσφορικά φυτοφάρμακα όπως το μαλαθείο, το παραθείο (parathion) και το χλωροπυροφώς (chlorpyrifos) αναστέλλουν μη αναστρέψιμα την ακετυλοχολινεστεράση.[119]
Ζιζανιοκτόνα
[Επεξεργασία | επεξεργασία κώδικα]Το ζιζανιοκτόνο γλυφοσάτη είναι ένας αναστολέας της 3-φωσφοσικιμικής 1-καρβοξυβινυλμεταφοράση (3-phosphoshikimate 1-carboxyvinyltransferase),[120] άλλα ζιζανιοκτόνα, όπως οι σουλφονυλουρίες (sulfonylureas) αναστέλλουν το ένζυμο ακετογαλακτική συνθάση.[121] Και τα δύο ένζυμα χρειάζονται για τα φυτά ώστε να παράγουν αμινοξέα διακλαδισμένης αλυσίδας. Πολλά άλλα ένζυμα αναστέλλονται από ζιζανιοκτόνα, συμπεριλαμβανομένων των ενζύμων που απαιτούνται για τη βιοσύνθεση των λιπιδίων και των καροτενοειδών και τις διεργασίες της φωτοσύνθεση και της οξειδωτικής φωσφορυλίωσης.[122]
Ανακάλυψη και σχεδιασμός
[Επεξεργασία | επεξεργασία κώδικα]
Τα νέα φάρμακα είναι προϊόντα μιας μακράς διαδικασίας ανάπτυξης φαρμάκων, το πρώτο βήμα της οποίας είναι συχνά η ανακάλυψη ενός νέου αναστολέα ενζύμου.[123] Υπάρχουν δύο βασικές προσεγγίσεις για την ανακάλυψη αυτών των αναστολέων.[124] Η πρώτη γενική μέθοδος είναι ο ορθολογικός σχεδιασμός του φαρμάκου που βασίζεται στη μίμηση της μεταβατικής κατάστασης της χημικής αντίδρασης που καταλύεται από το ένζυμο.[125] Ο σχεδιασμένος αναστολέας συχνά μοιάζει πολύ με το υπόστρωμα, εκτός από το ότι το τμήμα του υποστρώματος που υφίσταται τη χημική αντίδραση αντικαθίσταται από μια χημικά σταθερή χαρακτηριστική ομάδα που μοιάζει με τη μεταβατική κατάσταση. Εφόσον το ένζυμο έχει εξελιχθεί για να σταθεροποιεί τη μεταβατική κατάσταση, τα ανάλογα μεταβατικής κατάστασης έχουν γενικά υψηλότερη συγγένεια για το ένζυμο σε σύγκριση με το υπόστρωμα και επομένως είναι αποτελεσματικοί αναστολείς.[46] Ο δεύτερος τρόπος ανακάλυψης νέων αναστολέων ενζύμου είναι η διαλογή υψηλής απόδοσης μεγάλων βιβλιοθηκών δομικά διαφορετικών ενώσεων για τον εντοπισμό χτυπημένων μορίων που συνδέονται με το ένζυμο. Αυτή η μέθοδος έχει επεκταθεί για να συμπεριλάβει την εικονική διαλογή βάσεων δεδομένων διαφορετικών μορίων που χρησιμοποιούν υπολογιστές,[126][127] τα οποία στη συνέχεια ακολουθούνται από πειραματική επιβεβαίωση της δέσμευσης των επιτυχιών της εικονικής διαλογής.[128] Οι συμπληρωματικές προσεγγίσεις που μπορούν να παρέχουν νέα σημεία εκκίνησης για τους αναστολείς περιλαμβάνουν ανακάλυψη οδηγών με βάση θραύσμα (fragment-based lead discovery)[129] και χημικές βιβλιοθήκες με κωδικοποιημένο DNA (DNA Encoded Chemical Libraries, DEL).[130] Οι επιτυχίες από οποιαδήποτε από τις παραπάνω προσεγγίσεις μπορούν να είναι βελτιστοποιημένοι σε συνδετικά υψηλής συγγένειας που αναστέλλουν αποτελεσματικά το ένζυμο.[131] Οι μέθοδοι που βασίζονται σε υπολογιστή για την πρόβλεψη του προσανατολισμού δέσμευσης και της συγγένειας ενός αναστολέα για ένα ένζυμο όπως η μοριακή πρόσδεση (molecular docking)[132] και η μοριακή μηχανική μπορούν να χρησιμοποιηθούν για να βοηθήσουν στη διαδικασία βελτιστοποίησης.[133] Νέοι αναστολείς χρησιμοποιούνται για τη λήψη κρυσταλλογραφικών δομών του ενζύμου σε ένα σύμπλεγμα αναστολέα/ενζύμου για να δείξουν πώς το μόριο δεσμεύεται στην ενεργή θέση, επιτρέποντας την πραγματοποίηση αλλαγών στον αναστολέα για τη βελτιστοποίηση της δέσμευσης σε μια διαδικασία που είναι γνωστή ως σχεδιασμός φαρμάκου με βάση τη δομή (structure-based drug design).[1]:66 Αυτός ο κύκλος δοκιμής και βελτίωσης επαναλαμβάνεται μέχρι να παραχθεί ένας επαρκώς ισχυρός αναστολέας.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 1,3 Copeland RA (Μαρτίου 2013). «Why Enzymes as Drug Targets? Enzyme are Essential for Life». Evaluation of Enzyme Inhibitors in Drug Discovery: A Guide for Medicinal Chemists and Pharmacologists (Second έκδοση). John Wiley & Sons, Inc. σελίδες 1–23. doi:10.1002/9781118540398.ch1. ISBN 978-1-118-48813-3.
- ↑ 2,0 2,1 2,2 «Control and regulation of pathways via negative feedback». Journal of the Royal Society, Interface 14 (127): 1–13. February 2017. doi:. PMID 28202588.
- ↑ 3,0 3,1 3,2 Plaxton WC (2004). «Principles of Metabolic Control». Στο: Storey KB. Functional Metabolism: Regulation and Adaptation. Hoboken, N.J.: John Wiley & Sons. σελίδες 1–24 (12). ISBN 978-0-471-67557-0. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Μαρτίου 2023. Ανακτήθηκε στις 14 Απριλίου 2022.
- ↑ 4,0 4,1 «Drugs from the deep: marine natural products as drug candidates». Drug Discovery Today 8 (12): 536–44. June 2003. doi:. PMID 12821301.
- ↑ Gualerzi CO, Brandi L, Fabbretti A, Pon CL (2013). Antibiotics: Targets, Mechanisms and Resistance. Hoboken: John Wiley & Sons. ISBN 978-3-527-65970-8.
- ↑ «SERPINs-From Trap to Treatment». Frontiers in Medicine 6: 25. 2019. doi:. PMID 30809526.
- ↑ «Interaction of human placental ribonuclease with placental ribonuclease inhibitor». Biochemistry 30 (8): 2246–2255. February 1991. doi:. PMID 1998683.
- ↑ «Protease propeptide structures, mechanisms of activation, and functions». Critical Reviews in Biochemistry and Molecular Biology 55 (2): 111–165. April 2020. doi:. PMID 32290726.
- ↑ 9,0 9,1 Rydzewski RM (2010). «Chapter 7.2.1: Competition and Allostery». Real World Drug Discovery: A Chemist's Guide to Biotech and Pharmaceutical Research (1st έκδοση). Amsterdam: Elsevier. σελίδες 281–285. ISBN 978-0-08-091488-6. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Μαρτίου 2023. Ανακτήθηκε στις 20 Ιουλίου 2022.
- ↑ «Analysis of equilibrium binding of an orthosteric tracer and two allosteric modulators». PLOS ONE 14 (3): e0214255. 2019. doi:. PMID 30917186. Bibcode: 2019PLoSO..1414255J.
- ↑ Patrick GL (2013). «Chapter 7: Enzymes as Drug Targets». An Introduction to Medicinal Chemistry (Fifth έκδοση). Oxford, UK: Oxford University Press. σελ. 90. ISBN 978-0-19-969739-7. Αρχειοθετήθηκε από το πρωτότυπο στις 20 Ιουλίου 2022. Ανακτήθηκε στις 20 Ιουλίου 2022.
- ↑ Kuriyan J, Konforti B, Wemmer D (2012). «Molecular Recognition: The Thermodynamics of Binding». The Molecules of Life : Physical and Chemical Principles (First έκδοση). Boca Raton, FL: Garland Science. σελίδες 531–580. ISBN 978-1-135-08892-7. Αρχειοθετήθηκε από το πρωτότυπο στις 7 Ιουνίου 2022. Ανακτήθηκε στις 7 Ιουνίου 2022.
- ↑ 13,0 13,1 13,2 «The Taxonomy of Covalent Inhibitors». Biochemistry 57 (24): 3326–3337. June 2018. doi:. PMID 29689165.
- ↑ 14,0 14,1 «The kinetics of enzyme-catalysed reactions with two or more substrates or products. II. Inhibition: nomenclature and theory». Biochimica et Biophysica Acta (BBA) - Specialized Section on Enzymological Subjects 67: 173–187. February 1963. doi:. PMID 14021668.
- ↑ Berg J, Tymoczko J, Stryer L (2002). Biochemistry. W. H. Freeman and Company. ISBN 978-0-7167-4955-4. Αρχειοθετήθηκε από το πρωτότυπο στις 26 Σεπτεμβρίου 2009. Ανακτήθηκε στις 31 Αυγούστου 2017.
- ↑ 16,0 16,1 16,2 «Types of Inhibition». NIH Center for Translational Therapeutics. Αρχειοθετήθηκε από το πρωτότυπο στις 8 Σεπτεμβρίου 2011. Ανακτήθηκε στις 2 Απριλίου 2012.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 17,6 17,7 Cornish-Bowden A (2012). Fundamentals of Enzyme Kinetics (4th έκδοση). Weinheim: Wiley-VCH. ISBN 978-3-527-66549-5.
- ↑ 18,0 18,1 Segel IH (1993). Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (New έκδοση). Wiley-Interscience. ISBN 978-0-471-30309-1.
- ↑ Palmer T, Bonner PL (2007). «Enzyme inhibition.». Enzymes: Biochemistry, Biotechnology, Clinical Chemistry (2nd έκδοση). Woodhead Publishing. σελίδες 126–152 (135). doi:10.1533/9780857099921.2.126. ISBN 978-1-904275-27-5.
- ↑ Delaune KP, Alsayouri K (Σεπτεμβρίου 2021). «Physiology: Noncompetitive Inhibitor». StatPearls. Treasure Island (FL): StatPearls Publishing. σελ. 31424826. PMID 31424826. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Νοεμβρίου 2021. Ανακτήθηκε στις 3 Απριλίου 2022.
- ↑ 21,0 21,1 Voet D, Voet JG, Pratt CW (2016). «Chapter 12: Enzyme Kinetics, Inhibition, and Control». Fundamentals of Biochemistry: Life at the Molecular Level (Fifth έκδοση). Hoboken, NJ: Wiley. σελίδες 361–401. ISBN 978-1-118-91840-1.
- ↑ «Enzyme-Inhibitor Interactions and a Simple, Rapid Method for Determining Inhibition Modality». SLAS Discovery: Advancing Life Sciences R & D 24 (5): 515–522 (516). June 2019. doi:. PMID 30811960. «In some cases, the inhibitor may bind to a distinct site on the enzyme that is in allosteric communication with the substrate binding pocket. In many cases, allosteric, substrate competitive compounds result in conformational changes to the enzyme that change the ability of the enzyme to bind substrate.».
- ↑ Laidler KJ (1978). Physical Chemistry with Biological Applications. Benjamin/Cummings. σελ. 437. ISBN 978-0-8053-5680-9.
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 Bisswanger H (2017). Enzyme Kinetics: Principles and Methods (3rd έκδοση). Newark: John Wiley & Sons, Incorporated. ISBN 978-3-527-80647-8.
- ↑ Marangoni AG (2003). «Reversible Enzyme Inhibition». Enzyme Kinetics: A Modern Approach. Hoboken, N.J.: Wiley-Interscience. σελίδες 61–69. ISBN 978-0-471-15985-8.
- ↑ Segel IH (1993). Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (New έκδοση). Wiley–Interscience. ISBN 978-0-471-30309-1.
- ↑ 27,0 27,1 «Limitations of conventional inhibitor classifications». Integrative Biology 3 (12): 1197–1201. December 2011. doi:. PMID 22038120.
- ↑ 28,0 28,1 28,2 «A versatile equation to describe reversible enzyme inhibition and activation kinetics: modeling beta-galactosidase and butyrylcholinesterase». Biochimica et Biophysica Acta (BBA) - General Subjects 1770 (5): 733–746. May 2007. doi:. PMID 17307293.
- ↑ «Alternative perspectives of enzyme kinetic modeling.». Medicinal Chemistry and Drug Design. (InTech) (16): 357–372. May 2012.
- ↑ Strelow J, Dewe W, Iversen PW, Brooks PB, Radding JA, McGee J, Weidner J (Οκτωβρίου 2012). «Mechanism of Action Assays for Enzymes». Στο: Markossian S, Grossman A, Brimacombe K, και άλλοι. Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. PMID 22553872. Αρχειοθετήθηκε από το πρωτότυπο στις 15 Ιουνίου 2022. Ανακτήθηκε στις 9 Απριλίου 2022.
- ↑ «Making cool drugs hot: isothermal titration calorimetry as a tool to study binding energetics». BioTechniques 31 (1): 164–6, 168, 170 passim. July 2001. PMID 11464510.
- ↑ «Using linear and non-linear regression to fit biochemical data». Trends in Biochemical Sciences 15 (12): 455–458. December 1990. doi:. PMID 2077683.
- ↑ 33,0 33,1 «A comparison of the parameter estimating procedures for the Michaelis-Menten model». Journal of Theoretical Biology 145 (4): 457–464. August 1990. doi:. PMID 2246896. Bibcode: 1990JThBi.145..457T.
- ↑ Dixon M, Webb EC, Thorne CJ, Tipton KF (1979). Enzymes (3rd έκδοση). London: Longman. σελ. 126. ISBN 978-0-470-20745-1.
- ↑ Radzicka A, Wolfenden R (1995). «Transition state and multisubstrate analog inhibitors». Enzyme Kinetics and Mechanism Part D: Developments in Enzyme Dynamics. Methods in Enzymology. 249. σελίδες 284–312. doi:10.1016/0076-6879(95)49039-6. ISBN 9780121821500. PMID 7791615.
- ↑ «Amylase/creatinine clearance fraction in patients on chronic hemodialysis». Annals of Internal Medicine 86 (1): 65–66. January 1977. doi:. PMID 319722. https://archive.org/details/sim_annals-of-internal-medicine_1977-01_86_1/page/65.
- ↑ «A multisubstrate adduct inhibitor of a purine biosynthetic enzyme with a picomolar dissociation constant». Journal of Medicinal Chemistry 32 (5): 937–940. May 1989. doi:. PMID 2709379.
- ↑ «Multisubstrate Adduct Inhibitors of Glycinamide Ribonucleotide Transformylase: Synthetic and Enzyme Generated.». Tetrahedron 47 (14–15): 2351–2364. 1991. doi:.
- ↑ «Modification of the NADH of the isoniazid target (InhA) from Mycobacterium tuberculosis». Science 279 (5347): 98–102. January 1998. doi:. PMID 9417034. Bibcode: 1998Sci...279...98R.
- ↑ «Molecular basis for the high-affinity binding and stabilization of firefly luciferase by PTC124». Proceedings of the National Academy of Sciences of the United States of America 107 (11): 4878–4883. March 2010. doi:. PMID 20194791. Bibcode: 2010PNAS..107.4878A.
- ↑ «Multisubstrate adduct inhibitors: drug design and biological tools». Journal of Enzyme Inhibition and Medicinal Chemistry 24 (6): 1291–318. December 2009. doi:. PMID 19912064.
- ↑ 42,0 42,1 Avendano C, Menendez JC (Ιουνίου 2015). «Chapter 2.5: Inhibitors of Dihydrofolate Reductase». Medicinal Chemistry of Anticancer Drugs. Elsevier. σελίδες 54–58. ISBN 978-0-444-62667-7.
- ↑ «Antiviral drug discovery targeting to viral proteases». Current Pharmaceutical Design 12 (11): 1301–1314. 2006. doi:. PMID 16611117.
- ↑ «Proteases and protease inhibitors in infectious diseases». Medicinal Research Reviews 38 (4): 1295–1331. July 2018. doi:. PMID 29149530.
- ↑ «Recent developments of peptidomimetic HIV-1 protease inhibitors». Current Medicinal Chemistry 18 (29): 4513–37. 2011. doi:. PMID 21864279.
- ↑ 46,0 46,1 «Enzymatic Transition States and Drug Design». Chemical Reviews 118 (22): 11194–11258. November 2018. doi:. PMID 30335982.
- ↑ «Discovery and development of GS 4104 (oseltamivir): an orally active influenza neuraminidase inhibitor». Current Medicinal Chemistry 7 (6): 663–672. June 2000. doi:. PMID 10702632.
- ↑ «The design, synthesis and application of stereochemical and directional peptide isomers: a critical review». Current Protein & Peptide Science 4 (5): 339–356. October 2003. doi:. PMID 14529528.
- ↑ «Small molecule substrate phosphorylation site inhibitors of protein kinases: approaches and challenges». ACS Chemical Biology 10 (1): 175–89. January 2015. doi:. PMID 25494294.
- ↑ «Peptide inhibitors of protein kinases-discovery, characterisation and use». Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1754 (1–2): 79–99. December 2005. doi:. PMID 16182621.
- ↑ 51,0 51,1 Patrick GL (2017). «Enzymes as Drug Targets». An Introduction to Medicinal Chemistry (Sixth έκδοση). Oxford, United Kingdom: Oxford University Press. σελ. 95. ISBN 978-0-19-874969-1. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Μαρτίου 2023. Ανακτήθηκε στις 3 Ιουνίου 2022.
- ↑ «Emerging and Re-Emerging Warheads for Targeted Covalent Inhibitors: Applications in Medicinal Chemistry and Chemical Biology». Journal of Medicinal Chemistry 62 (12): 5673–5724. June 2019. doi:. PMID 30565923.
- ↑ Lundblad RL (2004). Chemical reagents for protein modification (3rd έκδοση). CRC Press. ISBN 978-0-8493-1983-9.
- ↑ «Approaches for improved identification of mechanisms of enzyme inactivation.». Progress in Biotechnology (Elsevier) 15: 77–82. January 1998. doi:. ISBN 978-0-444-82970-2. «Enzyme inactivation is generally explained as a chemical process involving several phenomena like aggregation, dissociation into subunits, or denaturation (conformational changes), which occur simultaneously during the inactivation of a specific enzyme.».
- ↑ Price N, Hames B, Rickwood D (1996). Proteins LabFax. BIOS Scientific Publishers. ISBN 978-0-12-564710-6.
- ↑ «Profiling the specific reactivity of the proteome with non-directed activity-based probes». Chemistry & Biology 8 (1): 81–95. January 2001. doi:. PMID 11182321.
- ↑ «Comparison of methods for analyzing kinetic data from mechanism-based enzyme inactivation: application to nitric oxide synthase». AAPS PharmSci 2 (1): 68–77. 2000. doi:. PMID 11741224.
- ↑ «Application of mass spectrometry for target identification and characterization». Medicinal Research Reviews 19 (4): 307–319. July 1999. doi:. PMID 10398927. https://archive.org/details/sim_medicinal-research-reviews_1999-07_19_4/page/307.
- ↑ Purich DL (2010). «Irreversible Enzyme Inhibition by Affinity Labelling Agents». Enzyme Kinetics: Catalysis and Control: A Reference of Theory and Best-Practice Methods. San Diego, Calif.: Elsevier Academic. σελ. 542. ISBN 978-0-12-380925-4. Αρχειοθετήθηκε από το πρωτότυπο στις 20 Ιουλίου 2022. Ανακτήθηκε στις 20 Ιουλίου 2022.
- ↑ «Development of a matrix-assisted laser desorption/ionization-mass spectrometry screening test to evidence reversible and irreversible inhibitors of CDC25 phosphatases». Analytical Biochemistry 430 (1): 83–91. November 2012. doi:. PMID 22902804.
- ↑ 61,0 61,1 «Mechanism of the irreversible inactivation of mouse ornithine decarboxylase by alpha-difluoromethylornithine. Characterization of sequences at the inhibitor and coenzyme binding sites». The Journal of Biological Chemistry 267 (1): 150–158. January 1992. doi:. PMID 1730582.
- ↑ Szedlacsek SE, Duggleby RG (1995). «[6] Kinetics of slow and tight-binding inhibitors». Kinetics of slow and tight-binding inhibitors. Methods in Enzymology. 249. σελίδες 144–80. doi:10.1016/0076-6879(95)49034-5. ISBN 978-0-12-182150-0. PMID 7791610.
- ↑ «Mechanism of inhibition of dihydrofolate reductases from bacterial and vertebrate sources by various classes of folate analogs». Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology 869 (3): 275–285. February 1986. doi:. PMID 3511964.
- ↑ «Reaction of formaldehyde and of methanol with xanthine oxidase». European Journal of Biochemistry 18 (1): 65–72. January 1971. doi:. PMID 4322209.
- ↑ «Herpes simplex virus type 1 and human DNA polymerase interactions with 2'-deoxyguanosine 5'-triphosphate analogs. Kinetics of incorporation into DNA and induction of inhibition». The Journal of Biological Chemistry 264 (32): 19039–19044. November 1989. doi:. PMID 2553730.
- ↑ PDB: 1GXF; «Two interacting binding sites for quinacrine derivatives in the active site of trypanothione reductase: a template for drug design». The Journal of Biological Chemistry 279 (28): 29493–500. July 2004. doi:. PMID 15102853.
- ↑ Cohen JA, Oosterbaan RA, Berends F (1967). «[81] Organophosphorus compounds». Enzyme Structure. Methods in Enzymology. 11. σελίδες 686–702. doi:10.1016/S0076-6879(67)11085-9. ISBN 978-0-12-181860-9. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Φεβρουαρίου 2018.
- ↑ Brenner GM (2000). Pharmacology (1st έκδοση). Philadelphia, PA: W.B. Saunders. ISBN 978-0-7216-7757-6.
- ↑ «Suicide substrates, mechanism-based enzyme inactivators: recent developments». Annual Review of Biochemistry 53: 493–535. 1984. doi:. PMID 6433782. https://archive.org/details/sim_annual-review-of-biochemistry_1984_53_annual/page/493.
- ↑ «Two interacting binding sites for quinacrine derivatives in the active site of trypanothione reductase: a template for drug design». The Journal of Biological Chemistry 279 (28): 29493–29500. July 2004. doi:. PMID 15102853.
- ↑ Pereira DM, Andrade C, Valentão P, Andrade PB (Οκτωβρίου 2017). «Natural products as enzyme inhibitors.» (PDF). Natural Products Targeting Clinically Relevant Enzymes (First έκδοση). Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 978-3-527-34205-1. Αρχειοθετήθηκε (PDF) από το πρωτότυπο στις 5 Δεκεμβρίου 2022. Ανακτήθηκε στις 3 Απριλίου 2022.
- ↑ «Enzyme inhibitors as chemical tools to study enzyme catalysis: rational design, synthesis, and applications». Chemical Record (New York, N.Y.) 5 (4): 209–28. 2005. doi:. PMID 16041744.
- ↑ Page C, Pitchford S (2021). «Venoms, toxins, poisons and herbs». Dale's Pharmacology Condensed E-Book (Third έκδοση). Philadelphia, Pa.: Elsevier Health Sciences. σελίδες 153–155. ISBN 978-0-7020-7819-4. Αρχειοθετήθηκε από το πρωτότυπο στις 25 Απριλίου 2013. Ανακτήθηκε στις 3 Ιουνίου 2022.
- ↑ Stenersen J (2004). «Chapter 5: Specific Enzyme Inhibitors». Chemical Pesticides Mode of Action and Toxicology. Boca Raton: CRC Press. σελίδες 73–114. ISBN 978-0-203-64683-0. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Μαρτίου 2023. Ανακτήθηκε στις 14 Απριλίου 2022.
- ↑ Greathouse B, Zahra F, Brady MF (Σεπτεμβρίου 2021). «Acetylcholinesterase Inhibitors Toxicity». StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. PMID 30571049. Αρχειοθετήθηκε από το πρωτότυπο στις 17 Ιανουαρίου 2023. Ανακτήθηκε στις 14 Απριλίου 2022.
- ↑ Orencio-Trejo M, Utrilla J, Fernández-Sandoval MT, Huerta-Beristain G, Gosset G, Martinez A (2010). «Engineering the Escherichia coli Fermentative Metabolism». Στο: Cordes M, Wittmann C, Krull R. Biosystems Engineering II: Linking Cellular Networks and Bioprocesses. Berlin: Springer Science & Business Media. σελίδες 77–78. ISBN 978-3-642-13865-2.
- ↑ «Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes». BioFactors 10 (1): 1–14. 1999. doi:. PMID 10475585.
- ↑ Price NC, Stevens L (1999). Fundamentals of enzymology : the cell and molecular biology of catalytic proteins (3rd έκδοση). Oxford University Press. ISBN 978-0-19-850229-6.
- ↑ «Substrate variants versus transition state analogues as noncovalent reversible enzyme inhibitors». Bioorganic & Medicinal Chemistry 12 (15): 4081–4088. August 2004. doi:. PMID 15246086. https://zenodo.org/record/998967. Ανακτήθηκε στις 14 April 2022.
- ↑ «Barnase and barstar: two small proteins to fold and fit together». Trends in Biochemical Sciences 14 (11): 450–454. November 1989. doi:. PMID 2696173.
- ↑ Maheshwari VL (2022). Natural Products as Enzyme Inhibitors. Singapore: Springer. ISBN 978-981-19-0932-0.
- ↑ Birk Y (2003). Plant Protease Inhibitors: Significance in Nutrition, Plant Protection, Cancer Prevention and Genetic Engineering. Berlin: Springer. ISBN 978-3-540-00118-8.
- ↑ «Biodiversity as a source of anticancer drugs». Current Drug Targets 7 (3): 265–277. March 2006. doi:. PMID 16515527.
- ↑ «Taxanes: microtubule and centrosome targets, and cell cycle dependent mechanisms of action». Current Cancer Drug Targets 3 (3): 193–203. June 2003. doi:. PMID 12769688.
- ↑ «Natural Product Inhibitors of Acetylcholinesterase». Current Organic Chemistry 10 (8): 825–847. 2006. doi:.
- ↑ «A Systematic Review and Meta-Analysis of the Effectiveness of Acetylcholinesterase Inhibitors and Memantine in Treating the Cognitive Symptoms of Dementia». Dementia and Geriatric Cognitive Disorders 45 (3–4): 131–151. 2018. doi:. PMID 29734182.
- ↑ «Antimuscarinic intoxication resulting from the ingestion of moonflower seeds». The Annals of Pharmacotherapy 39 (1): 173–176. January 2005. doi:. PMID 15572604. https://archive.org/details/sim_annals-of-pharmacotherapy_2005-01_39_1/page/173.
- ↑ «Toxins of Amanita phalloides». Toxicon 36 (1): 13–24. January 1998. doi:. PMID 9604278. https://archive.org/details/sim_toxicon_1998-01_36_1/page/13.
- ↑ «Molecular enzymology underlying regulation of protein phosphatase-1 by natural toxins». Current Medicinal Chemistry 9 (22): 1981–1989. November 2002. doi:. PMID 12369866.
- ↑ «The toxicology of microcystin-LR: occurrence, toxicokinetics, toxicodynamics, diagnosis and treatment». Veterinary and Human Toxicology 43 (5): 294–297. October 2001. PMID 11577938.
- ↑ Savage GP, Morrison SC (2003). «Trypsin inhibitors.». Στο: Caballero B. Encyclopedia of Food Sciences and Nutrition (Second έκδοση). Academic Press. σελίδες 5878–5884. doi:10.1016/B0-12-227055-X/00934-2. ISBN 978-0-12-227055-0.
- ↑ «Ricin: An Ancient Story for a Timeless Plant Toxin». Toxins 11 (6): 324. June 2019. doi:. PMID 31174319.
- ↑ «Intracellular Transport and Cytotoxicity of the Protein Toxin Ricin». Toxins 11 (6): 350. June 2019. doi:. PMID 31216687.
- ↑ «Cytotoxic ribosome-inactivating lectins from plants». Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1701 (1–2): 1–14. September 2004. doi:. PMID 15450171.
- ↑ 95,0 95,1 Finkel R, Cubeddu LX, Clark MA (2009). «Chapter 41: Antiinfammatory Drugs». Pharmacology (4th έκδοση). Philadelphia: Lippincott Williams & Wilkins. σελίδες 499–518 (502). ISBN 978-0-7817-7155-9. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Μαρτίου 2023. Ανακτήθηκε στις 14 Απριλίου 2022.
- ↑ 96,0 96,1 «A comprehensive map of molecular drug targets». Nature Reviews. Drug Discovery 16 (1): 19–34 (Figure 1C). January 2017. doi:. PMID 27910877. «Figure 1C: Clinical success of privileged protein family classes (% approved drugs targeting each target class): Reductase 7.62, Kinase 5.94, Protease 3.35, Hydrolase 2.76, NPTase 2.09, Transferase 1.92, Lyase 1.59, Isomerase 1.51, Phosphodiesterase 1.50, Cytochrome p450 0.84, Epigenetic eraser 0.33, Total enzyme targets of approved drugs = 29.45%».
- ↑ «A comprehensive review of protein kinase inhibitors for cancer therapy». Expert Review of Anticancer Therapy 18 (12): 1249–1270. December 2018. doi:. PMID 30259761.
- ↑ «Current and future status of JAK inhibitors». Lancet 398 (10302): 803–816. August 2021. doi:. PMID 34454676.
- ↑ «Anticancer antifolates: current status and future directions». Current Pharmaceutical Design 9 (31): 2593–2613. 2003. doi:. PMID 14529544.
- ↑ «The Serendipitous Story of Sildenafil: An Unexpected Oral Therapy for Erectile Dysfunction». Sexual Medicine Reviews 7 (1): 115–128. January 2019. doi:. PMID 30301707.
- ↑ «Erectile dysfunction: from biochemical pharmacology to advances in medical therapy». European Journal of Endocrinology 143 (2): 143–154. August 2000. doi:. PMID 10913932.
- ↑ «Breaking down the cell wall: Strategies for antibiotic discovery targeting bacterial transpeptidases». European Journal of Medicinal Chemistry 194: 112262. May 2020. doi:. PMID 32248005. https://pure.qub.ac.uk/en/publications/breaking-down-the-cell-wall-strategies-for-antibiotic-discovery-targeting-bacterial-transpeptidases(e1bd1fbf-37a6-44ce-afdf-cc255bf217e6).html. Ανακτήθηκε στις 20 July 2022.
- ↑ «Cutting and stitching: the cross-linking of peptidoglycan in the assembly of the bacterial cell wall». ACS Chemical Biology 2 (9): 602–5. September 2007. doi:. PMID 17894443.
- ↑ «Selective toxicity of antibacterial agents-still a valid concept or do we miss chances and ignore risks?». Infection 49 (1): 29–56. February 2021. doi:. PMID 33367978.
- ↑ «How do antibiotics kill bacterial cells but not human cells?». Scientific American 294 (6): 98. 13 March 2006. PMID 16711368. https://www.scientificamerican.com/article/how-do-antibiotics-kill-b/. Ανακτήθηκε στις 9 April 2022.
- ↑ «Ribosome-targeting antibacterial agents: Advances, challenges, and opportunities». Medicinal Research Reviews 41 (4): 1855–1889. July 2021. doi:. PMID 33501747.
- ↑ «Bacterial fatty acid metabolism in modern antibiotic discovery». Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids 1862 (11): 1300–1309. November 2017. doi:. PMID 27668701.
- ↑ Li G, Jing X, Pan, Zhang P, De Clercq E (2021). «Antiviral Classification». Στο: Bamford D, Zuckerman MA. Encyclopedia of Virology. 5 (4th έκδοση). Amsterdam: Academic Press. σελίδες 129–130. doi:10.1016/B978-0-12-814515-9.00126-0
 . ISBN 978-0-12-814516-6. OCLC 1240584737.
. ISBN 978-0-12-814516-6. OCLC 1240584737.
- ↑ «Protease Inhibitors for the Treatment of HIV/AIDS: Recent Advances and Future Challenges». Current Topics in Medicinal Chemistry 19 (18): 1571–1598. 2019. doi:. PMID 31237209.
- ↑ «Protease inhibitor therapy for hepatitis C virus-infection». Expert Opinion on Pharmacotherapy 19 (6): 577–587. April 2018. doi:. PMID 29595065.
- ↑ «Approved HIV reverse transcriptase inhibitors in the past decade». Acta Pharmaceutica Sinica B 12 (4): 1567–1590. April 2022. doi:. PMID 35847492.
- ↑ «Antivirals Targeting the Neuraminidase». Cold Spring Harbor Perspectives in Medicine 12 (1): a038455. January 2022. doi:. PMID 32152244.
- ↑ «Targeting the terminase: An important step forward in the treatment and prophylaxis of human cytomegalovirus infections». Antiviral Research 161: 116–124. January 2019. doi:. PMID 30472161.
- ↑ Kuhr RJ, Dorough HW (1976). Carbamate Insecticides: Chemistry, Biochemistry, and Toxicology. Cleveland: CRC Press. ISBN 978-0-87819-052-2.
- ↑ Stone TW (Οκτωβρίου 2020). CNS Neurotransmitters and Neuromodulators: Acetylcholine (1st έκδοση). Boca Raton: CRC Press. ISBN 978-1-00-009898-3.
- ↑ Gupta RC (2006). «Classification and Uses of Organophosphates and Carbamates». Στο: Gupta RC. Toxicology of Organophosphate and Carbamate Compounds. Amsterdam: Elsevier Academic Press. σελίδες 5–24. ISBN 978-0-08-054310-9. Αρχειοθετήθηκε από το πρωτότυπο στις 21 Ιουλίου 2022. Ανακτήθηκε στις 21 Ιουλίου 2022.
- ↑ «Treatment of Myasthenia Gravis». Neurologic Clinics 36 (2): 311–337. May 2018. doi:. PMID 29655452.
- ↑ Butterworth JF, IV, Mackey DC, Wasnick JD, επιμ. (2013). «Chapter 12. Cholinesterase Inhibitors & Other Pharmacologic Antagonists to Neuromuscular Blocking Agents.». Morgan & Mikhail's Clinical Anesthesiology (5th έκδοση). McGraw Hill. Αρχειοθετήθηκε από το πρωτότυπο στις 30 Ιουνίου 2022. Ανακτήθηκε στις 9 Απριλίου 2022.
- ↑ «Acetylcholinesterase: A Primary Target for Drugs and Insecticides». Mini Reviews in Medicinal Chemistry 17 (17): 1665–1676. 2017. doi:. PMID 28117022.
- ↑ «Herbicidal inhibitors of amino acid biosynthesis and herbicide-tolerant crops». Amino Acids 30 (2): 195–204. March 2006. doi:. PMID 16547651.
- ↑ Hirai K, Uchida A, Ohno R (2012). «Major Synthetic Routes for Modern Herbicide Classes and Agrochemical Characteristics». Στο: Böger P, Wakabayashi K, Hirai K. Herbicide Classes in Development. Springer Science & Business Media. σελίδες 179–195. doi:10.1007/978-3-642-59416-8_10. ISBN 978-3-642-59416-8. Αρχειοθετήθηκε από το πρωτότυπο στις 27 Ιουνίου 2022. Ανακτήθηκε στις 27 Ιουνίου 2022.
Chapter 10.2.1: Sulfonylurea acetolactate synthase inhibitors
- ↑ «Overview of herbicide mechanisms of action». Environmental Health Perspectives 87: 263–271. July 1990. doi:. PMID 1980104. PMC 1567841. https://archive.org/details/sim_environmental-health-perspectives_1990-07_87/page/263.
- ↑ Ganguly AK, Alluri SS (12 Σεπτεμβρίου 2021). «Chapter 2: Enzyme Inhibitors». Medicinal Chemistry: A Look at How Drugs Are Discovered. Boca Raton, Florida: CRC Press. σελίδες 29–68. ISBN 978-1-00-043721-8.
- ↑ «Drug discovery for enzymes». Drug Discovery Today 26 (4): 875–886. April 2021. doi:. PMID 33454380.
- ↑ Lindquist RN (Οκτωβρίου 2013). «The design of enzyme inhibitors: Transition state analogues.». Στο: Ariëns EJ. Drug Design: Medicinal Chemistry: A Series of Monographs. 5. Elsevier. σελίδες 24–80.
- ↑ «Structural biology and drug discovery». Current Pharmaceutical Design 12 (17): 2087–2097. 2006. doi:. PMID 16796557.
- ↑ «Approaches to the description and prediction of the binding affinity of small-molecule ligands to macromolecular receptors». Angewandte Chemie 41 (15): 2644–2676. August 2002. doi:. PMID 12203463.
- ↑ «Automated medicinal chemistry». Drug Discovery Today 11 (11–12): 561–568. June 2006. doi:. PMID 16713909.
- ↑ «Fragment-based approaches to enzyme inhibition». Current Opinion in Biotechnology 18 (6): 489–96. December 2007. doi:. PMID 17959370.
- ↑ «Selections and screenings of DNA-encoded chemical libraries against enzyme and cellular targets». Bioorganic & Medicinal Chemistry Letters 39: 127851. May 2021. doi:. PMID 33631371.
- ↑ Perez O, Pena J, Fernandez-Vega V, Scampavia L, Spicer T (2019). «Chapter 4: High Throughput Screening». Drug Discovery and Development. Boca Raton, Florida: CRC Press. σελίδες 47–69. ISBN 978-1-315-11347-0.
- ↑ «Covalent Docking in Drug Discovery: Scope and Limitations». Current Pharmaceutical Design 26 (44): 5684–5699. 2020. doi:. PMID 33155894.
- ↑ «Mechanisms of Proteolytic Enzymes and Their Inhibition in QM/MM Studies». International Journal of Molecular Sciences 22 (6): 3232. March 2021. doi:. PMID 33810118.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- «BRENDA». Αρχειοθετήθηκε από το πρωτότυπο στις 1 Απριλίου 2022., Database of enzymes giving lists of known inhibitors for each entry
- «PubChem». National Center for Biotechnology Information. National Library of Medicine. Database of drugs and enzyme inhibitors
- «Symbolism and Terminology in Enzyme Kinetics». Αρχειοθετήθηκε από το πρωτότυπο στις 20 Ιουνίου 2006. Recommendations of the Nomenclature Committee of the International Union of Biochemistry (NC-IUB) on enzyme inhibition terminology

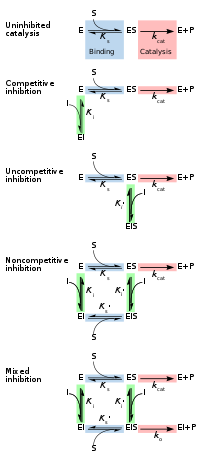

![{\displaystyle {\begin{aligned}{\cfrac {V_{\max }}{1+{\cfrac {\ce {[I]}}{K_{i}}}}}&={V_{\max }}\left({\cfrac {K_{i}}{K_{i}+[{\ce {I}}]}}\right)&&{\text{πολλαπλασιασμός επί }}{\cfrac {K_{i}}{K_{i}}}=1\\&={V_{\max }}\left({\cfrac {K_{i}+[{\ce {I}}]-[{\ce {I}}]}{K_{i}+[{\ce {I}}]}}\right)&&{\text{προσθήκη }}[{\ce {I}}]-[{\ce {I}}]=0{\text{ στον αριθμητή}}\\&={V_{\max }}\left(1-{\cfrac {[{\ce {I}}]}{K_{i}+[{\ce {I}}]}}\right)&&{\text{απλοποίηση }}{\cfrac {K_{i}+[{\ce {I}}]}{K_{i}+[{\ce {I}}]}}=1\\&=V_{\max }-V_{\max }{\cfrac {\ce {[I]}}{K_{i}+[{\ce {I}}]}}&&{\text{πολλαπλασιασμένο με }}V_{\max }\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b48b4a9c1617732f0608cab9c6f6114e1df1bfc5)
![{\displaystyle {\cfrac {\ce {[S]}}{[{\ce {S}}]+K_{m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb08dd139085a394e6e7370f47ebfa255f1ad685)
![{\displaystyle {\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ed50a1f7a5f2c52f406b52263916ab48b268e07)
![{\displaystyle V_{\max }-\Delta V_{\max }{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dff424ec79284c3a1cea14f0f82b0eaace53c69)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3874623edd9524ba2741fe448927bf5cf0ab257)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[X]}}{[{\ce {X}}]+K_{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/306d44733a89308883053e3b8372a8cf9ce0239b)
![{\displaystyle K_{m1}-(K_{m1}-K_{m2}){\cfrac {\ce {[X]}}{[{\ce {X}}]+K_{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4e0de216e1e625bb803ee725bf85c9989a15f5)
![{\displaystyle V={\frac {V_{max}[S]}{\alpha K_{m}+\alpha ^{\prime }[S]}}={\frac {(1/\alpha ^{\prime })V_{max}[S]}{(\alpha /\alpha ^{\prime })K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![{\displaystyle \alpha =1+{\frac {[I]}{K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![{\displaystyle \alpha ^{\prime }=1+{\frac {[I]}{K_{i}^{\prime }}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/65bf16742482cae7b0743781f47c327ddcf537e3)