Ενδομήτριο

Το ενδομήτριο είναι το εσωτερικό επιθηλιακό στρώμα, μαζί με τη βλεννογόνο μεμβράνη του, της μήτρας των θηλαστικών. Έχει ένα βασικό στρώμα και ένα λειτουργικό στρώμα: το βασικό στρώμα περιέχει βλαστοκύτταρα που αναγεννούν το λειτουργικό στρώμα.[1] Το λειτουργικό στρώμα παχύνεται και στη συνέχεια αποβάλλεται κατά τη διάρκεια της εμμήνου ρύσεως στους ανθρώπους και ορισμένα άλλα θηλαστικά, συμπεριλαμβανομένων των πιθήκων, ορισμένων ειδών νυχτερίδας, του ελέφαντα[2] και του ακανθοπόντικα του Καΐρου.[3] Στα περισσότερα άλλα θηλαστικά, το ενδομήτριο επαναρροφάται στον οιστρικό κύκλο. Κατά τη διάρκεια της εγκυμοσύνης, οι αδένες και τα αιμοφόρα αγγεία στο ενδομήτριο αυξάνονται περαιτέρω σε μέγεθος και αριθμό. Οι αγγειακοί χώροι συγχωνεύονται και αλληλοσυνδέονται, σχηματίζοντας τον πλακούντα, ο οποίος παρέχει οξυγόνο και θρεπτικά στοιχεία στο έμβρυο.[4] Η εικαζόμενη παρουσία ενδομήτριας μικροχλωρίδας[5] είναι ακόμη αμφιλεγόμενη.[6][7]
Δομή
[Επεξεργασία | επεξεργασία κώδικα]

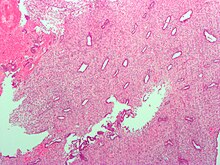
Το ενδομήτριο αποτελείται από ένα ενιαίο στρώμα στηλοειδούς επιθηλίου συν το στρώμα στο οποίο στηρίζεται. Το στρώμα είναι ένα στρώμα συνδετικού ιστού που ποικίλλει σε πάχος ανάλογα με τις ορμονικές επιδράσεις. Στη μήτρα, απλοί σωληνοειδείς αδένες φτάνουν από την επιφάνεια του ενδομητρίου μέχρι τη βάση του στρώματος, το οποίο διαθέτει πλούσια παροχή αίματος που παρέχεται από τις σπειροειδείς αρτηρίες. Σε άτομα αναπαραγωγικής ηλικίας με μήτρα, διακρίνονται δύο στρώματα ενδομητρίου. Αυτά τα δύο στρώματα εμφανίζονται μόνο στο ενδομήτριο που καλύπτει την κοιλότητα της μήτρας και όχι στην επένδυση των σαλπίγγων.[4]
- Το λειτουργικό στρώμα βρίσκεται δίπλα στην κοιλότητα της μήτρας. Αυτό το στρώμα συσσωρεύεται μετά το τέλος της εμμήνου ρύσεως κατά το πρώτο μέρος του προηγούμενου εμμηνορροϊκού κύκλου. Ο πολλαπλασιασμός προκαλείται από ta οιστρογόνα (θυλακική φάση του εμμηνορροϊκού κύκλου) και οι μετέπειτα αλλαγές σε αυτό το στρώμα προκαλούνται από την προγεστερόνη από το ωχρό σωμάτιο (ωχρινική φάση). Είναι προσαρμοσμένο για να παρέχει το βέλτιστο περιβάλλον για την εμφύτευση και την ανάπτυξη του εμβρύου. Αυτό το στρώμα αποβάλλεται εντελώς κατά τη διάρκεια της εμμήνου ρύσεως.
- Η βασική στιβάδα, δίπλα στο μυομήτριο και κάτω από τη λειτουργική στιβάδα, δεν αποβάλλεται κατά τη διάρκεια του εμμηνορροϊκού κύκλου. Περιέχει βλαστοκύτταρα που αναγεννούν το λειτουργικό στρώμα,[1] που αναπτύσσεται πάνω του.
Απουσία προγεστερόνης, οι αρτηρίες που παρέχουν αίμα στο λειτουργικό στρώμα συστέλλονται, με αποτέλεσμα τα κύτταρα σε αυτό το στρώμα να ισχαιμούν και πεθαίνουν, οδηγώντας σε έμμηνο ρύση.
Είναι δυνατό να προσδιοριστεί η φάση του εμμηνορροϊκού κύκλου με αναφορά είτε στον ωοθηκικό κύκλο είτε στον κύκλο της μήτρας, παρατηρώντας μικροσκοπικές διαφορές σε κάθε φάση — για παράδειγμα στον ωοθηκικό κύκλο:
| Φάση | Ημέρες | Πάχος | Επιθήλιο |
|---|---|---|---|
| Εμμηνορροϊκή φάση | 1–5 | Λεπτό | Απών |
| Θυλακική φάση | 5–14 | Ενδιάμεσο | Στηλοειδές |
| Ωχρινική φάση | 15–27 | Παχύ | Στηλοειδές. Επίσης ορατά είναι τα τοξοειδή αγγεία της μήτρας |
| Ισχαιμική φάση | 27–28 | Στηλοειδές. Επίσης ορατά είναι τα τοξοειδή αγγεία της μήτρας |
Παρουσία μικροβιώματος
[Επεξεργασία | επεξεργασία κώδικα]Η μήτρα και το ενδομήτριο θεωρούνταν για μεγάλο χρονικό διάστημα στείρα. Το τραχηλικό βύσμα του βλεννογόνου φάνηκε ότι εμποδίζει την είσοδο οποιωνδήποτε μικροοργανισμών ανεβαίνουν από τον κόλπο. Στη δεκαετία του 1980 αυτή η άποψη αμφισβητήθηκε όταν αποδείχθηκε ότι οι λοιμώξεις της μήτρας μπορούσαν να προκύψουν από αδυναμίες στο φράγμα του τραχηλικού βύσματος. Οι οργανισμοί από τη μικροχλωρίδα του κόλπου θα μπορούσαν να εισέλθουν στη μήτρα κατά τις συσπάσεις της μήτρας στον εμμηνορροϊκό κύκλο. Περαιτέρω μελέτες προσπάθησαν να εντοπίσουν μικροβιακή χλωρίδα ειδικά για τη μήτρα που θα βοηθούσε στον εντοπισμό περιπτώσεων ανεπιτυχούς εξωσωματικής γονιμοποίησης και αποβολών. Τα ευρήματά τους θεωρήθηκαν αναξιόπιστα λόγω της πιθανότητας διασταυρούμενης μόλυνσης στις διαδικασίες δειγματοληψίας που χρησιμοποιήθηκαν. Η καλά τεκμηριωμένη παρουσία των ειδών Lactobacillus, για παράδειγμα, εξηγήθηκε εύκολα από την αύξηση του κολπικού πληθυσμού που μπορεί να εισχωρήσει στον βλεννογόνο του τραχήλου της μήτρας.[6] Μια άλλη μελέτη τόνισε τα ελαττώματα των προηγούμενων μελετών, συμπεριλαμβανομένης της διασταυρούμενης μόλυνσης. Υποστηρίχθηκε επίσης ότι τα στοιχεία από μελέτες που χρησιμοποιούν απογόνους αξενικών ζώων χωρίς μικρόβια έδειξαν ξεκάθαρα τη στειρότητα της μήτρας. Οι συγγραφείς κατέληξαν στο συμπέρασμα ότι υπό το φως αυτών των ευρημάτων δεν υπήρχε ύπαρξη μικροβιώματος.[7]
Η φυσιολογική κυριαρχία των γαλακτοβάκιλλων στον κόλπο θεωρείται ως δείκτης για την υγεία του κόλπου. Ωστόσο, στη μήτρα αυτός ο πολύ χαμηλότερος πληθυσμός θεωρείται επεμβατικός σε ένα κλειστό περιβάλλον που ρυθμίζεται σε μεγάλο βαθμό από τις γυναικείες σεξουαλικές ορμόνες και αυτό θα μπορούσε να έχει ανεπιθύμητες συνέπειες. Σε μελέτες ενδομητρίωσης ο λακτοβάκιλλος δεν είναι ο κυρίαρχος τύπος και υπάρχουν υψηλότερα επίπεδα ειδών στρεπτόκοκκου και σταφυλόκοκκου. Οι μισές από τις περιπτώσεις βακτηριακής κολπίτιδας έδειξαν την παρουσία πολυμικροβιακής βιομεμβράνης στο ενδομήτριο.[6]
Λειτουργία
[Επεξεργασία | επεξεργασία κώδικα]Το ενδομήτριο είναι το εσώτερο στρώμα της μήτρας και έχει ως λειτουργία να αποτρέπει τις συμφύσεις μεταξύ των απέναντι τοιχωμάτων του μυομητρίου, διατηρώντας έτσι τη βατότητα της κοιλότητας της μήτρας.[8] Κατά τη διάρκεια του εμμηνορροϊκού κύκλου ή του οιστρικού κύκλου, το ενδομήτριο αναπτύσσεται σε ένα παχύ, πλούσιο σε αιμοφόρα αγγεία στρώμα αδενικού ιστού. Αυτό αντιπροσωπεύει το βέλτιστο περιβάλλον για την εμφύτευση μιας βλαστοκύστης κατά την άφιξή της στη μήτρα. Το ενδομήτριο είναι κεντρικό, ηχογενές (ανιχνεύεται με υπερήχους) και έχει μέσο πάχος 6,7 mm.
Κατά τη διάρκεια της εγκυμοσύνης, οι αδένες και τα αιμοφόρα αγγεία στο ενδομήτριο αυξάνονται περαιτέρω σε μέγεθος και αριθμό. Οι αγγειακοί χώροι συγχωνεύονται και αλληλοσυνδέονται, σχηματίζοντας τον πλακούντα, ο οποίος παρέχει οξυγόνο και θρεπτικά συστατικά στο έμβρυο.
Κύκλος
[Επεξεργασία | επεξεργασία κώδικα]Το λειτουργικό στρώμα της επένδυσης του ενδομητρίου υφίσταται κυκλική αναγέννηση από βλαστοκύτταρα στη βασική στιβάδα.[1] Οι άνθρωποι, οι πίθηκοι και ορισμένα άλλα είδη εμφανίζουν τον εμμηνορροϊκό κύκλο, ενώ τα περισσότερα άλλα θηλαστικά υπόκεινται σε κύκλο οίστρου.[2] Και στις δύο περιπτώσεις, το ενδομήτριο αρχικά πολλαπλασιάζεται υπό την επίδραση των οιστρογόνων. Ωστόσο, μόλις συμβεί η ωορρηξία, η ωοθήκη (ειδικά το ωχρό σωμάτιο) θα παράγει πολύ μεγαλύτερες ποσότητες προγεστερόνης. Αυτό αλλάζει το πολλαπλασιαστικό σχέδιο του ενδομητρίου προς μια εκκριτική επένδυση. Τελικά, η εκκριτική επένδυση παρέχει ένα φιλόξενο περιβάλλον για μία ή περισσότερες βλαστοκύστες.
Κατά τη γονιμοποίηση, το ωάριο μπορεί να εμφυτευτεί στο τοίχωμα της μήτρας και να παρέχει ανατροφοδότηση στο σώμα παράγοντας ανθρώπινη χοριακή γοναδοτροπίνη (hCG). Η hCG παρέχει συνεχή ανατροφοδότηση σε όλη τη διάρκεια της εγκυμοσύνης διατηρώντας το ωχρό σωμάτιο, το οποίο θα συνεχίσει τον ρόλο του να απελευθερώνει προγεστερόνη και οιστρογόνα. Σε περίπτωση εμφύτευσης, η επένδυση του ενδομητρίου παραμένει ως φθαρτός υμένας. Ο φθαρτός υμένας γίνεται μέρος του πλακούντα. Παρέχει υποστήριξη και προστασία για την κύηση.
Χωρίς την εμφύτευση γονιμοποιημένου ωαρίου, η επένδυση του ενδομητρίου είτε επαναρροφάται (οιστρικός κύκλος) είτε αποβάλλεται (έμμηνος κύκλος). Στη δεύτερη περίπτωση, η διαδικασία αποβολής περιλαμβάνει τη διάσπαση του βλεννογόνου, το σχίσιμο μικρών συνδετικών αιμοφόρων αγγείων και την απώλεια του ιστού και του αίματος που το αποτελούσαν μέσω του κόλπου. Η όλη διαδικασία λαμβάνει χώρα σε διάστημα αρκετών ημερών. Η έμμηνος ρύση μπορεί να συνοδεύεται από μια σειρά συσπάσεων της μήτρας οι οποίες βοηθούν στην αποβολή του εμμηνορροϊκού ενδομητρίου.
Εάν υπάρχει ανεπαρκής διέγερση της επένδυσης, λόγω έλλειψης ορμονών, το ενδομήτριο παραμένει λεπτό και ανενεργό. Στους ανθρώπους, αυτό θα οδηγήσει σε αμηνόρροια ή απουσία εμμήνου ρύσεως. Μετά την εμμηνόπαυση, η επένδυση συχνά περιγράφεται ως ατροφική. Αντίθετα, το ενδομήτριο που είναι χρόνια εκτεθειμένο σε οιστρογόνα, αλλά όχι στην προγεστερόνη, μπορεί να γίνει υπερπλαστικό. Η μακροχρόνια χρήση από του στόματος αντισυλληπτικών με ιδιαίτερα ισχυρές προγεστίνες μπορεί επίσης να προκαλέσει ατροφία του ενδομητρίου.[9][10]
Στον άνθρωπο, ο κύκλος δημιουργίας και αποβολής της ενδομήτριας επένδυσης διαρκεί κατά μέσο όρο 28 ημέρες. Το ενδομήτριο αναπτύσσεται με διαφορετικούς ρυθμούς σε διαφορετικά θηλαστικά. Διάφοροι παράγοντες, όπως οι εποχές, το κλίμα και το άγχος μπορούν να επηρεάσουν την ανάπτυξή του. Το ίδιο το ενδομήτριο παράγει ορισμένες ορμόνες σε διαφορετικά στάδια του κύκλου και αυτό επηρεάζει άλλα μέρη του αναπαραγωγικού συστήματος.
Ασθένειες που σχετίζονται με το ενδομήτριο
[Επεξεργασία | επεξεργασία κώδικα]
(Α) πολλαπλασιαστικό ενδομήτριο (Αριστερά: HE × 400) και πολλαπλασιαστικά ενδομήτρια κύτταρα (Δεξιά: HE × 100)
(Β) εκκριτικό ενδομήτριο (Αριστερά: HE × 10) και εκκριτικά ενδομήτρια κύτταρα (Δεξιά: HE × 10)
(Γ) ατροφικό ενδομήτριο (Αριστερά: HE × 10) και ατροφικά ενδομήτρια κύτταρα (Δεξιά: HE × 10)
(D) μικτό ενδομήτριο (Αριστερά: HE × 10) και μικτά ενδομήτρια κύτταρα (Δεξιά: HE × 10)
(Ε): άτυπη υπερπλασία του ενδομητρίου (αριστερά: HE × 10) και άτυπα κύτταρα ενδομητρίου (Δεξιά: HE × 200)
(ΣΤ) καρκίνωμα ενδομητρίου (Αριστερά: HE × 400) και καρκινικά κύτταρα ενδομητρίου (Δεξιά: HE × 400).
Ο χοριακός ιστός μπορεί να οδηγήσει σε έντονες ενδομήτριες αλλαγές, γνωστές ως αντίδραση Αρίας-Στέλλα, που έχουν εμφάνιση παρόμοια με καρκίνο.[11] Ιστορικά, αυτή η αλλαγή διαγνώστηκε ως καρκίνος του ενδομητρίου και είναι σημαντική μόνο στο βαθμό που δεν θα έπρεπε να διαγνωστεί λανθασμένα ως καρκίνος.
- Η αδενομύωση είναι η ανάπτυξη του ενδομητρίου στο μυϊκό στρώμα της μήτρας (το μυομήτριο).
- Η ενδομητρίωση είναι η ανάπτυξη ιστού παρόμοιου με το ενδομήτριο, έξω από τη μήτρα.[12]
- Υπερπλασία ενδομητρίου
- Ο καρκίνος του ενδομητρίου είναι ο πιο συχνός καρκίνος του ανθρώπινου γυναικείου γεννητικού συστήματος.
- Το σύνδρομο Άσερμαν, γνωστό και ως ενδομήτριες συμφύσεις, εμφανίζεται όταν η βασική στιβάδα του ενδομητρίου έχει υποστεί βλάβη από όργανα (π.χ. απόξεση) ή μόλυνση (π.χ. φυματίωση ενδομητρίου) με αποτέλεσμα σκλήρυνση του ενδομητρίου και σχηματισμό συμφύσεων που εξαλείφουν μερικώς ή πλήρως την κοιλότητα της μήτρας.
Το λεπτό ενδομήτριο μπορεί να οριστεί ως πάχος ενδομήτριου μικρότερο από 8 mm. Εμφανίζεται συνήθως μετά την εμμηνόπαυση . Οι θεραπείες που μπορούν να βελτιώσουν το πάχος του ενδομητρίου περιλαμβάνουν βιταμίνη Ε, L-αργινίνη και κιτρική σιλδεναφίλη.[13]

Η παρατήρηση του ενδομητρίου με διακολπικό υπερηχογράφημα χρησιμοποιείται κατά τη χορήγηση αγωγής γονιμότητας, όπως η εξωσωματική γονιμοποίηση. Κατά τη στιγμή της εμβρυομεταφοράς, είναι ευνοϊκό το ενδομήτριο να έχει πάχος μεταξύ 7 και 14 mm με διαμόρφωση τριπλής γραμμής,[14] που σημαίνει ότι το ενδομήτριο περιέχει μια υπερηχική (συνήθως εμφανίζεται ως φωτεινή) γραμμή στο μέση που περιβάλλεται από δύο ακόμη υποηχητικές (πιο σκοτεινές) γραμμές. Ένα ενδομήτριο τριπλής γραμμής αντανακλά το διαχωρισμό της βασικής στιβάδας και της λειτουργικής στιβάδας, και παρατηρείται επίσης στην περίοδο της περιωορρηξίας δευτερογενώς στην αύξηση των επιπέδων οιστραδιόλης και εξαφανίζεται μετά την ωορρηξία.[15]
Πάχος ενδομητρίου μικρότερο από 7 mm μειώνει το ποσοστό εγκυμοσύνης στην εξωσωματική γονιμοποίηση κατά λόγο απόδοσης περίπου 0,4 σε σύγκριση με πάχος άνω των 7 mm. Ωστόσο, τόσο μικρό πάχος εμφανίζεται σπάνια και οποιαδήποτε τακτική χρήση αυτής της παραμέτρου θεωρείται αδικαιολόγητη. Το βέλτιστο πάχος του ενδομητρίου είναι 10mm.[16]
Προστασία του ενδομητρίου
[Επεξεργασία | επεξεργασία κώδικα]Τα οιστρογόνα διεγείρουν τον πολλαπλασιασμό του ενδομητρίου και την καρκινογένεση.[17][18][19] Αντίθετα, τα προγεσταγόνα αναστέλλουν τον πολλαπλασιασμό του ενδομητρίου και την καρκινογένεση που προκαλείται από τα οιστρογόνα και διεγείρουν τη διαφοροποίηση του ενδομητρίου σε φθαρτό υμένα, η οποία ονομάζεται ενδομήτριος μετασχηματισμός ή φθαρτοποίηση.[17][18][19] Αυτό προκαλείται από τα προγεσταγόνα και λειτουργικά αντιοιστρογόνα αποτελέσματα των προγεσταγόνων σε αυτόν τον ιστό.[18] Αυτές οι επιδράσεις των προγεσταγόνων και η προστασία τους από την υπερπλασία του ενδομητρίου και τον καρκίνο του ενδομητρίου που προκαλείται από τα οιστρογόνα αναφέρονται ως προστασία του ενδομητρίου.[17][18][19]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 Gargett, C.E.; Schwab, K.E.; Zillwood, R.M.; Nguyen, H.P.; Wu, D. (June 2009). «Isolation and culture of epithelial progenitors and mesenchymal stem cells from human endometrium.» (στα αγγλικά). Biology of Reproduction 80 (6): 1136–1145. doi:. PMID 19228591.
- ↑ 2,0 2,1 Emera, D; Romero, R; Wagner, G (January 2012). «The evolution of menstruation: a new model for genetic assimilation: explaining molecular origins of maternal responses to fetal invasiveness.». BioEssays 34 (1): 26–35. doi:. PMID 22057551.
- ↑ Bellofiore, N.; Ellery, S.; Mamrot, J.; Walker, D.; Temple-Smith, P.; Dickinson, H. (2016-06-03). «First evidence of a menstruating rodent: the spiny mouse (Acomys cahirinus)» (στα αγγλικά). bioRxiv 216 (1): 40.e1–40.e11. doi:. PMID 27503621. https://www.biorxiv.org/content/10.1101/056895v1.
- ↑ 4,0 4,1 «Chapter 81 Female Physiology Before Pregnancy and Female Hormones». Textbook of Medical Physiology (11th έκδοση). Elsevier Saunders. 2006. σελίδες 1018ff. ISBN 9780721602400.
- ↑ Franasiak, Jason M.; Scott, Richard T. (2015). «Reproductive tract microbiome in assisted reproductive technologies». Fertility and Sterility 104 (6): 1364–1371. doi:. ISSN 0015-0282. PMID 26597628.
- ↑ 6,0 6,1 6,2 Baker, JM; Chase, DM; Herbst-Kralovetz, MM (2018). «Uterine Microbiota: Residents, Tourists, or Invaders?». Frontiers in Immunology 9: 208. doi:. PMID 29552006.
- ↑ 7,0 7,1 Perez-Muñoz, ME; Arrieta, MC; Ramer-Tait, AE; Walter, J (28 April 2017). «A critical assessment of the "sterile womb" and "in utero colonization" hypotheses: implications for research on the pioneer infant microbiome.». Microbiome 5 (1): 48. doi:. PMID 28454555.
- ↑ «Dictionary - Normal: Endometrium - The Human Protein Atlas». www.proteinatlas.org. Ανακτήθηκε στις 28 Δεκεμβρίου 2022.
- ↑ Deligdisch, L. (1993). «Effects of hormone therapy on the endometrium». Modern Pathology 6 (1): 94–106. PMID 8426860.
- ↑ William's Gynecology, McGraw 2008, Chapter 8, Abnormal Uterine Bleeding
- ↑ Arias-Stella, J. (Jan 2002). «The Arias-Stella reaction: facts and fancies four decades after.». Adv Anat Pathol 9 (1): 12–23. doi:. PMID 11756756.
- ↑ Laganà, AS; Garzon, S; Götte, M (10 Nov 2019). «The Pathogenesis of Endometriosis: Molecular and Cell Biology Insights». International Journal of Molecular Sciences 20 (22): 5615. doi:. PMID 31717614.
- ↑ «Endometrial growth and uterine blood flow: a pilot study for improving endometrial thickness in the patients with a thin endometrium». Fertil. Steril. 93 (6): 1851–8. April 2010. doi:. PMID 19200982.
- ↑ Zhao, Jing; Zhang, Qiong; Li, Yanping (2012). «The effect of endometrial thickness and pattern measured by ultrasonography on pregnancy outcomes during IVF-ET cycles». Reproductive Biology and Endocrinology 10 (1): 100. doi:. ISSN 1477-7827. PMID 23190428.
- ↑ Baerwald, A. R.; Pierson, R. A. (2004). «Endometrial development in association with ovarian follicular waves during the menstrual cycle». Ultrasound in Obstetrics and Gynecology 24 (4): 453–460. doi:. ISSN 0960-7692. PMID 15343603.
- ↑ Kasius, A.; Smit, J. G.; Torrance, H. L.; Eijkemans, M. J. C.; Mol, B. W.; Opmeer, B. C.; Broekmans, F. J. M. (2014). «Endometrial thickness and pregnancy rates after IVF: a systematic review and meta-analysis». Human Reproduction Update 20 (4): 530–541. doi:. ISSN 1355-4786. PMID 24664156.
- ↑ 17,0 17,1 17,2 «Hormonal contraception and risk of endometrial cancer: a systematic review». Endocr Relat Cancer 17 (4): R263–71. December 2010. doi:. PMID 20870686.
- ↑ 18,0 18,1 18,2 18,3 «Pharmacology of estrogens and progestogens: influence of different routes of administration». Climacteric 8 Suppl 1: 3–63. August 2005. doi:. PMID 16112947.
- ↑ 19,0 19,1 19,2 «British Menopause Society tools for clinicians: Progestogens and endometrial protection». Post Reprod Health 28 (1): 40–46. March 2022. doi:. PMID 34841960.
