Δραστικές μορφές οξυγόνου

Οι Δραστικές μορφές οξυγόνου (Reactive oxygen species (ROS)) είναι πολύ ενεργές χημικές ουσίες που σχηματίζονται από το O2. Παραδείγματα ROS περιλαμβάνουν τα υπεροξείδια (peroxides), τα σουπεροξείδια ή υπερ-υπεροξείδια (superoxides), τις ρίζες υδροξυλίου, το μονήρες οξυγόνο,[3] και το άλφα-οξυγόνο.
Η αναγωγή του μοριακού οξυγόνου (O2) παράγει σουπεροξείδιο (ή υπερ-υπεροξείδιο) (•O−
2), το οποίο είναι το πρόδρομο στις περισσότερες άλλες δραστικές μορφές οξυγόνου:[4]
- O2 + e− → •O−
2
Αυτοοξειδοαναγωγή του σουπεροξειδίου παράγει υπεροξείδιο του υδρογόνου (H2O2): [4]
- 2 H+ + •O−
2 + •O−
2 → H2O2 + O2
Το υπεροξείδιο του υδρογόνου με τη σειρά του μπορεί να αναχθεί μερικώς, σχηματίζοντας έτσι ιόντα υδροξειδίου και ρίζες υδροξυλίου (• OH), ή να αναχθεί πλήρως σε νερό:[4]
- H2O2 + e− → HO− + •OH
- 2 H+ + 2 e− + H2O2 → 2 H2O
Σε βιολογικό πλαίσιο, οι ROS είναι υποπροϊόντα του φυσιολογικού μεταβολισμού του οξυγόνου. Οι ROS έχουν ρόλους στην κυτταρική σηματοδότηση (cell signaling) και την ομοιόσταση.[5][6] Τα ROS είναι εσωτερικά στην κυτταρική λειτουργία και είναι παρόντα σε χαμηλά και σταθερά επίπεδα σε φυσιολογικά κύτταρα. Στα λαχανικά, οι ROS εμπλέκονται σε μεταβολικές διαδικασίες που σχετίζονται με τη φωτοπροστασία και την ανοχή σε διάφορους τύπους καταπόνησης.[7] Ωστόσο, τα ROS μπορεί να προκαλέσουν μη αναστρέψιμη βλάβη στο DNA καθώς οξειδώνονται και τροποποιούν ορισμένα κυτταρικά συστατικά και τα εμποδίζουν να εκτελέσουν τις αρχικές τους λειτουργίες. Αυτό υποδηλώνει ότι τα ROS έχει διπλό ρόλο. Εάν θα λειτουργήσουν ως επιβλαβείς, προστατευτικοί ή σηματοδοτικοί παράγοντες εξαρτάται από την ισορροπία μεταξύ παραγωγής και διάθεσης των ROS τη σωστή στιγμή και στο σωστό τόπο.[8] Με άλλα λόγια, η τοξικότητα οξυγόνου μπορεί να προκύψει τόσο από ανεξέλεγκτη παραγωγή όσο και από την αναποτελεσματική εξάλειψη των ROS από το αντιοξειδωτικό σύστημα. Σε περιόδους περιβαλλοντικής καταπόνησης (π.χ., υπεριώδες φως ή έκθεση σε θερμότητα), τα επίπεδα ROS μπορεί να αυξηθούν δραματικά.[5] Αυτό μπορεί να οδηγήσει σε σημαντική βλάβη στις κυτταρικές δομές. Σωρευτικά, αυτό είναι γνωστό ως οξειδωτική καταπόνηση. Η παραγωγή ROS επηρεάζεται έντονα από τις αποκρίσεις των παραγόντων καταπόνησης στα φυτά, αυτοί οι παράγοντες που αυξάνουν την παραγωγή ROS περιλαμβάνουν ξηρασία, αλατότητα, ψύξη, άμυνα παθογόνων, ανεπάρκεια θρεπτικών συστατικών, τοξικότητα μετάλλων και ακτινοβολία υπεριώδη ακτινοβολία Β. Οι ROS παράγονται επίσης από εξωγενείς πηγές όπως η ιονίζουσα ακτινοβολία,[9] δημιουργώντας μη αναστρέψιμα αποτελέσματα στην ανάπτυξη ιστών τόσο στα ζώα όσο και στα φυτά.[10]
Πηγές παραγωγής ROS
[Επεξεργασία | επεξεργασία κώδικα]
Ενδογενείς πηγές
[Επεξεργασία | επεξεργασία κώδικα]Οι ROS παράγονται από βιοχημικές αντιδράσεις που συμβαίνουν κατά τη διάρκεια των διαδικασιών αναπνοής και φωτοσύνθεσης σε οργανίδια όπως μιτοχόνδρια, υπεροξεισώματα και χλωροπλάστες.[8][11][12][13] Κατά τη διαδικασία της αναπνοής, τα μιτοχόνδρια μετατρέπουν την ενέργεια για το κύτταρο σε χρησιμοποιήσιμη μορφή, τριφωσφορική αδενοσίνη (ATP). Η διαδικασία παραγωγής ΑΤΡ στα μιτοχόνδρια, που ονομάζεται οξειδωτική φωσφορυλίωση, περιλαμβάνει τη μεταφορά πρωτονίων (ιόντων υδρογόνου) μέσω της εσωτερικής μιτοχονδριακής μεμβράνης μέσω της αλυσίδας μεταφοράς ηλεκτρονίων. Στην αλυσίδα μεταφοράς ηλεκτρονίων, τα ηλεκτρόνια διέρχονται μέσω μιας σειράς πρωτεϊνών μέσω αντιδράσεων οξειδοαναγωγής, με κάθε δέκτη πρωτεΐνης κατά μήκος της αλυσίδας να έχει μεγαλύτερη δυνατότητα αναγωγής από την προηγούμενη. Ο τελευταίος προορισμός για ένα ηλεκτρόνιο κατά μήκος αυτής της αλυσίδας είναι ένα μόριο οξυγόνου. Σε κανονικές συνθήκες, το οξυγόνο ανάγεται για να παράξει νερό. Ωστόσο, σε περίπου 0,1–2% των ηλεκτρονίων που διέρχονται από την αλυσίδα (αυτός ο αριθμός προέρχεται από μελέτες σε απομονωμένα μιτοχόνδρια, αν και ο ακριβής ρυθμός στους ζωντανούς οργανισμούς δεν έχει ακόμη συμφωνηθεί πλήρως), το οξυγόνο ανάγεται πρόωρα και ελλιπώς για να δώσει ρίζα σουπεροξειδίου (•O−
2), πιο καλά τεκμηριωμένο για τα συμπλέγματα I και III.[14]
Μια άλλη πηγή παραγωγής ROS σε ζωικά κύτταρα είναι οι αντιδράσεις μεταφοράς ηλεκτρονίων που καταλύονται από τα μιτοχονδριακά συστήματα P450 σε ιστούς στεροειδογενετικών.[15] Αυτά τα συστήματα P450 εξαρτώνται από τη μεταφορά ηλεκτρονίων από το NADPH στο P450. Κατά τη διάρκεια αυτής της διαδικασίας, ορισμένα ηλεκτρόνια "διαρρέουν" και αντιδρούν με το O2 παράγοντας σουπεροξείδιο. Για να αντιμετωπίσουν αυτή τη φυσική πηγή ROS, οι στεροειδογενετικοί ιστοί, οι ωοθήκες και οι όρχεις, έχουν μεγάλη συγκέντρωση αντιοξειδωτικών όπως βιταμίνη C (ασκορβικό) και β-καροτένιο, καθώς και αντιοξειδωτικά ένζυμα.[16]
Εάν υπάρχει μεγάλη ζημιά στα μιτοχόνδρια, ένα κύτταρο υφίσταται απόπτωση ή προγραμματισμένο κυτταρικό θάνατο.[17][18]
Επιπλέον, οι ROS παράγονται σε σηματοδότηση ανοσοκυττάρων μέσω της οδού οξειδάσης NADPH (NOX). Φαγοκυτταρικά κύτταρα όπως ουδετερόφιλα, ηωσινόφιλα και μονοπύρηνα φαγοκύτταρα παράγουν ROS όταν διεγείρονται.[19][20]
Στους χλωροπλάστες, οι αντιδράσεις καρβοξυλίωσης και οξυγόνωσης που καταλύονται από το rubisco (καρβοξυλάση-οξυγενάση της 1,5-διφωσφορικής ριβουλόζης) διασφαλίζουν ότι η λειτουργία της αλυσίδας μεταφοράς ηλεκτρονίων (ETC) πραγματοποιείται σε περιβάλλον πλούσιο σε O2 . Η διαρροή ηλεκτρονίων στο ETC αναπόφευκτα θα παράγει ROS μέσα στους χλωροπλάστες.[8] Το ETC στο φωτοσύστημα Ι (PSI) πιστεύεται ότι κάποτε ήταν η μόνη πηγή ROS σε χλωροπλάστες. Σύμφωνα με τους Huang κ.α.[21] η ροή των ηλεκτρονίων από τα διεγερμένα κέντρα αντίδρασης κατευθύνεται στο NADP και αυτά ανάγονται σε NADPH και στη συνέχεια εισέρχονται στον κύκλο του Κάλβιν και ανάγουν τον τελικό δέκτη ηλεκτρονίων, CO2. Σε περιπτώσεις όπου υπάρχει υπερφόρτωση ETC, μέρος της ροής ηλεκτρονίων εκτρέπεται από τη φερεδοξίνη σε O2, σχηματίζοντας την ελεύθερη ρίζα σουπεροξειδίου (με την αντίδραση Mehler). Επιπλέον, διαρροή ηλεκτρονίων στο O2 μπορεί επίσης να συμβεί από τα συμπλέγματα 2Fe-2S και 4Fe-4S στο PSI ETC. Ωστόσο, το PSII παρέχει επίσης θέσεις διαρροής ηλεκτρονίων (QA, QB) για το O2-παραγωγή O2-. [22][23] Το σουπεροξείδιο (O2-) παράγεται από το PSII, αντί του PSI. Το QB εμφανίζεται ως η θέση για τη δημιουργία του O2 •-.[22]
Εξωγενείς πηγές
[Επεξεργασία | επεξεργασία κώδικα]Ο σχηματισμός ROS μπορεί να διεγερθεί από μια ποικιλία παραγόντων όπως ρύποι, βαρέα μέταλλα,[2] καπνός, φάρμακα, ξενοβιοτικά ή ακτινοβολία. Στα φυτά, εκτός από τη δράση των ξηρών αβιοτικών παραγόντων, η υψηλή θερμοκρασία, η αλληλεπίδραση με άλλα ζωντανά όντα μπορεί να επηρεάσει την παραγωγή ROS.
Η ιονίζουσα ακτινοβολία μπορεί να δημιουργήσει επιζήμια ενδιάμεσα προϊόντα μέσα από την αλληλεπίδραση με το νερό, μια διαδικασία που ονομάζεται ραδιόλυση. Δεδομένου ότι το νερό αποτελεί το 55-60% του ανθρώπινου σώματος, η πιθανότητα ραδιόλυσης είναι αρκετά υψηλή υπό την παρουσία ιονίζουσας ακτινοβολίας. Κατά τη διαδικασία, το νερό χάνει ένα ηλεκτρόνιο και γίνεται πολύ δραστικό. Στη συνέχεια, μέσω αλυσιδωτής αντίδρασης τριών σταδίων, το νερό μετατρέπεται διαδοχικά σε ρίζα υδροξυλίου ( • OH), υπεροξείδιο του υδρογόνου (H2O2), ρίζα σουπεροξειδίου (•O−
2), και τελικά οξυγόνο (O2).
Η ρίζα υδροξυλίου είναι εξαιρετικά δραστική και αφαιρεί αμέσως ηλεκτρόνια από οποιοδήποτε μόριο στο δρόμο της, μετατρέποντας αυτό το μόριο σε ελεύθερη ρίζα και διαδίδοντας έτσι μια αλυσιδωτή αντίδραση. Ωστόσο, το υπεροξείδιο του υδρογόνου είναι στην πραγματικότητα πιο επιβλαβές για το DNA από τη ρίζα υδροξυλίου, καθώς η χαμηλότερη δραστικότητα του υπεροξειδίου του υδρογόνου παρέχει αρκετό χρόνο στο μόριο να ταξιδέψει στον πυρήνα του κυττάρου, αντιδρώντας στη συνέχεια με μακρομόρια όπως το DNA.
Στα φυτά, η παραγωγή ROS συμβαίνει κατά τη διάρκεια γεγονότων αβιοτικής καταπόνησης που οδηγούν σε μείωση ή διακοπή της μεταβολικής δραστηριότητας. Για παράδειγμα, η αύξηση της θερμοκρασίας, η ξηρασία είναι παράγοντες που περιορίζουν τη διαθεσιμότητα CO2 λόγω του κλεισίματος των στομάτων, αυξάνοντας την παραγωγή ROS, όπως O2·- και 1O2 σε χλωροπλάστες.[24][25] Η παραγωγή του 1O2 σε χλωροπλάστες μπορεί να προκαλέσει επαναπρογραμματισμό της έκφρασης των γονιδίων του πυρήνα που οδηγεί σε χλώρωση και προγραμματισμένο κυτταρικό θάνατο. [25] Σε περιπτώσεις βιοτικής καταόνησης, η δημιουργία ROS συμβαίνει γρήγορα και ασθενώς αρχικά και στη συνέχεια γίνεται πιο συμπαγής και διαρκής.[26] Η πρώτη φάση της συσσώρευσης ROS σχετίζεται με τη μόλυνση των φυτών και είναι πιθανώς ανεξάρτητη από τη σύνθεση νέων ενζύμων που δημιουργούν ROS. Ωστόσο, η δεύτερη φάση της συσσώρευσης ROS σχετίζεται μόνο με μόλυνση από μη μολυσματικά παθογόνα και είναι μια επαγόμενη απόκριση που εξαρτάται από αυξημένα ένζυμα που κωδικοποιούν μεταγραφή του mRNA.
Αντιοξειδωτικά ένζυμα
[Επεξεργασία | επεξεργασία κώδικα]Σουπεροξείδο (ή υπερ-υπεροξείδιο) της δισμουτάσης (Superoxide dismutase)
[Επεξεργασία | επεξεργασία κώδικα]Τα σουπεροξείδια της δισμουτάσης (SOD) είναι μια κατηγορία ενζύμων που καταλύει την αυτοοξειδοαναγωγή του σουπεροξειδίου σε οξυγόνο και υπεροξείδιο του υδρογόνου. Ως εκ τούτου, αποτελούν μια σημαντική αντιοξειδωτική άμυνα σε σχεδόν όλα τα κύτταρα που εκτίθενται στο οξυγόνο. Στα θηλαστικά και στα περισσότερα χορδωτά, υπάρχουν τρεις μορφές σουπεροξειδικής δισμουτάσης. Το SOD1 βρίσκεται κυρίως στο κυτταρόπλασμα, το SOD2 στα μιτοχόνδρια και το SOD3 είναι εξωκυττάριο. Το πρώτο είναι ένα διμερές (αποτελείται από δύο μονάδες), ενώ τα άλλα είναι τετραμερή (τέσσερις υπομονάδες). Το SOD1 και το SOD3 περιέχουν ιόντα χαλκού και ψευδαργύρου, ενώ το SOD2 έχει ιόν μαγγανίου στο δραστικό του κέντρο. Τα γονίδια βρίσκονται στα χρωμοσώματα 21, 6 και 4, αντίστοιχα (21q22.1, 6q25.3 και 4p15.3-p15.1).
Η καταλυόμενη με SOD αυτοοξειδοαναγωγή του σουπεροξειδίου (υπερ-υπεροξειδίου) μπορεί να γραφτεί με τις ακόλουθες ημιαντιδράσεις:
- M(n+1)+ − SOD + O−
2 → Mn+ − SOD + O2 - Mn+ − SOD + O−
2 + 2H+ → M(n+1)+ − SOD + H2O2.
όπου M = Cu (n = 1); Mn (n = 2); Fe (n = 2); Ni (n = 2). Σε αυτήν την αντίδραση ο αριθμός οξείδωσης του μεταλλικού κατιόντος ταλαντεύεται μεταξύ n και n + 1.
Η καταλάση, που συγκεντρώνεται σε υπεροξεισώματα που βρίσκονται δίπλα στα μιτοχόνδρια, αντιδρά με το υπεροξείδιο του υδρογόνου για να καταλύσει τον σχηματισμό νερού και οξυγόνου. Η γλουταθειονική υπεροξειδάση ανάγει το υπεροξείδιο του υδρογόνου μεταφέροντας την ενέργεια των αντιδρώντων υπεροξειδίων σε ένα διπεπτίδιο που λέγεται γλουταθειόνη. Το θείο που περιέχεται σε αυτά τα ένζυμα λειτουργεί ως το κέντρο αντίδρασης, μεταφέροντας δραστικά ηλεκτρόνια από το υπεροξείδιο στη γλουταθειόνη. Οι υπεροξειρεδοξίνες υποβαθμίζουν επίσης το H2O2, μέσα στα μιτοχόνδρια, το κυτταρόλυμα και τον πυρήνα.
- 2 H2O2 → 2 H2O + O2 (καταλάση catalase)
- 2GSH + H2O2 → GS–SG + 2H2O (υπεροξειδάση της γλουταθειόνης glutathione peroxidase)
Μονήρες οξυγόνο (singlet oxygen)
[Επεξεργασία | επεξεργασία κώδικα]Ένας άλλος τύπος δραστικής μορφής οξυγόνου είναι το μονήρες οξυγόνο (1O2) το οποίο παράγεται για παράδειγμα ως παραπροϊόν της φωτοσύνθεσης στα φυτά. Παρουσία φωτός και οξυγόνου, φωτοευαισθητοποιητές όπως η χλωροφύλλη μπορεί να μετατρέψουν το οξυγόνο τριπλότητας (3O2) σε μονήρες οξυγόνο:[27]
Το μονήρες οξυγόνο είναι ιδιαίτερα δραστικό, ειδικά με οργανικές ενώσεις που περιέχουν διπλούς δεσμούς. Η προκύπτουσα βλάβη που προκαλείται από το μονήρες οξυγόνο μειώνει τη φωτοσυνθετική απόδοση των χλωροπλαστών. Στα φυτά που εκτίθενται σε υπερβολικό φως, η αυξημένη παραγωγή μονήρους οξυγόνου μπορεί να οδηγήσει σε κυτταρικό θάνατο.[27] Διάφορες ουσίες όπως καροτενοειδή, τοκοφερόλες και πλαστοκινόνες που περιέχονται στους χλωροπλάστες σβήνουν το μονήρες οξυγόνο και προστατεύουν από τις τοξικές επιδράσεις του. Εκτός από την άμεση τοξικότητα, το μονήρες οξυγόνο δρα ως μόριο σηματοδότησης.[27] Τα οξειδωμένα προϊόντα της β-καροτίνης που προκύπτουν από την παρουσία του μονήρους οξυγόνου δρουν ως δεύτεροι αγγελιοφόροι που μπορούν είτε να προστατεύσουν από την επαγόμενη τοξικότητα που προκαλείται από μονήρες οξυγόνο είτε να ξεκινήσουν τον προγραμματισμένο κυτταρικό θάνατο. Τα επίπεδα jasmonate παίζουν βασικό ρόλο στην απόφαση μεταξύ εγκλιματισμού κυττάρων ή κυτταρικού θανάτου ως απόκριση σε αυξημένα επίπεδα αυτής της δραστικής μορφής οξυγόνου.[27]
Επιβλαβή αποτελέσματα
[Επεξεργασία | επεξεργασία κώδικα]Οι επιπτώσεις των ROS στον κυτταρικό μεταβολισμό είναι τεκμηριωμένες σε διάφορα είδη. [2] Αυτά περιλαμβάνουν όχι μόνο ρόλους στην απόπτωση (προγραμματισμένος κυτταρικός θάνατος) αλλά και θετικά αποτελέσματα όπως η εμπλοκή [28][29]γονιδίων και η κινητοποίηση μεταφορέων ιόντων της άμυνας ξενιστή. Αυτό τους εμπλέκει στον έλεγχο της κυτταρικής λειτουργίας. Συγκεκριμένα, τα αιμοπετάλια που εμπλέκονται στην επιδιόρθωση της πληγής και ομοιόσταση του αίματος απελευθερώνουν ROS για να στρατολογήσουν επιπλέον αιμοπετάλια στα σημεία τραυματισμού. Αυτά παρέχουν επίσης μια σύνδεση με το προσαρμοστικό ανοσοποιητικό σύστημα μέσω της στρατολόγησης λευκοκυττάρων.
Οι δραστικές μορφές οξυγόνου εμπλέκονται στην κυτταρική δραστηριότητα σε μια ποικιλία φλεγμονωδών αποκρίσεων συμπεριλαμβανομένης των καρδιαγγειακών παθήσεων. Μπορεί επίσης να εμπλέκονται σε διαταραχές ακοής μέσω κοχλιακής βλάβης που προκαλείται από αυξημένα επίπεδα ήχου, σε ωτοτοξικότητα φαρμάκων όπως σισπλατίνη και σε συγγενή κώφωση τόσο σε ζώα όσο και σε ανθρώπους. Οι ROS εμπλέκονται επίσης στη διαμεσολάβηση της απόπτωσης ή του προγραμματισμένου κυτταρικού θανάτου και του ισχαιμικού τραυματισμού. Συγκεκριμένα παραδείγματα περιλαμβάνουν εγκεφαλικό επεισόδιο και καρδιακή προσβολή.
Γενικά, τα βλαβερά αποτελέσματα των δραστικών μορφών οξυγόνου στο κύτταρο είναι πολύ συχνά:[30]
- βλάβη DNA ή RNA
- οξείδωση πολυακόρεστων λιπαρών οξέων σε λιπίδια (υπεροξείδωση λιπιδίων)
- οξείδωση των αμινοξέων στις πρωτεΐνες
- οξειδωτική απενεργοποίηση συγκεκριμένων ενζύμων με οξείδωση συμπαραγόντων
Παθογόνος απόκριση
[Επεξεργασία | επεξεργασία κώδικα]Όταν ένα φυτό αναγνωρίζει έναν επιθετικό παθογόνο παράγοντα, μία από τις πρώτες επαγόμενες αντιδράσεις είναι η ταχεία παραγωγή σουπεροξειδίου (υπερ-υπεροξειδίου) (O−
2) ή υπεροξειδίου του υδρογόνου (H2O2) για την ενίσχυση του κυτταρικού τοιχώματος. Αυτό εμποδίζει την εξάπλωση του παθογόνου παράγοντα σε άλλα μέρη του φυτού, σχηματίζοντας ουσιαστικά ένα δίχτυ γύρω από το παθογόνο παράγοντα για να περιορίσει την κίνηση και την αναπαραγωγή.
Στον ξενιστή θηλαστικών, οι ROS εμπλέκονται ως αντιμικροβιακή άμυνα.[19] Για να τονιστεί η σημασία αυτής της άμυνας, τα άτομα με χρόνια κοκκιωματώδη νόσο που έχουν ανεπάρκειες στη δημιουργία ROS, είναι πολύ ευαίσθητα στη μόλυνση από ένα ευρύ φάσμα μικροβίων, όπως Salmonella enterica, Staphylococcus aureus, Serratia marcescens και Aspergillus spp.
Μελέτες για την ομοιόσταση των εντέρων της Drosophila melanogaster έδειξαν την παραγωγή ROS ως βασικού συστατικού της ανοσολογικής απόκρισης στο έντερο της μύγας. Οι ROS δρουν τόσο ως βακτηριοκτόνο, βλάπτοντας το βακτηριακό DNA, RNA και τις πρωτεΐνες, όσο και ως μόριο σηματοδότησης που προκαλεί μηχανισμούς επιδιόρθωσης του επιθηλίου.[31] Η ουρακίλη που απελευθερώνεται από μικροοργανισμό ενεργοποιεί την παραγωγή και τη δραστηριότητα του Duox, του ενζύμου που παράγει ROS στο έντερο. Η δραστηριότητα Duox προκαλείται ανάλογα με το επίπεδο της ουρακίλης στο έντερο. Υπό βασικές συνθήκες, ρυθμίζεται προς τα κάτω από την πρωτεϊνική κινάση MkP3. Η αυστηρή ρύθμιση του Duox αποφεύγει την υπερβολική παραγωγή ROS και διευκολύνει τη διαφοροποίηση μεταξύ καλοήθων και μικροοργανισμών που προκαλούν βλάβες στο έντερο.[32]
Ο τρόπος με τον οποίο οι ROS υπερασπίζονται τον ξενιστή από την εισβολή μικροβίων δεν είναι πλήρως κατανοητός. Ένας από τους πιο πιθανούς τρόπους άμυνας είναι η βλάβη στο μικροβιακό DNA. Μελέτες με σαλμονέλα έδειξαν ότι απαιτούνταν μηχανισμοί επιδιόρθωσης DNA για να αντισταθούν στη θανάτωση από τις ROS. Ένας ρόλος των ROS στους αντιιικούς αμυντικούς μηχανισμούς έχει αποδειχθεί μέσω της Rig-like ελικάσης-1 και της μιτοχονδριακής αντι-ιικής πρωτεΐνης σηματοδότησης. Τα αυξημένα επίπεδα ROS ενισχύουν τη σηματοδότηση μέσω αυτού του αντιιικού υποδοχέα που σχετίζεται με μιτοχόνδρια για να ενεργοποιήσουν τον ρυθμιστικό παράγοντα ιντερφερόνης (IRF) -3, IRF-7 και τον πυρηνικό παράγοντα κάππα B (NF-κB), με αποτέλεσμα μια αντιική κατάσταση.[33] Τα αναπνευστικά επιθηλιακά κύτταρα επάγουν μιτοχονδριακές ROS ως απάντηση στη μόλυνση της γρίπης. Αυτή η επαγωγή των ROS οδήγησε στην επαγωγή ιντερφερόνης τύπου ΙΙΙ και στην επαγωγή μιας αντι-ιικής κατάστασης, περιορίζοντας την αντιγραφή του ιού. [34] Στην άμυνα του ξενιστή ενάντια στα μυκοβακτηρίδια, οι ROS παίζουν ρόλο, αν και η άμεση θανάτωση πιθανότατα δεν είναι ο βασικός μηχανισμός. Μάλλον, οι ROS πιθανώς επηρεάζει τους ελέγχους σηματοδότησης που εξαρτώνται από ROS, όπως η παραγωγή κυτοκινών, η αυτοφαγία και ο σχηματισμός κοκκιωμάτων.[35][36]
Οι δραστικές μορφές οξυγόνου εμπλέκονται επίσης στην ενεργοποίηση, της ανοσοαδράνειας και στην απόπτωση των Τ κυττάρων.[37]
Οξειδωτική βλάβη
[Επεξεργασία | επεξεργασία κώδικα]Στους αερόβιους οργανισμούς η ενέργεια που απαιτείται για την τροφοδότηση των βιολογικών λειτουργιών παράγεται στα μιτοχόνδρια μέσω της αλυσίδας μεταφοράς ηλεκτρονίων. Παράγονται δραστικές μορφές οξυγόνου (ROS) με τη δυνατότητα να προκαλέσουν κυτταρική βλάβη μαζί με την απελευθέρωση ενέργειας. Οι ROS μπορούν να βλάψουν τα λιπίδια, το DNA, το RNA και τις πρωτεΐνες, που, θεωρητικά, συμβάλλουν στη φυσιολογία της γήρανσης.
Οι ROS παράγονται ως ένα φυσιολογικό προϊόν κυτταρικού μεταβολισμού. Ειδικότερα, ένας σημαντικός παράγοντας στην οξειδωτική βλάβη είναι το υπεροξείδιο του υδρογόνου (H2O2), το οποίο μετατρέπεται από σουπεροξείδιο που διαρρέει από το μιτοχόνδρια. Η καταλάση και το σουπεροξείδιο της δισμαουτάσης βελτιώνουν τις βλαβερές συνέπειες του υπεροξειδίου του υδρογόνου και του σουπεροξειδίου, αντίστοιχα, μετατρέποντας αυτές τις ενώσεις σε οξυγόνο και υπεροξείδιο του υδρογόνου (που αργότερα μετατρέπεται σε νερό), με αποτέλεσμα την παραγωγή καλοήθων μορίων. Ωστόσο, αυτή η μετατροπή δεν είναι 100% αποτελεσματική και τα υπολειμματικά υπεροξείδια παραμένουν στο κύτταρο. Ενώ οι ROS παράγονται ως προϊόν φυσιολογικής κυτταρικής λειτουργίας, υπερβολικές ποσότητες μπορεί να προκαλέσουν επιβλαβή αποτελέσματα.[38]
Διαταραχή της γνωστικής λειτουργίας
[Επεξεργασία | επεξεργασία κώδικα]Οι ικανότητες μνήμης μειώνονται με την ηλικία, εμφανείς σε ανθρώπινες εκφυλιστικές ασθένειες όπως η νόσος Αλτσχάιμερ, η οποία συνοδεύεται από συσσώρευση οξειδωτικής βλάβης. Οι τρέχουσες μελέτες καταδεικνύουν ότι η συσσώρευση ROS μπορεί να μειώσει την ικανότητα ενός οργανισμού, επειδή η οξειδωτική βλάβη συμβάλλει στη γήρανση. Συγκεκριμένα, η συσσώρευση οξειδωτικής βλάβης μπορεί να οδηγήσει σε γνωστική δυσλειτουργία, όπως αποδείχθηκε σε μελέτη στην οποία σε ηλικιωμένους αρουραίους χορηγήθηκαν μιτοχονδριακοί μεταβολίτες και στη συνέχεια γνωστικές εξετάσεις. Τα αποτελέσματα έδειξαν ότι οι αρουραίοι είχαν καλύτερη απόδοση μετά τη λήψη των μεταβολιτών, υποδηλώνοντας ότι οι μεταβολίτες μείωσαν την οξειδωτική βλάβη και βελτίωσαν τη μιτοχονδριακή λειτουργία.[39] Η συσσώρευση οξειδωτικής βλάβης μπορεί στη συνέχεια να επηρεάσει την αποτελεσματικότητα των μιτοχονδρίων και να αυξήσει περαιτέρω τον ρυθμό παραγωγής ROS.[40] Η συσσώρευση οξειδωτικής βλάβης και οι επιπτώσεις της στη γήρανση εξαρτώνται από τον συγκεκριμένο τύπο ιστού όπου συμβαίνει η βλάβη. Πρόσθετα πειραματικά αποτελέσματα υποδηλώνουν ότι η οξειδωτική βλάβη είναι υπεύθυνη για τη μείωση της λειτουργίας του εγκεφάλου που σχετίζεται με την ηλικία. Οι γηραιότεροι γερβίλοι βρέθηκαν να έχουν υψηλότερα επίπεδα οξειδωμένης πρωτεΐνης σε σύγκριση με τους νεότερους γερβίλους. Η θεραπεία ηλικιωμένων και νεαρών ποντικών με μια ένωση παγίδευσης σπιν προκάλεσε μείωση του επιπέδου των οξειδωμένων πρωτεϊνών στους γηραιότερους γερβίλους αλλά δεν είχε επίδραση στους νεότερους γερβίλους. Επιπλέον, οι γηραιότεροι γέρβιλοι εκτέλεσαν καλύτερα γνωστικές εργασίες κατά τη διάρκεια της θεραπείας, αλλά σταμάτησαν τη λειτουργική ικανότητα όταν η θεραπεία διακόπηκε, προκαλώντας αύξηση των επιπέδων οξειδωμένης πρωτεΐνης. Αυτό οδήγησε τους ερευνητές στο συμπέρασμα ότι η οξείδωση των κυτταρικών πρωτεϊνών είναι δυνητικά σημαντική για τη λειτουργία του εγκεφάλου. [41]
Αιτία γήρανσης
[Επεξεργασία | επεξεργασία κώδικα]Σύμφωνα με τη θεωρία των ελεύθερων ριζών για τη γήρανση, η οξειδωτική βλάβη που ξεκινά από τις δραστικές μορφές οξυγόνου είναι ένας σημαντικός συντελεστής στη λειτουργική παρακμή που είναι χαρακτηριστική της γήρανσης. Ενώ μελέτες σε ασπόνδυλα πρότυπα υποδεικνύουν ότι τα γενετικά τροποποιημένα ζώα στερούνται συγκεκριμένων αντιοξειδωτικών ενζύμων (όπως το SOD (υπερ-υπεροξείδιο της δισμουτάσης)), γενικά, δείχνουν μικρότερη διάρκεια ζωής (όπως θα περίμενε κανείς από τη θεωρία), ο αντίστροφος χειρισμός, αυξάνοντας τα επίπεδα αντιοξειδωτικών ενζύμων, έχει αποφέρει ασυνεπή αποτελέσματα στη διάρκεια ζωής (αν και ορισμένες μελέτες στη δροσόφιλα δείχνουν ότι η διάρκεια ζωής μπορεί να αυξηθεί με την υπερέκφραση των ενζύμων βιοσύνθεσης MnSOD ή γλουταθειόνης). Επίσης σε αντίθεση με αυτήν τη θεωρία, η απαλοιφή του μιτοχονδριακού SOD2 μπορεί να παρατείνει τη διάρκεια ζωής στο Caenorhabditis elegans.[42]
Στα ποντίκια, η ιστορία είναι κάπως παρόμοια. Η απαλοιφή αντιοξειδωτικών ενζύμων, γενικά, αποδίδει μικρότερη διάρκεια ζωής, αν και οι μελέτες υπερέκφρασης δεν έχουν (με ορισμένες εξαιρέσεις) σταθερή παράταση της διάρκειας ζωής.[43] Μελέτη προτύπου αρουραίου πρόωρης γήρανσης διαπίστωσε αυξημένη οξειδωτική καταπόνηση, μειωμένη αντιοξειδωτική ενζυμική δραστηριότητα και σημαντικά μεγαλύτερη βλάβη του DNA στον εγκεφαλικό νεοφλοιό και τον ιππόκαμπο των αρουραίων πρόωρης γήρανσης από ό,τι στους κανονικά ηλικιωμένους αρουραίους του ελέγχου.[44] Η βλάβη στη 8-οξο-2'-δεοξυγουανοσίνης (8-OHdG) του DNA είναι προϊόν αλληλεπίδρασης ROS με DNA. Πολυάριθμες μελέτες έχουν δείξει ότι η 8-οξο-2'-δεοξυγουανοσίνη αυξάνεται με την ηλικία[45]
Ανδρική στειρότητα
[Επεξεργασία | επεξεργασία κώδικα]Η έκθεση σπερματοζωαρίων σε οξειδωτική καταπόνηση είναι ο κύριος αιτιολογικός παράγοντας της ανδρικής στειρότητας.[46] Ο κατακερματισμός DNA του σπέρματος, που προκαλείται από την οξειδωτική καταπόνηση, φαίνεται να είναι ένας σημαντικός παράγοντας στην αιτιολογία της ανδρικής στειρότητας.[47] Ένα υψηλό επίπεδο της 8-οξο-2'-δεοξυγουανοσίνης στην οξειδωτική βλάβη του DNA σχετίζεται με ανώμαλα σπερματοζωάρια και ανδρική στειρότητα.[48] κκκ
Καρκίνος
[Επεξεργασία | επεξεργασία κώδικα]Οι ROS παράγονται και εξαλείφονται συνεχώς στο βιολογικό σύστημα και απαιτούνται για την καθοδήγηση ρυθμιστικών οδών.[49] Υπό κανονικές φυσιολογικές συνθήκες, τα κύτταρα ελέγχουν τα επίπεδα ROS εξισορροπώντας τη δημιουργία ROS με την εξάλειψή τους με συστήματα καθαρισμού. Αλλά υπό συνθήκες οξειδωτικής καταπόνησης, οι υπερβολικές ROS μπορεί να βλάψει τις κυτταρικές πρωτεΐνες, τα λιπίδια και το DNA, οδηγώντας σε θανατηφόρες αλλοιώσεις στο κύτταρο που συμβάλλουν στην καρκινογένεση.
Τα καρκινικά κύτταρα εμφανίζουν μεγαλύτερη καταπόνηση ROS από τα κανονικά κύτταρα, εν μέρει λόγω ογκογόνου διέγερσης, αυξημένης μεταβολικής δραστηριότητας και μιτοχονδριακής δυσλειτουργίας. Οι ROS είναι δίκοπο μαχαίρι. Από τη μία πλευρά, σε χαμηλά επίπεδα, οι ROS διευκολύνουν την επιβίωση των καρκινικών κυττάρων αφού η πρόοδος του κυτταρικού κύκλου που οφείλεται σε αυξητικούς παράγοντες και οι υποδοχείς κινασών τυροσίνης (receptor tyrosine kinases ή RTK) απαιτούν ROS για ενεργοποίηση[50] και η χρόνια φλεγμονή, κύριος μεσολαβητής του καρκίνου, ρυθμίζεται από τις ROS. Από την άλλη πλευρά, ένα υψηλό επίπεδο ROS μπορεί να καταστέλλει την ανάπτυξη του όγκου μέσω της συνεχούς ενεργοποίησης του αναστολέα του κυτταρικού κύκλου[51][52] και πρόκληση κυτταρικού θανάτου καθώς και γήρανση με καταστροφή μακρομορίων. Στην πραγματικότητα, οι περισσότεροι χημειοθεραπευτικοί και ραδιοθεραπευτικοί παράγοντες σκοτώνουν τα καρκινικά κύτταρα αυξάνοντας την καταπόνηση των ROS.[53][54] Η ικανότητα των καρκινικών κυττάρων να διακρίνουν τις ROS ως σήμα επιβίωσης ή απόπτωσης ελέγχεται από τη δοσολογία, τη διάρκεια, τον τύπο και τον τόπο παραγωγής των ROS. Απαιτούνται μέτρια επίπεδα ROS για να επιβιώσουν τα καρκινικά κύτταρα, ενώ τα υπερβολικά επίπεδα τα σκοτώνουν.
Η μεταβολική προσαρμογή στους όγκους εξισορροπεί την ανάγκη των κυττάρων για ενέργεια με εξίσου σημαντική ανάγκη για μακρομοριακά δομικά στοιχεία και αυστηρότερο έλεγχο της οξειδοαναγωγικής ισορροπίας. Ως αποτέλεσμα, η παραγωγή NADPH είναι πολύ ενισχυμένη, η οποία λειτουργεί ως συμπαράγοντας για την παροχή αναγωγικής ισχύος σε πολλές ενζυματικές αντιδράσεις για μακρομοριακή βιοσύνθεση και ταυτόχρονα τη διάσωση των κυττάρων από τις υπερβολικές ROS που παράγονται κατά τον γρήγορο πολλαπλασιασμό. Τα κύτταρα αντισταθμίζουν τις επιβλαβείς επιπτώσεις των ROS παράγοντας αντιοξειδωτικά μόρια, όπως η αναγμένη γλουταθειόνη (GSH) και η θειορεδοξίνη (TRX), τα οποία βασίζονται στη αναγωγική ισχύ του NADPH για να διατηρήσουν τις δραστηριότητές τους.[55]
Οι περισσότεροι παράγοντες κινδύνου που σχετίζονται με τον καρκίνο αλληλεπιδρούν με τα κύτταρα μέσω της παραγωγής ROS. Στη συνέχεια, οι ROS ενεργοποιούν διάφορους παράγοντες μεταγραφής, όπως τον πυρηνικό παράγοντα ενισχυτή ελαφράς αλυσίδας κάππα των ενεργοποιημένων Β κυττάρων (NF-κB), τον ενεργοποιητή πρωτεΐνης-1 (AP-1), την υποξία-επαγώγιμο παράγοντα-1α και μετατροπέα σήματος και ενεργοποιητή μεταγραφής 3 (STAT3), που οδηγεί σε έκφραση των πρωτεϊνών που ελέγχουν τη φλεγμονή, τον κυτταρικό μετασχηματισμό, την επιβίωση των καρκινικών κυττάρων, τον πολλαπλασιασμό των καρκινικών κυττάρων και την εισβολή, αγγειογένεση καθώς και τη μετάσταση. Και οι ROS ελέγχουν επίσης την έκφραση διαφόρων γονιδίων καταστολής όγκων όπως τον p53, το γονίδιο ρετινοβλαστώματος (Rb) και το ομόλογο φωσφατάσης και τανσίνης (PTEN). [56]
Καρκινογένεση
[Επεξεργασία | επεξεργασία κώδικα]Η οξείδωση του DNA που σχετίζεται με τις ROS είναι μια από τις κύριες αιτίες μεταλλάξεων, οι οποίες μπορούν να προκαλέσουν διάφορους τύπους βλάβης στο DNA, συμπεριλαμβανομένων μη ογκωδών (8-οξογουανίνη και φορμαμιδοπυριμιδίνη) και ογκωδών (κυκλοπροουρίνες και αιθενο-προσθήκες) τροποποιήσεων βάσεων, μη βασικές θέσεις, μη συμβατικές θραύσεις μονής αλυσίδας, πρόσδετα πρωτεΐνης-DNA και διασταυρούμενοι σύνδεσμοι ενδοκλωνικού/διακλωνικού DNA.[57] Έχει υπολογιστεί ότι οι ενδογενές ROS που παράγονται μέσω φυσιολογικού κυτταρικού μεταβολισμού τροποποιούν περίπου 20.000 βάσεις DNA ημερησίως σε ένα μόνο κύτταρο. Η 8-οξογουανίνη είναι η πιο άφθονη μεταξύ διαφόρων οξειδωμένων νιτρογόνων βάσεων που παρατηρήθηκαν. Κατά τη διάρκεια της αντιγραφής του DNA, η πολυμεράση DNA κακοζευγαρώνει την 8-οξογουανίνη με την αδενίνη, οδηγώντας σε μια μεταλλαγή μεταστροφής G→T. Η τελική γονιδιωματική αστάθεια συμβάλλει άμεσα στην καρκινογένεση. Ο κυτταρικός μετασχηματισμός οδηγεί σε καρκίνο και η αλληλεπίδραση της άτυπης ισομορφής PKC-ζ με το p47phox ελέγχει την παραγωγή ROS και τον μετασχηματισμό από αποπτωτικά καρκινικά βλαστικά κύτταρα μέσω επείγοντος προγράμματος ασπίδας πομφόλυγας (blebbishield emergency program).[58][59]
Πολλαπλασιασμός κυττάρων
[Επεξεργασία | επεξεργασία κώδικα]Ο ανεξέλεγκτος πολλαπλασιασμός αποτελεί χαρακτηριστικό γνώρισμα των καρκινικών κυττάρων. Τόσο οι εξωγενείς όσο και οι ενδογενείς ROS έχει αποδειχθεί ότι ενισχύουν τον πολλαπλασιασμό των καρκινικών κυττάρων. Ο ρόλος των ROS στην προώθηση του πολλαπλασιασμού των όγκων υποστηρίζεται περαιτέρω από την παρατήρηση ότι παράγοντες με δυνατότητα αναστολής της δημιουργίας ROS μπορούν επίσης να αναστείλουν τον πολλαπλασιασμό των καρκινικών κυττάρων.[56] Παρόλο που οι ROS μπορούν να προάγουν τον πολλαπλασιασμό των κυτταρικών όγκων, μια μεγάλη αύξηση των ROS έχει συσχετιστεί με μειωμένο πολλαπλασιασμό των καρκινικών κυττάρων με επαγωγή της παύσης του κυτταρικού κύκλου G2/M και αυξημένη φωσφορυλίωση μεταλλαγμένης αταξίας τελαγγειεκστάσιας (ataxia telangiectasia mutated (ATM)), σημείου ελέγχου κινάσης 1 (Chk 1), Chk 2 και μειωμένος κύκλος κυτταρικής διαίρεσης 25 ομόλογο c (CDC25).[60]
Κυτταρικός θάνατος
[Επεξεργασία | επεξεργασία κώδικα]Ένα καρκινικό κύτταρο μπορεί να πεθάνει με τρεις τρόπους: απόπτωση, νέκρωση και αυτοφαγία. Οι υπερβολικές ROS μπορεί να προκαλέσουν απόπτωση τόσο μέσω της εξωτερικής όσο και της εσωτερικής οδού.[61] Στην εξωγενή οδό της απόπτωσης, οι ROS δημιουργούνται από το πρόσδεμα Fas ως ένα ανάντη γεγονός για ενεργοποίηση του Fas μέσω φωσφορυλίωσης, το οποίο είναι απαραίτητο για την επακόλουθη στρατολόγηση πρωτεΐνης που σχετίζεται με Fas με τομέα θανάτου και την κασπάση 8 καθώς και επαγωγή απόπτωσης.[56] Στην εγγενή οδό, η λειτουργία των ROS διευκολύνει την απελευθέρωση του κυτοχρώματος c ενεργοποιώντας πρωτεΐνες σταθεροποίησης πόρων (Bcl-2 και Bcl-xL) καθώς και αναστέλλοντας πρωτεΐνες αποσταθεροποίησης πόρων (πρωτεΐνη X που σχετίζεται με Bcl-2, ομόλογος ανταγωνιστής Bcl-2/δολοφόνος).[62]Η ενδογενής οδός είναι επίσης γνωστή ως ο καταρράκτης κασπάσης και προκαλείται μέσω μιτοχονδριακής βλάβης που προκαλεί την απελευθέρωση του κυτοχρώματος c. Η βλάβη του DNA, η οξειδωτική καταπόνηση και η απώλεια του δυναμικού της μιτοχονδριακής μεμβράνης οδηγούν στην απελευθέρωση των προ-αποπτωτικών πρωτεϊνών που αναφέρθηκαν παραπάνω διεγείροντας την απόπτωση. [63] Η μιτοχονδριακή βλάβη συνδέεται στενά με την απόπτωση και δεδομένου ότι τα μιτοχόνδρια στοχεύονται εύκολα υπάρχει πιθανότητα για θεραπεία του καρκίνου.[64]
Η κυτταροτοξική φύση των ROS είναι μια κινητήρια δύναμη πίσω από την απόπτωση, αλλά σε ακόμη υψηλότερες ποσότητες, οι ROS μπορεί να οδηγήσουν τόσο σε απόπτωση όσο και σε νέκρωση, μια μορφή ανεξέλεγκτου κυτταρικού θανάτου, σε καρκινικά κύτταρα.[65]
Πολυάριθμες μελέτες έχουν δείξει τις οδούς και τις συσχετίσεις μεταξύ των επιπέδων ROS και της απόπτωσης, αλλά μια νεότερη γραμμή μελέτης έχει συνδέσει τα επίπεδα ROS και την αυτοφαγία.[66] Οι ROS μπορεί επίσης να προκαλέσουν τον κυτταρικό θάνατο μέσω της αυτοφαγίας, η οποία είναι μια αυτοκαταβολική διαδικασία που περιλαμβάνει απομόνωση κυτταροπλασματικών περιεχομένων (εξαντλημένα ή κατεστραμμένα οργανίδια και πρωτεϊνικά συσσωματώματα) για αποικοδόμηση σε λυσοσώματα.[67] Επομένως, η αυτοφαγία μπορεί επίσης να ρυθμίσει την υγεία του κυττάρου σε περιόδους οξειδωτικής καταπόνησης. Η αυτοφαγία μπορεί να προκληθεί από τα επίπεδα ROS μέσω πολλών οδών στο κύτταρο σε μια προσπάθεια να απορρίψει τα επιβλαβή οργανίδια και να αποτρέψει βλάβες, όπως οι καρκινογόνες ουσίες, χωρίς να προκαλέσει απόπτωση.[68] Ο αυτοφαγικός κυτταρικός θάνατος μπορεί να προκληθεί από την υπερβολική έκφραση της αυτοφαγίας όπου το κύτταρο χωνεύει πάρα πολύ από τον εαυτό του σε μια προσπάθεια να ελαχιστοποιήσει τη ζημιά και δεν μπορεί πλέον να επιβιώσει. Όταν συμβαίνει αυτός ο τύπος κυτταρικού θανάτου, παρατηρείται συνήθως αύξηση ή απώλεια ελέγχου των γονιδίων που ρυθμίζουν την αυτοφαγία.[69] Έτσι, μόλις επιτευχθεί μια βαθύτερη κατανόηση του αυτοφαγικού κυτταρικού θανάτου και της σχέσης του με το ROS, αυτή η μορφή προγραμματισμένου κυτταρικού θανάτου μπορεί να χρησιμεύσει ως μελλοντική θεραπεία για τον καρκίνο. Η αυτοφαγία και η απόπτωση είναι ξεχωριστοί μηχανισμοί για τον κυτταρικό θάνατο που προκαλείται από υψηλά επίπεδα ROS. Η αυτοφαγία και η απόπτωση, ωστόσο, σπάνια δρουν μέσω αυστηρά ανεξάρτητων οδών. Υπάρχει σαφής σύνδεση μεταξύ ROS και αυτοφαγίας και συσχέτιση μεταξύ υπερβολικών ποσοτήτων ROS που οδηγούν σε απόπτωση.[68] Η αποπόλωση της μιτοχονδριακής μεμβράνης είναι επίσης χαρακτηριστική της έναρξης της αυτοφαγίας. Όταν τα μιτοχόνδρια είναι κατεστραμμένα και αρχίζουν να απελευθερώνουν ROS, ξεκινά η αυτοφαγία για τη διάθεση του επιβλαβούς οργανιδίου. Εάν ένα φάρμακο στοχεύει στα μιτοχόνδρια και δημιουργεί ROS, η αυτοφαγία μπορεί να απορρίψει τόσα πολλά μιτοχόνδρια και άλλα κατεστραμμένα οργανίδια που το κύτταρο δεν είναι πλέον βιώσιμο. Η εκτεταμένη ποσότητα ROS και μιτοχονδριακής βλάβης μπορεί επίσης να σηματοδοτήσει για απόπτωση. Η ισορροπία της αυτοφαγίας μέσα στο κύτταρο και η παρεμβολή μεταξύ αυτοφαγίας και απόπτωσης που μεσολαβεί τις ROS είναι ζωτικής σημασίας για την επιβίωση ενός κυττάρου. Αυτή η παρεμβολή και η σύνδεση μεταξύ της αυτοφαγίας και της απόπτωσης θα μπορούσε να είναι ένας μηχανισμός που στοχεύει σε θεραπείες για τον καρκίνο ή που χρησιμοποιείται σε συνδυασμένες θεραπείες για καρκίνους υψηλής αντοχής.
Εισβολή καρκινικών κυττάρων, αγγειογένεση και μετάσταση
[Επεξεργασία | επεξεργασία κώδικα]Μετά τη διέγερση του παράγοντα ανάπτυξης των RTK (receptor tyrosine kinases), οι ROS μπορεί να προκαλέσουν ενεργοποίηση των οδών σηματοδότησης που εμπλέκονται στη μετανάστευση και την εισβολή των κυττάρων, όπως μέλη της οικογένειας πρωτεϊνικής κινάσης που ενεργοποιούνται με μιτογόνα (mitogen-activated protein kinase (MAPK))-εξωκυτταρικά ρυθμιζόμενη κινάση ((ERK), c-jun NH-2 τελική κινάση ( JNK) και p38 MAPK. Οι ROS μπορεί επίσης να προωθήσουν τη μετανάστευση αυξάνοντας τη φωσφορυλίωση της κινάσης εστιακής προσκόλλησης (focal adhesion kinase (FAK)) p130Cas και της παξιλίνης.[70]
Τόσο στο εργαστήριο όσο και εν ζωή, οι ROS έχει αποδειχθεί ότι προκαλούν μεταγραφικούς παράγοντες και ρυθμίζουν μόρια σηματοδότησης που εμπλέκονται στην αγγειογένεση (MMP, VEGF) και τη μετάσταση (υπερρύθμιση του AP-1, CXCR4, AKT και υπορύθμιση του PTEN).[56]
Χρόνια φλεγμονή και καρκίνος
[Επεξεργασία | επεξεργασία κώδικα]Πειραματική και επιδημιολογική έρευνα τα τελευταία χρόνια έχει δείξει στενούς συσχετισμούς μεταξύ ROS, χρόνιας φλεγμονής και καρκίνου.[56] Οι ROS προκαλούν χρόνια φλεγμονή με την επαγωγή COX-2, φλεγμονωδών κυτοκινών (TNFα, ιντερλευκίνης 1 (IL-1), IL-6), χημειοκινών (IL-8, CXCR4) και προφλεγμονωδών μεταγραφικών παραγόντων (NF-κB).[56] Αυτές οι χημειοκίνες και οι υποδοχείς χημειοκίνης, με τη σειρά τους, προωθούν την εισβολή και μετάσταση διαφόρων τύπων όγκων.
Θεραπεία καρκίνου
[Επεξεργασία | επεξεργασία κώδικα]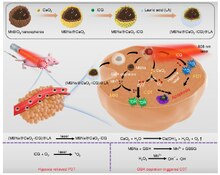
Τόσο οι στρατηγικές αύξησης όσο και εξάλειψης των ROS έχουν αναπτυχθεί με τις πρώτες να χρησιμοποιούνται κυρίως. Τα καρκινικά κύτταρα με αυξημένα επίπεδα ROS εξαρτώνται σε μεγάλο βαθμό από το αντιοξειδωτικό αμυντικό σύστημα. Τα φάρμακα που αυξάνουν τις ROS αυξάνουν περαιτέρω το επίπεδο καταπόνησης των κυτταρικού ROS, είτε με άμεση παραγωγή ROS (π.χ. μοτεξαφίνη γαδολίνιο, ελεσκλομόλη) είτε με παράγοντες που καταργούν το εγγενές αντιοξειδωτικό σύστημα όπως τον αναστολέα SOD (π.χ. ATN-224, 2-μεθοξυεστραδιόλη) και αναστολέα GSH (π.χ. PEITC, σουλφοξιμίνη της βουθειονίνης (BSO)). Το αποτέλεσμα είναι μια συνολική αύξηση των ενδογενών ROS, το οποίο όταν είναι πάνω από ένα όριο κυτταρικής ανεκτικότητας και μπορεί να προκαλέσει τον κυτταρικό θάνατο.[71] Από την άλλη πλευρά, τα φυσιολογικά κύτταρα φαίνεται να έχουν, κάτω από χαμηλότερο βασική καταπόνηση και αποθέματα, υψηλότερη ικανότητα να αντιμετωπίσουν επιπλέον προσβολές που προκαλούν οι ROS από ό,τι τα καρκινικά κύτταρα.[72] Επομένως, η ανύψωση των ROS σε όλα τα κύτταρα μπορεί να χρησιμοποιηθεί για την επίτευξη της επιλεκτικής θανάτωσης των καρκινικών κυττάρων.
Η ακτινοθεραπεία βασίζεται επίσης στην τοξικότητα των ROS για την εξάλειψη των καρκινικών κυττάρων. Η ακτινοθεραπεία χρησιμοποιεί ακτίνες Χ, ακτίνες γ καθώς και ακτινοβολία βαρέων σωματιδίων όπως πρωτόνια και νετρόνια για να προκαλέσει κυτταρικό θάνατο που προκαλείται από τις ROS και μιτωτική αποτυχία.[56]
Λόγω του διπλού ρόλου των ROS, έχουν αναπτυχθεί τόσο προοξειδωτικοί όσο και αντιοξειδωτικοί αντικαρκινικοί παράγοντες. Ωστόσο, η διαμόρφωση της σηματοδότησης των ROS από μόνη της δεν φαίνεται να είναι μια ιδανική προσέγγιση λόγω της προσαρμογής των καρκινικών κυττάρων στην καταπόνηση των ROS, των περιττών οδών για την υποστήριξη της ανάπτυξης του καρκίνου και της τοξικότητας από αντικαρκινικά φάρμακα που παράγουν οι ROS. Ο συνδυασμός φαρμάκων που παράγουν ROS με φαρμακευτικά προϊόντα που μπορούν να σπάσουν την οξειδοαναγωγική προσαρμογή θα μπορούσε να είναι μια καλύτερη στρατηγική για την ενίσχυση της κυτταροτοξικότητας των καρκινικών κυττάρων.[56]
Ο Τζέιμς Γουάτσον[73] και άλλοι[74] έχουν προτείνει ότι η έλλειψη ενδοκυττάριων ROS λόγω έλλειψης σωματικής άσκησης μπορεί να συμβάλει στην κακοήθη εξέλιξη του καρκίνου, επειδή χρειάζονται αιχμές ROS για να διπλωθούν σωστά οι πρωτεΐνες στο ενδοπλασματικό δίκτυο και τα χαμηλά επίπεδα ROS μπορεί έτσι να εμποδίσουν τον σχηματισμό πρωτεϊνών καταστολέων όγκων.[74] Δεδομένου ότι η σωματική άσκηση προκαλεί προσωρινές αυξήσεις των ROS, αυτό μπορεί να εξηγήσει γιατί η σωματική άσκηση είναι ευεργετική για την πρόγνωση των ασθενών με καρκίνο.[75] Επιπλέον, υψηλοί επαγωγείς ROS, όπως οι 2-δεοξυ-D-γλυκόζη και οι επαγωγείς κυτταρικής καταπόνησης με βάση τους υδατάνθρακες, προκαλούν τον θάνατο των καρκινικών κυττάρων πιο ισχυρά επειδή εκμεταλλεύονται την υψηλή ισχύ σύνδεσης των καρκινικών κυττάρων για τα σάκχαρα.[76]
Χημειοθεραπευτικά για τον καρκίνο που κατευθύνονται από ROS
[Επεξεργασία | επεξεργασία κώδικα]Πρόσφατη έρευνα καταδεικνύει ότι η οξειδοαναγωγική δυσρύθμιση που προέρχεται από μεταβολικές μεταβολές και εξάρτηση από μιτογόνο και επιβιωτική σηματοδότηση μέσω ROS αντιπροσωπεύει μια συγκεκριμένη ευπάθεια κακοηθών κυττάρων που μπορούν να στοχοποιηθούν επιλεκτικά από προοξειδωτικά και αντιοξειδωτικά οξειδοαναγωγικά χημειοθεραπευτικά.[77]
Θετικός ρόλος των ROS στη μνήμη
[Επεξεργασία | επεξεργασία κώδικα]

Δύο μελέτες[80][81] συνοψίζουν το μεγάλο σύνολο αποδεικτικών στοιχείων, που αναφέρθηκαν σε μεγάλο βαθμό μεταξύ 1996 και 2011, για τον κρίσιμο και ουσιαστικό ρόλο των ROS στο σχηματισμό μνήμης. Ένα πρόσθετο σύνολο στοιχείων αποδεικνύει ότι τόσο ο σχηματισμός όσο και η αποθήκευση της μνήμης εξαρτώνται από τις επιγενετικές τροποποιήσεις στους νευρώνες, συμπεριλαμβανομένων των μεταβολών στη νευρωσική μεθυλίωση του DNA .[82][83] Τα δύο σύνολα πληροφοριών σχετικά με τον σχηματισμό μνήμης φαίνεται να συνδέονται το 2016 από το έργο των Zhou κ.α.,[78] που έδειξαν ότι οι ROS έχουν κεντρικό ρόλο στην επιγενετική απομεθυλίωση του DNA.
Στο πυρηνικό DNA των θηλαστικών, μια ομάδα μεθυλίου μπορεί να προστεθεί, με μεθυλοτρανσφεράση του DNA, στον 5ο άνθρακα της κυτοσίνης για να σχηματίσει 5mC (βλ. Κόκκινη ομάδα μεθυλίου που προστίθεται για να σχηματίσει 5mC κοντά στην κορυφή του πρώτου σχήματος). Οι μεθυλοτρανσφεράσες του DNA σχηματίζουν συχνά 5mC εντός της αλληλουχίας δινουκλεοτιδίων "κυτοσίνη-φωσφορική-γουανίνη" για να σχηματίσουν 5mCpG. Αυτή η προσθήκη είναι ένας κύριος τύπος επιγενετικής μεταβολής και μπορεί να σιγάσει την έκφραση του γονιδίου. Η μεθυλιωμένη κυτοσίνη μπορεί επίσης να είναι απομεθυλιωμένη, μια επιγενετική μεταβολή που μπορεί να αυξήσει την έκφραση ενός γονιδίου. Ένα κύριο ένζυμο που εμπλέκεται στην απομεθυλίωση 5mCpG είναι το TET1. Ωστόσο, το TET1 μπορεί να δράσει μόνο με 5mCpG εάν μία ROS έχει ενεργήσει πρώτα στη γουανίνη για να σχηματίσει 8-υδροξυ-2'-δεοξυγουανοσίνη (8-OHdG), με αποτέλεσμα ένα δινουκλεοτίδιο 5mCp-8-OHdG (βλέπε πρώτο σχήμα).[78] Ωστόσο, το TET1 μπορεί να δράσει μόνο στο τμήμα 5mC του δινουκλεοτιδίου όταν το ένζυμο επιδιόρθωσης αποκοπής βάσεων γλυκοζυλάση της οξογουανίνης (OGG1) δεσμεύεται στην αλλοίωση 8-OHdG χωρίς άμεση εκτομή. Η προσκόλληση του OGG1 στις 5mCp-8-OHdG νέες θέσεις TET1 και το TET1 στη συνέχεια οξειδώνει το 5mC δίπλα στο 8-OHdG, όπως φαίνεται στο πρώτο σχήμα, ξεκινώντας μια οδό απομεθυλίωσης που φαίνεται στο δεύτερο σχήμα .
Το 2016 οι Halder κ.α.[84] χρησιμοποιώντας ποντίκια και το 2017 οι Duke κ.α.[85] χρησιμοποιώντας αρουραίους, υπέβαλαν τα τρωκτικά σε κλιματισμό φόβου, προκαλώντας τη δημιουργία μιας ιδιαίτερα ισχυρής μακροπρόθεσμης μνήμης. Σε 24 ώρες μετά τον κλιματισμό, στον ιππόκαμπο των αρουραίων, η έκφραση 1.048 γονιδίων υπορυθμίστηκε (συνήθως σχετίζεται με υπερμεθυλιωμένο προαγωγούς γονιδίων) και η έκφραση 564 γονιδίων υπερρυθμίστηκε (συχνά σχετίζεται με υπομεθυλιωμένους προαγωγείς γονιδίων). Σε 24 ώρες μετά την εκπαίδευση, το 9,2% των γονιδίων στο γονιδίωμα των αρουραίων των νευρώνων του ιπποκάμπου μεθυλιώθηκε διαφορετικά. Ωστόσο, ενώ ο ιππόκαμπος είναι απαραίτητος για την εκμάθηση νέων πληροφοριών, δεν αποθηκεύει τις ίδιες τις πληροφορίες. Στα πειράματα με ποντίκια του Halder, 1.206 διαφοροποιημένα μεθυλιωμένα γονίδια παρατηρήθηκαν στον ιππόκαμπο μία ώρα μετά τον περιβαλλοντικό κλιματισμό φόβου, αλλά αυτά αντιστράφηκαν και δεν εμφανίστηκαν μετά από τέσσερις εβδομάδες. Σε αντίθεση με την απουσία μακροχρόνιων αλλαγών μεθυλίωσης στον ιππόκαμπο, σημαντική διαφορική μεθυλίωση θα μπορούσε να ανιχνευθεί σε νευρώνες του φλοιού κατά τη διάρκεια της διατήρησης της μνήμης. Υπήρχαν 1.223 διαφοροποιημένα μεθυλιωμένα γονίδια στον πρόσθιο προσαγώγιο φλοιό των ποντικών, τέσσερις εβδομάδες μετά τον περιβαλλοντικό κλιματισμό του φόβου.
Οι χιλιάδες θέσεις CpG που απομεθυλιώνονται κατά τον σχηματισμό μνήμης εξαρτώνται από τις ROS σε ένα πρώτο βήμα. Η μεταβαλλόμενη πρωτεϊνική έκφραση στους νευρώνες, που ελέγχεται εν μέρει από την εξαρτώμενη από ROS απομεθυλίωση των θέσεων CpG σε γονιδιακούς προαγωγούς στο νευρώνα DNA, είναι κεντρική στο σχηματισμό μνήμης.[86]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «Redox mechanisms in hepatic chronic wound healing and fibrogenesis». Fibrogenesis & Tissue Repair 1 (1): 5. October 2008. doi:. PMID 19014652.
- ↑ 2,0 2,1 2,2 «Cadmium-induced oxidative stress in Saccharomyces cerevisiae». Indian Journal of Biochemistry & Biophysics 47 (6): 383–7. December 2010. PMID 21355423. http://nopr.niscair.res.in/handle/123456789/10863.
- ↑ «Superoxide Ion: Generation and Chemical Implications». Chemical Reviews 116 (5): 3029–85. March 2016. doi:. PMID 26875845.
- ↑ 4,0 4,1 4,2 «Mitochondrial formation of reactive oxygen species». The Journal of Physiology 552 (Pt 2): 335–44. October 2003. doi:. PMID 14561818.
- ↑ 5,0 5,1 «Free radicals and antioxidants in human health: current status and future prospects». The Journal of the Association of Physicians of India 52: 794–804. October 2004. PMID 15909857.
- ↑ Edreva, Aglika (2 April 2005). «Generation and scavenging of reactive oxygen species in chloroplasts: a submolecular approach» (στα αγγλικά). Agriculture, Ecosystems & Environment 106 (2): 119–133. doi:. ISSN 0167-8809. https://www.sciencedirect.com/science/article/pii/S0167880904002889?casa_token=I44eIpYBZ-YAAAAA:OkUCOZjk2zNaHGTtzpzUcL8nOYTB3I1x9ZrkpdFL9YLtwud8ml-8vx6MSToSEuNzioluir5Fj0Ah. Ανακτήθηκε στις 3 November 2020.
- ↑ «Role of reactive oxygen intermediates and cognate redox signaling in disease resistance». Plant Physiology 124 (1): 21–9. September 2000. doi:. PMID 10982418. PMC 1539275. https://archive.org/details/sim_plant-physiology_2000-09_124_1/page/21.
- ↑ 8,0 8,1 8,2 Edreva, Aglika (2 April 2005). «Generation and scavenging of reactive oxygen species in chloroplasts: a submolecular approach» (στα αγγλικά). Agriculture, Ecosystems & Environment 106 (2): 119–133. doi:. ISSN 0167-8809. https://doi.org/10.1016/j.agee.2004.10.022.
- ↑ Sosa Torres, Martha E.· Saucedo-Vázquez, Juan P.· Kroneck, Peter M.H. (2015). «Chapter 1, Section 3 The dark side of dioxygen». Στο: Kroneck, Peter M.H.· Torres, Martha E. Sosa. Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. 15. Springer. σελίδες 1–12. doi:10.1007/978-3-319-12415-5_1. PMID 25707464.
- ↑ «ROS Are Good». Trends in Plant Science 22 (1): 11–19. January 2017. doi:. PMID 27666517.
- ↑ «Thiol-Based Peroxidases and Ascorbate Peroxidases: Why Plants Rely on Multiple Peroxidase Systems in the Photosynthesizing Chloroplast?». Molecules and Cells 39 (1): 20–5. January 2016. doi:. PMID 26810073.
- ↑ «The nature and mechanism of superoxide production by the electron transport chain: Its relevance to aging». Journal of the American Aging Association 23 (4): 227–53. October 2000. doi:. PMID 23604868.
- ↑ «Mitochondrial respiratory chain-dependent generation of superoxide anion and its release into the intermembrane space». The Biochemical Journal 353 (Pt 2): 411–6. January 2001. doi:. PMID 11139407.
- ↑ «Targeting mitochondrial reactive oxygen species as novel therapy for inflammatory diseases and cancers». Journal of Hematology & Oncology 6 (19): 19. February 2013. doi:. PMID 23442817.
- ↑ «Electron leakage from the mitochondrial NADPH-adrenodoxin reductase-adrenodoxin-P450scc (cholesterol side chain cleavage) system». Archives of Biochemistry and Biophysics 305 (2): 489–98. September 1993. doi:. PMID 8396893. https://zenodo.org/record/890721.
- ↑ «Antioxidant protective mechanisms against reactive oxygen species (ROS) generated by mitochondrial P450 systems in steroidogenic cells». Drug Metabolism Reviews 38 (1–2): 171–96. 2006. doi:. PMID 16684656. https://zenodo.org/record/890701.
- ↑ «Regulation and measurement of oxidative stress in apoptosis». Journal of Immunological Methods 265 (1–2): 49–72. July 2002. doi:. PMID 12072178. https://arrow.dit.ie/cgi/viewcontent.cgi?article=1039&context=scschbioart.
- ↑ Alberts, Bruce· Johnson, Alexander· Lewis, Julian· Morgan, David· Raff, Martin· Roberts, Keith· Walter, Peter (2014). Molecular Biology of the Cell (6 έκδοση). New York: Garland Science. σελ. 1025. ISBN 978-0-8153-4432-2.
- ↑ 19,0 19,1 «Functions of ROS in Macrophages and Antimicrobial Immunity». Antioxidants 10 (2): 313. February 2021. doi:. PMID 33669824.
- ↑ Chen, Xinfeng; Song, Mengjia; Zhang, Bin; Zhang, Yi (July 28, 2016). «Reactive Oxygen Species Regulate T Cell Immune Response in the Tumor Microenvironment». Oxidative Medicine and Cellular Longevity 2016: 1–10. doi:. PMID 27547291.
- ↑ «Mechanisms of ROS Regulation of Plant Development and Stress Responses». Frontiers in Plant Science 10: 800. 2019. doi:. PMID 31293607.
- ↑ 22,0 22,1 Zhang, Suping; Weng, Jun; Pan, Jingxi; Tu, Tiecheng; Yao, Side; Xu, Chunhe (1 January 2003). «Study on the photo-generation of superoxide radicals in Photosystem II with EPR spin trapping techniques» (στα αγγλικά). Photosynthesis Research 75 (1): 41–48. doi:. ISSN 1573-5079. PMID 16245092. https://doi.org/10.1023/A:1022439009587.
- ↑ Cleland, Robyn E.; Grace, Stephen C. (3 September 1999). «Voltammetric detection of superoxide production by photosystem II» (στα αγγλικά). FEBS Letters 457 (3): 348–352. doi:. PMID 10471806. https://archive.org/details/sim_febs-letters_1999-09-03_457_3/page/348.
- ↑ «Mechanism of enhanced superoxide production in the cytochrome b(6)f complex of oxygenic photosynthesis». Biochemistry 52 (50): 8975–83. December 2013. doi:. PMID 24298890.
- ↑ 25,0 25,1 «Retrograde signaling: Organelles go networking». Biochimica et Biophysica Acta (BBA) - Bioenergetics 1857 (8): 1313–1325. August 2016. doi:. PMID 26997501.
- ↑ «Role of reactive oxygen intermediates and cognate redox signaling in disease resistance». Plant Physiology 124 (1): 21–9. September 2000. doi:. PMID 10982418. PMC 1539275. https://archive.org/details/sim_plant-physiology_2000-09_124_1/page/21.
- ↑ 27,0 27,1 27,2 27,3 «Key players of singlet oxygen-induced cell death in plants». Frontiers in Plant Science 6: 39. 2015. doi:. PMID 25699067.
- ↑ Rada B, Leto TL (2008). «Oxidative innate immune defenses by Nox/Duox family NADPH oxidases». Στο: Egesten A, Schmidt A, Herwald H. Trends in Innate Immunity. Contributions to Microbiology. 15. Basel: Karger. σελίδες 164–87. doi:10.1159/000136357. ISBN 978-3-8055-8548-4. PMC 2776633
 . PMID 18511861. — Review
. PMID 18511861. — Review
- ↑ «Lactoperoxidase and hydrogen peroxide metabolism in the airway». American Journal of Respiratory and Critical Care Medicine 166 (12 Pt 2): S57-61. December 2002. doi:. PMID 12471090.
- ↑ Brooker, Robert J. (2011). Genetics: analysis and principles (4th έκδοση). McGraw-Hill Science. ISBN 978-0-07-352528-0.
- ↑ «Gut homeostasis in a microbial world: insights from Drosophila melanogaster». Nature Reviews. Microbiology 11 (9): 615–26. September 2013. doi:. PMID 23893105. http://infoscience.epfl.ch/record/189299.
- ↑ «Bacterial-derived uracil as a modulator of mucosal immunity and gut-microbe homeostasis in Drosophila». Cell 153 (4): 797–811. May 2013. doi:. PMID 23663779.
- ↑ West AP et al 2011 Nature Reviews Immunology 11, 389–402
- ↑ «Reactive oxygen species induce antiviral innate immune response through IFN-λ regulation in human nasal epithelial cells». American Journal of Respiratory Cell and Molecular Biology 49 (5): 855–65. November 2013. doi:. PMID 23786562.
- ↑ «Mitochondrial reactive oxygen species enable proinflammatory signaling through disulfide linkage of NEMO». Science Signaling 12 (568): eaar5926. February 2019. doi:. PMID 30755476.
- ↑ «Phagocyte NADPH oxidase, chronic granulomatous disease and mycobacterial infections». Cellular Microbiology 16 (8): 1168–78. August 2014. doi:. PMID 24916152.
- ↑ «T cells and reactive oxygen species». Journal of Biomedical Science 22: 85. October 2015. doi:. PMID 26471060.
- ↑ Patel RP, T Cornwell T, Darley-Usmar VM (1999). «The biochemistry of nitric oxide and peroxynitrite: implications for mitochondrial function». Στο: Packer L, Cadenas E. Understanding the process of aging: the roles of mitochondria, free radicals, and antioxidants. New York, NY: Marcel Dekker. σελίδες 39–56. ISBN 0-8247-1723-6.
- ↑ «Memory loss in old rats is associated with brain mitochondrial decay and RNA/DNA oxidation: partial reversal by feeding acetyl-L-carnitine and/or R-alpha -lipoic acid». Proceedings of the National Academy of Sciences of the United States of America 99 (4): 2356–61. February 2002. doi:. PMID 11854529. Bibcode: 2002PNAS...99.2356L.
- ↑ «Protein oxidation and aging». Science 257 (5074): 1220–4. August 1992. doi:. PMID 1355616. Bibcode: 1992Sci...257.1220S. https://zenodo.org/record/1230934.
- ↑ «Reversal of age-related increase in brain protein oxidation, decrease in enzyme activity, and loss in temporal and spatial memory by chronic administration of the spin-trapping compound N-tert-butyl-alpha-phenylnitrone». Proceedings of the National Academy of Sciences of the United States of America 88 (9): 3633–6. May 1991. doi:. PMID 1673789. Bibcode: 1991PNAS...88.3633C.
- ↑ «Deletion of the mitochondrial superoxide dismutase sod-2 extends lifespan in Caenorhabditis elegans». PLOS Genetics 5 (2): e1000361. February 2009. doi:. PMID 19197346.
- ↑ «Trends in oxidative aging theories». Free Radical Biology & Medicine 43 (4): 477–503. August 2007. doi:. PMID 17640558.
- ↑ «Increased macromolecular damage due to oxidative stress in the neocortex and hippocampus of WNIN/Ob, a novel rat model of premature aging». Neuroscience 269: 256–64. June 2014. doi:. PMID 24709042.
- ↑ Bernstein H, Payne CM, Bernstein C, Garewal H, Dvorak K (2008). «Chapter 1: Cancer and aging as consequences of un-repaired DNA damage.». Στο: Kimura H, Suzuki A. New Research on DNA Damages. New York: Nova Science Publishers, Inc. σελίδες 1–47. ISBN 978-1-60456-581-2. Αρχειοθετήθηκε από το πρωτότυπο στις 25 Οκτωβρίου 2014. Ανακτήθηκε στις 5 Αυγούστου 2021.
 , but read only.
, but read only.
- ↑ «The Simmet lecture: new horizons on an old landscape--oxidative stress, DNA damage and apoptosis in the male germ line». Reproduction in Domestic Animals = Zuchthygiene 47 Suppl 4: 7–14. August 2012. doi:. PMID 22827344.
- ↑ «Sperm DNA damage caused by oxidative stress: modifiable clinical, lifestyle and nutritional factors in male infertility». Reproductive Biomedicine Online 28 (6): 684–703. June 2014. doi:. PMID 24745838.
- ↑ «Comparison of oxidative stress/DNA damage in semen and blood of fertile and infertile men». PLOS ONE 8 (7): e68490. 2013. doi:. PMID 23874641. Bibcode: 2013PLoSO...868490G.
- ↑ «Chemistry and biology of reactive oxygen species in signaling or stress responses». Nature Chemical Biology 7 (8): 504–11. July 2011. doi:. PMID 21769097.
- ↑ «Mitogenic signaling mediated by oxidants in Ras-transformed fibroblasts». Science 275 (5306): 1649–52. March 1997. doi:. PMID 9054359.
- ↑ «ROS as a tumour suppressor?». Nature Cell Biology 8 (11): 1213–5. November 2006. doi:. PMID 17077852.
- ↑ «Mitogenic signalling and the p16INK4a-Rb pathway cooperate to enforce irreversible cellular senescence». Nature Cell Biology 8 (11): 1291–7. November 2006. doi:. PMID 17028578.
- ↑ «The emerging role of reactive oxygen species in cancer therapy». European Journal of Cancer 40 (13): 1934–40. September 2004. doi:. PMID 15315800.
- ↑ «Selective enhancement of cellular oxidative stress by chloroquine: implications for the treatment of glioblastoma multiforme». Neurosurgical Focus 21 (6): E10. December 2006. doi:. PMID 17341043.
- ↑ «Regulation of cancer cell metabolism». Nature Reviews. Cancer 11 (2): 85–95. February 2011. doi:. PMID 21258394.
- ↑ 56,0 56,1 56,2 56,3 56,4 56,5 56,6 56,7 «Upsides and downsides of reactive oxygen species for cancer: the roles of reactive oxygen species in tumorigenesis, prevention, and therapy». Antioxidants & Redox Signaling 16 (11): 1295–322. June 2012. doi:. PMID 22117137.
- ↑ «Reactive oxygen species: role in the development of cancer and various chronic conditions». Journal of Carcinogenesis 5: 14. May 2006. doi:. PMID 16689993.
- ↑ «Novel PKC-ζ to p47 phox interaction is necessary for transformation from blebbishields». Scientific Reports 6: 23965. April 2016. doi:. PMID 27040869. Bibcode: 2016NatSR...623965J.
- ↑ Jinesh GG, Kamat AM. Blebbishield emergency program: an apoptotic route to cellular transformation. Cell Death Differ. 2016 In Press.
- ↑ «Dietary carcinogens and anticarcinogens. Oxygen radicals and degenerative diseases». Science 221 (4617): 1256–64. September 1983. doi:. PMID 6351251. Bibcode: 1983Sci...221.1256A.
- ↑ «Oxidative stress and apoptosis: impact on cancer therapy». Journal of Pharmaceutical Sciences 96 (9): 2181–96. September 2007. doi:. PMID 17593552.
- ↑ «Cellular response to oxidative stress: signaling for suicide and survival». Journal of Cellular Physiology 192 (1): 1–15. July 2002. doi:. PMID 12115731.
- ↑ «Self-eating and self-killing: crosstalk between autophagy and apoptosis». Nature Reviews. Molecular Cell Biology 8 (9): 741–52. September 2007. doi:. PMID 17717517.
- ↑ «Targeting mitochondria for cancer therapy». Nature Reviews. Drug Discovery 9 (6): 447–64. June 2010. doi:. PMID 20467424.
- ↑ «Dual regulation of caspase activity by hydrogen peroxide: implications for apoptosis». FEBS Letters 414 (3): 552–6. September 1997. doi:. PMID 9323034.
- ↑ «A matter of balance between life and death: targeting reactive oxygen species (ROS)-induced autophagy for cancer therapy». Autophagy 6 (7): 835–7. October 2010. doi:. PMID 20818163.
- ↑ «Cannabidiol induces programmed cell death in breast cancer cells by coordinating the cross-talk between apoptosis and autophagy». Molecular Cancer Therapeutics 10 (7): 1161–72. July 2011. doi:. PMID 21566064.
- ↑ 68,0 68,1 «ROS, mitochondria and the regulation of autophagy». Trends in Cell Biology 17 (9): 422–7. September 2007. doi:. PMID 17804237.
- ↑ «Autophagosome formation: core machinery and adaptations». Nature Cell Biology 9 (10): 1102–9. October 2007. doi:. PMID 17909521.
- ↑ «Redox regulation of cancer cell migration and invasion». Mitochondrion 13 (3): 246–53. May 2013. doi:. PMID 22960576.
- ↑ «Reactive oxygen species in cancer cells: live by the sword, die by the sword». Cancer Cell 10 (3): 175–6. September 2006. doi:. PMID 16959608.
- ↑ «Targeting cancer cells by ROS-mediated mechanisms: a radical therapeutic approach?». Nature Reviews. Drug Discovery 8 (7): 579–91. July 2009. doi:. PMID 19478820.
- ↑ «Type 2 diabetes as a redox disease». Lancet 383 (9919): 841–3. March 2014. doi:. PMID 24581668.
- ↑ 74,0 74,1 «Type 2 diabetes and cancer as redox diseases?». Lancet 384 (9946): 853. September 2014. doi:. PMID 25209484.
- ↑ «Influence of pre- and postdiagnosis physical activity on mortality in breast cancer survivors: the health, eating, activity, and lifestyle study». Journal of Clinical Oncology 26 (24): 3958–64. August 2008. doi:. PMID 18711185.
- ↑ «Carbohydrate-based inducers of cellular stress for targeting cancer cells». Bioorganic & Medicinal Chemistry Letters 26 (5): 1452–6. March 2016. doi:. PMID 26832785.
- ↑ «Redox-directed cancer therapeutics: molecular mechanisms and opportunities». Antioxidants & Redox Signaling 11 (12): 3013–69. December 2009. doi:. PMID 19496700.
- ↑ 78,0 78,1 78,2 «OGG1 is essential in oxidative stress induced DNA demethylation». Cellular Signalling 28 (9): 1163–71. September 2016. doi:. PMID 27251462.
- ↑ «The Role of Activity-Dependent DNA Demethylation in the Adult Brain and in Neurological Disorders». Frontiers in Molecular Neuroscience 11: 169. 2018. doi:. PMID 29875631.
- ↑ «Reactive oxygen species in the regulation of synaptic plasticity and memory». Antioxidants & Redox Signaling 14 (10): 2013–54. May 2011. doi:. PMID 20649473.
- ↑ «Reactive Oxygen Species: Physiological and Physiopathological Effects on Synaptic Plasticity». Journal of Experimental Neuroscience 10 (Suppl 1): 23–48. 2016. doi:. PMID 27625575.
- ↑ «Epigenetic modifications in neurons are essential for formation and storage of behavioral memory». Neuropsychopharmacology 36 (1): 357–8. January 2011. doi:. PMID 21116250.
- ↑ «Neural plasticity and behavior - sixty years of conceptual advances». Journal of Neurochemistry 139 Suppl 2: 179–199. October 2016. doi:. PMID 26875778.
- ↑ «DNA methylation changes in plasticity genes accompany the formation and maintenance of memory». Nature Neuroscience 19 (1): 102–10. January 2016. doi:. PMID 26656643.
- ↑ «Experience-dependent epigenomic reorganization in the hippocampus». Learning & Memory 24 (7): 278–288. July 2017. doi:. PMID 28620075.
- ↑ «DNA methylation and memory formation». Nature Neuroscience 13 (11): 1319–23. November 2010. doi:. PMID 20975755.
Παραπέρα μελέτη
[Επεξεργασία | επεξεργασία κώδικα]- «The general case for redox control of wound repair». Wound Repair and Regeneration 11 (6): 431–8. 2003. doi:. PMID 14617282.
- «NAD(P)H oxidase-dependent platelet superoxide anion release increases platelet recruitment». Blood 100 (3): 917–24. August 2002. doi:. PMID 12130503.
- «Hydrogen peroxide is involved in collagen-induced platelet activation». Blood 91 (2): 484–90. January 1998. doi:. PMID 9427701.
- «Nitric oxide and superoxide in inflammation and immune regulation». Journal of Physiology and Pharmacology 54 (4): 469–87. December 2003. PMID 14726604.

![{\displaystyle {\ce {^3O2 ->[{\ce {light}}][{\ce {photosensitizer}}] ^1O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a62c29558574cf534f0eaf188595d3f3c8bb29b)