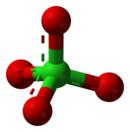
Υπερχλωρικό

| |||
| |||
| Ονομασίες | |||
|---|---|---|---|
| Συστηματική ονομασία IUPAC Υπερχλωρικό[1] | |||
| Χαρακτηριστικά | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider |
| ||
| DrugBank |
| ||
| ECHA InfoCard | 100.152.366 | ||
| 2136 | |||
IUPHAR/BPS
|
|||
| MeSH | 180053 | ||
PubChem CID
|
|||
| |||
| |||
| Ιδιότητες | |||
| ClO− 4 | |||
| Μοριακό βάρος | 99,451 g mol−1 | ||
| Συζυγές οξύ | Υπερχλωρικό οξύ | ||
Αν δε σημειώνεται διαφορετικά, τα δεδομένα ισχύουν για υλικά σε πρότυπη κατάσταση (25°C, 100 kPa). | |||
| Βιβλιογραφία πλαισίου πληροφοριών | |||
Το υπερχλωρικό είναι συστατικό του ονόματος μιας χημικής ένωσης που περιέχει το υπερχλωρικό ιόν ClO−
4. Το υπερχλωρικά άλατα χρησιμοποιούνται ως προωθητικά σπρέι, ως ισχυροί οξειδωτικοί παράγοντες και για περιορισμό του στατικού ηλεκτρισμού κατά τη συσκευασία τροφίμων.[2] Η ρύπανση τροφίμων, νερού και περιβάλλοντος μελετάται ως προς τις επιπτώσεις της στην υγεία. Το υπερχλωρικό μειώνει την παραγωγή ορμονών στο θυρεοειδή αδένα.
Τα περισσότερα υπερχλωρικά είναι άχρωμα στερεά διαλυτά στο νερό. Εμπορικού ενδιαφέροντος είναι τα: υπερχλωρικό αμμώνιο (NH4ClO4), υπερχλωρικό οξύ (HClO4), υπερχλωρικό κάλιο (KClO4) και υπερχλωρικό νάτριο (NaClO4). Το υπερχλωρικό είναι ανιόν που προκύπτει από την διάσταση του υπερχλωρικού οξέος και των αλάτων του κατά τη διάλυση τους σε νερό. Πολλά υπερχλωρικά άλατα είναι διαλυτά σε μη υδατικά διαλύματα.
Παρασκευή
[Επεξεργασία | επεξεργασία κώδικα]Τα υπερχλωρικά άλατα παράγονται βιομηχανικά με ηλεκτρολυτική οξείδωση διαλυμάτων χλωριούχου νατρίου, οπότε προκύπτει υπερχλωρικό νάτριο. Η κύρια εφαρμογή του είναι ως καύσιμο πυραύλων.[3] Με αντίδραση υπερχλωρικού οξέος και βάσης, όπως το υδροξειδίο του αμμωνίου, παράγεται άλας. Το υπερχλωρικό αμμώνιο παράγεται και ηλεκτροχημικά.[4]
Φυσικά το υπερχλωρικό μπορεί να παραχθεί από εκκενώσεις αστραπής παρουσία χλωριούχου. Ανιχνεύτηκε σε δείγματα βροχής και χιονιού από τη Φλόριντα και το Λάμποκ του Τέξας.[5]
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]- Η κύρια χρήση των υπερχλωρικών είναι ως οξειδωτικά σε προωθητικά πυραύλων και πυροτεχνημάτων. Ιδιαίτερου ενδιαφέροντος είναι το συνθετικό προωθητικό με υπερχλωρικό αμμώνιο ως συστατικό στερεών καυσίμων πυραύλων. Χρησιμοποιούνται ευρέως στις βιομηχανίες πυροτεχνίας, πυρομαχικών και κατασκευής σπίρτων.
- Το υπερχλωρικό χρησιμοποιείται για τον έλεγχο του στατικού ηλεκτρισμού κατά τη συσκευασία τροφίμων. Ψεκάζεται στους περιέκτες για να εμποδίσει την προσκόλληση στατικά φορτισμένων τροφίμων σε πλαστικές ή χάρτινες/χαρτονένιες επιφάνειες.[6]
- Χρησιμοποιείται για τη θεραπεία του υπερθυρεοειδισμού από νόσο του Graves. Εμποδίζει τη συσσώρευση ιωδίου στο θυρεοειδή.[7]
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το υπερχλωρικό ιόν είναι το λιγότερο οξειδωτικό από τα χλωρικά άλατα, όπως φαίνεται από τον πίνακα με τα δυναμικά αναγωγής.[8]
| Ιόν | Όξινη αντίδραση | E° (V) | Ουδέτερη/βασική αντίδραση | E° (V) |
|---|---|---|---|---|
| Υποχλωριώδες | H+ + Hoci + e− → ½ Cl2(g) + H2O | 1,63 | ClO− + H2O + 2 e− → Cl− + 2OH− | 0,89 |
| Χλωρίτης | 3 H+ + HOClO + 3 e− → ½ Cl2(g) + 2 H2O | 1,64 | ClO− 2 + 2 H2O + 4 e− → Cl− + 4 - − |
0,78 |
| Χλωρικό | 6 H+ + ClO− 3 + 5 e− → ½ Cl2(g) + 3 H2O |
1,47 | ClO− 3 + 3 H2O + 6 e− → Cl− + 6 - − |
0,63 |
| Υπερχλωρικό | 8 H+ + ClO− 4 + 7 e− → ½ Cl2(g) + 4 H2O |
1,42 | ClO− 4 + 4 H2O + 8 e− → Cl− + 8 Ω− |
0,56 |
Μετρήσεις θερμότητας αντίδρασης σε αέρια φάση (για προσδιορισμό του ΔHf°) διάφορων οξείδιων του χλωρίου έδειξαν ότι το Cl2O7 έχει τη μεγαλύτερη ενδόθερμη τιμή ΔHf° (238,1 kJ/mol), ενώ το Cl2O παρουσιάζει τη χαμηλότερη ενδόθερμη τιμή ΔHf° (80,3 kJ/mol).[9]
Το υπερχλωρικό κάλιο έχει τη μικρότερη διαλυτότητα από όλα τα υπερχλωρικά αλκαλιμέταλλα (1,5 g σε 100 ml νερού στους 25 °C).
Βιολογία
[Επεξεργασία | επεξεργασία κώδικα]Άπό το 1996 έχουν εντοπιστεί πάνω από 40 φυλογενετικά και μεταβολικά διαφορετικοί μικροοργανισμοί που αναπτύσσονται με αναγωγή των υπερχλωρικών. Οι περισσότεροι προέρχονται από Πρωτεοβακτήρια ενώ άλλοι είναι Firmicutes, Moorella perchloratireducens και Sporomusa sp., και το αρχαίο Archaeoglobus fulgidus.[10][11] Με εξαίρεση το τελευταίο, όλα τα μικρόβια της κατηγορίας διαθέτουν τα ένζυμα υπερχλωρική αναγωγάση και δισμουτάση χλωρίτη, που συνεργικά μετατρέπουν το υπερχλωρικό σε αβλαβές χλωριούχο. Η αντίδραση παράγει οξυγόνο (O2) .
Οξυανιόντα του χλωρίου
[Επεξεργασία | επεξεργασία κώδικα]Το χλώριο μπορεί να λάβει αριθμούς οξείδωσης: -1, +1, +3, +5, ή στο +7, και μια πρόσθετη κατάσταση οξείδωσης +4 στην ουδέτερη ένωση διοξείδιο του χλωρίου ClO2.
| Αριθμός οξείδωσης | -1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Ονομασία | χλωριούχο | υποχλωριώδες | χλωρίτης | χλωρικό | υπερχλωρικό |
| Τύπος | Cl− | ClO− | ClO− 2 |
ClO− 3 |
ClO− 4 |
| Δομή | 
|

|

|
Φυσική παρουσία
[Επεξεργασία | επεξεργασία κώδικα]Φυσικά υπάρχουν μεγάλα κοιτάσματα σε μείγμα με νιτρικό νάτριο στην Έρημο Ατακάμα της βόρειας Χιλής, από όπου εξορύσσονται συστατικά των αζωτούχων λιπασμάτων. Τα νιτρικά της Χιλής εκτιμάται ότι δίνουν 81.000 τόνους υπερχλωρικών που εισάγονται στις ΗΠΑ (1909-1997). Από μελέτες ύδατος εδάφους, νερού, πάγων, και ατάραχων ερήμων εκτιμήθηκε ότι το παγκόσμιο απόθεμα της Γης σε υπερχλωρικά είναι 100.000 - 3.000.000 τόνοι.[12]
Στον Άρη
[Επεξεργασία | επεξεργασία κώδικα]Τον Μάιο 2008, το Χημικό Εργαστήριο Υγρών (WCL) του Αρειανού λάντερ Φοίνιξ πραγματοποίησε την πρώτη υγρή χημική ανάλυση του Αρειανού εδάφους. Οι αναλύσεις των τριών δειγμάτων, δύο από την επιφάνεια και 1 από βάθος 5cm, αποκάλυψε ένα μέτρια αλκαλικό έδαφος και χαμηλά επίπεδα αλάτων που βρίσκονται κανονικά στη Γη. Απρόσμενη ήταν η παρουσία του ~0.6% κατά βάρος υπερχλωρικών (ClO−
4), πιθανότατα σε μείγμα 60% Ca(ClO4)2 και 40% Mg(ClO4)2.[13][14][15] Αυτά τα άλατα, που σχηματίζονται από τα υπερχλωρικά, είναι αντιψυκτικό που ελαττώνουν το σημείο πήξης του νερού. Με βάση τις συνθήκες θερμοκρασίας και πίεσης στην περιοχή προσεδάφισης του Φοίνιξ λάντερ, οι συνθήκες θα επέτρεπαν σε ένα διάλυμα υπερχλωρικού άλατος να παραμείνει σταθερό σε υγρή μορφή για λίγες ώρες ημερήσια κατά τη διάρκεια του καλοκαιριού.[16]
Η υπόθεση ότι τα υπερχλωρικά ήταν ρύποι που συνταξίδεψαν με το διαστημόπλοιο από τη Γη έχει καταρριφθεί. Οι ανασχετικοί πύραυλοι του Φοίνιξ καταναλώνουν εξαιρετικά καθαρή υδραζίνη και τα προωθητικά εκτόξευσης αποτελούνται από υπερχλωρικό αμμώνιο. Οι αισθητήρες του Phoenix δεν ανίχνευσαν ίχνη αμμωνίου, και συνεπώς τα υπερχλωρικά που βρέθηκαν στα τρία δείγματα εδάφους είναι γηγενή του Αρειανού εδάφους.
Το 2006 προτάθηκε ένας μηχανισμός για τον σχηματισμό των υπερχλωρικών που ίσως σχετίζεται με τα ευρήματα της περιοχής προσεδάφισης του Φοίνιξ. Αποδείχθηκε ότι τα χλωρίδια εμπλουτισμένων εδαφών μετατρέπονται σε υπερχλωρικά με την παρουσία διοξειδίου του τιτανίου και ηλιακού/υπεριώδους φωτός. Η αντίδραση μετατροπής προσομοιώθηκε στο εργαστήριο με χλωριούχα εδάφους από την Κοιλάδα του Θανάτου.[17] Άλλα πειράματα έδειξαν ότι ο σχηματισμός υπερχλωρικών σχετίζεται με ημιαγώγιμα οξείδια.[18] Το 2014, δείχθηκε ότι τα υπερχλωρικά και χλωρικά παράγονται από χλωριούχα μέταλλα στις Αρειανές συνθήκες με την παρουσία UV , NaCl και πυριτικών.[19]
Περαιτέρω ευρήματα υπερχλωρικών και χλωρικών στον Αρειανό μετεωρίτη EETA79001, [20] και από το Αρειανό ρόβερ Περιέργεια τη διετία 2012-2013, υποστηρίζουν την άποψη ότι τα υπερχλωρικά είναι κατανεμημένα παντού στην επιφάνεια του Άρη.[21][22][23] Με συγκεντρώσεις περί το 0,5% που υπερβαίνουν τα τοξικά επίπεδα, τα υπερχλωρικά θα δυσχεραίνουν τη διαβίωση ανθρώπων[24] και μικροοργανισμών.[25]
Την 28 Σεπτεμβρίου 2015 το NASA ανακοίνωσε ότι οι αναλύσεις των φασματικών δεδομένων του Συμπαγούς Αναγνωριστικού Απεικονιστικού Φασματόμετρου (CRISM) από τέσσερις διαφορετικές τοποθεσίες με περιοδικές κλίσεις (RSL) έδειξαν ίχνη ένυδρων αλάτων. Τα ένυδρα άλατα φασματικά μοιάζουν με υπερχλωρικό μαγνήσιο, χλωριούχο μαγνήσιο και υπερχλωρικό νάτριο. Τα ευρήματα υποστηρίζουν σθεναρά την υπόθεση ότι οι κλίσεις RSL σχετίζονται με ενεργότητα νερού στον Άρη.[26][27][28][29][30]
Ρύπανση του περιβάλλοντος
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχει ανησυχία και αβεβαιότητα για την τοξικότητα και τις επιπτώσεις των υπερχλωρικών στην υγεία, την παρουσία τους στο πόσιμο νερό, την επίδρασή τους στα οικοσυστήματα, και τις έμμεσες διαδρομές συσσώρευσης στα λαχανικά και τα ανθρώπινα τρόφιμα.Είναι υδατοδιαλυτά, ρευστά, και παραμένουν μακροχρόνια υπό τυπικών υπόγειων και επιφανειακών υδατικών συνθηκών. Τα ίχνη υπερχλωρικών που εντοπίζονται προέρχονται από απολυμαντικά, λευκαντικά, ζιζανιοκτόνα, και από προωθητικά πυραύλων. Είναι παραπροϊόντα της παραγωγής καυσίμων πυραύλων και πυροτεχνημάτων.[31] Η απομάκρυνση και ανάκτηση των υπερχλωρικών ενώσεων από τα εκρηκτικά και τα προωθητικά πυραύλων γίνεται με υψηλής πίεσης νερού έκπλυση, που παράγει υδατικό υπερχλωρικό αμμώνιο.
Στο αμερικάνικο πόσιμο νερό
[Επεξεργασία | επεξεργασία κώδικα]Σύμφωνα με την Υπηρεσία Προστασίας του Περιβάλλοντος (EPA), μικρές ποσότητες υπερχλωρικών βρέθηκαν στο πόσιμο νερό και τα εδαφικά ύδατα 26 αμερικανικών πολιτειών.[32] Το 2004 βρέθηκαν σε αγελαδινό γάλα στην Καλιφόρνια σε περιεκτικότητα 1,3 μέρη στο δισεκατομμύριο (ppb ή μg/L), και μάλλον προήλθαν από βοσκή ποτισμένη με ύδατα περιέχοντα υπερχλωρικά.[33] Ανιχνεύτηκαν υψηλά επίπεδα 5 µg/L στην Κοινή Βάση Cape Cod (παλαιά στρατιωτική εγκατάσταση στη Μασαχουσέτη), πολύ πάνω του νόμιμου ορίου της Μασαχουσέτης των 2 µg/L.[34][35] Τα πυροτεχνήματα είναι πηγές υπερχλωρικών σε λίμνες.[36]
Το 2000 στο Όλιν Πυροτεχνήματα του Μόργκαν Χιλ στην Καλιφόρνια διαπιστώθηκε ρύπανση με υπερχλωρικά από το παλαιό εργοστάσιο πυροτεχνημάτων.[37]
Στα τρόφιμα
[Επεξεργασία | επεξεργασία κώδικα]Το 2004 βρέθηκαν σε αγελαδινό γάλα στην Καλιφόρνια σε περιεκτικότητα 1,3 μέρη στο δισεκατομμύριο (ppb ή μg/L), και μάλλον προήλθαν από βοσκή ποτισμένη με ύδατα περιέχοντα υπερχλωρικά. Το 2005 μία μελέτη έδειξε ότι το ανθρώπινο μητρικό γάλα είχε κατά μέσο όρο 10,5 μg/L υπερχλωρικών.[38]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ "Perchlorate - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ Draft Toxicological Profile for Perchlorates, Agency for Toxic Substances and Disease Registry, U.S. Department of Health and Human Services, September, 2005.
- ↑ Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone "Chlorine Oxides and Chlorine Oxygen Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH.
- ↑ Dotson R.L. (1993). «A novel electrochemical process for the production of ammonium perchlorate». Journal of Applied Electrochemistry 23: 897–904. doi:. https://archive.org/details/sim_journal-of-applied-electrochemistry_1993-09_23_9/page/897.
- ↑ Kathleen Sellers, Katherine Weeks, William R. Alsop, Stephen R. Clough, Marilyn Hoyt, Barbara Pugh, Joseph Robb. Perchlorate: Environmental Problems and Solutions, 2007, p 9. Taylor & Francis Group, LLC.
- ↑ McMullen Jenica, Ghassabian Akhgar, Kohn Brenda, Trasande Leonardo (2017). «Identifying Subpopulations Vulnerable to the Thyroid-Blocking Effects of Perchlorate and Thiocyanate». The Journal of Clinical Endocrinology & Metabolism 102: 2637–2645. doi:.CS1 maint: Multiple names: authors list (link)
- ↑ Susarla Sridhar; Collette C. W.; Garrison A. W.; Wolfe N. L.; McCutcheon S. C. (1999). «Perchlorate Identification in Fertilizers». Environmental Science and Technology 33: 3469–3472. doi:. Bibcode: 1999EnST...33.3469S.
- ↑ Cotton, F. Albert· Wilkinson, Geoffrey (1988). Advanced Inorganic Chemistry (5th έκδοση). New York: Wiley-Interscience. σελ. 564. ISBN 0-471-84997-9.
- ↑ Wagman, D. D.; Evans, W. H.; Parker, V. P.; Schumm, R. H.; Halow, I.; Bailey, S. M.; Churney, K. L.; Nuttall, R. L. J. Phys. Chem. Ref. Data Vol. 11(2); &169;1982 by the American Chemical Society and the American Institute of Physics.
- ↑ John D. Coates; Laurie A. Achenbach (2004). «Microbial perchlorate reduction: rocket-fuelled metabolism». Nature Reviews Microbiology 2 (7): 569–580. doi:. PMID 15197392.
- ↑ Martin G. Liebensteiner, Martijn W. H. Pinkse, Peter J. Schaap, Alfons J. M. Stams, Bart P. Lomans (5 April 2013). «Archaeal (Per)Chlorate Reduction at High Temperature: An Interplay of Biotic and Abiotic Reactions». Science 340 (6128): 85–87. doi:. PMID 23559251. Bibcode: 2013Sci...340...85L. https://archive.org/details/sim_science_2013-04-05_340_6128/page/85.
- ↑ DuBois, Jennifer L.· Ojha, Sunil (2015). «Chapter 3, Section 2.2 Natural Abundance of Perchlorate on Earth». Στο: Peter M.H. Kroneck and Martha E. Sosa Torres. Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. 15. Springer. σελ. 49.
- ↑ Hecht, M. H., S. P. Kounaves, R. Quinn (2009). «Detection of Perchlorate & the Soluble Chemistry of Martian Soil at the Phoenix Mars Lander Site». Science 325 (5936): 64–67. doi:. PMID 19574385. Bibcode: 2009Sci...325...64H.
- ↑ Kounaves S. P. (2010). «Wet Chemistry Experiments on the 2007 Phoenix Mars Scout Lander: Data Analysis and Results». J. Geophys. Res. 115: E00E10. doi:. Bibcode: 2009JGRE..114.0A19K.
- ↑ Kounaves S. P. (2014). «Identification of the Perchlorate Parent Salts at the Phoenix Mars Landing Site and Possible Implications». Icarus 232: 226–231. doi:. Bibcode: 2014Icar..232..226K.
- ↑ Chevrier, V. C., Hanley, J., and Altheide, T.S. (2009). «Stability of perchlorate hydrates and their liquid solutions at the Phoenix landing site, Mars». Geophysical Research Letters 36 (10): L10202. doi:. Bibcode: 2009GeoRL..3610202C.
- ↑ Miller, Glen. "Photooxidation of chloride to perchlorate in the presence of desert soils and titanium dioxide Αρχειοθετήθηκε 2016-09-07 στο Wayback Machine.". American Chemical Society. March 29, 2006
- ↑ Schuttlefield Jennifer D.; Sambur Justin B.; Gelwicks Melissa; Eggleston Carrick M.; Parkinson B. A. (2011). «Photooxidation of Chloride by Oxide Minerals: Implications for Perchlorate on Mars». J. Am. Chem. Soc. 133: 17521–17523. doi:. PMID 21961793.
- ↑ Carrier B. L.; Kounaves S. P. (2015). «The Origin of Perchlorates in the Martian Soil». Geophys. Res. Lett. 42: 3746–3754. doi:. Bibcode: 2015GeoRL..42.3739C.
- ↑ Kounaves S. P.; Carrier B. L.; O'Neil G. D.; Stroble S. T.; Clair M. W. (2014). «Evidence of Martian Perchlorate, Chlorate, and Nitrate in Mars Meteorite EETA79001: Implications for Oxidants and Organics». Icarus 229: 206–213. doi:. Bibcode: 2014Icar..229..206K.
- ↑ Adam Mann. "Look What We Found on Mars - Curiosity Rover Serves Up Awesome Science". Slate (magazine). 26 September 2013.
- ↑ Chang, Kenneth (1 October 2013). «Hitting Pay Dirt on Mars». New York Times. https://www.nytimes.com/2013/10/01/science/space/hitting-pay-dirt-on-mars.html. Ανακτήθηκε στις 2 October 2013.
- ↑ Kerr Richard A (2013). «Pesky Perchlorates All Over Mars». Science 340 (6129): 138. doi:. PMID 23580505. http://www.sciencemag.org/content/340/6129/138.2.summary.
- ↑ David, Leonard (13 Ιουνίου 2013). «Toxic Mars: Astronauts Must Deal with Perchlorate on the Red Planet». Space.com. Ανακτήθηκε στις 9 Μαΐου 2017.
- ↑ Mars covered in toxic chemicals that can wipe out living organisms, tests reveal. Ian Sample, The Guardian. 6 July 2017.
- ↑ Webster, Guy· Agle, DC· Brown, Dwayne· Cantillo, Laurie (28 Σεπτεμβρίου 2015). «NASA Confirms Evidence That Liquid Water Flows on Today's Mars». Αρχειοθετήθηκε από το πρωτότυπο στις 29 Σεπτεμβρίου 2015. Ανακτήθηκε στις 28 Σεπτεμβρίου 2015.
- ↑ Chang, Kenneth (28 September 2015). «NASA Says Signs of Liquid Water Flowing on Mars». New York Times. https://www.nytimes.com/2015/09/29/science/space/mars-life-liquid-water.html. Ανακτήθηκε στις 28 September 2015.
- ↑ Ojha, Lujendra; Wilhelm, Mary Beth; Murchie, scortt L.; McEwen, Alfred S.; Wray, James J.; Hanley, Jennifer; Massé, Marion; Chojnacki, Matt (28 September 2015). «Spectral evidence for hydrated salts in recurring slope lineae on Mars». Nature Geoscience 8: 829–832. doi:. Bibcode: 2015NatGe...8..829O. http://www.nature.com/ngeo/journal/vaop/ncurrent/full/ngeo2546.html. Ανακτήθηκε στις 28 September 2015.
- ↑ Staff (28 Σεπτεμβρίου 2015). «Video Highlight (02:58) - NASA News Conference - Evidence of Liquid Water on Today's Mars». NASA. Ανακτήθηκε στις 30 Σεπτεμβρίου 2015.
- ↑ Staff (28 Σεπτεμβρίου 2015). «Video Complete (58:18) - NASA News Conference - Water Flowing on Present-Day Mars m». NASA. Ανακτήθηκε στις 30 Σεπτεμβρίου 2015.
- ↑ Kucharzyk, Katarzyna (2009). «Development of drinking water standards for perchlorate in the United States». Journal of Environmental Management (Elsevier B.V.) 91: 303–310. doi:. http://www.sciencedirect.com/science/article/pii/S0301479709003272.
- ↑ Brandhuber, Philip; Clark, Sarah; Morley, Kevin (November 2009). «A review of perchlorate occurrence in public drinking water systems». Journal American Water Works Association 101 (11): 63–73. https://www.epa.gov/sites/production/files/2015-09/documents/12004-exhibita.pdf.
- ↑ Associated Press. "Toxic chemical found in California milk". MSNBC. June 22, 2004.
- ↑ Clausen, Jay (Νοεμβρίου 2001). «Perchlorate, Source and Distribution in Groundwater at Massachusetts Military Reservation» (PDF). Presentation at U.S. EPA Technical Support Project Semi-Annual Meeting, Cambridge, MA.
- ↑ «Inorganic Chemical Maximum Contaminant Levels, Monitoring Requirements and Analytical Methods» (PDF). Massachusetts Office of Energy and Environmental Affairs. Code of Massachusetts Regulations (CMR), 310 CMR 22.06. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Φεβρουαρίου 2017. Ανακτήθηκε στις 5 Ιουλίου 2017.
- ↑ «Fireworks Displays Linked To Perchlorate Contamination In Lakes». Science Daily (Rockville, MD). 2007-05-28. https://www.sciencedaily.com/releases/2007/05/070528095714.htm.
- ↑ «Perchlorate in the Pacific Southwest: California». EPA - Region 9. San Francisco, CA: EPA.
- ↑ McKee, Maggie. "Perchlorate found in breast milk across US Αρχειοθετήθηκε 2008-09-27 στο Wayback Machine.". New Scientist. February 23, 2005