Μπιλαστίνη
 | |
| Ονομασία IUPAC | |
|---|---|
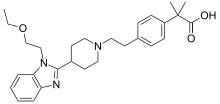
2-[4-(2-{4-[1-(2-ethoxyethyl)-1H-1,3-benzodiazol-2-yl]piperidin-1-yl}ethyl)phenyl]-2-methylpropanoic acid | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Ilaxten, Bilaz |
| Οδοί χορήγησης | Από το στόμα |
| Κυκλοφορία | |
| Κυκλοφορία |
|
| Φαρμακοκινητική | |
| Βιοδιαθεσιμότητα | 61% |
| Πρωτεϊνική σύνδεση | 84-90% |
| Μεταβολισμός | Η μπιλαστίνη δεν αλληλεπιδρά με το σύστημα του κυτοχρώματος P450 και δεν υφίσταται σημαντικό μεταβολισμό στον άνθρωπο. |
| Βιολογικός χρόνος ημιζωής | Η μέση ημιζωή αποβολής είναι 14,5 ώρες. |
| Διάρκεια δράσης | Η μπιλαστίνη είναι ένα νέο αντιισταμινικό νέας γενιάς που είναι εξαιρετικά εκλεκτικό για τον υποδοχέα ισταμίνης Η1, έχει ταχεία έναρξη και παρατεταμένη διάρκεια δράσης. |
| Απέκκριση | Η μπιλαστίνη απεκκρίνεται κυρίως με τα κόπρανα (66,5%) και ένα μέρος απεκκρίνεται στα ούρα (28,3%). Σχεδόν όλα απεκκρίνονται ως η μητρική ένωση. |
| Κωδικοί | |
| Αριθμός CAS | 202189-78-4 |
| Κωδικός ATC | R06AX29 S01GX13 |
| PubChem | CID 185460 |
| DrugBank | DB11591 |
| ChemSpider | 161234 |
| UNII | PA1123N395 |
| KEGG | D09570 |
| ChEBI | CHEBI:135954 |
| ChEMBL | CHEMBL1742423 |
| Συνώνυμα | , bilastina |
| Χημικά στοιχεία | |
| Χημικός τύπος | C28H37N3O3 |
| Μοριακή μάζα | 463,62 g·mol−1 |
CCOCCN1C(=NC2=CC=CC=C12)C1CCN(CCC2=CC=C(C=C2)C(C)(C)C(O)=O)CC1 | |
InChI=1S/C28H37N3O3/c1-4-34-20-19-31-25-8-6-5-7-24(25)29-26(31)22-14-17-30(18-15-22)16-13-21-9-11-23(12-10-21)28(2,3)27(32)33/h5-12,22H,4,13-20H2,1-3H3,(H,32,33) Key:ACCMWZWAEFYUGZ-UHFFFAOYSA-N | |
| Φυσικά στοιχεία | |
| Υδροδιαλυτότητα | 0.00203 mg/mL (water solubility) mg/mL (20 °C) |
| (verify) | |
Η μπιλαστίνη ή βιλαστίνη, που πωλείται με την εμπορική ονομασία Ilaxten μεταξύ άλλων, είναι αντιισταμινικό φάρμακο δεύτερης γενιάς που χρησιμοποιείται στη θεραπεία της αλλεργικής ρινοεπιπεφυκίτιδας και της κνίδωσης. Ασκεί την επίδρασή του ως εκλεκτικός ανταγωνιστής του υποδοχέα Η1 ισταμίνης[2] και έχει παρόμοια αποτελεσματικότητα με τη σετιριζίνη, τη φεξοφεναδίνη και τη δεσλοραταδίνη.[3] Αναπτύχθηκε στην Ισπανία από την FAES Farma.
Η μπιλαστίνη είναι εγκεκριμένη στην Ευρωπαϊκή Ένωση για τη συμπτωματική θεραπεία της αλλεργικής ρινοεπιπεφυκίτιδας και της κνίδωσης,[4] αλλά δεν έχει εγκριθεί για χρήση στις Ηνωμένες Πολιτείες.[5] Η μπιλαστίνη πληροί τα τρέχοντα κριτήρια της Ευρωπαϊκής Ακαδημίας Αλλεργίας και Κλινικής Ανοσολογίας (EAACI) και της Αλλεργικής Ρινίτιδας και της Επίδρασής του στο άσθμα (ARIA) για φάρμακα που χρησιμοποιούνται στη θεραπεία της αλλεργικής ρινίτιδας.[6]
Η μπιλαστίνη ήταν αποτελεσματική στη θεραπεία ασθενειών αλλεργιών, συμπεριλαμβανομένης της ρινοεπιπεφυκίτιδας.[3] Επιπλέον, η βιλαστίνη έχει αποδειχθεί ότι βελτιώνει την ποιότητα ζωής και όλα τα ρινικά και οφθαλμικά συμπτώματα που σχετίζονται με την αλλεργική ρινίτιδα.[6]
Ιατρικές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Η κλινική αποτελεσματικότητα της βιλαστίνης στην αλλεργική ρινίτιδα (ΑΡ) και την κνίδωση έχει αξιολογηθεί σε 10 κλινικές αναλύσεις στις οποίες συμμετείχαν περισσότεροι από 4.600 ασθενείς. Όλοι συνέκριναν τη βιλαστίνη με εικονικό φάρμακο και ένα άλλο αντιισταμινικό δεύτερης γενιάς με επιβεβαιωμένη αποτελεσματικότητα (ενεργός συγκριτικός παράγοντας).
Οι μελέτες για ήταν διπλά τυφλές, ελεγχόμενες με εικονικό φάρμακο, παράλληλης ομάδας που αφορούσαν άνδρες και γυναίκες ασθενείς ηλικίας άνω των 12 ετών με συμπτωματική νόσο στην αρχή της μελέτης. Τα ρινικά συμπτώματα (φτέρνισμα, ρινική καταρροή, ρινικός κνησμός και συμφόρηση) αξιολογήθηκαν τόσο πριν από τη θεραπεία όσο και κατά τη διάρκεια της περιόδου θεραπείας σε καθημερινή βάση. Τα μη ρινικά συμπτώματα (φαγούρα στα μάτια, υγρά μάτια, φαγούρα στο αυτί και στον ουρανίσκο) αξιολογήθηκαν επίσης σύμφωνα με μια κλίμακα 0-3, έτσι ώστε το συνολικό σκορ συμπτωμάτων και άλλες σχετικές παράμετροι να μπορούν να αντικατοπτρίζουν ξεκάθαρα την καθημερινή εξέλιξη της αλλεργικής ρινίτιδας σε κάθε ασθενή και ομάδα θεραπείας. Αξιολογήθηκαν επίσης παράμετροι όπως η ποιότητα ζωής και η δυσφορία και με τον ίδιο τρόπο καταγράφηκαν ο τύπος και η συχνότητα των ΑΕ, η ανεκτικότητα και η γενική ασφάλεια της θεραπείας. Σε αυτές τις μελέτες SAR, η καθημερινή από του στόματος χορήγηση βιλαστίνης για 14 ημέρες αποδεικνύεται ότι έχει την ίδια αποτελεσματικότητα με τη χορήγηση σετιριζίνης και δεσλοραταδίνης.[7]
Ένα άρθρο ανασκόπησης αξιολόγησε δεδομένα από δοκιμές που περιγράφουν λεπτομερώς την αποτελεσματικότητα της βιλαστίνης σε δερματικά μοντέλα και κνίδωση για να αξιολογηθεί εάν η βιλαστίνη έχει το βέλτιστο προφίλ για χορήγηση δόσης στην κνίδωση. Οι συγγραφείς κατέληξαν στο συμπέρασμα ότι η βιλαστίνη έχει εξαιρετικό προφίλ τόσο για την αποτελεσματικότητα όσο και για την ασφάλεια, αν και υπάρχει ανάγκη για ελεγχόμενες κλινικές δοκιμές για τη σύγκριση της αποτελεσματικότητας της βιλαστίνης σε μια πραγματική μελέτη ανανέωσης δόσης σε ασθενείς με κνίδωση, δίνοντας ιδιαίτερη προσοχή στον έλεγχο του κνησμού.[8]
Λαμβάνεται από το στόμα. Έχει ταχεία έναρξη δράσης (μέσα σε 30–60 λεπτά).[3] Πρέπει να λαμβάνεται μόνο από παιδιά άνω των 12 ετών και ενήλικες.[6]
Παρενέργειες
[Επεξεργασία | επεξεργασία κώδικα]Στην κλινική έρευνα, η βιλαστίνη έχει αποδειχθεί καλά ανεκτή, με προφίλ ανεπιθύμητων ενεργειών παρόμοιο με αυτό του εικονικού φαρμάκου σε υγιείς εθελοντές, ασθενείς με ΑΡ και με χρόνια ιδιοπαθή κνίδωση. Αν και το προφίλ ανοχής της βιλαστίνης και της λεβοσετιριζίνης ή της δεσλοραταδίνης ήταν πολύ παρόμοιο,[9] η βιλαστίνη ήταν αξιοσημείωτα καλύτερα ανεκτή από τη σετιριζίνη, με λιγότερες ανεπιθύμητες ενέργειες στην ομάδα της βιλαστίνης. Δεν παρατηρήθηκαν αντιχολινεργικές ανεπιθύμητες ενέργειες στις κλινικές δοκιμές με τη βιλαστίνη. Δεν αναφέρθηκαν σοβαρές ανεπιθύμητες ενέργειες κατά τη διάρκεια της έρευνας και δεν υπήρξαν κλινικά σημαντικές αλλαγές στα ζωτικά σημεία, στο ηλεκτροκαρδιογράφημα (ΗΚΓ) ή στις εργαστηριακές εξετάσεις. Φαρμακοκινητικά/φαρμακοδυναμικά προφίλ και μελέτες σε ειδικούς πληθυσμούς υποδεικνύουν ότι η προσαρμογή της δόσης της βιλαστίνης δεν είναι απαραίτητη σε ηλικιωμένους ασθενείς ή σε χρόνια ηπατική νόσο ή χρόνια νεφρική νόσο.
Η τοξικότητα της βιλαστίνης διερευνήθηκε σε προκλινικές τοξικολογικές μελέτες σε ποντικούς, αρουραίους και σκύλους μετά από του στόματος και ενδοφλέβια χορήγηση και δεν έδειξε θνησιμότητα μετά την από του στόματος χορήγηση τεράστιων δόσεων. Μετά από ενδοφλέβια χορήγηση, οι τιμές LD50 (θανατηφόρα δόση για το 50% των ζώων) ήταν 33 και 45–75 mg/kg σε ποντικούς και αρουραίους, αντίστοιχα. Δεν παρατηρήθηκαν σημάδια τοξικότητας σε κάποιο όργανο μετά από τεράστια υπερδοσολογία βιλαστίνης, είτε από το στόμα (σε ποντίκια, αρουραίους και σκύλους), είτε ενδοφλέβια (σε αρουραίους και σκύλους) για 4 εβδομάδες. Δεν παρατηρήθηκαν επιδράσεις στη γονιμότητα, καμία τερατογόνος ή μεταλλαξιογόνος δράση και καμία προφανής καρκινογόνος δυνατότητα στις μελέτες που πραγματοποιήθηκαν σε αρουραίους, ποντικούς και κουνέλια.[10]
Αλληλεπιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Τα προκλινικά δεδομένα υποδηλώνουν την πιθανότητα αλληλεπιδράσεων μεταξύ της βιλαστίνης και φαρμάκων ή τροφών που είναι αναστολείς ή επαγωγείς των P-γλυκοπρωτεϊνών. Η συγχορήγηση βιλαστίνης και χυμού γκρέιπφρουτ (ένας γνωστός ενεργοποιητής μεταφοράς φαρμάκου με τη μεσολάβηση της P-γλυκοπρωτεΐνης) μείωσε σημαντικά τη συστηματική έκθεση στη βιλαστίνη.[11] Αυτή η αλληλεπίδραση οφείλεται στη γνωστή επίδραση των φλαβονοειδών του γκρέιπφρουτ στα εντερικά συστήματα μεταφοράς όπως οι P-γλυκοπρωτεΐνες και το πεπτίδιο μεταφοράς οργανικών ανιόντων (OATP).[12]
Φαρμακολογία
[Επεξεργασία | επεξεργασία κώδικα]Φαρμακοδυναμική
[Επεξεργασία | επεξεργασία κώδικα]Η βιλαστίνη δεσμεύεται στους υποδοχείς Η1 ισταμίνης της παρεγκεφαλίδας του ινδικού χοιριδίου (Ki=44 nM) και στους ανθρώπινους ανασυνδυασμένους υποδοχείς Η1 ισταμίνης (Ki=64 nM) με συγγένεια συγκρίσιμη με αυτή της αστεμιζόλης και της διφαινυδραμίνης και ανώτερη από αυτή της σετιριζίνης κατά τρεις φορές και φεξοφεναδίνη πενταπλάσια. Σε διαφορετικά μοντέλα ποντικού, η βιλαστίνη από του στόματος, ανταγωνίζεται τις επιδράσεις της ισταμίνης με δοσοεξαρτώμενο τρόπο, με ισχύ παρόμοια με εκείνη της σετιριζίνης και μεταξύ 5,5 και 10 φορές μεγαλύτερη από αυτή της φεξοφεναδίνης.[13]
Φαρμακοκινητική
[Επεξεργασία | επεξεργασία κώδικα]Η βιλαστίνη απορροφάται πιο γρήγορα με την απουσία τροφής και φτάνει σε μέση μέγιστη συγκέντρωση στο πλάσμα 220 ng/mL περίπου 1 ώρα μετά από εφάπαξ και πολλαπλές δόσεις.[14] Η απορρόφηση μειώνεται από ένα πρωινό με υψηλή περιεκτικότητα σε λιπαρά ή χυμό φρούτων και η εκτιμώμενη συνολική βιοδιαθεσιμότητα από το στόμα είναι περίπου 60%.[14] Η μπιλαστίνη έχει γραμμική φαρμακοκινητική στο εύρος δόσεων 2,5–220 mg σε υγιή ενήλικα άτομα χωρίς ένδειξη συσσώρευσης μετά από 14 ημέρες θεραπείας.[14]
Η κατανομή της βιλαστίνης έχει φαινομενικό όγκο κατανομής 1,29 L/kg και έχει χρόνο ημιζωής αποβολής 14,5 ώρες και δέσμευση με πρωτεΐνες πλάσματος 84–90%.[15]
Η βιλαστίνη δεν μεταβολίζεται σημαντικά στον άνθρωπο και αποβάλλεται σε μεγάλο βαθμό αμετάβλητη τόσο στα ούρα όσο και στα κόπρανα – το ένα τρίτο και τα δύο τρίτα της χορηγούμενης δόσης, αντίστοιχα, σύμφωνα με μια μελέτη ισοζυγίου μάζας Φάσης Ι με ραδιοσημασμένη βιλαστίνη.[16] Η βιλαστίνη δεν διαπερνά εύκολα τον αιματοεγκεφαλικό φραγμό και δεν μεταβολίζεται από το ήπαρ.[14] Το ενενήντα έξι τοις εκατό της χορηγούμενης δόσης αποβάλλεται εντός 24 ωρών.[14]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «Ilaxten 20 mg tablets - Summary of Product Characteristics (SmPC)». (emc). Ανακτήθηκε στις 16 Ιουνίου 2021.
- ↑ «Preclinical pharmacology of bilastine, a new selective histamine H1 receptor antagonist: Receptor selectivity and in vitro antihistaminic activity». Drugs in R&D 6 (6): 371–84. 2005. doi:. PMID 16274260.
- ↑ 3,0 3,1 3,2 «Bilastine and quality of life». Journal of Investigational Allergology and Clinical Immunology 21 Suppl 3: 16–23. 2011. PMID 22185046.
- ↑ Cumulative Nce introduction index, 1983–2010. Annual Reports in Medicinal Chemistry. 46. 2011. σελίδες 531–551. ISBN 9780123860095.
- ↑ Bilastine Approval Status, drugs.com
- ↑ 6,0 6,1 6,2 «Establishing the place in therapy of bilastine in the treatment of allergic rhinitis according to ARIA: evidence review». Current Medical Research and Opinion 28 (1): 131–9. 2012. doi:. PMID 22149770.
- ↑ «Comparison of the efficacy and safety of bilastine 20 mg vs desloratadine 5 mg in seasonal allergic rhinitis patients». Allergy 64 (1): 158–65. 2009. doi:. PMID 19132976.
- ↑ «Bilastine: a new H1 -antihistamine with an optimal profile for updosing in urticaria». J Eur Acad Dermatol Venereol 31 (9): 1447–1452. 2017. doi:. PMID 28467671.
- ↑ «Efficacy and safety of bilastine 20 mg compared with cetirizine 10 mg and placebo for the symptomatic treatment of seasonal allergic rhinitis: a randomized, double-blind, parallel-group study». Clin. Exp. Allergy 39 (9): 1338–1347. 2009. doi:. PMID 19438584. https://archive.org/details/sim_clinical-and-experimental-allergy_2009-09_39_9/page/1338.
- ↑ «The effects of bilastine compared with cetirizine, fexofenadine, and placebo on allergen-induced nasal and ocular symptoms in patients exposed to aeroallergen in the Vienna challenge chamber». Inflamm. Res. 59 (5): 391–398. 2010. doi:. PMID 19943178.
- ↑ Bachert, C.; Kuna, P.; Zuberbier, T. (1 June 2010). «Bilastine in allergic rhinoconjunctivitis and urticaria». Allergy 65: 1–13. doi:.
- ↑ «Fruit juice inhibition of uptake transport: a new type of food-drug interaction». Br. J. Clin. Pharmacol. 70 (5): 645–655. 2010. doi:. PMID 21039758.
- ↑ «Preclinical pharmacology of bilastine, a new selective histamine H1 receptor antagonist. Receptor selectivity and in vitro antihistaminic activity». Drugs in R&D 6 (6): 371–384. 2005. doi:. PMID 16274260.
- ↑ 14,0 14,1 14,2 14,3 14,4 «An overview of the novel H1-antihistamine bilastine in allergic rhinitis and urticaria». Expert Review of Clinical Immunology 8 (1): 33–41. 1 January 2012. doi:. PMID 22149338.
- ↑ «Pharmacokinetic-Pharmacodynamic Modelling of the Antihistaminic (H1) Effect of Bilastine». Clinical Pharmacokinetics 48 (8): 543–554. 1 August 2009. doi:. PMID 19705924.
- ↑ «Human mass balance with [14 C]-bilastine following oral administration to healthy volunteers». Basic Clin. Pharmacol. Toxicol. 105. 2009.
