Προπένιο: Διαφορά μεταξύ των αναθεωρήσεων
μ Ρομπότ: Προσθήκη: fa:پروپیلن |
|||
| Γραμμή 275: | Γραμμή 275: | ||
==Πηγές== |
==Πηγές== |
||
*[http://www. |
*[http://www.shell.com/home/content/chemicals/products_services/our_products/lower_olefins/propylene/product_overview/propylene_overview.html Πληροφορίες για το προπυλένιο στη ιστοσελίδα της Shell.] |
||
*[http://ecb.jrc.it/classification-labelling/ Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών]</ |
*[http://ecb.jrc.it/classification-labelling/ Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών]</ |
||
*[http://www.oehha.ca.gov/air/chronic_rels/pdf/115071.pdf Τοξικολογική εκτίμηση προπυλενίου.] |
*[http://www.oehha.ca.gov/air/chronic_rels/pdf/115071.pdf Τοξικολογική εκτίμηση προπυλενίου.] |
||
Έκδοση από την 08:32, 18 Σεπτεμβρίου 2009
| Προπένιο | |
|---|---|
 | |
 | |
| Χημικό όνομα | Προπένιο |
| Συνώνυμα | Προπυλένιο |
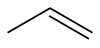
| SMILES | C=CC |
| Αριθμός CAS | 115-07-1 |
| Αριθμός EC | 204-062-1 |
| Χημικός τύπος | C3H6 |
| Ισομερές θέσης | κυκλοπροπάνιο |
| Συντακτικός τύπος | CH3CH=CH2 |
| Δομικές ιδιότητες | |
| Γωνίες δεσμών | 120° |
| Γωνίες δεσμών | 120° |
| Γωνίες δεσμών | 120° |
| Γωνίες δεσμών | 109° 28' |
| Πόλωση δεσμού H-C | 3% |
| Μήκος δεσμού H-Csp3 | 109 pm |
| Μήκος δεσμού H-Csp2 | 99 pm |
| Μήκος δεσμού C=C (Csp2-Csp2) | 134 pm |
| Μήκος δεσμού C-C (Csp3-Csp2) | 144 pm |
| Διπολική ροπή | 0,366 D |
| Φυσικές ιδιότητες | |
| Εμφάνιση | Άχρωμο αέριο |
| Μοριακή μάζα | 42,08 g/mol |
| Σημείο τήξης (1 atm) | -185,2°C (87,95 K) |
| Σημείο βρασμού (1 atm) | -47,6°C (225,55 K) |
| Ειδικό βάρος | 0,609 (υγρό) (-47°C), 1,50 (αέριο) |
| Διαλυτότητα στο νερό |
0,61 g/m3[1] |
| Τάση ατμών | 1158 kPa (25°C) |
| Ιξώδες | 8.34 µPa·s στους 16,7 °C |
| Χημικές ιδιότητες | |
| Ενέργεια τέλειας καύσης | 1971 kJ/mole |
| Άλλες ιδιότητες | |
| Προσδιορισμός κινδύνων |
Εξαιρετικά εύφλεκτο (F+) |
| Σημείο ανάφλεξης | -107,8°C (165,35 K) |
| Θερμοκρασία αυτανάφλεξης |
497,2°C (770,35 K) |
| Όρια εκρηκτικότητας | 2,4 – 10,3 %κ.ο. (στον αέρα) |
| Φράσεις R/S | R: 12 S: 2,9,16,33 |
| MSDS | - |
Το προπένιο ή προπυλένιο ανήκει στην οικογένεια των ακόρεστων υδρογονανθράκων. Έχει χημικό τύπο CH3CH=CH2 και είναι το δεύτερο μέλος της ομόλογης σειράς των αλκενίων. Με βάση το συνοπτικό χημικό τύπο, C3H6, είναι ισομερές θέσης με το κυκλοπροπάνιο, από το οποίο διαφέρει πολύ στις ιδιότητες.

Το προπυλένιο είναι αέριο σε συνθήκες περιβάλλοντος, άχρωμο, άοσμο και εξαιρετικά εύφλεκτο. Στην εμπορική του μορφή είναι αναμεμειγμένο με ίχνη κάποιας χημικής ένωσης (συνήθως κάποια μερκαπτάνη), η οποία του δίνει χαρακτηριστική οσμή και έτσι το κάνει εύκολα ανιχνεύσιμο ακόμα και σε πολύ μικρές συγκεντρώσεις.
Συνήθως μεταφέρεται και αποθηκεύεται σε υγρή μορφή υπό πίεση, γιατί καταλαμβάνει πολύ μικρότερο όγκο (1 μέρος υγρού δίνει 250 μέρη αερίου). Είναι πολύ λίγο διαλυτό στο νερό αλλά διαλύεται εύκολα στην αλκοόλη.
Παρασκευές
1. Βιομηχανικά παράγεται με απομόνωση προϊόντων του φυσικού αερίου, του πετρελαίου και πυρόλυσης προϊόντων αυτών. Πιο συγκεκριμένα:
- 1. Απομονώνεται ως παραπροϊόν της καταλυτικής πυρόλυσης του πετρελαίου κατά την παραγωγή βενζίνης.
- 2. Απομονώνεται ως παραπροϊόν της πυρόλυσης με ατμό υδρογονανθράκων κατά την παραγωγή του αιθυλενίου.
2. Για εργαστηριακή κυρίως χρήση προσφέρονται οι παρακάτω χημικές μέθοδοι:
- 1. Αντιδράσεις απόσπασης:
- 1. Αφυδάτωση CH3CH2CH2OH ή CH3CH(OH)CH3:
ή
- 2. Αφυδραλογόνωση προπυλο- ή ισοπροπυλοαλογονιδίου:
CH3CH2CH2X + NaOH → CH3CH=CH2 + NaX + H2O
ή
CH3CHXCH3 + NaOH → CH3CH=CH2 + NaX + H2O
- 3. Απαλογόνωση 1,2-διαλογονοπροπανίου:
CH3CHXCH2X + Mg → CH3CH=CH2 + MgX2
ή
- 2. Αντιδράσεις μερικής υδρογόνωσης περισσότερο ακόρεστων υδρογονανθράκων με 3 άτομα C:
- 1. Μερική υδρογόνωση CH3C≡CH:
- 2. Μερική υδρογόνωση CH2=C=CH2
- 3. Αντίδραση παρεμβολής μεθυλενίου σε αιθένιο:
Χημικές ιδιότητες
Τέλεια καύση
CH3CH=CH2 +Ο2 → 3CO2 + 3H2O + 1971 kJ
Πολυμερισμός
1. Η σημαντικότερη (βιομηχανικά) αντίδραση του προπενίου είναι ο πολυμερισμός του προς πολυπροπυλένιο (βλ. χρήσεις):
- Προκύπτουν διάφορα πολυπροπυλένια με αριθμό ατόμων C της τάξης του 103 - 106, με ποικίλλες ειδιότητες ανάλογα με το βαθμό πολυμερισμού.
2. Φωτοχημικός διμερισμός προς 1,2-διμεθυλοκυκλοβουτάνιο:
Αντιδράσεις προσθήκης στο διπλό δεσμό
Μια μεγάλη ποικιλία προϊόντων μπορεί να παρασκευαστεί βιομηχανικά ή εργαστηριακά με αντιδράσεις προσθήκης στο διπλό δεσμό του:
1. Καταλυτική προσθήκη H2. Παράγεται προπάνιο:
2. Προσθήκη υδραλογόνου (ΗΧ). Παραγεται ισοπροπυλοαλογονίδιο:
CH3CH=CH2 + HX → CH3CHXCH3
3. Προσθήκη αλογόνου (X2). Παράγεται 1,2-διαλογονοπροπάνιο:
4. Προσθήκη υποαλογονώδους οξέος (ΗΟΧ). Παράγεται 1-αλογονοπροπανόλη-2:
CH3CH=CH2 + ΗΟΧ → CH3CH(OH)CH2X
5. Προσθήκη θειικού οξέος. Παράγεται προπανοσουλφονικό οξύ-2.
CH3CH=CH2 + Η2SO4 → CH3CH(SO3H)CH3
6. Προσθήκη νερού (ενυδάτωση). Παράγεται προπανόλη-2:
7. Προσθήκη βορανίου. Παράγεται προπυλοβοράνιο-1:
CH3CH=CH2 + ΒΗ3 → CH3CH2CH2BH2
8. Επίδραση αρ. KMnO4 (ισοδυναμεί με προσθήκη H2O2 και είναι επίσης εφικτή με χρήση, εναλλακτικά, μίγματος H2O2 και καρβονικού οξέος). Παράγεται προπανοδιόλη-1,2:
ή
9. Καταλυτική προσθήκη οξυγόνου για παρασκευή μεθυλοοξιρανίου:
10. Προσθήκη αλκυκλαλογονιδίου (RX):
Αντιδράσεις αλλυλικών παραγώγων
Αλλυλική αλογόνωση:
- 1. Χλωρίωση - Παράγεται 3-χλωροπροπένιο:
΄
- Εναλλακτική μέθοδος:
΄
- 2. Βρωμίωση - Παράγεται 3-βρωμοπροπένιο:
΄
Παρεμβολή - προσθήκη καρβενίων
10. Παράδειγμα: Προσθήκη μεθιυλενίου: ([:CH2]) (προκύπτει από CH3Cl + KOH). Σχηματίζεται μεθυλοκυκλοπροπάνιο:
- Αν θέλουμε αποκλειστικά μεθυλοκυκλοπροπάνιο χρησιμοποιούμε την ακόλουθη αντίδραση:
Χρήσεις
Xρησιμοποιείται κυρίως ως πρώτη ύλη για την παραγωγή πλαστικών (πολυπροπυλενίου).
Περισσότερο από το 60% της παγκόσμιας παραγωγής προπυλενίου χρησιμοποιείται για την παραγωγή πολυπροπυλενίου, ένα ευρείας χρήσεως πλαστικό, στη καθημερινή μας ζωή.
Επίσης χρησιμοποιείται στην παρασκευή του ακρυλονιτριλίου (από το οποίο παίρνουμε ακρυλικές ίνες), του προπυλενοξειδίου (που χρησιμοποιείται στην παρασκευή ρητινών πολυουρεθάνης και άλλων χημικών), του κουμενίου (από το οποίο παράγονται εποξειδικές ρητίνες, ακετόνη) και της ισοπροπυλικής αλκοόλης (που χρησιμοποιείται ως διαλύτης).
Έτσι το προπυλένιο αποτελεί βασική πρώτη ύλη για την παρασκευή μιας πλειάδας προϊόντων όπως είναι για παράδειγμα: προβολείς των αυτοκινήτων, συνθετικά χαλιά, οπτικοί δίσκοι (CD), συσκευασίες και μεμβράνες τροφίμων, μονώσεις, παράθυρα ασφαλείας (αλεξίσφαιρα), μαγειρικά σκεύη, χρώματα και προστατευτικά τοίχων, συνθετικές ίνες για ρούχα και κουβέρτες και άλλα.[3]
Ασφάλεια - Υγεία
Το προπυλένιο είναι ένα εξαιρετικά εύφλεκτο αέριο το οποίο πρέπει να αποθηκεύεται σε καλά αεριζόμενο μέρος και μακριά από πηγές ανάφλεξης.[4]
Είναι αέριο βαρύτερο του αέρα και σε περίπτωση διαρροής χρειάζεται ιδιαίτερη προσοχή γιατί μπορεί να δημιουργήσει εκρηκτικές ατμόσφαιρες με αυτόν.
Παραπομπές
- ↑ Το πήρα από την αγγλόφωνη Wiki αλλά αμφιβάλλουν κι εκεί.
- ↑ Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- ↑ Πληροφορίες για το προπυλένιο στη ιστοσελίδα της Shell.
- ↑ Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών
Πηγές
- Πληροφορίες για το προπυλένιο στη ιστοσελίδα της Shell.
- Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών</
- Τοξικολογική εκτίμηση προπυλενίου.
- Μέθοδοι παραγωγής προπυλενίου.
- Occupational Safety and Health Information.
- Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Το προπένιο στην αγγλική έκδοση της Βικιπαίδειας.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
| Αυτό το λήμμα σχετικά με χημεία χρειάζεται επέκταση. Μπορείτε να βοηθήσετε την Βικιπαίδεια επεκτείνοντάς το. |






![{\displaystyle CH_{3}CH_{2}CH_{2}OH{\xrightarrow[{170^{o}C}]{\pi .H_{2}SO_{4}}}CH_{3}CH=CH_{2}+H_{2}O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3b2b520ccbd2d3817d4d69da8cfd690bfe48a0c)
![{\displaystyle CH_{3}CH(OH)CH_{3}{\xrightarrow[{170^{o}C}]{\pi .H_{2}SO_{4}}}CH_{3}CH=CH_{2}+H_{2}O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/97f5595442670c449ad514661fb103dca4ff0d8d)





![{\displaystyle CH_{3}CH=CH_{2}{\xrightarrow[{}]{+H^{+}}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}CH_{2}^{+}...}](https://wikimedia.org/api/rest_v1/media/math/render/svg/76682d4123b767f8e58ee8b91767b17017ece2b7)





![{\displaystyle CH_{3}CH=CH_{2}{\xrightarrow[{RCOOH}]{H_{2}O_{2}}}CH_{3}CH{\begin{pmatrix}OH\end{pmatrix}}CH_{2}OH}](https://wikimedia.org/api/rest_v1/media/math/render/svg/048b4bfc74acedc1ee235482d103ecb66d9fe51b)
![{\displaystyle CH_{3}CH=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eacaebb9d68a54e1d1ed57dfabffcac7744bcec2)





