2,3,4-τριυδροξυβουτανάλη
| 2,3,4-τριυδροξυβουτανάλη | |
|---|---|

| |

| |

| |

| |
| Γενικά | |
| Όνομα IUPAC | 2,3,4-τριυδροξυβουτανάλη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C4H8O4 |
| Μοριακή μάζα | 120,042259 amu |
| Σύντομος συντακτικός τύπος |
HOCH2CH(OH)CH(OH)CHO |
| SMILES | O=CC(O)C(O)CO |
| Ισομέρεια | |
| Ισομερή θέσης | 63 (τουλάχιστον) |
| Οπτικά ισομερή | 4 (2x2 ζεύγη) |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η 2,3,4-τριυδροξυβουτανάλη βρίσκεται σε δύο (2) ζεύγη εναντιομερών, που αντιπροσωπεύουν δύο αλδοτετρόζες: την ερυθρόζη και τη θρεόζη. Η βιοχημική συμπεριφορά των δυο αυτών τετροζών είναι διαφοροποιήσιμη, γιατί οι ενζυμικές αντιδράσεις είναι συχνά στερεοχημικά εκλεκτικές (και κάθε τέτοια συμπεριφορά αναλύεται στο οικείο άρθρο). Ωστόσο, ο κοινός σύντομος συντακτικός τους τύπος, HOCH2CH(OH)CH(OH)CHO, επιτρέπει μια σειρά από όμοιες χημικές συμπεριφορρές (που είναι το αντικείμενο αυτού του άρθρου).
Δομή
[Επεξεργασία | επεξεργασία κώδικα]| Δεσμοί[1] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#2-#4-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#1-H | σ | 2sp2-1s | 107 pm | 3% C- H+ |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| C-O | σ | 2sp3-2sp3 | 150 pm | 19% C+ O- |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C#2-C#1 | σ | 2sp3-2sp2 | 151 pm | |
| C#3-C#2 | σ | 2sp3-2sp3 | 154 pm | |
| C#4-C#3 | σ | 2sp3-2sp3 | 154 pm | |
| Στατιστικό ηλεκτρικό φορτίο[2] | ||||
| Ο (COH) | -0,51 | |||
| Ο (C=O) | -0,38 | |||
| Η (H-C) | +0,03 | |||
| C#4 | +0,13 | |||
| C#2,#3 | +0,16 | |||
| Η (H-O) | +0,32 | |||
| C#1 | +0,35 | |||
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Θέσης
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το χημικό της τύπο, C4H8O4, έχει τα ακόλουθα (τουλάχιστον) σταθερά ισομερή θέσης:
- Κυκλοβουτανοτετρόλη-1,2,3,4 (σε τρία (3) γεωμετρικά ισομερή).
- 1-υδροξυμεθυλοκυκλοπροπανοτριόλη-1,2,3 (σε τέσσερα (4) γεωμετρικά ισομερή).
- 1-μεθοξυκυκλοπροπανοτριόλη-1,2,3 (σε τέσσερα (4) γεωμετρικά ισομερή).
- 1,2-διυδροξυ-2-υδροξυμεθυλοπροπανάλη με σύντομο συντακτικό τύπο (HOCH2)2C(OH)CHO.
- 2,3-διυδροξυβουτανικό οξύ με σύντομο συντακτικό τύπο CH3CH(OH)CH(OH)COOH (σε τέσσερα (4) οπτικά ισομερή).
- 2,4-διυδροξυβουτανικό οξύ με σύντομο συντακτικό τύπο HOCH2CH2CH2COOH (σε δύο (2) οπτικά ισομερή).
- 3,4-υδροξυβουτανικό οξύ με σύντομο συντακτικό τύπο HOCH2CH(OH)CH2COOH (σε δύο (2) οπτικά ισομερή).
- Μεθυλο-2,3-διυδροξυπροπανικό οξύ με σύντομο συντακτικό τύπο HOCH2C(OH)(CH3)COOH (σε δύο (2) οπτικά ισομερή).
- 3-Υδροξυ(2-υδροξυμεθυλο)προπανικό οξύ με σύντομο συντακτικό τύπο (HOCH2)2CHCOOH (σε δύο (2) οπτικά ισομερή).
- 2.3-διυδροξυπροπανικός μεθυλεστέρας με σύντομο συντακτικό τύπο ΗΟCH2CH(OH)COOCH3.
- Υδροξυαιθανικός 2-υδροξυαιθυλεστέρας με σύντομο συντακτικό τύπο HOCH2COOCH2CH2OH.
- Μεθανικός 2,3-διυδροξυπροπυλεστέρας με σύντομο συντακτικό τύπο HCOOCH2CH(OH)CH2OH (σε δύο (2) οπτικά ισομερή).
- 3-μεθοξυ-2-υδροξυπροππανικό οξύ με σύντομο συντακτικό τύπο CH3OCH2CH(OH)COOH (σε δύο (2) οπτικά ισομερή).
- (2-υδροξυαιθυλοξυ)αιθανικό οξύ με σύντομο συντακτικό τύπο HOCH2CH2OCH2COOH.
- (Μεθοξυμεθοξυ)αιθανικό οξύ με σύντομο συντακτικό τύπο CH3OCH2OCH2COOH.
- Ανθρακικός προπυλεστέρας με σύντομο συντακτικό τύπο HOCOOCH2CH2CH3.
- Ανθρακικός ισοπροπυλεστέρας με σύντομο συντακτικό τύπο HOCOOCH(CH3)2.
- Ανθρακικός αιθυλομεθυλεστέρας με σύντομο συντακτικό τύπο CH3OCOOCH2CH3.
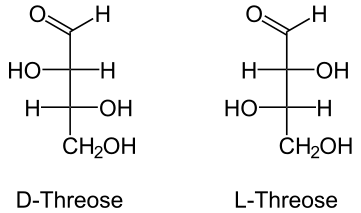
Οπτική
[Επεξεργασία | επεξεργασία κώδικα]Η 2,3,4-τριυδροξυβουτανάλη έχει δύο (2) χειρόμορφα κέντρα, με αποτέλεσμα να παράγονται δύο ζεύγη εναντιομερών που βιοχημικά χαρακτηρίζονται ως ερυθρόζη και θρεόζη, αντιστοίχως. Σημειώνεται ακόμη, ότι μόνο τα D- ισομερή των τελευταίων είναι τα φυσικά, που μετέχουν στους βιοχημικούς μηχανισμούς της ζωής. Τα δύο ζεύγη που διαχωρίζουν τις δύο τετρόζες που αντιστοιχούν στο ίδιο ισομερές θέσης, που αντιπροσωπεύει η συστηματική ονομασία 2,3,4-τριυδροξυβουτανάλη, είναι τα ακόλουθα:
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με τετραμερισμό μεθανάλης
[Επεξεργασία | επεξεργασία κώδικα]Η 2,3,4-τριυδροξυβουτανάλη είναι ένα ενδιάμεσο της αντίδρασης φορμόζης, κατά την οποία παράγονται σάκχαρα με πρώτη ύλη τη μεθανάλη (αλδολική συμπύκνωση)[3]:
Με διμερισμό υδροξυαιθανάλης
[Επεξεργασία | επεξεργασία κώδικα]Ο διμερισμός της υδροξυαιθανάλης μια άλλη εφαρμογή της αλδολικής συμπύκνωσης[3]:
Με μερική οξείδωση ερυθριτόλης
[Επεξεργασία | επεξεργασία κώδικα]Με μερική οξείδωση ερυθριτόλης, με σχετικά ήπια οξειδωτικά μέσα, όπως το τριοξείδιο του χρωμίου ή υπεροξείδιο του υδρογόνου, με χρήση αλάτων σιδήρου ως καταλύτη, παράγεται 2,3,4-τριυδροξυβουτανάλη (δηλαδή ερυθρόζη και θρεόζη) και η ισομερής θέσης ερυθρουλόζη (δηλαδή τελικά μείγμα όλων των τετροζών)[4]:
Με μερική αναγωγή περισσότερο οξειδωμένων παραγώγων της ερυθριτόλης
[Επεξεργασία | επεξεργασία κώδικα]1. Με μερική αναγωγή 2,3-υδροξυβουτανοδιάλης παράγεται 2,3,4-τριυδροξυβουτανάλη[5]:
2. Με μερική αναγωγή 2-οξο-3,4-διυδροξυβουτανάλης παράγεται 2,3,4-τριυδροξυβουτανάλη [5]:
3. Με μερική αναγωγή 3-οξο-2,4-διυδροξυβουτανάλης παράγεται 2,3,4-τριυδροξυβουτανάλη [5]:
4. Με μερική αναγωγή 2,3-διοξοπροπανοδιάλης παράγεται 2,3,4-τριυδροξυβουτανάλη [5]:
5. Με μερική αναγωγή 2,3-διοξοπροπανοδιάλης παράγεται 2,3,4-τριυδροξυβουτανάλη [5]:
Με έμμεση μερική αναγωγή 2,3,4-τριυδροξυβουτανικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]1. Αρχικά το 2,3,4-τριυδροξυβουτανικό οξύ μετατρέπεται σε 2,3,4-τριυδροξυβουτανοϋλοχλωρίδιο[6]:
2. Το 2,3,4-τριυδροξυβουτανοϋλοχλωρίδιο ανάγεται καταλυτικά άμεσα προς 2,3,4-τριυδροξυβουτανάλη :
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ 3,0 3,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.2.
- ↑ 5,0 5,1 5,2 5,3 5,4 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.3.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.