Συντακτικός τύπος (χημεία)

Ο συντακτικός ή δομικός τύπος μιας χημικής ένωσης είναι μια γραφική αναπαράσταση της μοριακής δομής (που καθορίζεται με μεθόδους δομικής χημείας (structural formula)), που δείχνει πώς είναι πιθανώς διατεταγμένα τα άτομα στο πραγματικό τρισδιάστατο χώρο. Φαίνονται επίσης οι χημικοί δεσμοί εντός του μορίου, είτε ρητά είτε σιωπηρά. Σε αντίθεση με άλλους χημικούς τύπους,[1] που έχουν περιορισμένο αριθμό συμβόλων και είναι ικανά μόνο για περιορισμένη περιγραφική ισχύ, οι συντακτικοί τύποι παρέχουν μια πληρέστερη γεωμετρική αναπαράσταση της μοριακής δομής. Για παράδειγμα, πολλές χημικές ενώσεις υπάρχουν σε διαφορετικές ισομερείς (isomeric) μορφές, οι οποίες έχουν διαφορετικές εναντιομερείς (enantiomeric) δομές αλλά τον ίδιο μοριακό τύπο. Υπάρχουν πολλοί τύποι τρόπων σχεδίασης αυτών των δομικών τύπων, όπως: δομές Λιούις, συμπυκνωμένους τύπους, σκελετικούς τύπους, προβολές Νιούμαν, διαμορφώσεις κυκλοεξανίου (Cyclohexane conformations), προβολές κατά Χάουορθ και προβολές Φίσερ.[2] Χρησιμοποιούνται πολλές συστηματικές χημικές μορφές ονομασίας, όπως στις χημικές βάσεις δεδομένων, οι οποίες είναι ισοδύναμες και εξίσου ισχυρές με τις γεωμετρικές δομές. Αυτά τα συστήματα χημικής ονοματολογίας περιλαμβάνουν το SMILES (απλοποιημένο σύστημα καταχώρησης γραμμής μοριακής εισαγωγής, Simplified molecular-input line-entry system), InChI (διεθνές χημικό αναγνωριστικό, International Chemical Identifier) και Χημική Γλώσσα Σήμανσης (Chemical Markup Language, CML). Αυτά τα συστηματικά χημικά ονόματα μπορούν να μετατραπούν σε δομικούς τύπους και αντίστροφα, αλλά οι χημικοί σχεδόν πάντα περιγράφουν μια χημική αντίδραση ή αντίδραση σύνθεσης χρησιμοποιώντας συντακτικούς τύπους και όχι χημικές ονομασίες, επειδή οι συντακτικοί τύποι επιτρέπουν στον χημικό να οπτικοποιήσει τα μόρια και τις δομικές αλλαγές που συμβαίνουν σε αυτά κατά τη διάρκεια των χημικών αντιδράσεων. Τα ACD/ChemSketch και ChemDraw είναι δημοφιλείς λήψεις/ιστότοποι που επιτρέπουν στους χρήστες να σχεδιάζουν αντιδράσεις και δομικούς τύπους, συνήθως με τη δομή Λιούις.
Δομές σε συντακτικούς τύπους
[Επεξεργασία | επεξεργασία κώδικα]Δεσμοί
[Επεξεργασία | επεξεργασία κώδικα]Οι δεσμοί εμφανίζονται συχνά ως γραμμή που συνδέει ένα άτομο με ένα άλλο. Η μία γραμμή υποδεικνύει έναν απλό δεσμό (single bond). Δύο γραμμές δηλώνουν διπλό δεσμό και τρεις γραμμές υποδηλώνουν τριπλό δεσμό. Σε ορισμένες δομές τα άτομα μεταξύ κάθε δεσμού καθορίζονται και παρουσιάζονται. Ωστόσο, σε ορισμένες δομές, τα μόρια του άνθρακα δεν αναγράφονται συγκεκριμένα. Αντίθετα, αυτοί οι άνθρακες υποδεικνύονται από μια γωνία που σχηματίζεται όταν συνδέονται δύο γραμμές. Επιπλέον, τα άτομα υδρογόνου υπονοούνται και συνήθως δεν σχεδιάζονται. Αυτά μπορούν να συναχθούν με βάση πόσα άλλα άτομα είναι συνδεδεμένος ο άνθρακας. Για παράδειγμα, εάν ο άνθρακας Α είναι συνδεδεμένος με έναν άλλο άνθρακα Β, ο άνθρακας Α θα έχει τρία υδρογόνα για να γεμίσει την οκτάδα του.[3]


Ηλεκτρόνια
[Επεξεργασία | επεξεργασία κώδικα]
Τα ηλεκτρόνια εμφανίζονται συνήθως χρωματισμένα σε κύκλους. Ένας κύκλος υποδηλώνει ένα ηλεκτρόνιο. Δύο κύκλοι υποδεικνύουν ένα ζεύγος ηλεκτρονίων. Τυπικά, ένα ζεύγος ηλεκτρονίων θα υποδηλώνει επίσης αρνητικό φορτίο. Χρησιμοποιώντας τους έγχρωμους κύκλους, υποδεικνύεται ο αριθμός των ηλεκτρονίων στο κέλυφος σθένους κάθε αντίστοιχου ατόμου παρέχοντας περαιτέρω περιγραφικές πληροφορίες σχετικά με την αντιδραστική ικανότητα αυτού του ατόμου στο μόριο.[3]
Φορτία
[Επεξεργασία | επεξεργασία κώδικα]Συχνά, τα άτομα θα έχουν θετικό ή αρνητικό φορτίο καθώς η οκτάδα τους μπορεί να μην είναι πλήρης. Εάν από το άτομο λείπει ένα ζεύγος ηλεκτρονίων ή έχει ένα πρωτόνιο, θα έχει θετικό φορτίο. Εάν το άτομο έχει ηλεκτρόνια που δεν είναι συνδεδεμένα με άλλο άτομο, θα υπάρχει αρνητικό φορτίο. Στους συντακτικούς τύπους, το θετικό φορτίο υποδεικνύεται με ⊕ και το αρνητικό φορτίο υποδεικνύεται με ⊖ .[3]

Στερεοχημεία (Στερεοχημικός τύπος, σκελετικός τύπος, Skeletal formula)
[Επεξεργασία | επεξεργασία κώδικα]
Η Χειρομορφία στους στερεοχημικούς τύπους υποδεικνύεται με τη μέθοδο προβολής Νάτα (Natta). Η Στερεοχημεία χρησιμοποιείται για να δείξει τη σχετική χωρική διάταξη των ατόμων σε ένα μόριο. Οι σφήνες χρησιμοποιούνται για να το δείξουν αυτό και υπάρχουν δύο τύποι: διακεκομμένες και γεμάτες. Μια γεμάτη σφήνα δείχνει ότι το άτομο βρίσκεται στο μπροστινό μέρος του μορίου και δείχνει πάνω από το επίπεδο του χαρτιού προς τα εμπρός. Μια διακεκομμένη σφήνα δείχνει ότι το άτομο βρίσκεται πίσω από το μόριο και δείχνει κάτω από το επίπεδο του χαρτιού. Όταν χρησιμοποιείται μια ευθεία, μη διακεκομμένη γραμμή, το άτομο βρίσκεται στο επίπεδο του χαρτιού. Αυτή η χωρική διάταξη παρέχει μια ιδέα του μορίου σε έναν τρισδιάστατο χώρο και υπάρχουν περιορισμοί ως προς το πώς μπορούν να διευθετηθούν οι χωρικές διατάξεις.[3]
Απροσδιόριστη στερεοχημεία
[Επεξεργασία | επεξεργασία κώδικα]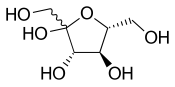
Οι κυματιστοί απλοί δεσμοί αντιπροσωπεύουν άγνωστη ή απροσδιόριστη στερεοχημεία ή ένα μείγμα ισομερών. Για παράδειγμα, το διπλανό διάγραμμα δείχνει το μόριο φρουκτόζης με κυματιστό δεσμό στην ομάδα HOCH2- στα αριστερά. Σε αυτήν την περίπτωση, οι δύο πιθανές δομές δακτυλίου βρίσκονται σε χημική ισορροπία μεταξύ τους και επίσης με τη δομή της ανοιχτής αλυσίδας. Ο δακτύλιος ανοίγει και κλείνει αυτόματα, άλλοτε κλείνοντας με τη μια στερεοχημεία και άλλοτε με την άλλη. Οι στερεοχημικοί τύποι μπορούν να απεικονίζουν cis και trans ισομερή αλκενίων. Οι κυματιστοί απλοί δεσμοί είναι ο τυπικός τρόπος αναπαράστασης άγνωστης ή απροσδιόριστης στερεοχημείας ή μείγματος ισομερών (όπως με τα τετραεδρικά στερεόκεντρα). Ένας διασταυρωμένος διπλός δεσμός έχει χρησιμοποιηθεί μερικές φορές, αλλά δεν θεωρείται πλέον αποδεκτή μορφή για γενική χρήση.[4]
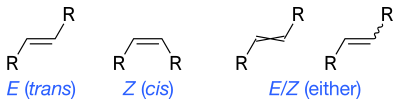
Δομές Λιούις (Lewis structures)
[Επεξεργασία | επεξεργασία κώδικα]
Οι δομές Λιούις (ή Δομές κουκκίδων λιούις) είναι επίπεδοι γραφικοί τύποι που δείχνουν συνδεσιμότητα ατόμων και μονήρες ζεύγος (lone pair) ή ασύζευκτα ηλεκτρόνια, αλλά όχι τρισδιάστατη δομή. Αυτή η σημειογραφία χρησιμοποιείται κυρίως για μικρά μόρια. Κάθε γραμμή αντιπροσωπεύει τα δύο ηλεκτρόνια ενός απλού δεσμού. Δύο ή τρεις παράλληλες γραμμές μεταξύ ζευγών ατόμων αντιπροσωπεύουν διπλούς ή τριπλούς δεσμούς, αντίστοιχα. Εναλλακτικά, μπορούν να χρησιμοποιηθούν ζεύγη κουκκίδων για την αναπαράσταση ζευγών σύνδεσης. Επιπλέον, υποδεικνύονται όλα τα μη συνδεδεμένα ηλεκτρόνια (ζευγαρωμένα ή όχι) και τυχόν τυπικά φορτία στα άτομα. Μέσω της χρήσης δομών Λιούις, η τοποθέτηση ηλεκτρονίων, είτε είναι σε δεσμό είτε σε μονήρη ζεύγη, θα επιτρέψει την αναγνώριση των τυπικών φορτίων των ατόμων στο μόριο για να κατανοήσουμε τη σταθερότητα και να προσδιορίσουμε το πιο πιθανό μόριο (με βάση τη διαφορά στη μοριακή γεωμετρία) που θα σχηματιζόταν σε μια αντίδραση. Οι δομές Λιούις δίνουν κάποιες ιδέες στη γεωμετρία του μορίου, καθώς συχνά οι δεσμοί σχεδιάζονται σε ορισμένες γωνίες για να αναπαραστήσουν το μόριο στην πραγματική ζωή. Η δομή Λιούις χρησιμοποιείται καλύτερα για τον υπολογισμό των τυπικών φορτίων ή του τρόπου σύνδεσης μεταξύ των ατόμων, καθώς εμφανίζονται τόσο τα ηλεκτρόνια όσο και οι δεσμοί. Οι δομές Λιούις δίνουν μια ιδέα της μοριακής και της ηλεκτρονικής γεωμετρίας που ποικίλλει με βάση την παρουσία δεσμών και μονήρων ζευγών και μέσω αυτής θα μπορούσε κανείς να προσδιορίσει επίσης τις γωνίες των δεσμών και την υβριδοποίηση.
-
Η δομή Λιούις του νερού
Συμπυκνωμένοι τύποι
[Επεξεργασία | επεξεργασία κώδικα]Στις πρώτες εκδόσεις οργανικής χημείας, όπου η χρήση γραφικών ήταν έντονα περιορισμένη, προέκυψε ένα τυπογραφικό σύστημα για να περιγράψει τις οργανικές δομές σε μια γραμμή κειμένου. Αν και αυτό το σύστημα τείνει να είναι προβληματικό στην εφαρμογή σε κυκλικές ενώσεις, παραμένει ένας βολικός τρόπος για την αναπαράσταση απλών δομών:
- (αιθανόλη)
Οι παρενθέσεις χρησιμοποιούνται για να υποδείξουν πολλές ταυτόσημες ομάδες, υποδεικνύοντας προσκόλληση στο πλησιέστερο άτομο μη υδρογόνου στα αριστερά όταν εμφανίζεται σε έναν τύπο, ή στο άτομο στα δεξιά όταν εμφανίζεται στην αρχή ενός τύπου:
- ή (2-προπανόλη)
Σε όλες τις περιπτώσεις, εμφανίζονται όλα τα άτομα, συμπεριλαμβανομένων των ατόμων του υδρογόνου. Είναι επίσης χρήσιμο να δείξετε τα καρβονύλια όπου το υπονοείται μέσω του τοποθετημένου στις αγκύλες. Για παράδειγμα: (ακετόνη) Επομένως, είναι σημαντικό να κοιτάξετε προς τα αριστερά του ατόμου στην παρένθεση για να βεβαιωθείτε με ποιο άτομο είναι συνδεδεμένο. Αυτό είναι χρήσιμο κατά τη μετατροπή από συμπυκνωμένο τύπο σε άλλη μορφή συντακτικού τύπου όπως στερεοχημικός (σκελετικός) τύπος ή δομές Λιούις. Υπάρχουν διάφοροι τρόποι για να εμφανιστούν οι διάφορες χαρακτηριστικές ομάδες στους συμπυκνωμένους τύπους όπως στην αλδεΰδες ως , στα καρβοξυλικά οξέα ως ή , στους εστέρες είναι ως ή . Ωστόσο, η χρήση συμπυκνωμένων τύπων δεν δίνει άμεση ιδέα για τη μοριακή γεωμετρία της ένωσης ή τον αριθμό των δεσμών μεταξύ των ανθράκων και πρέπει να αναγνωρίζεται με βάση τον αριθμό των ατόμων που συνδέονται με τους άνθρακες και εάν υπάρχουν φορτία στον άνθρακα.[5]
Στερεοχημικοί (σκελετικοί) τύποι
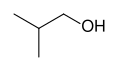
[Επεξεργασία | επεξεργασία κώδικα]Ο στερεοχημικός τύπος είναι ο τυπικός συμβολισμός για πιο πολύπλοκα οργανικά μόρια. Σε αυτόν τον τύπο διαγράμματος, που χρησιμοποιήθηκε για πρώτη φορά από τον οργανικό χημικό Άουγκουστ Κέκουλε,[6] τα άτομα άνθρακα υπονοείται ότι βρίσκονται στις κορυφές (γωνίες) και στα άκρα των ευθύγραμμων τμημάτων αντί να υποδεικνύονται με το ατομικό σύμβολο C. Τα άτομα υδρογόνου που συνδέονται με τα άτομα άνθρακα δεν υποδεικνύονται: κάθε άτομο άνθρακα θεωρείται ότι σχετίζεται με αρκετά άτομα υδρογόνου για να δώσει στο άτομο του άνθρακα τέσσερις δεσμούς. Η παρουσία θετικού ή αρνητικού φορτίου σε ένα άτομο άνθρακα αντικαθιστά ένα από τα υπονοούμενα άτομα υδρογόνου. Τα άτομα υδρογόνου που συνδέονται με άτομα άλλα από τον άνθρακα πρέπει να γράφονται ρητά. Ένα επιπλέον χαρακτηριστικό των σκελετικών τύπων είναι ότι με την προσθήκη ορισμένων δομών μπορεί να προσδιοριστεί η στερεοχημεία, δηλαδή η τρισδιάστατη δομή, της ένωσης. Συχνά, ο σκελετικός τύπος μπορεί να υποδεικνύει στερεοχημεία μέσω της χρήσης σφηνών αντί για γραμμές. Οι συμπαγείς σφήνες αντιπροσωπεύουν δεσμούς που δείχνουν πάνω από το επίπεδο του χαρτιού, ενώ οι διακεκομμένες σφήνες αντιπροσωπεύουν δεσμούς που δείχνουν κάτω από το επίπεδο.
-
Στερεοχημικός τύπος της ισοβουτανόλης, (CH3)2CHCH2OH
Προοπτικά σχέδια
[Επεξεργασία | επεξεργασία κώδικα]Προβολή Νιούμαν (Newman projection) και πλαγιογωνιακή προβολή (sawhorse projection)
[Επεξεργασία | επεξεργασία κώδικα]Η προβολή Νιούμαν και η πλαγιογωνιακή προβολή χρησιμοποιούνται για την απεικόνιση συγκεκριμένων διαμορφομερών (conformers) ή για τη διάκριση γειτονικής στερεοχημείας. Και στις δύο περιπτώσεις, δύο συγκεκριμένα άτομα άνθρακα και ο συνδετικός δεσμός τους είναι το επίκεντρο της προσοχής. Η μόνη διαφορά είναι μια ελαφρώς διαφορετική οπτική: η προβολή Νιούμαν που κοιτάζει κατευθείαν κάτω από τον ενδιαφερόμενο δεσμό, η πλαγιογωνιακή προβολή που κοιτάζει τον ίδιο δεσμό αλλά από μια κάπως λοξή πλεονεκτική θέση. Στην προβολή Newman, ένας κύκλος χρησιμοποιείται για να αναπαραστήσει ένα επίπεδο κάθετο στον δεσμό, διακρίνοντας τους υποκαταστάτες στον μπροστινό άνθρακα από τους υποκαταστάτες στον πίσω άνθρακα. Στην πλαγιογωνιακή προβολή, ο μπροστινός άνθρακας είναι συνήθως στα αριστερά και είναι πάντα ελαφρώς χαμηλότερος. Μερικές φορές, χρησιμοποιείται ένα βέλος για να υποδείξει το μπροστινό άνθρακα. Η πλαγιογωνιακή προβολή είναι πολύ παρόμοια με έναν σκελετικό τύπο και μπορεί ακόμη και να χρησιμοποιήσει σφήνες αντί για γραμμές για να υποδείξει τη στερεοχημεία του μορίου. Η πλαγιογωνιακή προβολή διαχωρίζεται από τους σκελετικούς τύπους επειδή η πλαγιογωνιακή προβολή δεν είναι πολύ καλός δείκτης της γεωμετρίας των μορίων και της μοριακής διάταξης. Τόσο η προβολή Νιούμαν όσο και η πλαγιογωνιακή προβολή μπορούν να χρησιμοποιηθούν για τη δημιουργία μιας προβολής Φίσερ.
-
Προβολή Νιούμαν του βουτανίου
-
Πλαγιογωνιακή προβολή του βουτανίου
Διαμορφώσεις του κυκλοεξανίου
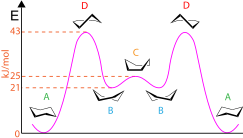
[Επεξεργασία | επεξεργασία κώδικα]Ορισμένες διαμορφώσεις του κυκλοεξανίου και άλλων ενώσεων μικρού δακτυλίου μπορούν να παρουσιαστούν χρησιμοποιώντας μια τυπική σύμβαση. Για παράδειγμα, η τυπική διαμόρφωση ανάκλιντρου του κυκλοεξανίου περιλαμβάνει μια προοπτική προβολή από ελαφρώς πάνω από το μέσο επίπεδο των ατόμων άνθρακα και υποδεικνύει σαφώς ποιες ομάδες είναι αξονικές (δείχνοντας κατακόρυφα πάνω ή κάτω) και οι οποίες είναι ισημερινή (σχεδόν οριζόντια, ελαφρώς λοξά προς τα πάνω ή προς τα κάτω). Οι δεσμοί μπροστά μπορεί να τονιστούν ή όχι με ισχυρότερες γραμμές ή σφήνες. Οι διαμορφώσεις εξελίσσονται ως εξής: από ανάκλιντρο σε ημιανάκλιντρο (half-chair), σε συνεστραμμένο λουτήρα (twist-boat), σε λουτήρα, σε συνεστραμμένο λουτήρα, σε ημιανάκλιντρο, σε ανάκλιντρο. Οι διαμορφώσεις του κυκλοεξανίου μπορούν επίσης να χρησιμοποιηθούν για να δείξουν τη δυναμική ενέργεια που υπάρχει σε κάθε στάδιο, όπως φαίνεται στο διάγραμμα. Οι διαμορφώσεις ανάκλιντρου (Α) έχουν τη χαμηλότερη ενέργεια, ενώ οι διαμορφώσεις ημιανάκλιντρου (D) έχουν την υψηλότερη ενέργεια. Υπάρχει μία κορυφή/τοπικό μέγιστο στη διαμόρφωση λουτήρα (C), και υπάρχουν κοιλάδες/τοπικά ελάχιστα στις διαμορφώσεις του συνεστραμμένου λουτήρα (B). Επιπλέον, οι διαμορφώσεις του κυκλοεξανίου μπορούν να χρησιμοποιηθούν για να υποδείξουν εάν το μόριο έχει οποιεσδήποτε 1,3 διαξονικές αλληλεπιδράσεις που είναι στερεοχημικές αλληλεπιδράσεις μεταξύ αξονικών υποκαταστατών στους άνθρακες 1,3 και 5.[7]
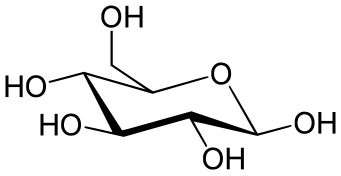
Προβολή κατά Χάουορθ
[Επεξεργασία | επεξεργασία κώδικα]Η προβολή κατά Χάουορθ χρησιμοποιείται για κυκλικά σάκχαρα. Οι αξονικές και ισημερινές θέσεις δεν διακρίνονται. Αντίθετα, οι υποκαταστάτες τοποθετούνται ακριβώς πάνω ή κάτω από το άτομο δακτυλίου στο οποίο συνδέονται. Οι υποκαταστάτες υδρογόνου συνήθως παραλείπονται.
Ωστόσο, ένα σημαντικό πράγμα που πρέπει να έχετε κατά νου κατά την ανάγνωση μιας προβολής Haworth είναι ότι οι δομές του δακτυλίου δεν είναι επίπεδες. Επομένως, η Haworth δεν παρέχει τρισδιάστατο σχήμα. Ο Norman Haworth, ήταν Βρετανός χημικός, ο οποίος κέρδισε το βραβείο Νόμπελ για το έργο του στους υδατάνθρακες και την ανακάλυψη της δομής της βιταμίνης C. Κατά την ανακάλυψή του, αφαίρεσε επίσης διαφορετικούς συντακτικούς τύπους που τώρα αναφέρονται ως προβολές Haworth. Σε μια προβολή Haworth ένα σάκχαρο πυρανόζης απεικονίζεται ως εξάγωνο και ένα σάκχαρο φουρανόζης απεικονίζεται ως πεντάγωνο. Συνήθως ένα οξυγόνο τοποθετείται στην επάνω δεξιά γωνία σε πυρανόζη και στο πάνω κέντρο σε σάκχαρο φουρανόζης. Οι λεπτότεροι δεσμοί στην κορυφή του δακτυλίου αναφέρονται στους δεσμούς ως πιο απομακρυσμένοι και οι παχύτεροι δεσμοί στο κάτω μέρος του δακτυλίου αναφέρονται στο άκρο του δακτυλίου που είναι πιο κοντά στον θεατή.[8]

-
Προβολή Haworth της βήτα-D-γλυκόζης
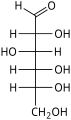
Προβολή Φίσερ
[Επεξεργασία | επεξεργασία κώδικα]Η προβολή Φίσερ (Fischer) χρησιμοποιείται κυρίως για γραμμικούς μονοσακχαρίτες. Σε οποιοδήποτε δεδομένο κέντρο άνθρακα, οι κατακόρυφες γραμμές δεσμού είναι ισοδύναμες με στερεοχημικά κατακερματισμένα σημάδια, που κατευθύνονται μακριά από τον παρατηρητή, ενώ οι οριζόντιες γραμμές ισοδυναμούν με σφήνες, που δείχνουν προς τον παρατηρητή. Η προβολή δεν είναι ρεαλιστική, καθώς ένας σακχαρίτης δεν θα υιοθετούσε ποτέ αυτήν την πολλαπλασιαστική εκλειπτική διαμόρφωση. Ωστόσο, η προβολή Φίσερ είναι ένας απλός τρόπος απεικόνισης πολλαπλών διαδοχικών στερεοκέντρων που δεν απαιτεί ούτε συνεπάγεται καμία γνώση της πραγματικής διαμόρφωσης. Μια προβολή Fischer θα περιορίσει ένα μόριο 3-D σε 2-D, και επομένως, υπάρχουν περιορισμοί στην αλλαγή της διαμόρφωσης των χειρόμορφων κέντρων. Οι προβολές Φίσερ χρησιμοποιούνται για τον προσδιορισμό της διαμόρφωσης R και S σε έναν χειρόμορφο άνθρακα και γίνεται χρησιμοποιώντας τους κανόνες Cahn-Ingold-Prelog. Είναι ένας βολικός τρόπος αναπαράστασης και διάκρισης μεταξύ των εναντιομερών (enantiomers) και των διαστερεομερών (diastereomers).[8]
Περιορισμοί
[Επεξεργασία | επεξεργασία κώδικα]Ένας συντακτικός τύπος είναι ένα απλοποιημένο πρότυπο που δεν μπορεί να αντιπροσωπεύει ορισμένες πτυχές των χημικών δομών. Για παράδειγμα, η τυπική σύνδεση μπορεί να μην είναι εφαρμόσιμη σε δυναμικά συστήματα όπως οι απεντοπισμένοι δεσμοί (delocalized bonds). Η αρωματικότητα είναι μια τέτοια περίπτωση και βασίζεται στη σύμβαση για να αναπαραστήσει το δεσμό. Διαφορετικές τεχνοτροπίες συντακτικών τύπων μπορεί να αντιπροσωπεύουν την αρωματικότητα με διαφορετικούς τρόπους, οδηγώντας σε διαφορετικές απεικονίσεις της ίδιας χημικής ένωσης. Ένα άλλο παράδειγμα είναι οι τυπικοί διπλοί δεσμοί όπου η πυκνότητα των ηλεκτρονίων απλώνεται έξω από τον τυπικό δεσμό, οδηγώντας σε μερικό χαρακτήρα διπλού δεσμού και αργή αλληλομετατροπή σε θερμοκρασία δωματίου. Για όλα τα δυναμικά αποτελέσματα, η θερμοκρασία θα επηρεάσει τους ρυθμούς αλληλομετατροπών και μπορεί να αλλάξει τον τρόπο με τον οποίο θα πρέπει να αναπαρασταθεί η δομή. Δεν υπάρχει ρητή θερμοκρασία που να σχετίζεται με έναν συντακτικό τύπο, αν και πολλοί υποθέτουν ότι θα ήταν σε κανονικές συνθήκες.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Denise DeCooman (8 Απριλίου 2022). «What are Chemical Formulas and How are They Used?». Study.com. sec. Chemical Formula Examples. Αρχειοθετήθηκε από το πρωτότυπο στις 23 Ιουνίου 2022.
- ↑ Goodwin, W. M. (2007-04-13). «Structural formulas and explanation in organic chemistry». Foundations of Chemistry 10 (2): 117–127. doi:. ISSN 1386-4238.
- ↑ 3,0 3,1 3,2 3,3 Brown, William Henry· Brent L. Iverson· Eric V. Anslyn· Christopher S. Foote (2018). Organic chemistry (Eighth έκδοση). Boston. ISBN 978-1-305-58035-0. OCLC 974377227.
- ↑ J. Brecher (2006). «Graphical representation of stereochemical configuration (IUPAC Recommendations 2006)». Pure Appl. Chem. 78 (10): 1897–1970. doi:. http://www.iupac.org/publications/pac/pdf/2006/pdf/7810x1897.pdf.
- ↑ Liu, Xin (2021-12-09) (στα αγγλικά). 2.1 Structures of Alkenes. https://kpu.pressbooks.pub/organicchemistry/chapter/2-1-alkanes-structures-and-naming-nomenclature/.
- ↑ «Friedrich August Kekule von Stradonitz –inventor of benzene structure - World Of Chemicals». www.worldofchemicals.com. Αρχειοθετήθηκε από το πρωτότυπο στις 10 Νοεμβρίου 2022. Ανακτήθηκε στις 4 Απριλίου 2022.
- ↑ Brown, William Henry (2018). Organic chemistry. Brent L. Iverson, Eric V. Anslyn, Christopher S. Foote (Eighth έκδοση). Boston, MA. ISBN 978-1-305-58035-0. OCLC 974377227.
- ↑ 8,0 8,1 Zhang, Qing-zhi; Zhang, Shen-song (June 1999). «A New Method To Convert the Fischer Projection of a Monosaccharide to the Haworth Projection» (στα αγγλικά). Journal of Chemical Education 76 (6): 799. doi:. ISSN 0021-9584. https://pubs.acs.org/doi/abs/10.1021/ed076p799.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- The Importance of Structural Formulas
- «Structural Formulas». 9 Μαΐου 2016. Αρχειοθετήθηκε από το πρωτότυπο στις 9 Μαΐου 2016. Ανακτήθηκε στις 17 Δεκεμβρίου 2022.
- How to get structural formulas using crystallography