Τεντιζολίδη
 | |
| Ονομασία IUPAC | |
|---|---|
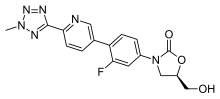
(5R)-3-{3-fluoro-4-[6-(2-methyl-2H-tetrazol-5-yl)pyridin-3-yl]phenyl}-5-(hydroxymethyl)-1,3-oxazolidin-2-one | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Sivextro |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a614038 |
| Κατηγορία ασφαλείας κύησης |
|
| Οδοί χορήγησης | Από του στόματος χορήγηση, ενδοφλέβια |
| Κυκλοφορία | |
| Κυκλοφορία | |
| Φαρμακοκινητική | |
| Βιοδιαθεσιμότητα | 91% |
| Πρωτεϊνική σύνδεση | 70–90% |
| Βιολογικός χρόνος ημιζωής | 12 ώρες |
| Απέκκριση | Κόπρανα |
| Κωδικοί | |
| Αριθμός CAS | 856866-72-3 |
| Κωδικός ATC | J01XX11 |
| PubChem | CID 11234049 |
| DrugBank | DB09042 |
| ChemSpider | 9409096 |
| UNII | 97HLQ82NGL |
| KEGG | D09685 |
| ChEBI | CHEBI:82717 |
| ChEMBL | CHEMBL1257051 |
| Συνώνυμα | TR-700 |
| Χημικά στοιχεία | |
| Χημικός τύπος | C17H15FN6O3 |
| Μοριακή μάζα | 370,34 g·mol−1 |
O=C4O[C@H](CN4c3cc(F)c(c1ccc(nc1)c2nn(nn2)C)cc3)CO | |
InChI=1S/C17H15FN6O3/c1-23-21-16(20-22-23)15-5-2-10(7-19-15)13-4-3-11(6-14(13)18)24-8-12(9-25)27-17(24)26/h2-7,12,25H,8-9H2,1H3/t12-/m1/s1 Key:XFALPSLJIHVRKE-GFCCVEGCSA-N | |
| (verify) | |
Η τεντιζολίδη (πρώην τορεζολίδη, εμπορική ονομασία Sivextro ), [3] είναι ένα αντιβιοτικό κατηγορίας οξαζολιδινόνης . Η φωσφορική τεντιζολίδη είναι ένα προφάρμακο φωσφορικού εστέρα της δραστικής ένωσης τεντιζολίδης. Αναπτύχθηκε από την Cubist Pharmaceuticals, μετά την εξαγορά της Trius Therapeutics (δημιουργός: Dong-A Pharmaceuticals) και διατίθεται στην αγορά για τη θεραπεία οξέων βακτηριακών λοιμώξεων του δέρματος και της δομής του δέρματος (γνωστές επίσης ως περίπλοκες λοιμώξεις του δέρματος και της δομής του δέρματος (cSSSIs)) . [4]
Οι πιο συχνές ανεπιθύμητες ενέργειες περιλαμβάνουν ναυτία (αίσθημα αδιαθεσίας), πονοκέφαλο, διάρροια και έμετο. [1] Αυτές οι ανεπιθύμητες ενέργειες ήταν γενικά ήπιας ή μέτριας σοβαρότητας. [1]
Η τεντιζολίδη εγκρίθηκε για ιατρική χρήση στις Ηνωμένες Πολιτείες τον Ιούνιο του 2014, [5] [6] και για ιατρική χρήση στην Ευρωπαϊκή Ένωση τον Μάρτιο του 2015 [1]
Ιατρικές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Η Τεντιζολίδη εγκρίθηκε από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) στις 20 Ιουνίου 2014, με την ένδειξη για τη θεραπεία οξειών βακτηριακών λοιμώξεων του δέρματος και της δομής του δέρματος (ABSSSI) που προκαλούνται από ορισμένα ευαίσθητα βακτήρια, συμπεριλαμβανομένου του Staphylococcus aureus (συμπεριλαμβανομένου του ανθεκτικού στη μεθικιλλίνη στελέχη, MRSA και στελέχη ευαίσθητα στη μεθικιλλίνη), διάφορα είδη στρεπτόκοκκου ( S. pyogenes, S. agalactiae και ομάδα S. anginosus συμπεριλαμβανομένων των S. anginosus, S. intermedius και S. constellatus ) και Enterococcus faecalis . [5] [6] [7] [2] Το Tedizolid είναι ένα παράγωγο οξαζολιδινόνης δεύτερης γενιάς που είναι 4 έως 16 φορές πιο ισχυρό έναντι των σταφυλόκοκκων και των εντερόκοκκων σε σύγκριση με τη λινεζολίδη . [8] Η συνιστώμενη δόση για θεραπεία είναι 200 mg μία φορά ημερησίως για συνολική διάρκεια έξι ημερών, είτε από το στόμα (με ή χωρίς τροφή) είτε με ενδοφλέβια ένεση (εάν ο ασθενής είναι άνω των 18 ετών). [2]
Στην Ευρωπαϊκή Ένωση η Τεντιζολίδη ενδείκνυται για τη θεραπεία οξέων βακτηριακών λοιμώξεων του δέρματος και της δομής του δέρματος (ABSSSI) σε ενήλικες. [1]
Μηχανισμός δράσης
[Επεξεργασία | επεξεργασία κώδικα]Η φωσφορική Τεντιζολίδη (TR-701) είναι ένα προφάρμακο που ενεργοποιείται από τις φωσφατάσες του πλάσματος ή του εντέρου σε tedizolid (TR-700) μετά από χορήγηση του φαρμάκου είτε από το στόμα είτε ενδοφλεβίως. [2] [9] Μόλις ενεργοποιηθεί, η τεντιζολίδη ασκεί τη βακτηριοστατική μικροβιακή της δράση μέσω της αναστολής της πρωτεϊνικής σύνθεσης δεσμεύοντας στη ριβοσωμική υπομονάδα 50S (στη θέση αποδέκτη) των βακτηρίων. [2]

- ↑ 1,0 1,1 1,2 1,3 1,4 «Sivextro EPAR». European Medicines Agency (EMA). 17 Σεπτεμβρίου 2018. Ανακτήθηκε στις 5 Ιουλίου 2020. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ↑ 2,0 2,1 2,2 2,3 2,4 «Sivextro- tedizolid phosphate tablet, film coated Sivextro- tedizolid phosphate injection, powder, lyophilized, for solution». DailyMed. 22 Ιουνίου 2020. Ανακτήθηκε στις 24 Οκτωβρίου 2020.
- ↑ «Trius grows as lead antibiotic moves forward». 31 Oct 2011. http://www.signonsandiego.com/news/2011/oct/31/trius-grows-lead-antibiotic-moves-forward/.
- ↑ «Cubist Pharmaceuticals to Acquire Trius Therapeutics». July 2013. Αρχειοθετήθηκε από το πρωτότυπο στις 2015-04-02. https://web.archive.org/web/20150402125618/http://investors.cubist.com/Mobile/file.aspx?IID=4093793&FID=18531897. Ανακτήθηκε στις 2024-02-10.
- ↑ 5,0 5,1 «Drug Approval Package: Sivextro (tedizolid phosphate) Tablets NDA #205435». U.S. Food and Drug Administration (FDA). 24 Δεκεμβρίου 1999. Ανακτήθηκε στις 5 Ιουλίου 2020.
- ↑ 6,0 6,1 «Drug Approval Package: Sivextro (tedizolid phosphate) Injection NDA #205436». U.S. Food and Drug Administration (FDA). 24 Δεκεμβρίου 1999. Ανακτήθηκε στις 5 Ιουλίου 2020.
- ↑ (June 2014). FDA approves Sivextro to treat skin infections. Δελτίο τύπου.
- ↑ "Tedizolid (TR-701): a new oxazolidinone with enhanced potency". Accessed 2015-03-16.
- ↑ «In vitro activity of TR-700, the active ingredient of the antibacterial prodrug TR-701, a novel oxazolidinone antibacterial agent». Antimicrobial Agents and Chemotherapy 53 (8): 3236–3239. August 2009. doi:. PMID 19528279.
Φαρμακοκινητικές/φαρμακοδυναμικές (PK/PD) ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Τα δισκία Τεντιζολίδης έχουν βιοδιαθεσιμότητα από το στόμα μεγαλύτερη του 90%. Η Τεντιζολίδη έχει υψηλότερη σύνδεση με τις πρωτεΐνες του πλάσματος (80%), μεγαλύτερο χρόνο ημιζωής και μεγαλύτερο όγκο κατανομής σε σύγκριση με τη λινεζολίδη. Μεταβολίζεται κυρίως από το ήπαρ ως ανενεργό θειικό συζυγές (αντίδραση φάσης ΙΙ), χωρίς μεταβολισμό από τα ένζυμα του κυτοχρώματος P-450. Λιγότερο από το 20% του φαρμάκου απεκκρίνεται αμετάβλητο στα ούρα. Η βακτηριοκτόνος δράση της Τεντιζολίδης στο VRE και το MRSA εξαρτάται από το χρόνο. Οι συσχετίσεις είναι πλησιέστερες μεταξύ του fAUC24/MIC και του δείκτη PK/PD της τεντιζολίδης έναντι του MRSA και του VRE. Για να επιτευχθεί 1 log10 kill, οι fAUC24/MIC της τεντιζολίδης σε μοντέλα ποντικιών με ουδετεροπενία με μόλυνση μηρού με VRE και MRSA θα πρέπει να είναι 14,2 και 138,5, αντίστοιχα. Οι μετα-αντιβιοτικές επιδράσεις της Τεντιζολίδης έναντι του VRE και του MRSA είναι 2,39 και 0,99 ώρες, αντίστοιχα. [1]
Κλινικές δοκιμές
[Επεξεργασία | επεξεργασία κώδικα]Η τεντιζολίδη απέδειξε τη μη κατωτερότητά του έναντι της λινεζολίδης σε δύο δοκιμές φάσης ΙΙΙ, γνωστές ως δοκιμές ESTABLISH. [2]
Η τεντιζολίδη είναι η δεύτερη θεραπεία που εγκρίθηκε από τον FDA βάσει του νέου ομοσπονδιακού νόμου Generating Antibiotic Incentives Now (γνωστός ως νόμος GAIN). [3] [4] Τα νέα αντιβιοτικά που παράγονται στο πλαίσιο αυτού του νέου νόμου θα σχεδιαστούν ως Προϊόν Πιστοποιημένων Λοιμωδών Νόσων (QIDP), επιτρέποντας μια ταχεία αναθεώρηση από τον FDA και μια επιπλέον πενταετία αποκλειστικότητας στην αγορά. [4]
Ανεπιθύμητες ενέργειες
[Επεξεργασία | επεξεργασία κώδικα]Οι πιο συχνές ανεπιθύμητες ενέργειες που βρέθηκαν στις κλινικές δοκιμές ήταν ναυτία, πονοκέφαλος, διάρροια, έμετος και ζάλη. [5] Η τεντιζολίδη έχει επίσης βρεθεί ότι έχει αιματολογικές (αιματολογικές) επιδράσεις, όπως φαίνεται σε μελέτες Φάσης Ι στις οποίες άτομα που εκτέθηκαν σε δόσεις μεγαλύτερες από 6 ημέρες έδειξαν πιθανή επίδραση δόσης και διάρκειας στις αιματολογικές παραμέτρους. [5] Η ασφάλειά του σε ασθενείς με μειωμένα επίπεδα λευκών αιμοσφαιρίων δεν έχει τεκμηριωθεί. [6] Οι ασθενείς που λαμβάνουν τεντιζολίδη διατρέχουν επίσης χαμηλό κίνδυνο περιφερικής και οπτικής νευροπάθειας, παρόμοια με άλλα μέλη της κατηγορίας των οξαζολιδινονών. [5]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «New Antimicrobials for Gram-Positive Sustained Infections: A Comprehensive Guide for Clinicians». Pharmaceuticals 16 (9): 1304. September 2023. doi:. PMID 37765112.
- ↑ "Analysis of the Phase 3 ESTABLISH Trials of Tedizolid versus Linezolid in Acute Bacterial Skin and Skin Structure Infections". Accessed March 16, 2015
- ↑ «New FDA task force will support innovation in antibacterial drug development». September 2012. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm320643.htm.
- ↑ 4,0 4,1 «Three encouraging steps towards new antibiotics». September 2014. http://blogs.fda.gov/fdavoice/index.php/tag/gain-act/.
- ↑ 5,0 5,1 5,2 Σφάλμα αναφοράς: Σφάλμα παραπομπής: Λανθασμένο
<ref>. Δεν υπάρχει κείμενο για τις παραπομπές με όνομαSivextro FDA label. - ↑ Σφάλμα αναφοράς: Σφάλμα παραπομπής: Λανθασμένο
<ref>. Δεν υπάρχει κείμενο για τις παραπομπές με όνομαFDA Approval.
Εξωτερικοί Σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- «Tedizolid». Drug Information Portal. U.S. National Library of Medicine.
- «Tedizolid phosphate». Drug Information Portal. U.S. National Library of Medicine.
- «Tedizolid Injection: MedlinePlus Drug Information». MedlinePlus.
