Ιδιοπαθής πνευμονική ίνωση
| Ιδιοπαθής πνευμονική ίνωση (IPF) | |
|---|---|
| Συνώνυμα | Κρυπτογενής ινώδης κυψελίδα, διάχυτη ινώδης κυψελίδα, συνήθης διάμεση πνευμονίτιδα[1] |
 | |
| Η Εικόνα A δεικνύει την θέση των πνευμόνων και αεραγωγών στο σώμα. Η ένθετη εικόνα δεικνύει μια λεπτομερή όψη των αεραγωγών των πνευμόνων και των θυλάκων αέρα σε διατομή. Η Εικόνα B δεικνύει ινώσεις (ουλές) στους πνεύμονες. Η ένθετη εικόνα δεικνύει μια λεπτομερή άποψη της ίνωσης και πως καταστρέφει τους αεραγωγούς και τους θύλακες αέρα.[1] | |
| Ειδικότητα | Πνευμονολογία |
| Συμπτώματα | Δύσπνοια, ξηρός βήχας[1] |
| Επιπλοκές | Πνευμονική υπέρταση, καρδιακή ανεπάρκεια, πνευμονία ή πνευμονική εμβολή.[1] |
| Συνήθη έναρξη | Σταδιακή[1] |
| Αίτια | Άγνωστη[2] |
| Παράγοντες κινδύνου | Κάπνισμα, ορισμένες ιογενείς λοιμώξεις, οικογενειακό ιστορικό[1] |
| Διαγνωστική μέθοδος | Αξονική τομογραφία, βιοψία πνευμόνων[3] |
| Διαφορική διάγνωση | Σαρκοείδωση, άλλες διάμεσες πνευμονικές παθήσεις, πνευμονίτιδα υπερευαισθησίας[4] |
| Θεραπεία | Πνευμονική αποκατάσταση, συμπληρωματικό οξυγόνο, μεταμόσχευση πνεύμονα[1] |
| Φαρμακευτική αγωγή | Pirfenidone (Πιρφενιδόνη), Nintedanib (Νιντεδανίμπη)[2] |
| Πρόγνωση | Προσδόκιμο ζωής ~ 4 έτη[1] με μέγιστο τα 10 έτη[5] |
| Συχνότητα | 12 ανά 100.000 άτομα ετησίως[4] |
Η Ιδιοπαθής πνευμονική ίνωση (Αγγλικά: Idiopathic pulmonary fibrosis (IPF)), είναι μία χρόνια και σχετικά σπάνια πνευμονική νόσος,[Σημ. 1] η οποία χαρακτηρίζεται από προοδευτική και μη αναστρέψιμη μείωση της πνευμονικής λειτουργίας.[3][4] Η ιδιοπαθής πνευμονική ίνωση (IPF) είναι μια πνευμονική πάθηση η οποία χαρακτηρίζεται από προοδευτική διάμεση ίνωση.[5] Τα συμπτώματα τυπικά περιλαμβάνουν βαθμιαία έναρξη της δύσπνοιας και ξηρό βήχα.[1] Άλλες αλλαγές μπορεί να περιλαμβάνουν αίσθημα κόπωσης και πληκτροδακτυλία (clubbing)[Σημ. 2] στα δάχτυλα των χεριών ή / και των ποδιών (βλ. σχετική εικόνα).[1] Οι επιπλοκές μπορεί να περιλαμβάνουν πνευμονική υπέρταση,[Σημ. 3] καρδιακή ανεπάρκεια, πνευμονία ή πνευμονική εμβολή.[1] Εν κατακλείδι, η ιδιοπαθής πνευμονική ίνωση (IPF) είναι μια βαθιά ανοσοκατασταλτική ασθένεια, μία προοδευτική και γενικά θανατηφόρος πάθηση, η οποία χαρακτηρίζεται από ουλές στους πνεύμονες και οι οποίες πυκνώνουν την επένδυση των πνευμόνων, προκαλώντας μη αναστρέψιμη απώλεια της ικανότητας του ιστού να μεταφέρει οξυγόνο. Η IPF τελικά, στερεί από τον ασθενή την ικανότητα να αναπνέει.[6]
Τα αίτια είναι άγνωστα.[2] Οι παράγοντες κινδύνου περιλαμβάνουν το κάπνισμα τσιγάρων, ορισμένες ιογενείς λοιμώξεις και το οικογενειακό ιστορικό της πάθησης.[1] Ο υποκείμενος μηχανισμός περιλαμβάνει ουλές στους πνεύμονες.[1] Η διάγνωση απαιτεί την εξάλειψη άλλων πιθανών αιτιών και μπορεί να υποστηριχθεί από αξονική τομογραφία ή βιοψία πνευμόνων.[3] Πρόκειται για έναν τύπο διάμεσης πνευμονοπάθειας ή διάμεσης πνευμονικής νόσου (ILD).[Σημ. 4][3]
Οι πάσχοντες από IPF, συχνά επωφελούνται με την πνευμονική αποκατάσταση και το συμπληρωματικό οξυγόνο.[1] Ορισμένα φάρμακα όπως το Esbriet ή το Ofev,[Σημ. 5] τα οποία περιέχουν αντίστοιχα πιρφενιδόνη (pirfenidone) ή νιντεδανίμπη (nintedanib), μπορεί να επιβραδύνουν την εξέλιξη της νόσου (βλ. παρακάτω «Θεραπευτική αγωγή»).[2] Η μεταμόσχευση πνεύμονα μπορεί επίσης να είναι μια επιλογή.[1] Περίπου 5 εκατομμύρια άνθρωποι προσβάλλονται παγκοσμίως.[7] Η νόσος εμφανίζεται πρόσφατα σε περίπου 12 ανά 100.000 άτομα ετησίως.[4] Αυτοί που ηλικιακά βρίσκονται μεταξύ 60 και 70 ετών, είναι αυτοί οι οποίοι προσβάλλονται περισσότερο.[4] Οι άντρες προσβάλλονται συχνότερα από τις γυναίκες.[4] Το μέσο προσδόκιμο ζωής, μετά τη διάγνωση, είναι περίπου τέσσερα έτη[1] με μέγιστο τα 10 έτη.[5]
Ορισμένα ενδιαφέροντα στατιστικά στοιχεία, αναφορικά με τη νόσο είναι πως:[6]
- 100% πέθαναν χωρίς να έχουν πραγματοποιήσει μεταμόσχευση πνεύμονα
- 80% πέθαναν εντός 5 ετών από τη διάγνωση
- 50% πέθαναν εντός 2 ετών από τη διάγνωση
- 50% των περιπτώσεων είχαν αρχικά λανθασμένη διάγνωση της IPF
Έρευνες έδειξαν πως «συγγενείς πρώτου βαθμού ασθενών με οικογενειακό και σποραδικό (μη οικογενειακό) IPF φαίνεται να διατρέχουν παρόμοιο κίνδυνο (για αδιάγνωστη διάμεση πνευμονοπάθεια [ILD])».[8]
Το εκτιμώμενο ποσοστό των ασθενών με ιδιοπαθή πνευμονική ίνωση οι οποίοι παραμένουν αδιάγνωστοι στις ΗΠΑ, την Ιαπωνία και σε πέντε μεγάλες αγορές της ΕΕ είναι:[9]
- 52% με ήπιας μορφής IPF
- 33% με μέτριας μορφής IPF και
- 17% με σοβαρής μορφής IPF
Ετυμολογία — σημασία[Επεξεργασία | επεξεργασία κώδικα]
Ο όρος “ιδιοπαθής”, προέρχεται από το ελληνικό “ίδιος” που σημαίνει “το δικό του” και “πάθος” που σημαίνει “πάθηση”.[10] “Ιδιοπαθής”, δηλαδή, άγνωστης αιτίας. Για παράδειγμα, η επιληψία της οποίας δεν γνωρίζουμε τα ακριβή αίτια πρόκλησής της, αναφέρεται ως “Ιδιοπαθής επιληψία”.[10]
Ίνωση, όταν ο φλεγμονώδης ιστός αντικαθίσταται με ιστό ουλής, καθιστώντας τον παχύρρευστο και γίνεται πιο άκαμπτο. Είναι δηλαδή, ένας υπερανεπτυγμένος ιστός ουλής ή συνδετικός ιστός (υλικό το οποίο περιβάλλει τις δομές του σώματος και τις συγκρατεί ενωμένες)[10] ή άλλως μια κατάσταση που χαρακτηρίζεται από την αύξηση του ενδιάμεσου ινώδους ιστού[11] δηλαδή, ο σχηματισμός μιας ασυνήθους ποσότητας ινώδους ιστού σε ένα όργανο ή ένα τμήμα, ως αποτέλεσμα φλεγμονής, ερεθισμού ή επούλωσης.[12]
Σημεία και συμπτώματα[Επεξεργασία | επεξεργασία κώδικα]

 |
Αναπνευστικός, διχαστικός ήχος «τύπου velcro» κατά την ακρόαση με το στηθοσκόπιο, ασθενούς με IPF.
|
| Έχετε προβλήματα με αυτό το αρχείο; Δείτε βοήθεια πολυμέσων. | |
Σε πολλούς ανθρώπους, τα συμπτώματα εμφανίζονται για μεγάλο χρονικό διάστημα πριν από τη διάγνωση.[7] Τα πιο κοινά κλινικά χαρακτηριστικά της IPF περιλαμβάνουν τα ακόλουθα:[3][13][14]
- Ηλικία άνω των 50 ετών
- Ξηρός, μη παραγωγικός βήχας κατά την προσπάθεια
- Προοδευτική δύσπνοια (λαχάνιασμα με την άσκηση)
- Στεγνός, αναπνευστικός, διχαστικός ήχος «τύπου velcro» κατά την ακρόαση με το στηθοσκόπιο (έναν ήχο τριγμού στους πνεύμονες κατά τη διάρκεια της εισπνοής, παρόμοιο με αυτόν των velcro όταν αποχωρίζονται μεταξύ των (ακούγεται με στηθοσκόπιο)[3][15][16]
- Πληκτροδακτυλία (clubbing) των χεριών ή / και των ποδιών (βλ. σχετική εικόνα)
- Μη φυσιολογικά αποτελέσματα δοκιμών πνευμονικής λειτουργίας, με ενδείξεις περιορισμού και εξασθενημένη ανταλλαγή αερίων.
Ορισμένα από αυτά τα χαρακτηριστικά είναι λόγω χρόνιας υποξαιμίας (ανεπάρκεια οξυγόνου στο αίμα), δεν είναι αποκλειστικά για την IPF και μπορεί να εμφανιστούν και σε άλλες πνευμονικές διαταραχές. Η IPF θα πρέπει να αποδίδεται σε όλους τους ασθενείς με ανεξήγητη χρόνια δύσπνοια, η οποία συνοδεύεται με βήχα, διχαστικό αναπνευστικό ραγισμένο ήχο ή πληκτροδακτυλία.[3]
Η αξιολόγηση των τριγμών «τύπου velcro» στην πνευμονική ακρόαση, είναι ένας πρακτικός τρόπος για τη βελτίωση της πρώιμης διάγνωσης της IPF. Οι λεπτοί τριγμοί αναγνωρίζονται εύκολα από τους κλινικούς ιατρούς και είναι χαρακτηριστικοί της IPF.[17]
Εάν υπάρχουν αμφίπλευροι λεπτοί τριγμοί καθ' όλη τη διάρκεια του εισπνευστικού χρόνου και εξακολουθούν να υφίστανται μετά από αρκετές βαθιές αναπνοές και αν παραμένουν αρκετές φορές σε διάστημα αρκετών εβδομάδων σε ένα άτομο ηλικίας ≥60 ετών, αυτό θα αυξήσει την υποψία της IPF και θα οδηγήσει σε εξέταση μιας ψηφιακής τομογραφίας υψηλής ανάλυσης (HRCT)[Σημ. 6] του θώρακα η οποία είναι πιο ευκρινής από μια ακτινογραφία θώρακος.[16] Καθώς οι τριγμοί δεν είναι συγκεκριμένοι για την IPF, θα πρέπει να προκληθούν διεξοδικές διαγνωστικές διαδικασίες.[3]
Αίτια[Επεξεργασία | επεξεργασία κώδικα]
Τα αίτια της IPF είναι άγνωστα, αλλά ορισμένοι περιβαλλοντικοί παράγοντες και εκθέσεις έχουν αποδειχθεί ότι αυξάνουν τον κίνδυνο εμφάνισης της IPF.[18] Το κάπνισμα τσιγάρων είναι ο πιο γνωστός και πιο αποδεκτός παράγοντας κινδύνου για την IPF και αυξάνει περίπου στο διπλάσιο τον κίνδυνο της IPF.[18] Άλλες περιβαλλοντικές και επαγγελματικές εκθέσεις όπως η έκθεση σε σκόνη μετάλλου, σκόνη ξύλου, σκόνη άνθρακα, πυρίτιο, σκόνη πέτρας, βιολογικές σκόνες οι οποίες προέρχονται από σκόνες χόρτων ή σπορίων μούχλας ή άλλων γεωργικών προϊόντων και επαγγελμάτων τα οποία σχετίζονται με την γεωργία / κτηνοτροφία έχουν δείξει ότι αυξάνουν τον κίνδυνο για την IPF.[18] Υπάρχουν κάποιες ενδείξεις ότι οι ιογενείς λοιμώξεις μπορεί να σχετίζονται με την ιδιοπαθή πνευμονική ίνωση και άλλες ινωτικές πνευμονικές παθήσεις.
Παθογένεια[Επεξεργασία | επεξεργασία κώδικα]

Παρά την εκτεταμένη έρευνα, τα αίτια της IPF παραμένουν άγνωστα.[3] Η ίνωση της IPF έχει συνδεθεί με το κάπνισμα τσιγάρων, περιβαλλοντικούς παράγοντες (π.χ. επαγγελματική έκθεση σε αέρια, καπνό, χημικές ουσίες ή σκόνες), άλλες παθήσεις όπως την γαστροοισοφαγική παλινδρόμηση (GERD) ή την γενετική προδιάθεση (οικογενή IPF). Ωστόσο, κανένας από αυτούς δεν υπάρχει σε όλα τα άτομα με IPF και συνεπώς δεν παρέχει μια πλήρως ικανοποιητική εξήγηση για την ασθένεια.[3][19]
Η IPF πιστεύεται ότι είναι το αποτέλεσμα μίας ανώμαλης διαδικασίας επούλωσης τραύματος η οποία περιλαμβάνει / προκαλεί ανώμαλη και υπερβολική απόθεση κολλαγόνου (ίνωση) στο πνευμονικό διάμεσο με ελάχιστη σχετιζόμενη φλεγμονή.[20]
Υποτίθεται ότι η αρχική ή επαναλαμβανόμενη βλάβη στην IPF απαντάται στα πνευμονικά κύτταρα, τα οποία ονομάζονται κυψελιδικά επιθηλιακά κύτταρα (AEC)[Σημ. 7] (AEC, πνευμονοκύτταρα), τα οποία καλύπτουν την πλειονότητα της κυψελιδικής επιφάνειας.[21] Όταν τα AEC τύπου Ι υποστούν βλάβη ή έχουν απολεσθεί, θεωρείται ότι τα AEC τύπου ΙΙ υφίστανται πολλαπλασιασμό ώστε να καλύψουν τις εκτεθειμένες μεμβράνες της βάσης. Κατά την κανονική αποκατάσταση, οι υπερπλαστικοί τύποι II των AEC αποθνήσκουν και τα υπόλοιπα κύτταρα εξαπλώνονται και υφίστανται διαδικασία διαφοροποίησης για να γίνουν AEC τύπου Ι. Κάτω από παθολογικές καταστάσεις και την παρουσία του μετατρεπτικού αυξητικού παράγοντα βήτα (TGFβ),[Σημ. 8] ινοβλάστες συσσωρεύονται σε αυτές τις περιοχές βλάβης και διαφοροποιούνται σε μυοϊνοβλάστες οι οποίοι εκκρίνουν κολλαγόνο και άλλες πρωτεΐνες.[21] Κατά το παρελθόν, θεωρείτο ότι η φλεγμονή ήταν το πρώτο γεγονός στην έναρξη των ουλών του ιστού των πνευμόνων. Ωστόσο, σύμφωνα με τα πιο πρόσφατα ευρήματα, η ανάπτυξη των ινοβλαστικών εστιών προηγείται της συσσώρευσης των φλεγμονωδών κυττάρων και της επακόλουθης εναπόθεσης κολλαγόνου.[22] Αυτό το παθογενετικό μοντέλο υποστηρίζεται έμμεσα από τα κλινικά χαρακτηριστικά της IPF, συμπεριλαμβανομένης μιας ύπουλης εκδήλωσης, εξέλιξης κατά τη διάρκεια αρκετών ετών, σχετικά σπάνιων έντονων παροξύνσεων και μη ανταπόκρισης στην ανοσοκατασταλτική θεραπεία.[20][23] Ορισμένες θεραπείες οι οποίες στοχεύουν την ενεργοποίηση ινοβλάστης ή τη σύνθεση εξωκυτταρικής μήτρας, βρίσκονται σήμερα σε πρώιμο έλεγχο ή εξετάζονται για αξιοποίηση. Η οικογενής IPF αντιπροσωπεύει λιγότερο από 5% του συνόλου των ασθενών με IPF και είναι κλινικά και ιστολογικά αδιαχώριστη από τη σποραδική IPF.[3] Οι γενετικές ενώσεις περιλαμβάνουν μεταλλάξεις σε πρωτεΐνες πνευμονικών επιφανειοδραστικών ουσιών Α1, Α2, C (SFTPA1, SFTPA2B) και μουκίνης (MUC5B).[24] Μια αξιοσημείωτη πτυχή της παραλλαγής MUC5B είναι η υψηλή συχνότητα ανίχνευσής της, καθώς βρίσκεται στο 20% περίπου των ατόμων με καταγωγή από τη Βόρεια και τη Δυτική Ευρώπη και στο 19% του πληθυσμού του Framingham στη Μελέτη Καρδίας.[25] Οι μεταλλάξεις σε γονίδια ανθρώπινης τελομεράσης σχετίζονται επίσης με την οικογενή πνευμονική ίνωση και σε μερικούς ασθενείς με σποραδική IPF (π.χ. τα γονίδια TERT, TERC).[24] Πρόσφατα έχει περιγραφεί σε μια οικογένεια με IPF, η δυσσερίνη (DKC1), μια μεταλλαγμένη με Χ μετάλλαξη σε ένα τρίτο γονίδιο που σχετίζεται με την τελομεράση.[26]
Διάγνωση[Επεξεργασία | επεξεργασία κώδικα]
Μια πρωτύτερη διάγνωση της IPF αποτελεί αναγκαία προϋπόθεση για την αρχύτερη θεραπεία και ενδεχομένως, τη βελτίωση της μακροπρόθεσμης κλινικής έκβασης αυτής της προοδευτικής και τελικά θανατηφόρου νόσου.[3] Εάν υπάρχει υποψία για IPF, η διάγνωση μπορεί να είναι πρόκληση, αλλά μια διεπιστημονική προσέγγιση η οποία περιλαμβάνει πνευμονολόγο, ακτινολόγο και εμπειρογνώμονα παθολόγο στην διάμεση πνευμονοπάθεια έχει δείξει ότι βελτιώνει την ακρίβεια της διάγνωσης της IPF.[3][27][28]
Μία διεπιστημονική δήλωση συναίνεσης για τις Ιδιοπαθείς διάμεσες πνευμονίες που δημοσιεύτηκαν από τις Αμερικανική Θωρακική Εταιρεία (ATS)[Σημ. 9] και Ευρωπαϊκή Αναπνευστική Εταιρεία (ERS)[Σημ. 10] το 2000, πρότειναν συγκεκριμένα σημαντικά και δευτερεύοντα κριτήρια για τον καθορισμό της διάγνωσης της IPF.[3] Ωστόσο, το 2011, νέα απλουστευμένα και ενημερωμένα κριτήρια για τη διάγνωση και τη διαχείριση της IPF δημοσιεύθηκαν από τις ATS, ERS, μαζί με την Ιαπωνική Αναπνευστική Εταιρεία (JRS)[Σημ. 11] και τη Λατινοαμερικανική Θωρακική Εταιρεία (ALAT).[Σημ. 12][3] Επί του παρόντος, η διάγνωση της IPF απαιτεί:
- Τον αποκλεισμό των γνωστών αιτιών διάμεσης πνευμονικής νόσου (ILD), π.χ. οικιακών και επαγγελματικών περιβαλλοντικών εκθέσεων, διαταραχών συνδετικού ιστού ή έκθεσης / τοξικότητας φαρμάκου
- Την παρουσία ενός τυπικού ραδιολογικού σχεδίου συνήθους διάμεσης πνευμονίας (UIP)[Σημ. 13] στην ψηφιακή τομογραφία υψηλής ανάλυσης (HRCT).
Στο σωστό κλινικό περιβάλλον, είναι δυνατόν να γίνει η διάγνωση της IPF μόνο από HRCT, αποφεύγοντας την ανάγκη για χειρουργική βιοψία πνευμόνων.[3][13]
Η αναγνώριση της IPF στην κλινική πρακτική μπορεί να είναι πρόκληση, καθώς τα συμπτώματα εμφανίζονται συχνά παρόμοια με εκείνα των πιο κοινών ασθενειών, όπως το άσθμα, η χρόνια αποφρακτική πνευμονοπάθεια (ΧΑΠ)[Σημ. 14] και η συμφορητική καρδιακή ανεπάρκεια (www.diagnoseipf.com). Το βασικό ζήτημα το οποίο αντιμετωπίζουν οι κλινικοί ιατροί είναι το κατά πόσον το ιστορικό, τα συμπτώματα ή τα σημεία, η ακτινολογία και ο έλεγχος της πνευμονικής λειτουργίας είναι συλλογικά συμβατά με τη διάγνωση της IPF ή αν τα ευρήματα οφείλονται σε μια άλλη διαδικασία. Εδώ και καιρό, αναγνωρίζεται ότι οι ασθενείς με διάμεση πνευμονική νόσο (ILD), οι οποίοι σχετίζονται με την έκθεση σε αμίαντο, φάρμακα (όπως χημειοθεραπευτικοί παράγοντες ή νιτροφουραντοϊνη), ρευματοειδή αρθρίτιδα και σκληροδερμία / συστημική σκλήρυνση μπορεί να είναι δύσκολο να ξεχωρίσουν από την IPF. Άλλες διαφορικές διαγνωστικές θεωρήσεις περιλαμβάνουν διάμεση πνευμονοπάθεια η οποία σχετίζεται με μικτή ασθένεια συνδετικού ιστού, προχωρημένη σαρκοείδωση, χρόνια πνευμονίτιδα υπερευαισθησίας, πνευμονική ιστιοκυττάρωση Langerhan και πνευμονική βλάβη που προκαλείται από την ακτινοβολία.[3][13]
Ταξινόμηση[Επεξεργασία | επεξεργασία κώδικα]

Η ιδιοπαθής πνευμονική ίνωση (IPF) ανήκει σε μια μεγάλη ομάδα με περισσότερες από 200 πνευμονοπάθειες οι οποίες είναι γνωστές ως διάμεσες πνευμονικές νόσοι (ILD), οι οποίες χαρακτηρίζονται από την εμπλοκή του ενδιάμεσου πνεύμονα,[13] του ιστού ανάμεσα στους αερόσακους του πνεύμονα. Η IPF είναι μια συγκεκριμένη παρουσίαση της ιδιοπαθούς διάμεσης πνευμονίας (IIP),[Σημ. 15] η οποία με τη σειρά της είναι ένας τύπος ILD, επίσης γνωστή ως διάχυτη παρεγχυματική πνευμονική νόσος (DPLD).[Σημ. 16]
Το 2002 η κατάταξη των IIP από τις Αμερικανική Θωρακική Εταιρεία (ATS) και Ευρωπαϊκή Αναπνευστική Εταιρεία (ERS) ενημερώθηκε το 2013.[13] Σε αυτή τη νέα ταξινόμηση υπάρχουν τρεις κύριες κατηγορίες ιδιοπαθών διάμεσων πνευμονιών (IIP): οι μείζονες IIP, οι σπάνιες IIP και οι μη ταξινομημένες IIP. Οι μείζονες IIP ομαδοποιούνται στις χρόνιες ινώδεις IP (αυτή περιλαμβάνει την IPF και τη μη εξειδικευμένη διάμεση πνευμονία (NSIP)·[Σημ. 17] IP που σχετίζονται με το κάπνισμα (δηλαδή αναπνευστική βρογχιολίτιδα-διάμεση πνευμονική νόσο (RB-ILD)·[Σημ. 18] και αποφρακτική διάμεση πνευμονία (DIP)·[Σημ. 19] και οξείες / υποξείες IP (δηλαδή κρυπτογονική πνευμονία οργάνωσης (COP))[Σημ. 20] και οξεία διάμεση πνευμονία (AIP).[Σημ. 21][13]
Η διάγνωση των IIP απαιτεί τον αποκλεισμό γνωστών αιτιών της ILD. Παραδείγματα ILD γνωστής αιτίας, περιλαμβάνουν πνευμονίτιδα υπερευαισθησίας, πνευμονική ιστιοκυττάρωση κυττάρων Langerhan, αμιάντωση και αγγειακή νόσο κολλαγόνου. Ωστόσο, αυτές οι διαταραχές επηρεάζουν συχνά όχι μόνο το ενδιάμεσο, αλλά και τους εναέριους χώρους, τους περιφερειακούς αεραγωγούς και τα αιμοφόρα αγγεία.[13]
Ακτινολογία[Επεξεργασία | επεξεργασία κώδικα]
Οι ακτινογραφίες θώρακος είναι χρήσιμες στη ρουτίνα παρακολούθησης των ασθενών με IPF. Οι απλές ακτινογραφίες στο θώρακα δυστυχώς δεν είναι διαγνωστικές, αλλά μπορούν να αποκαλύψουν μειωμένους όγκους πνευμόνων, τυπικά με προεξέχουσες διασωματικές ενδιάμεσες σημάνσεις κοντά στις βάσεις των πνευμόνων.[3]

Η ακτινολογική αξιολόγηση μέσω ψηφιακής τομογραφίας υψηλής ανάλυσης (HRCT) αποτελεί βασικό σημείο της διαγνωστικής οδού στην IPF. Η ψηφιακή τομογραφία υψηλής ανάλυσης (HRCT) διεξάγεται με τη χρήση συμβατικού σαρωτή αξονικού τομογράφου χωρίς ένεση παραγόντων αντίθεσης. Οι φέτες αξιολόγησης είναι πολύ λεπτές, 1–2 mm.
Η τυπική ψηφιακή τομογραφία υψηλής ανάλυσης (HRCT) ενός στήθους με IPF καταδεικνύει ινωτικές αλλαγές και στους δύο πνεύμονες, με προτίμηση για τις βάσεις και την περιφέρεια. Σύμφωνα με τις κοινές κατευθυντήριες οδηγίες του 2011, από τους ATS / ERS / JRS / ALAT, η HRCT είναι ένα βασικό συστατικό της διαγνωστικής οδού στην IPF η οποία δύναται να αναγνωρίσει τη συνήθη διάμεση πνευμονία (UIP) με την παρουσία του:[3]
- Δικτυωτές αδιαφάνειες, οι οποίες συχνά σχετίζονται με την βρογχιεκτασία έλξης
- Κυψελίδες οι οποίες εκδηλώνονται ως συστάδες κυστικών θυλάκων αέρα, συνήθως συγκρίσιμων διαμετρημάτων (3-10 mm), αλλά περιστασιακά μεγάλες. Συνήθως υπο-πλευρικές και χαρακτηρίζονται από καλά καθορισμένα τοιχώματα και διατίθεται σε τουλάχιστον δύο σειρές. Γενικώς, μία σειρά από κύστεις δεν επαρκεί για τον ορισμό της κυψελίδας
- Οι αδιαφάνειες εδάφους-υάλου είναι κοινές αλλά λιγότερο εκτενείς απ' ότι οι δικτυωτές
- Η κατανομή χαρακτηριστικά είναι βασική και περιφερική, αν και συχνά ανομοιόμορφη.

Ιστολογία[Επεξεργασία | επεξεργασία κώδικα]
Σύμφωνα με ενημερωμένες οδηγίες του 2011, ελλείψει ενός τυπικού προτύπου συνήθους διάμεσης πνευμονίας (UIP) σε ψηφιακή τομογραφία υψηλής ανάλυσης (HRCT), για την ασφαλή διάγνωση απαιτείται χειρουργική βιοψία πνευμόνων.[3]
Τα ιστολογικά δείγματα για τη διάγνωση του IPF πρέπει να ληφθούν από τουλάχιστον τρία διαφορετικά σημεία και να είναι αρκετά μεγάλα ώστε ο παθολόγος να μπορεί να σχολιάσει την υποκείμενη αρχιτεκτονική του πνεύμονα. Μικρές βιοψίες, όπως εκείνες οι οποίες λαμβάνονται μέσω διαβρογχιακής βιοψίας πνευμόνων (που εκτελούνται κατά τη διάρκεια της βρογχοσκόπησης), συνήθως δεν επαρκούν για το σκοπό αυτό. Ως εκ τούτου, συνήθως είναι απαραίτητες μεγαλύτερες βιοψίες οι οποίες λαμβάνονται χειρουργικά μέσω θωρακοτομής ή θωρακοσκόπησης.[3][13]
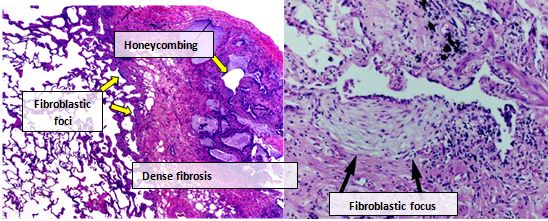
Ο ιστός των πνευμόνων από άτομα με IPF, συνήθως παρουσιάζει ένα χαρακτηριστικό πρότυπο ιστοπαθολογικό UIP και ως εκ τούτου είναι το παθολογικό αντίστοιχο της IPF.[3][30] Παρόλο που μια παθολογική διάγνωση της UIP συχνά αντιστοιχεί σε μια κλινική διάγνωση της IPF, ιστολογική μορφή της UIP μπορεί να παρατηρηθεί και σε άλλες ασθένειες και ίνωση γνωστής προέλευσης (για παράδειγμα ρευματικές ασθένειες).[1][3] Υπάρχουν τέσσερα βασικά χαρακτηριστικά της UIP, συμπεριλαμβανομένης της διάμεσης ίνωσης σε ένα «πρότυπο μπαλωμάτων», διάμεσων ουλών, αλλαγών κυψελοκηλίδων και εστιών ινοβλαστών.
Οι ινοβλαστικές εστίες είναι πυκνές συλλογές μυοϊνοβλαστών και ουλώδους ιστού και, μαζί με τις κυψελοκηλίδες, είναι τα κύρια παθολογικά ευρήματα που επιτρέπουν τη διάγνωση της UIP.
Βρογχοκυψελιδικό έκπλυμα[Επεξεργασία | επεξεργασία κώδικα]
Το βρογχοκυψελιδικό έκπλυμα (BAL)[Σημ. 22] είναι μια καλά ανεκτή διαγνωστική διαδικασία στην ILD.[14] Οι κυτταρολογικές αναλύσεις (διαφορικός αριθμός κυττάρων) BAL θα πρέπει να λαμβάνεται υπόψη στην αξιολόγηση των ασθενών με IPF κατά την κρίση του θεράποντος ιατρού βάσει της διαθεσιμότητας και της εμπειρίας του ιδρύματός του. Το BAL μπορεί να αποκαλύψει εναλλακτικές ειδικές διαγνώσεις: κακοήθεια, λοιμώξεις, ηωσινοφιλική πνευμονία, ιστιοκυττάρωση Χ ή κυψελιδική πρωτεΐνωση. Στην αξιολόγηση των ασθενών με υποψία IPF, η πιο σημαντική εφαρμογή του BAL είναι η εξαίρεση από άλλες διαγνώσεις. Εμφανή λεμφοκύτταρα (>30%), γενικά, επιτρέπουν την εξαίρεση διάγνωσης της IPF.[31]
Δοκιμασίες πνευμονικής λειτουργίας[Επεξεργασία | επεξεργασία κώδικα]
Η σπιρομέτρηση αποκαλύπτει κλασικά μια μείωση της ζωτικής ικανότητας (VC)[Σημ. 23] είτε με αναλογική μείωση των ροών του αέρα, είτε με αυξημένες ροές αέρα για την παρατηρούμενη ζωτική ικανότητα. Το τελευταίο εύρημα αντανακλά την αυξημένη δυσκαμψία των πνευμόνων (μειωμένη συμμόρφωση των πνευμόνων) που σχετίζεται με πνευμονική ίνωση, η οποία οδηγεί σε αυξημένη ελαστική ανάκρουση των πνευμόνων.[32]
Η μέτρηση των στατικών πνευμονικών όγκων με τη χρήση της πλεγματογραφίας του σώματος ή άλλων τεχνικών αποκαλύπτει τυπικά μειωμένους όγκους πνεύμονα (περιορισμό). Αυτή αντικατοπτρίζει τη δυσκολία που συναντάται στο να φουσκώνει τους ινώδεις πνεύμονες.
Η ικανότητα διάχυσης για το μονοξείδιο του άνθρακα (DLCO)[Σημ. 24] είναι πάντοτε μειωμένη στην IPF και μπορεί να είναι η μόνη ανωμαλία στην ήπια ή έγκαιρη ασθένεια. Η εξασθένησή της στηρίζεται στην τάση των ασθενών με ΙΡΡ να παρουσιάζουν αποκορεσμό οξυγόνου με άσκηση, η οποία μπορεί επίσης να αξιολογηθεί χρησιμοποιώντας τη δοκιμασία των 6 λεπτών βάδισης (6MWT).[Σημ. 25][3]
Όροι όπως «ήπια», «μέτρια» και «σοβαρή» χρησιμοποιούνται μερικές φορές για τη σταδιοποίηση της νόσου και βασίζονται συνήθως στις μετρήσεις δοκιμής της πνευμονικής λειτουργίας.[3] Ωστόσο, δεν υπάρχει σαφής συναίνεση όσον αφορά τη σταδιοποίηση των ασθενών με IPF και ποια είναι τα καλύτερα κριτήρια και οι αξίες που πρέπει να χρησιμοποιηθούν. Η ήπια έως μέτρια IPF χαρακτηρίζεται από τα ακόλουθα λειτουργικά κριτήρια:[33][34][35][36]
- Ενίσχυση ζωτικής ικανότητας (FVC) ≥50%[Σημ. 26]
- DLCO ≥30%
- 6MWT απόσταση ≥150 μέτρων.
Θεραπείες[Επεξεργασία | επεξεργασία κώδικα]
Οι στόχοι της θεραπείας στην IPF είναι ουσιαστικά η μείωση των συμπτωμάτων, η πρόληψη της εξέλιξης της νόσου, η πρόληψη της οξείας παροξύνωσης και η παράταση της επιβίωσης. Η προληπτική φροντίδα (π.χ. εμβολιασμοί) και η θεραπεία με βάση τα συμπτώματα πρέπει να ξεκινούν από ενωρίς σε κάθε ασθενή.[37]
Οξυγονοθεραπεία[Επεξεργασία | επεξεργασία κώδικα]
Στις κατευθυντήριες γραμμές της IPF του 2011, η οξυγονοθεραπεία ή το συμπληρωματικό οξυγόνο για οικιακή χρήση κατέστη μια ισχυρή σύσταση για χρήση στους ασθενείς με σημαντικά χαμηλά επίπεδα οξυγόνου σε κατάσταση ηρεμίας. Παρόλο που δεν έχει αποδειχθεί ότι η οξυγονοθεραπεία βελτιώνει την επιβίωση στο IPF, ορισμένα δεδομένα υποδεικνύουν βελτίωση στη ικανότητα άσκησης.[3][38]
Πνευμονική αποκατάσταση[Επεξεργασία | επεξεργασία κώδικα]
Η κόπωση και η απώλεια μυϊκής μάζας είναι κοινά και δυσάρεστα προβλήματα για τους ασθενείς με IPF. Η πνευμονική αποκατάσταση μπορεί να μετριάσει τα εμφανή συμπτώματα της IPF και να βελτιώσει τη λειτουργική κατάσταση σταθεροποιώντας ή / και αντιστρέφοντας τα εξωπνευμονικά χαρακτηριστικά της νόσου.[39][40] Ο αριθμός των δημοσιευθεισών μελετών σχετικά με το ρόλο της πνευμονικής αποκατάστασης στην ιδιοπαθή πνευμονική ίνωση είναι μικρός, αλλά οι περισσότερες από αυτές τις μελέτες έχουν βρει σημαντικές βραχυπρόθεσμες βελτιώσεις στη λειτουργική ανοχή, στην άσκηση, στην ποιότητα ζωής και στη δύσπνοια κατά την προσπάθεια.[41] Τα τυπικά προγράμματα αποκατάστασης περιλαμβάνουν την άσκηση, τη διατροφική διαφοροποίηση, την επαγγελματική θεραπεία, την εκπαίδευση και την ψυχοκοινωνική συμβουλευτική. Στην πρόσφατη φάση της νόσου, οι ασθενείς με ΙΡΙ τείνουν να διακόπτουν τη σωματική τους δραστηριότητα λόγω της αύξησης της δύσπνοιας. Όποτε είναι δυνατόν, αυτό πρέπει να αποθαρρύνεται.
Θεραπευτική αγωγή[Επεξεργασία | επεξεργασία κώδικα]
Ορισμένες θεραπείες έχουν στο παρελθόν διερευνηθεί για την IPF, συμπεριλαμβανομένων των interferon gamma-1β,[42] bosentan,[43] ambrisentan[44] και αντιπηκτικών,[45] αλλά αυτές δεν θεωρούνται πλέον αποτελεσματικές θεραπευτικές επιλογές. Πολλές από αυτές τις προηγούμενες μελέτες βασίστηκαν στην υπόθεση ότι η IPF είναι μια φλεγμονώδης διαταραχή.
Πιρφενιδόνη (Pirfenidone)[Επεξεργασία | επεξεργασία κώδικα]
Μια αναθεώρηση του Cochrane η οποία συγκρίνει την πιρφενιδόνη[Σημ. 27] με εικονικό φάρμακο, βρήκε μειωμένο κίνδυνο εξέλιξης της νόσου κατά 30%.[46] Η FVC ή η VC επίσης βελτιώθηκαν, ακόμη και αν μια ήπια επιβράδυνση στην πτώση της FVC θα μπορούσε να αποδειχθεί μόνο σε μία από τις δύο δοκιμές CAPACITY.[33] Μια τρίτη μελέτη, η οποία ολοκληρώθηκε το 2014, διαπίστωσε μειωμένη μείωση της πνευμονικής λειτουργίας και της εξέλιξης της νόσου της IPF.[35] Τα δεδομένα από τη μελέτη ASCEND συγκεντρώθηκαν επίσης με δεδομένα από τις δύο μελέτες CAPACITY σε μια προκαθορισμένη ανάλυση που έδειξε ότι η πιρφενιδόνη μείωσε σχεδόν κατά 50% τον κίνδυνο θανάτου σε διάστημα ενός έτους θεραπείας.[35]
Ν-ακετυλοκυστεΐνη και τριπλή θεραπεία[Επεξεργασία | επεξεργασία κώδικα]
Η Ν-ακετυλοκυστεΐνη (NAC)[Σημ. 28] είναι ένας πρόδρομος της γλουταθειόνης, ενός αντιοξειδωτικού. Έχει υποτεθεί ότι η θεραπεία με υψηλές δόσεις NAC μπορεί να επιδιορθώσει μια ανισορροπία οξειδωτικού-αντιοξειδωτικού που εμφανίζεται στον πνευμονικό ιστό των ασθενών με IPF. Στην πρώτη κλινική δοκιμή 180 ασθενών (IFIGENIA), η NAC παρουσιάστηκε σε προηγούμενη μελέτη για τη μείωση της πτώσης των VC και DLCO σε 12 μήνες παρακολούθησης όταν χρησιμοποιήθηκε σε συνδυασμό με πρεδνιζόνη και αζαθειοπρίνη (τριπλή θεραπεία).[47]
Πιο πρόσφατα, μια μεγάλη, τυχαιοποιημένη, ελεγχόμενη δοκιμή (PANTHER-IPF) πραγματοποιήθηκε από το Εθνικό Ινστιτούτο Υγείας (NIH)[Σημ. 29] στις ΗΠΑ για να αξιολογηθεί η τριπλή θεραπεία και η μονοθεραπεία NAC σε ασθενείς με IPF. Αυτή η μελέτη διαπίστωσε ότι ο συνδυασμός πρεδνιζόνης, αζαθειοπρίνης και NAC αύξησε τον κίνδυνο θανάτου και νοσηλείας[48] και το NIH ανακοίνωσε το 2012 ότι ο βραχίονας τριπλής θεραπείας της μελέτης PANTHER-IPF είχε λήξει ενωρίς.[49]
Η μελέτη αυτή αξιολόγησε επίσης μόνο τη NAC και τα αποτελέσματα για αυτό το σκέλος της μελέτης δημοσιεύθηκαν το Μάιο του 2014 στο New England Journal of Medicine, καταλήγοντας ότι "σε σύγκριση με το εικονικό φάρμακο, η ακετυλοκυστεΐνη δεν προσέφερε κανένα σημαντικό όφελος σε σχέση με τη συντήρηση της FVC σε ασθενείς με ιδιοπαθή πνευμονική ίνωση με ήπια έως μέτρια εξασθένηση της πνευμονικής λειτουργίας".[50]
Νιντεδανίμπη (Nintedanib)[Επεξεργασία | επεξεργασία κώδικα]
Η νιντεδανίμπη[Σημ. 30] είναι ένας διερευνητικός αναστολέας, χορηγούμενος στοματικά, τριπλής αγγειοκινάσης, ο οποίος στοχεύει υποδοχέα κινάσες τυροσίνης που εμπλέκονται στη ρύθμιση της αγγειογένεσης: υποδοχέα αυξητικού παράγοντα ινοβλαστών (FGFR),[Σημ. 31] υποδοχέα αυξητικού παράγοντα από αιμοπετάλια (PDGFR)[Σημ. 32] και υποδοχέα αγγειακού ενδοθηλιακού αυξητικού παράγοντα (VEGFR),[Σημ. 33][51] που έχουν επίσης εμπλακεί στην παθογένεση της ίνωσης και της ΙΡΡ. Και στις δύο φάσης ΙΙΙ δοκιμές, η νιντεδανίμπη μείωσε σημαντικά την πτώση της πνευμονικής λειτουργίας κατά περίπου 50% σε διάστημα ενός έτους.[36]
Μεταμόσχευση πνευμόνων[Επεξεργασία | επεξεργασία κώδικα]
Η μεταμόσχευση πνευμόνων μπορεί να είναι κατάλληλη για εκείνους τους ασθενείς που είναι φυσικά επιλέξιμοι για να υποβληθούν σε μια σημαντική μεταμόσχευση. Στους ασθενείς με IPF, η μεταμόσχευση πνευμόνων έχει αποδειχθεί ότι μειώνει τον κίνδυνο θανάτου κατά 75% σε σύγκριση με τους ασθενείς οι οποίοι παραμένουν στην κατάσταση αναμονής.[52] Από την εισαγωγή της βαθμολογίας κατανομής των πνευμόνων (LAS),[Σημ. 34] η οποία δίνει προτεραιότητα στις υποψήφιες μεταμοσχεύσεις με βάση την πιθανότητα επιβίωσης, η IPF έχει καταστεί στις ΗΠΑ η πιο κοινή ένδειξη για τη μεταμόσχευση πνευμόνων.[39]
Συμπτωματικοί ασθενείς με IPF ηλικίας κάτω των 65 ετών και με δείκτη μάζας σώματος (ΔΜΣ) ≤26 kg/m², θα πρέπει να τους γίνεται αναφορά για μεταμόσχευση πνευμόνων αλλά δεν υπάρχουν σαφή δεδομένα για τον ακριβή χρονισμό της LTx. Αν και αμφιλεγόμενα, τα πιο πρόσφατα δεδομένα υποδεικνύουν ότι σε ασθενείς με IPF, η αμφίπλευρη μεταμόσχευση πνευμόνων είναι ανώτερη από τη μονή μεταμόσχευση πνεύμονα.[53] Τα πενταετή ποσοστά επιβίωσης μετά τη μεταμόσχευση πνευμόνων στην IPF εκτιμώνται μεταξύ 50 και 56%.[3][54][55]
Καταπραϋντική φροντίδα[Επεξεργασία | επεξεργασία κώδικα]
Η καταπραϋντική φροντίδα επικεντρώνεται στη μείωση των συμπτωμάτων και στη βελτίωση της άνεσης των ασθενών παρά στην θεραπεία της νόσου. Αυτή δύναται να περιλαμβάνει τη θεραπεία των επιδεινούμενων συμπτωμάτων με τη χρήση χρόνιων οπιοειδών για σοβαρή δύσπνοια και βήχα. Περαιτέρω, η οξυγονοθεραπεία μπορεί να είναι χρήσιμη για την ανακούφιση της δύσπνοιας σε ασθενείς με υποξαιμία.
Η καταπραϋντική φροντίδα περιλαμβάνει επίσης την ανακούφιση των σωματικών και συναισθηματικών πόνων και την ψυχοκοινωνική υποστήριξη των ασθενών και φροντιστών.[3] Με την εξέλιξη της νόσου, οι ασθενείς μπορεί να αισθανθούν φόβο, άγχος και κατάθλιψη, ως εκ τούτου δε, θα πρέπει να λαμβάνεται υπόψη η ψυχολογική συμβουλή. Σε μια πρόσφατη μελέτη των εξωτερικών ασθενών με ILD, συμπεριλαμβανομένης της IPF, της κατάθλιψης, της λειτουργικής κατάστασης (όπως εκτιμήθηκε με τη δοκιμή βάδισης), καθώς και της πνευμονικής λειτουργίας, όλα συνέβαλαν στη σοβαρότητα της δύσπνοιας.[56]
Σε επιλεγμένες περιπτώσεις ιδιαίτερα σοβαρής δύσπνοιας θα μπορούσε να ληφθεί υπόψη η μορφίνη. Μπορεί να μειώσει τη δύσπνοια, το άγχος και το βήχα χωρίς σημαντική μείωση του κορεσμού οξυγόνου.[57]
Παρακολούθηση[Επεξεργασία | επεξεργασία κώδικα]
Η IPF συχνά διαγράφεται λανθασμένα, τουλάχιστον μέχρις ότου φυσιολογικά δεδομένα και / ή δεδομένα απεικόνισης υποδηλώνουν την παρουσία μιας ILD η οποία οδηγεί σε καθυστέρηση στην πρόσβαση στην κατάλληλη περίθαλψη[39] Λαμβάνοντας υπόψη ότι η IPF είναι ασθένεια με μέση επιβίωση τριών ετών μετά τη διάγνωση, θα πρέπει να εξεταστεί η έγκαιρη παραπομπή σε κέντρο με συγκεκριμένη εμπειρογνωμοσύνη για οποιονδήποτε ασθενή με υποψία ή γνωστή ILD. Με βάση τη σύνθετη διαφορική διάγνωση, η διεπιστημονική συζήτηση μεταξύ πνευμονολόγων, ακτινολόγων και παθολόγων που έχουν εμπειρία στη διάγνωση της ILD είναι υψίστης σημασίας για την ακριβή διάγνωση.[3]
Μετά τη διάγνωση της IPF και την κατάλληλη επιλογή θεραπείας σύμφωνα με τα συμπτώματα και το στάδιο της νόσου, θα πρέπει να εφαρμοστεί στενή παρακολούθηση. Λόγω της μεγάλης μεταβλητής πορείας της νόσου, η υψηλότερη συχνότητα εμφάνισης επιπλοκών, όπως ο καρκίνος του πνεύμονα (έως και το 25% των ασθενών έχει αναφερθεί στην IPF), αποτελεί αξιολόγηση ρουτίνας κάθε 3 έως 6 μήνες, συμπεριλαμβανομένης της σπιρομέτρησης (πλεισιοσματογραφία του σώματος), ακτινογραφίες θώρακα, 6MWT, αξιολόγηση της δύσπνοιας, ποιότητα ζωής, η απαίτηση οξυγόνου είναι υποχρεωτική.
Επιπλέον, η αυξανόμενη συνειδητοποίηση των επιπλοκών και των κοινών συναφών συνθηκών που συχνά σχετίζονται με την IPF απαιτεί μια συστηματική αξιολόγηση των συν-νοσηροτήτων, οι περισσότερες από τις οποίες αντικατοπτρίζουν απλώς τις ταυτόχρονες ασθένειες της γήρανσης και τα φάρμακα με την αλληλεπίδραση και τις παρενέργειες τους.
Οξείες παροξύνσεις[Επεξεργασία | επεξεργασία κώδικα]
Οι οξείες παροξύνσεις της IPF (AE-IPF)[Σημ. 35] ορίζονται ως ανεξήγητη επιδείνωση ή ανάπτυξη δύσπνοιας εντός 30 ημερών με νέα ραδιολογικά διηθήματα σε ανωμαλία HRCT η οποία συχνά τοποθετείται σε φόντο που είναι σύμφωνη με το πρότυπο UIP. Η ετήσια επίπτωση της AE-IPF είναι μεταξύ 10 και 15% όλων των ασθενών. Η πρόγνωση της AE-IPF είναι χαμηλή, με τη θνησιμότητα να κυμαίνεται από 78% έως 96%.[58] Άλλες αιτίες της ΑΕ-IPF όπως η πνευμονική εμβολή, η συμφορητική καρδιακή ανεπάρκεια, ο πνευμοθώρακας ή η μόλυνση, θα πρέπει να αποκλείονται. Η πνευμονική μόλυνση πρέπει να αποκλειστεί με ενδοτραχειακή αναρρόφηση ή BAL.
Πολλοί ασθενείς που υποφέρουν από οξεία αλλοίωση απαιτούν αντιμετώπιση εντατικής θεραπείας, ιδιαίτερα όταν η αναπνευστική ανεπάρκεια σχετίζεται με αιμοδυναμική αστάθεια, σημαντικές συν-νοσηρότητες ή σοβαρή υποξαιμία.[59] Ωστόσο, η θνησιμότητα κατά τη διάρκεια της νοσηλείας είναι υψηλή.[58] Ο μηχανικός αερισμός θα πρέπει να εισάγεται μόνο αφού προσεγγισθεί προσεκτικά η μακροπρόθεσμη πρόγνωση του ασθενούς και, όπου είναι δυνατόν, οι επιθυμίες του ασθενούς. Ωστόσο, οι τρέχουσες κατευθυντήριες οδηγίες αποθαρρύνουν τη χρήση μηχανικού αερισμού σε ασθενείς με αναπνευστική ανεπάρκεια δευτερεύουσα προς την IPF.[3]
Πρόγνωση[Επεξεργασία | επεξεργασία κώδικα]
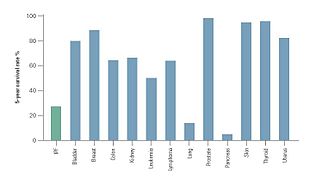
Η κλινική πορεία της IPF μπορεί να είναι απρόβλεπτη.[3][60][61] Η πρόοδος της IPF συνδέεται με έναν υπολογιζόμενο διάμεσο χρόνο επιβίωσης 2 έως 5 ετών μετά τη διάγνωση.[1][3] Η 5-ετής επιβίωση για την IPF κυμαίνεται μεταξύ 20–40%,[61] ποσοστό θνησιμότητας υψηλότερο από αυτό ενός αριθμού κακοηθειών, συμπεριλαμβανομένων του καρκίνου του παχέος εντέρου, του πολλαπλού μυελώματος[Σημ. 36] και του καρκίνου της ουροδόχου κύστης.[60][61]
Πρόσφατα έχει προταθεί ένα πολυδιάστατο σύστημα δείκτη και στάσης για την πρόβλεψη της θνησιμότητας στην IPF.[62] Το όνομα του δείκτη είναι GAP και βασίζεται στο φύλο [G], στην ηλικία [Α] και στις δύο μεταβλητές φυσιολογίας του πνεύμονα [P] (FVC και DLCO που συνήθως μετριούνται στην κλινική πρακτική για την πρόβλεψη της θνησιμότητας στην IPF. Το υψηλότερο στάδιο του GAP (στάδιο ΙΙΙ) έχει συσχετιστεί με κίνδυνο θνησιμότητας κατά 39% σε 1 χρόνο.[62] Αυτό το μοντέλο έχει επίσης αξιολογηθεί στις IPF και τις άλλες ILD και έχει δείξει καλές επιδόσεις στην πρόβλεψη της θνησιμότητας σε όλους τους κύριους υποτύπους της ILD. Ένας τροποποιημένος δείκτης ILD-GAP έχει αναπτυχθεί για εφαρμογή σε υποτύπους ILD για την παροχή εκτιμήσεων επιβίωσης για συγκεκριμένες νόσους.[63] Σε ασθενείς με IPF, η συνολική θνησιμότητα σε ποσοστό 5 ετών είναι υψηλή, αλλά ο ετήσιος ρυθμός θνησιμότητας όλων των αιτιών σε ασθενείς με ήπια έως μέτρια πνευμονική εξασθένιση είναι σχετικά χαμηλός. Αυτός είναι ο λόγος για τον οποίο η αλλαγή στη λειτουργία των πνευμόνων (FVC) συνήθως μετριέται σε μονοετείς κλινικές δοκιμές θεραπευτικών αγωγών IPF παρά σε επιβίωση.[64]
Εκτός από τις κλινικές και φυσιολογικές παραμέτρους για την πρόβλεψη της ταχείας εξέλιξης των ασθενών με IPF, τα γενετικά και μοριακά χαρακτηριστικά σχετίζονται επίσης με τη θνησιμότητα από την IPF. Παραδείγματος χάριν, έχει αποδειχθεί ότι οι ασθενείς με ΙΡΡ οι οποίοι έχουν έναν συγκεκριμένο γονότυπο στον πολυμορφισμό γονιδίου MUC5B γονιδίου βλεννίνης (βλέπε παραπάνω) παρουσιάζουν βραδύτερη μείωση της FVC και σημαντικά βελτιωμένη επιβίωση.[65][66] Ακόμη και αν τα δεδομένα αυτά είναι ενδιαφέροντα από επιστημονική άποψη, η εφαρμογή στην κλινική ρουτίνα ενός προγνωστικού μοντέλου που βασίζεται σε συγκεκριμένους γονότυπους δεν είναι ακόμη δυνατή.
Επιδημιολογία[Επεξεργασία | επεξεργασία κώδικα]
Παρόλο που είναι σπάνια, η IPF είναι η πιο κοινή μορφή της IIP.[13] Η επικράτηση της IPF εκτιμήθηκε μεταξύ 14,0 και 42,7 ανά 100.000 άτομα, βάσει ανάλυσης των στοιχείων των ισχυρισμών περί υγειονομικής περίθαλψης των ΗΠΑ, με παραλλαγές ανάλογα με τους ορισμούς των περιπτώσεων που χρησιμοποιήθηκαν σε αυτές τις αναλύσεις.[30][15] Η IPF είναι συχνότερη στους άντρες παρά στις γυναίκες και συνήθως διαγιγνώσκεται σε άτομα άνω των 50 ετών.[3]
Η επίπτωση της IPF είναι δύσκολο να προσδιοριστεί, δεδομένου ότι τα ενιαία διαγνωστικά κριτήρια δεν έχουν εφαρμοστεί με συνέπεια.[3][15] Μια πρόσφατη μελέτη από τις ΗΠΑ, εκτιμά ότι η συχνότητα εμφάνισης της IPF είναι μεταξύ 6,8 και 16,3 ανά 100.000 άτομα. Στις 27 χώρες της Ευρωπαϊκής Ένωσης, μια σειρά πηγών εκτιμά ότι η συχνότητα εμφάνισης είναι 4,6–7,4 άτομα ανά 100.000 κατοίκους,[67][68] γεγονός που υποδηλώνει ότι περίπου 30.000–35.000 νέοι ασθενείς θα διαγνωστούν με IPF κάθε χρόνο.[30][69]
Μια πρόσφατη μονόκεντρη, αναδρομική μελέτη παρατήρησης κοόρτης, συμπεριλαμβάνοντας περιστατικά ασθενών οι οποίοι διαγνώστηκαν με ILD στο Πανεπιστημιακό Νοσοκομείο του Aarhus (Δανία) μεταξύ 2003 και 2009, αποκάλυψε συχνότητα 4,1 ανά 100.000 κατοίκους / έτος για την ILD. Η IPF ήταν η πιο συνηθισμένη διάγνωση (28%), ακολουθούμενη από την ILD σχετιζόμενη με τη νόσο συνδετικού ιστού (14%), την πνευμονίτιδα υπερευαισθησίας (7%) και τη μη ειδική διασωληνωτή πνευμονία (NSIP) (7%). Η επίπτωση της IPF ήταν 1,3 ανά 100.000 κατοίκους / έτος.[70]
Λόγω της ετερογενούς κατανομής της νόσου σε όλες τις ευρωπαϊκές χώρες, τα επιδημιολογικά δεδομένα πρέπει να επικαιροποιηθούν μέσω ενός ευρωπαϊκού μητρώου για την ILD και την IPF.
Άλλα ζώα[Επεξεργασία | επεξεργασία κώδικα]
Η IPF έχει αναγνωριστεί σε διάφορες ράτσες σκύλων και γάτων,[71] και έχει χαρακτηριστεί καλύτερα στα West Highland White Terriers.[72] Οι κτηνιατρικοί ασθενείς με την κατάσταση, μοιράζονται πολλά από τα ίδια κλινικά συμπτώματα με τους ανθρώπινους ομολόγους των, συμπεριλαμβανομένης της προοδευτικής αδιαλλαξίας, τον αυξημένο αναπνευστικό ρυθμό και την ενδεχόμενη αναπνευστική δυσχέρεια.[73] Η πρόγνωση είναι γενικά πτωχή.
Έρευνα[Επεξεργασία | επεξεργασία κώδικα]
Στην κλινική δοκιμή φάσης ΙΙ εξετάζονται επί του παρόντος αρκετοί παράγοντες για την IPF, συμπεριλαμβανομένων των μονοκλωνικών αντισωμάτων simtuzumab, tralokimab, lebrikizumab και FG-3019, ενός ανταγωνιστή υποδοχέα λυσοφωσφατιδικού οξέος (BMS-986020). Μια μελέτη Φάσης ΙΙ του STX-100 είναι επίσης σε εξέλιξη.[74] Αυτά τα μόρια κατευθύνονται εναντίον διαφόρων αυξητικών παραγόντων και κυτοκινών που είναι γνωστό ότι παίζουν ρόλο στον πολλαπλασιασμό, την ενεργοποίηση, τη διαφοροποίηση ή την ακατάλληλη επιβίωση των ινοβλαστών.
Οι έρευνες του πρόδρομου μικροοργανισμού mir-29 σε ποντίκια, έχουν προκαλέσει αντιστροφή της προτρεπόμενης IPF. Το MRG-201 εξετάζεται επί του παρόντος από το 2016, αλλά όχι σε ασθενείς με IPF και δεν έχουν προγραμματιστεί ανθρώπινες δοκιμές για χρήση της IPF από τον Ιανουάριο του 2016.[75]
Οι θεραπείες βλαστοκυττάρων για την IPF [76][77] είναι ένας ενεργός τομέας έρευνας.
Αλλαγές στον τρόπο ζωής[Επεξεργασία | επεξεργασία κώδικα]
Αυτή η πάθηση επιβάλλει αλλαγές στον τρόπο της ζωής, όπως:
- Άμεση διακοπή του καπνίσματος — Δύναται να αυξήσει την αποτελεσματικότητα της φαρμακευτικής αγωγής. Μπορεί να ελαττώσει τον κίνδυνο ορισμένων ασθενειών λ.χ. καρδιακή νόσο, καρκίνο κλπ.[78]
- Λήψη ικανοποιητικής ξεκούρασης — Ένας σύντομος υπνάκος, κατά τη διάρκεια της ημέρας, είναι αναζωογονητικός[78]
- Εξάσκηση τεχνικών ξεκούρασης — Πολλοί, βρίσκουν χρήσιμο το γιόγκα ή / και το διαλογισμό, στη διαχείριση του IPF[78]
- Γίνετε μέλος σε κάποια Ομάδα Υποστήριξης — Συζητώντας με άλλους που έχουν παρόμοιες εμπειρίες, μπορεί να βοηθήσει στην ελάττωση του άγχους και να φέρει παρηγοριά[78]
Διαιτητικές αλλαγές[Επεξεργασία | επεξεργασία κώδικα]
- Γεύματα και σνακ που επιτρέπονται
- Φρούτα και γλυκά
- Υγρά για την αποφυγή της αφυδάτωσης
- Πόση υγρών
- Νερά ή αθλητικά ποτά με ηλεκτρολύτες
- Απλή σόδα όπως την τζιτζιμπίρα
- Κράνμπερι ή χυμό σταφυλιού
- Τσάι χωρίς καφεΐνη[78]
- Πόση υγρών
- Τρόφιμα προς αποφυγή
- Πικάντικα τρόφιμα
- Τροφές με υψηλή περιεκτικότητα σε ίνες
- Τηγανητά ή λιπαρά τρόφιμα
- Αλκοόλ ή καφεΐνη
- Γλυκίσματα χωρίς ζάχαρη, παρασκευασμένα με αλκοόλες σακχάρων όπως ξυλιτόλη
- Γάλα ή γαλακτοκομικά προϊόντα
- Αλμυρά ή γλυκά φαγητά[78]
- Πικάντικα τρόφιμα
Απαιτούμενες ιατρικές εξετάσεις[Επεξεργασία | επεξεργασία κώδικα]
Για την αποδοχή ή μη της αρχικής φαρμακευτικής αγωγής αλλά και για την παρακολούθηση της πορείας της νόσου, απαιτούνται οι παρακάτω εξετάσεις (κατ'ελάχιστον):
- Αιματολογικές
- Γενική Εξέταση Αίματος (αρχικά, μετά από 15 ημέρες, ένα μήνα, ανά μήνα [για τους πρώτους τρεις μήνες], κατόπιν, ανά τρίμηνο και στον χρόνο της νόσου, ανά εξάμηνο)
- Ανοσολογικές εξετάσεις: ANA, ANCA-C, ANCA-P,[Σημ. 37][Σημ. 38][Υποσημ. 1] RA TEST,[Σημ. 39] CCP IgG (μια φορά το χρόνο)
- Σπιρομέτρηση (αρχικά, ανά τρίμηνο και στον χρόνο της νόσου, ανά εξάμηνο)[Σημ. 40][Σημ. 41]
- Αξονική τομογραφία θώρακος (μια φορά το χρόνο)[Σημ. 42][Σημ. 43]
- Triplex καρδίας (αργότερα, στην πορεία της νόσου, συνήθως μια φορά το χρόνο)
Σε κάθε εξέταση (πλην των αιματολογικών), ο ασθενής, υποχρεούται να προσκομίζει και τις τελευταίες του εξετάσεις, ώστε ο εξεταστής ιατρός, να δυνηθεί να συγκρίνει την τελευταία με την τωρινή.
Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
Σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Η νόσος είναι αντιληπτή ή μετρήσιμη, αντιθέτως η ασθένεια (και ο συνοδευόμενος πόνος, ταλαιπωρία ή καταπόνηση) είναι εξαιρετικά ατομική και προσωπική και δεν είναι μετρήσιμη. Π.χ. Νόσοι: νεφρική νόσος, καρδιακή νόσος, ηπατική νόσος κ.ά. Ασθένειες: μετατραυματικό στρες, μεταλόχειος κατάθλιψη κ.ά..[Παρ. Σημ. 1]
- ↑ Η πληκτροδακτυλία (Αγγλικά: clubbing), είναι μια παραμόρφωση των δακτύλων των χεριών ή / και των δακτύλων των ποδιών, η οποία συνδέεται με μια σειρά ασθενειών, κυρίως της καρδιάς και των πνευμόνων. Η πληκτροδακτυλία μπορεί να εμφανισθεί και χωρίς προφανή λόγο, αλλά είναι σπάνια. Η πληκροδακτυλία είναι ένα ανώδυνο πρήξιμο στη βάση των ονύχων και η αιτία του δεν είναι σαφής. Εμφανίζεται σε άτομα με διάφορες θωρακικές και καρδιακές παθήσεις. Ο Ιπποκράτης ήταν ίσως ο πρώτος ο οποίος κατέγραψε την πληκτροδακτυλία ως σημάδι ασθένειας και επομένως το φαινόμενο περιστασιακά ονομάζεται «δάκτυλα του Ιπποκράτη». Δεν υπάρχει ειδική θεραπεία της πληκτροδακτυλίας. Η θεραπεία της υποκείμενης παθολογικής κατάστασης μπορεί να μειώσει την πληκτροδακτυλία ή δυνητικά να την αναστρέψει, εάν γίνει έγκαιρα.[Παρ. Σημ. 2][Παρ. Σημ. 3][Παρ. Σημ. 4][Παρ. Σημ. 5][Παρ. Σημ. 6]
- ↑ Δοθέντος ότι όλες οι παθήσεις που προκαλούν πνευμονική υπέρταση καταλήγουν σε πνευμονική καρδία οι δύο αυτές καταστάσεις θα περιγραφούν από κοινού.[Παρ. Σημ. 7]
- Πνευμονική υπέρταση: Η μέση πίεση στην πνευμονική αρτηρία είναι φυσιολογικά 15mm Hg, για ένα άτομο ευρισκόμενο στο επίπεδο της θαλάσσης. Πιέσεις >25 mm Hg χαρακτηρίζουν την πνευμονική υπέρταση σε ηρεμία ενώ >30mm Hg σε άσκηση.[Παρ. Σημ. 8]
- Πνευμονική καρδία: Ορίζεται η μεταβολή της δομής (υπερτροφία) ή της λειτουργικότητας της δεξιάς κοιλίας που προκαλούνται από πνευμονική υπέρταση συνεπεία παθήσεων των πνευμόνων ή της πνευμονικής αγγειώσεως.[Παρ. Σημ. 9]
- ↑ Διάμεση πνευμονοπάθεια ή διάμεση πνευμονική νόσος και στα Αγγλικά: Interstitial lung disease (ILD).
- ↑ Ειδικότερα για την Ελλάδα, δεν ενδείκνυται το Esbriet (pirfenidone) λόγω της έντονης ηλιοφάνειας που υπάρχει στη χώρα. Αντιθέτως, ενδείκνυται το Ofev (νιντεδανίμπη (nintedanib)), που όμως συνήθως προκαλεί συχνές διάρροιες, οι οποίες όμως προλαμβάνονται με τη λήψη φυσικών αντι-διαρροϊκών όπως του Smecta ή του Tasectan.
- ↑ Ψηφιακή τομογραφία υψηλής ανάλυσης και στα Αγγλικά: High-resolution computed tomography (HRCT).
- ↑ Κυψελιδικά επιθηλιακά κύτταρα και στα Αγγλικά: Alveolar epithelial cells (AEC).
- ↑ Μετατρεπτικός αυξητικός παράγοντας βήτα και στα Αγγλικά: Transforming growth factor beta (TGFβ).
- ↑ Αμερικανική Θωρακική Εταιρεία και στα Αγγλικά: American Thoracic Society (ATS).
- ↑ Ευρωπαϊκή Αναπνευστική Εταιρεία και στα Αγγλικά: European Respiratory Society (ERS).
- ↑ Ιαπωνική Αναπνευστική Εταιρεία και στα Αγγλικά: Japanese Respiratory Society (JRS).
- ↑ Λατινοαμερικανική Θωρακική Εταιρεία και στα Αγγλικά: Latin American Thoracic Association (ALAT).
- ↑ Συνήθης διάμεση πνευμονία και στα Αγγλικά: Usual interstitial pneumonia (UIP).
- ↑ Χρόνια Αποφρακτική Πνευμονοπάθεια και στα Αγγλικά: Chronic Obstructive Pulmonary Disease (COPD).
- ↑ Ιδιοπαθής διάμεση πνευμονία και στα Αγγλικά: Idiopathic interstitial pneumonia (IIP).
- ↑ Διάχυτη παρεγχυματική πνευμονική νόσος και στα Αγγλικά: Diffuse parenchymal lung disease (DPLD).
- ↑ Μη εξειδικευμένη διάμεση πνευμονία και στα Αγγλικά: Non-specific interstitial pneumonia (NSIP).
- ↑ Αναπνευστική βρογχιολίτιδα-διάμεση πνευμονική νόσος και στα Αγγλικά: Respiratory bronchiolitis–interstitial lung disease (RB-ILD).
- ↑ Αποφρακτική διάμεση πνευμονία και στα Αγγλικά: Desquamative interstitial pneumonia (DIP).
- ↑ Κρυπτογονική πνευμονία οργάνωσης και στα Αγγλικά: Cryptogenic organizing pneumonia (COP).
- ↑ Οξεία διάμεση πνευμονία και στα Αγγλικά: Acute interstitial pneumonia (AIP).
- ↑ Βρογχοκυψελιδικό έκπλυμα και στα Αγγλικά: Bronchoalveolar lavage (BAL).
- ↑ Ζωτική Ικανότητα και στα Αγγλικά: Vital Capacity (VC).
- ↑ Ικανότητα διάχυσης για το μονοξείδιο του άνθρακα και στα Αγγλικά: Diffusing capacity for carbon monoxide (DLCO).
- ↑ Δοκιμασία βάδισης 6 λεπτών και στα Αγγλικά: 6 Minute Walking Test (6MWT).
- ↑ Ενίσχυση ζωτικής ικανότητας και στα Αγγλικά: Forced Vital Capacity (FVC).
- ↑ Η Πιρφενιδόνη (Pirfenidone) κυκλοφορεί με την εμπορική ονομασία Esbriet.
- ↑ Ν-ακετυλοκυστεΐνη και στα Αγγλικά: N-Acetylcysteine (NAC).
- ↑ Εθνικό Ινστιτούτο Υγείας και στα Αγγλικά: National Institute of Health (NIH).
- ↑ Η Νιντεδανίμπη (Nintedanib) κυκλοφορεί με την εμπορική ονομασία Ofev.
- ↑ Υποδοχέας αυξητικού παράγοντα ινοβλαστών και στα Αγγλικά: Fibroblast growth factor receptor (FGFR).
- ↑ Υποδοχέας αυξητικού παράγοντα από αιμοπετάλια και στα Αγγλικά: Platelet-derived growth factor receptor (PDGFR).
- ↑ Υποδοχέας αγγειακού ενδοθηλιακού αυξητικού παράγοντα και στα Αγγλικά: Vascular endothelial growth factor receptor (VEGFR).
- ↑ Βαθμολογία κατανομής των πνευμόνων και στα Αγγλικά: Lung allocation score (LAS).
- ↑ Οξείες παροξύνσεις της IPF και στα Αγγλικά: Acute exacerbations-Idiopathic pulmonary fibrosis (AE-IPF).
- ↑ Το πολλαπλούν μυέλωμα είναι ένα σπάνιο είδος ανίατου καρκίνου το οποίο συνήθως προσβάλλει άνδρες άνω των 50 ετών. Πρόκειται για έναν ύπουλο και απειλητικό για τη ζωή ανίατο καρκίνο των πλασματοκυττάρων, ενός τύπου λευκών αιμοσφαιρίων στο μυελό των οστών που παράγουν αντισώματα και βοηθούν στην καταπολέμηση των λοιμώξεων. Τα κοινά συμπτώματα της νόσου περιλαμβάνουν: πόνο στα οστά (συχνά στην πλάτη ή στα πλευρά), οστική βλάβη, (συμπεριλαμβάνονται κατάγματα και/ή λέπτυνση των οστών), κόπωση, συχνές λοιμώξεις και πυρετό, απώλεια βάρους, ναυτία ή δυσκοιλιότητα, συχνοουρία.[Παρ. Σημ. 14]
- ↑ 1. Αντιπυρικά αντισώματα (ΑΝΑ) (Κωδικός ΙΚΑ-ΕΤΑΜ: 120000161)
2. ANCA-C (Κωδικός ΙΚΑ-ΕΤΑΜ: 120000206)
3. ANCA-P (Κωδικός ΙΚΑ-ΕΤΑΜ: 120000207). - ↑ Προκειμένου να διαπιστωθεί εάν ο ασθενής υποφέρει ή όχι από ρευματισμούς.
- ↑ 1. Εξέταση αίματος για ταχύτητα καθιζήσεως ερυθρών αιμοσφαιρίων ΤΚΕ (Κωδικός ΙΚΑ-ΕΤΑΜ: 110000110)
2. Γενική εξέταση αίματος (αιμοσφαιρίνη - αριθμός ερυθρών αιμοσφαιρίων, αριθμός λευκών και τύπος αυτών, μετά προσδιορισμού αιματοκρίτου ΗΤ) (Κωδικός ΙΚΑ-ΕΤΑΜ: 110000107)
3. Προσδιορισμός ουρίας αίματος (Κωδικός ΙΚΑ-ΕΤΑΜ: 130000088)
4. Κρεατίνη αίματος (CREAT) (Κωδικός ΙΚΑ-ΕΤΑΜ: 130000324)
5. Ra Test (Κωδικός ΙΚΑ-ΕΤΑΜ: 150000083). - ↑ Για την εξέταση της σπιρομέτρησης, ο ασθενής πρέπει απαραιτήτως:
α). Να προσκομίσει εκτός από την τελευταία του σπιρομέτρηση και την τελευταία αιματολογική του εξέταση (προκειμένου ο εξεταστής ιατρός να δει τον αιματοκρίτη).
β). Να μην έχει λάβει εισπνεόμενα την προηγούμενη της εξέτασης. - ↑ Σπιρομέτρηση:
1. Αναπνευστικές δοκιμασίες: γ) Καθορισμός ικανότητας διαλύσεως οξυγόνου (Κωδικός ΙΚΑ-ΕΤΑΜ: 430000035)
2. Αναπνευστικές δοκιμασίες: β) Καθορισμός υπολειπομένου αέρος (Κωδικός ΙΚΑ-ΕΤΑΜ: 430000034)
3. Απλή σπιρομέτρηση μετά βρογχοδιαστολής (Κωδικός ΙΚΑ-ΕΤΑΜ: 430000058)
4. Καμπύλη ροής-όγκου 23 παράμετροι προ βρογχοδιαστολής (Κωδικός ΙΚΑ-ΕΤΑΜ: 430000055)
5. Καμπύλη ροής-όγκου 23 παράμετροι μετά βρογχοδιαστολής (Κωδικός ΙΚΑ-ΕΤΑΜ: 430000056)
6. Πλήρης πληθυσμογραφία. Στατικοί και δυναμικοί όγκοι (Κωδικός ΙΚΑ-ΕΤΑΜ: 020000010). - ↑ Αξονική Τομογραφία Θώρακος (περιλαμβάνονται: πνεύμονες, καρδιαγγειακός σχηματισμός πύλες, μεσοθωράκιο, υπεζωκός και οστά θωρακικού κήτους) (C/T)
Σχόλιο HR CT (Κωδικός ΙΚΑ-ΕΤΑΜ: 040000071). - ↑ Για την εξέταση της Αξονικής Τομογραφίας Θώρακος, ο ασθενής πρέπει απαραιτήτως να προσκομίσει την τελευταία του Αξονική Τομογραφία Θώρακος.
- Παραπομπές σημειώσεων
- ↑ «Νόσος, πάθηση, ασθένεια». iatronet.gr. 1999–2021. Ανακτήθηκε στις 2 Σεπτεμβρίου 2021.
- ↑ Rutherford, JD (14 May 2013). «Digital clubbing.». Circulation 127 (19): 1997–9. doi:. PMID 23671180. https://archive.org/details/sim_circulation_2013-05-14_127_19/page/1997.
- ↑ Freedberg, et al. (2003). Fitzpatrick's Dermatology in General Medicine. (6th ed.). McGraw-Hill. (ISBN 0-07-138076-0).:656
- ↑ Schwatz, RA. «Clubbing of the Nails». Medscape. Medscape. Ανακτήθηκε στις 14 Αυγούστου 2014.
- ↑ «Prevalence, aetiologies and significance of clubbing in a department of general internal medicine». Eur. J. Intern. Med. 19 (5): 325–9. July 2008. doi:. PMID 18549933.
- ↑ «Πληκτροδακτυλία / Θεραπεία». e-rheumatology.gr. Ανακτήθηκε στις 17 Απριλίου 2020.
- ↑ ΟΙ ΥΠΟΥΡΓΟΙ ΕΡΓΑΣΙΑΣ, ΚΟΙΝΩΝΙΚΗΣ ΑΣΦΑΛΙΣΗΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ - ΟΙΚΟΝΟΜΙΚΩΝ (27.12.2017). «5.6. Πνευμονική υπέρταση – Πνευμονική καρδία / σελ. 61343». Εφημερίδα της Κυβερνήσεως της Ελληνικής Δημοκρατίας Τεύχος Δεύτερο / Αριθμ. Φύλλου 4591 / σελ. 61285 (Αριθμ. Φ. 80000/45219/1864): 276. doi:. https://www.elinyae.gr/sites/default/files/2019-07/4591b_2017.1515500402841.pdf.
- ↑ ΟΙ ΥΠΟΥΡΓΟΙ ΕΡΓΑΣΙΑΣ, ΚΟΙΝΩΝΙΚΗΣ ΑΣΦΑΛΙΣΗΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ - ΟΙΚΟΝΟΜΙΚΩΝ (27.12.2017). «5.6. Πνευμονική υπέρταση – Πνευμονική καρδία / σελ. 61343». Εφημερίδα της Κυβερνήσεως της Ελληνικής Δημοκρατίας Τεύχος Δεύτερο / Αριθμ. Φύλλου 4591 / σελ. 61285 (Αριθμ. Φ. 80000/45219/1864): 276. doi:. https://www.elinyae.gr/sites/default/files/2019-07/4591b_2017.1515500402841.pdf.
- ↑ ΟΙ ΥΠΟΥΡΓΟΙ ΕΡΓΑΣΙΑΣ, ΚΟΙΝΩΝΙΚΗΣ ΑΣΦΑΛΙΣΗΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ - ΟΙΚΟΝΟΜΙΚΩΝ (27.12.2017). «5.6. Πνευμονική υπέρταση – Πνευμονική καρδία / σελ. 61343». Εφημερίδα της Κυβερνήσεως της Ελληνικής Δημοκρατίας Τεύχος Δεύτερο / Αριθμ. Φύλλου 4591 / σελ. 61285 (Αριθμ. Φ. 80000/45219/1864): 276. doi:. https://www.elinyae.gr/sites/default/files/2019-07/4591b_2017.1515500402841.pdf.
- ↑ ΟΙ ΥΠΟΥΡΓΟΙ ΕΡΓΑΣΙΑΣ, ΚΟΙΝΩΝΙΚΗΣ ΑΣΦΑΛΙΣΗΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ - ΟΙΚΟΝΟΜΙΚΩΝ (27.12.2017). «5.6. Πνευμονική υπέρταση – Πνευμονική καρδία / σελ. 61343». Εφημερίδα της Κυβερνήσεως της Ελληνικής Δημοκρατίας Τεύχος Δεύτερο / Αριθμ. Φύλλου 4591 / σελ. 61285 (Αριθμ. Φ. 80000/45219/1864): 276. doi:. https://www.elinyae.gr/sites/default/files/2019-07/4591b_2017.1515500402841.pdf.
- ↑ ΟΙ ΥΠΟΥΡΓΟΙ ΕΡΓΑΣΙΑΣ, ΚΟΙΝΩΝΙΚΗΣ ΑΣΦΑΛΙΣΗΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ - ΟΙΚΟΝΟΜΙΚΩΝ (27.12.2017). «5.6. Πνευμονική υπέρταση – Πνευμονική καρδία / σελ. 61343». Εφημερίδα της Κυβερνήσεως της Ελληνικής Δημοκρατίας Τεύχος Δεύτερο / Αριθμ. Φύλλου 4591 / σελ. 61285 (Αριθμ. Φ. 80000/45219/1864): 276. doi:. https://www.elinyae.gr/sites/default/files/2019-07/4591b_2017.1515500402841.pdf.
- ↑ ΟΙ ΥΠΟΥΡΓΟΙ ΕΡΓΑΣΙΑΣ, ΚΟΙΝΩΝΙΚΗΣ ΑΣΦΑΛΙΣΗΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ - ΟΙΚΟΝΟΜΙΚΩΝ (27.12.2017). «5.6. Πνευμονική υπέρταση – Πνευμονική καρδία / σελ. 61343». Εφημερίδα της Κυβερνήσεως της Ελληνικής Δημοκρατίας Τεύχος Δεύτερο / Αριθμ. Φύλλου 4591 / σελ. 61285 (Αριθμ. Φ. 80000/45219/1864): 276. doi:. https://www.elinyae.gr/sites/default/files/2019-07/4591b_2017.1515500402841.pdf.
- ↑ ΟΙ ΥΠΟΥΡΓΟΙ ΕΡΓΑΣΙΑΣ, ΚΟΙΝΩΝΙΚΗΣ ΑΣΦΑΛΙΣΗΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ - ΟΙΚΟΝΟΜΙΚΩΝ (27.12.2017). «5.6. Πνευμονική υπέρταση – Πνευμονική καρδία / σελ. 61343». Εφημερίδα της Κυβερνήσεως της Ελληνικής Δημοκρατίας Τεύχος Δεύτερο / Αριθμ. Φύλλου 4591 / σελ. 61285 (Αριθμ. Φ. 80000/45219/1864): 276. doi:. https://www.elinyae.gr/sites/default/files/2019-07/4591b_2017.1515500402841.pdf.
- ↑ «Πολλαπλούν μυέλωμα: Τα ύπουλα συμπτώματα και η πρόγνωση». onmed.gr. Ανακτήθηκε στις 17 Απριλίου 2020.
Υποσημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Εάν διαπιστωθεί ότι ο ασθενής υποφέρει από ρευματισμούς, ο θεράπων ιατρός, θα αποφασίσει την διακοπή ή την συνέχιση της φαρμακευτικής αγωγής.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 «Idiopathic Pulmonary Fibrosis». NHLBI. Ανακτήθηκε στις 21 Ιανουαρίου 2018.
- ↑ 2,0 2,1 2,2 2,3 Raghu, G; Rochwerg, B; Zhang, Y; Garcia, CA; Azuma, A; Behr, J; Brozek, JL; Collard, HR και άλλοι. (15 July 2015). «An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline.». American Journal of Respiratory and Critical Care Medicine 192 (2): e3-19. doi:. PMID 26177183.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 3,15 3,16 3,17 3,18 3,19 3,20 3,21 3,22 3,23 3,24 3,25 3,26 3,27 3,28 3,29 3,30 3,31 3,32 3,33 «An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management». Am. J. Respir. Crit. Care Med. 183 (6): 788–824. 2011. doi:. PMID 21471066.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Ferri, Fred F. (2017). Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1 (στα Αγγλικά). Elsevier Health Sciences. σελ. 691. ISBN 9780323529570.
- ↑ 5,0 5,1 5,2 «Predicting prognosis in idiopathic pulmonary fibrosis». PMID. Ανακτήθηκε στις 20 Δεκεμβρίου 2019.
- ↑ 6,0 6,1 «IPF Foundation». IPF Foundation. 2021. Ανακτήθηκε στις 16 Σεπτεμβρίου 2021.
- ↑ 7,0 7,1 «Idiopathic pulmonary fibrosis». Orphanet J Rare Dis. 3 (1): 8. 2008. doi:. PMID 18366757.
- ↑ Gary M. Hunninghake, Luisa D. Quesada-Arias, Nikkola E. Carmichael, Jose M. Martinez Manzano, Sergio Poli De Frías, Maura Alvarez Baumgartner, Lisa DiGianni, Shannon N. Gampala-Sagar, Dominick A. Leone, Swati Gulati, Souheil El-Chemaly, Hilary J. Goldberg, Rachel K. Putman, Hiroto Hatabu, Benjamin A. Raby and Ivan O. Rosas. «Interstitial Lung Disease in Relatives of Patients with Pulmonary Fibrosis». ATS Journals American Journal of Respiratory and Critical Care Medicine > List of Issues > Volume 201 (10). doi:. https://www.atsjournals.org/doi/full/10.1164/rccm.201908-1571OC.
- ↑ Datamonitor Healthcare (2021). «Estimated percentage of idiopathic pulmonary fibrosis patients in each severity who remain undiagnosed across the US, Japan, and five major EU markets». IPF Foundation. Ανακτήθηκε στις 16 Σεπτεμβρίου 2021.
- ↑ 10,0 10,1 10,2 Dr. Tony Smith (Medical Editor) (1998). «idiopathic / fibrosis». The British Medical Association Complete Family Health Encyclopedia. London, England: Dorling Kindersley. σελ. 562 / 447. ISBN 0-86318-438-3.
- ↑ Frederick C.Mish, επιμ. (2014). «fibrosis». Merriam Webster's Collegiate Dictionary. United States of America: Merriam Webster, Incorporated. σελ. 465. ISBN 978-0-87779-810-1.
- ↑ J M Sinclair (1995). «fibrosis». Collins English Dictionary. Glasgow: HarperCollins Publishers. σελ. 571. ISBN 0-00-470677-3.
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 13,6 13,7 13,8 Travis, WD; Costabel, U; Hansell, DM; King TE, Jr; Lynch, DA; Nicholson, AG; Ryerson, CJ; Ryu, JH και άλλοι. (15 September 2013). «An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias.». American Journal of Respiratory and Critical Care Medicine 188 (6): 733–48. doi:. PMID 24032382.
- ↑ 14,0 14,1 «Prognostic implications of physiologic and radiographic changes in idiopathic interstitial pneumonia». Am J Respir Crit Care Med 168 (5): 543–548. 2007. doi:. PMID 12773329.
- ↑ 15,0 15,1 15,2 «Incidence and prevalence of idiopathic pulmonary fibrosis». Am. J. Respir. Crit. Care Med. 174 (7): 810–816. 2006. doi:.
- ↑ 16,0 16,1 «Velcro crackles: the key for early diagnosis of idiopathic pulmonary fibrosis». Eur Respir J. 40 (3): 519–521. 2012. doi:. PMID 22941541.
- ↑ «Crackles in interstitial lung disease. Comparison of sarcoidosis and fibrosing alveolitis». Chest 100 (1): 96–101. 1991. doi:. PMID 2060395. https://archive.org/details/sim_chest_1991-07_100_1/page/96.
- ↑ 18,0 18,1 18,2 «Idiopathic pulmonary fibrosis: diagnosis and epidemiology». Clinics in chest medicine 33 (1): 41–50. Mar 2012. doi:. PMID 22365244. https://archive.org/details/sim_clinics-in-chest-medicine_2012-03_33_1/page/41.
- ↑ García-Sancho C; Buendía-Roldán I; Fernández-Plata MR; Navarro C; Pérez-Padilla R; Vargas MH; Loyd JE; Selman M. Buendía-Roldán I και άλλοι. (2011). «Familial pulmonary fibrosis is the strongest risk factor for idiopathic pulmonary fibrosis». Respir Med. 105 (12): 1902–1990. doi:. PMID 21917441.
- ↑ 20,0 20,1 «IPF: new insight on pathogenesis and treatment». Allergy 65 (5): 537–553. 2010. doi:. PMID 20121758.
- ↑ 21,0 21,1 «Pathogenesis, current treatments and future directions for idiopathic pulmonary fibrosis». Current Opinion in Pharmacology 13 (3): 377–385. April 2013. doi:.
- ↑ «Idiopathic pulmonary fibrosis: new insights in its pathogenesis». Int J Biochem Cell Biol 34 (12): 1534–1538. 2002. doi:. https://archive.org/details/sim_international-journal-of-biochemistry-cell-biology_2002-12_34_12/page/1534.
- ↑ «Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy». Annals of Internal Medicine 134 (2): 136–151. 2001. doi:. PMID 11177318.
- ↑ 24,0 24,1 «OMIM Entry - # 178500 - PULMONARY FIBROSIS, IDIOPATHIC; IPF». Omim.org. Ανακτήθηκε στις 7 Ιουνίου 2018.
- ↑ «Genetic susceptibility and pulmonary fibrosis». Curr Opin Pulm Med 20 (5): 429–435. 2014. doi:. PMID 25022318.
- ↑ «A novel dyskerin (DKC1) mutation is associated with familial interstitial pneumonia». Chest 146 (1): e1-7. Feb 6, 2014. doi:. PMID 24504062.
- ↑ «Idiopathic interstitial pneumonia: what is the effect of a multidisciplinary approach to diagnosis?». Am J Respir Crit Care Med 170 (8): 904–910. 2004. doi:. PMID 15256390.
- ↑ «Idiopathic interstitial pneumonia: do community and academic physicians agree on diagnosis?». Am J Respir Crit Care Med 175 (10): 1054–1060. 2007. doi:. PMID 17255566.
- ↑ Travis, WD; Costabel, U; Hansell, DM; King TE, Jr; Lynch, DA; Nicholson, AG; Ryerson, CJ; Ryu, JH και άλλοι. (15 September 2013). «An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias.». American Journal of Respiratory and Critical Care Medicine 188 (6): 733–48. doi:. PMID 24032382.
- ↑ 30,0 30,1 30,2 Pulmonary Fibrosis Foundation. "Prevalence and Incidence". Pulmonaryfibrosis.org. Retrieved 2013-04-11
- ↑ «Significance of bronchoalveolar lavage for the diagnosis of idiopathic pulmonary fibrosis». Am J Respir Crit Care Med 179 (11): 1043–1047. 2009. doi:.
- ↑ «Interpretative strategies for lung function tests». Eur Respir J. 26 (5): 948–968. 2005. doi:. PMID 16264058.
- ↑ 33,0 33,1 «Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials». Lancet 377 (9779): 1760–1769. 2011. doi:. PMID 21571362.
- ↑ Martinez FJ, Safrin S, Weycker D, Starko KM, Bradford WZ, King TE Jr, Flaherty KR, Schwartz DA, et al. IPF study group (2005). «The clinical course of patients with idiopathic pulmonary fibrosis». Annals of Internal Medicine 142: 963. doi:.
- ↑ 35,0 35,1 35,2 Martinez FJ, Safrin S, Weycker D, Starko KM, Bradford WZ, King TE Jr, Flaherty KR, Schwartz DA, et al. IPF study group (2014). «A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis». N Engl J Med 370 (22): 2083–2092. doi:. PMID 24836312.
- ↑ 36,0 36,1 Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, M Costabel U, Cottin V, Flaherty KR, for the INPULSIS Trial Investigators. (2014). «Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis». N Engl J Med 370 (22): 2071–2082. doi:. PMID 24836310.
- ↑ «Comprehensive care of the patient with idiopathic pulmonary fibrosis». Current Opinion in Pulmonary Medicine 17 (5): 348–354. 2011. doi:.
- ↑ «Increased exercise capacity in hypoxemic patients after long-term oxygen therapy». Chest 102 (2): 542–550. 1992. doi:. PMID 1643945. https://archive.org/details/sim_chest_1992-08_102_2/page/542.
- ↑ 39,0 39,1 39,2 «Idiopathic pulmonary fibrosis: diagnostic pitfalls and therapeutic challenges». Multidiscip Respir Med. 7 (1): 42. 2012. doi:.
- ↑ «Comprehensive care of the patient with idiopathic pulmonary fibrosis». Current Opinion in Pulmonary Medicine 17 (5): 348–354. 2011. doi:.
- ↑ Kenn, K; Gloeckl, R; Behr, J (2013). «Pulmonary rehabilitation in patients with idiopathic pulmonary fibrosis—a review». Respiration; international review of thoracic diseases 86 (2): 89–99. doi:. PMID 23942353.
- ↑ King TE Jr; Albera C; Bradford WZ; Costabel U; Hormel P; Lancaster L; Noble PW; Sahn SA (2009). «Effect of interferon gamma-1b on survival in patients with idiopathic pulmonary fibrosis». Lancet 374 (9685): 222–228. doi:. PMID 19570573.
- ↑ King TE Jr; Brown KK; Raghu G; du Bois RM; Lynch DA; Martinez F; Valeyre D; Leconte I (2011). «BUILD-3: a randomized, controlled trial of bosentan in idiopathic pulmonary fibrosis». Am J Respir Crit Care Med 184 (1): 92–99. doi:. PMID 21474646.
- ↑ «Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial». Ann Intern Med 158 (9): 641–649. 2013. doi:. PMID 23648946.
- ↑ «Idiopathic Pulmonary Fibrosis Clinical Research Network (IPFnet) A placebo-controlled randomized trial of warfarin in idiopathic pulmonary fibrosis». Am J Respir Crit Care Med 186 (1): 88–95. 2012. doi:. PMID 22561965.
- ↑ «Non-steroid agents for idiopathic pulmonary fibrosis». Cochrane Database Syst Rev (9): CD003134. 2010. doi:. PMID 20824834.
- ↑ «High-dose acetylcysteine in idiopathic pulmonary fibrosis». N Engl J Med 353 (21): 2229–2242. 2005. doi:. PMID 16306520.
- ↑ Raghu G, Anstrom KJ, King TE, Lasky JA, Martinez FJ. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. NEnglJMed. 2012 May 24;366:1968–77.
- ↑ Commonly used three-drug regimen for idiopathic pulmonary fibrosis found harmful [1], Nih.gov., Retrieved 2013-04-11
- ↑ The Idiopathic Pulmonary Fibrosis Clinical Research Network. (2014). «Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis». N Engl J Med 370 (22): 2093–2102. doi:. PMID 24836309.
- ↑ «BIBF 1120 Fact Sheet» (PDF). Dl.groovygecko.net. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 3 Μαρτίου 2016. Ανακτήθηκε στις 8 Απριλίου 2014.
- ↑ «High lung allocation score is associated with increased morbidity and mortality following transplantation». Chest 137 (3): 651–657. 2010. doi:. PMID 19820072. PMC 2832864. https://archive.org/details/sim_chest_2010-03_137_3/page/651.
- ↑ «Lung transplantation for idiopathic pulmonary fibrosis». Ann Thorac Surg. 84 (4): 1121–1128. 2007. doi:. PMID 17888957. https://archive.org/details/sim_annals-of-thoracic-surgery_2007-10_84_4/page/1121.
- ↑ «Lung transplant in idiopathic pulmonary fibrosis». Arch Surg. 146 (10): 1204–1209. 2011. doi:.
- ↑ «Lung transplantation in pulmonary fibrosis challenging early outcomes counter balanced by surprisingly good outcomes beyond 15 years». Transplant Proc. 41 (1): 289–291. 2009. doi:. PMID 19249537.
- ↑ «Depression and functional status are strongly associated with dyspnea in interstitial lung disease». Chest 139 (3): 609–616. 2011. doi:. https://archive.org/details/sim_chest_2011-03_139_3/page/609.
- ↑ «Low dose diamorphine reduces breathlessness without causing a fall in oxygen saturation in elderly patients with end-stage idiopathic pulmonary fibrosis». Palliat Med. 19 (2): 128–130. 2005. doi:.
- ↑ 58,0 58,1 «Acute exacerbation of idiopathic pulmonary fibrosis: a systematic review». Eur J Intern Med. 19 (4): 227–235. 2008. doi:.
- ↑ «Prognosis of patients with advanced idiopathic pulmonary fibrosis requiring mechanical ventilation for acute respiratory failure». Chest 120 (1): 213–219. 2001. doi:. https://archive.org/details/sim_chest_2001-07_120_1/page/213.
- ↑ 60,0 60,1 60,2 «Prognostic significance of histopathologic subsets in idiopathic pulmonary fibrosis». Am J Respir Crit Care Med 157 (1): 199–203. 1998. doi:. PMID 9445300.
- ↑ 61,0 61,1 61,2 King, TE Jr., Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK, Gorina E, Hopkins PM, for the ASCEND Study Group. (2006). «Classification and natural history of the idiopathic interstitial pneumonias». Proc Am Thorac Soc. 3 (4): 285–292. doi:. PMID 16738191.
- ↑ 62,0 62,1 «A multidimensional index and staging system for idiopathic pulmonary fibrosis». Annals of Internal Medicine 156 (10): 684–691. doi:.
- ↑ «Predicting Survival Across Chronic Interstitial Lung Disease: The ILD-GAP Model». Chest 145 (4): 723–728. 2014. doi:. PMID 24114524. https://archive.org/details/sim_chest_2014-04_145_4/page/723.
- ↑ King, TE Jr, Albera C, Bradford WZ, Costabel U, du Bois RM, Leff JA, Nathan SD, Sahn SA (2014). «All-cause mortality rate in patients with idiopathic pulmonary fibrosis. Implications for the design and execution of clinical trials». Am J Respir Crit Care Med 189 (7): 825–831. doi:.
- ↑ «Association between the MUC5B promoter polymorphism and survival in patients with idiopathic pulmonary fibrosis». JAMA 309 (21): 2232–2239. 2013. doi:. PMID 23695349.
- ↑ «Mucin 5B promoter polymorphism is associated with idiopathic pulmonary fibrosis but not with development of lung fibrosis in systemic sclerosis or sarcoidosis». Thorax 68 (5): 436–441. 2013. doi:. PMID 23321605.
- ↑ «Incidence and mortality of idiopathic pulmonary fibrosis and sarcoidosis in the UK». Thorax 61 (11): 980–985. 2006. doi:. PMID 16844727. PMC 2121155. https://archive.org/details/sim_thorax_2006-11_61_11/page/980.
- ↑ «Eurostat News Release. European demography. 110/2010. 27 July 2010» (PDF). Epp.eurostat.ec.europa.eu. Ανακτήθηκε στις 7 Ιουνίου 2018.
- ↑ «A cohort study of interstitial lung diseases in central Denmark». Respir Med 108 (5): 793–799. 2014. doi:. PMID 24636811.
- ↑ «Identification of spontaneous feline idiopathic pulmonary fibrosis: morphology and ultrastructural evidence for a type II pneumocyte defect». Chest 125 (6): 2278–2288. 2004. doi:. PMID 15189952. https://archive.org/details/sim_chest_2004-06_125_6/page/2278.
- ↑ «Chronic idiopathic pulmonary fibrosis in a West Highland white terrier». Can Vet J. 43 (9): 703–705. 2002. PMID 12240528. PMC 339552. https://archive.org/details/sim_the-canadian-veterinary-journal_2002-09_43_9/page/703.
- ↑ «AKC Canine Health Foundation». Akcchf.org. Ανακτήθηκε στις 7 Ιουνίου 2018.
- ↑ «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 4 Σεπτεμβρίου 2014. Ανακτήθηκε στις 31 Δεκεμβρίου 2018.
- ↑ «Research Demonstrates Reversal Of Pulmonary Fibrosis With miRagen Therapeutics Synthetic microRNA-29 Mimic (promiR-29)». Pulmonaryfibrosisnews.com. Ανακτήθηκε στις 8 Ιουνίου 2018.
- ↑ «Stem Cell and Idiopathic Pulmonary Fibrosis: Mechanisms and Treatment». Ncbi.nlm.nih.gov. Ανακτήθηκε στις 8 Ιουνίου 2018.
- ↑ «Stem cell therapy for lung fibrosis conditions». Sciencedaily.com. Ανακτήθηκε στις 8 Ιουνίου 2018.
- ↑ 78,0 78,1 78,2 78,3 78,4 78,5 78,6 78,7 «Lifestyle Changes». ofev. Ανακτήθηκε στις 21 Δεκεμβρίου 2018.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
- Lung.gr - Ιδιοπαθής Πνευμονική Ίνωση Αρχειοθετήθηκε 2011-04-03 στο Wayback Machine.
- (Αγγλικά) [2] Σύντομα πληροφοριακά-ενημερωτικά βίντεο ασθενών
Πρόσθετη ανάγνωση[Επεξεργασία | επεξεργασία κώδικα]
- (Αγγλικά) - Predicting prognosis in idiopathic pulmonary fibrosis
- (Αγγλικά) - COPD and IPF: it's all about regulation and balance
- (Αγγλικά) - Molecular biomarkers in idiopathic pulmonary fibrosis
- (Αγγλικά) [3][νεκρός σύνδεσμος] Κατανοώντας την Ιδιοπαθή Πνευμονική Ίνωση

