Καρκινογένεση

Η καρκινογένεση, που ονομάζεται επίσης ογκογένεση (Carcinogenesis, ή oncogenesis, ή tumorigenesis), είναι ο σχηματισμός ενός καρκίνου, όπου τα φυσιολογικά κύτταρα μεταμορφώθηκαν σε καρκινικά κύτταρα. Η διαδικασία χαρακτηρίζεται από αλλαγές στα κυτταρικά, γενετικά και επιγενετικά επίπεδα και μη φυσιολογική κυτταρική διαίρεση. Η κυτταρική διαίρεση είναι μια φυσιολογική διαδικασία που συμβαίνει σχεδόν σε όλους τους ιστούς και υπό ποικίλες συνθήκες. Κανονικά, η ισορροπία μεταξύ του πολλαπλασιασμού και του προγραμματισμένου κυτταρικού θανάτου, με τη μορφή απόπτωσης, διατηρείται για να διασφαλιστεί η ακεραιότητα των ιστών και των οργάνων. Σύμφωνα με την επικρατούσα αποδεκτή θεωρία της καρκινογένεσης, η θεωρία της σωματικής μετάλλαξης, μεταλλάξεις στο DNA και επιμεταλλάξεις που οδηγούν σε καρκίνο διαταράσσουν αυτές τις κανονικές διαδικασίες παρεμβαίνοντας στον προγραμματισμό που ρυθμίζει τις διαδικασίες , ανατρέποντας τη φυσιολογική ισορροπία μεταξύ πολλαπλασιασμού και κυτταρικού θανάτου.[1][2][3][4][5] Αυτό έχει ως αποτέλεσμα την ανεξέλεγκτη κυτταρική διαίρεση και εξέλιξη αυτών των κυττάρων από φυσική επιλογή στο σώμα. Μόνο ορισμένες μεταλλάξεις οδηγούν σε καρκίνο, ενώ η πλειονότητα των μεταλλάξεων όχι. Παραλλαγές κληρονομικών γονιδίων μπορεί να προδιαθέτουν τα άτομα σε καρκίνο. Επιπλέον, περιβαλλοντικοί παράγοντες όπως καρκινογόνα και η ακτινοβολία προκαλούν μεταλλάξεις που μπορεί να συμβάλλουν στην ανάπτυξη καρκίνου. Τέλος, τυχαία λάθη στην κανονική αντιγραφή του DNA μπορεί να οδηγήσουν σε μεταλλάξεις που προκαλούν καρκίνο.[6] Συνήθως απαιτείται μια σειρά από πολλές μεταλλάξεις σε ορισμένες κατηγορίες γονιδίων πριν ένα φυσιολογικό κύτταρο μεταμορφωθεί σε καρκινικό κύτταρο.[7][8][9][10][11] Πρόσφατη ολοκληρωμένη ταξινόμηση σε επίπεδο ασθενή και η ποσοτικοποίηση των συμβάντων οδηγού σε ομάδες TCGA (The Cancer Genome Atlas) αποκάλυψε ότι υπάρχουν κατά μέσο όρο 12 συμβάντα οδηγού ανά όγκο, εκ των οποίων 0,6 είναι σημειακές μεταλλάξεις (point mutations) στα ογκογονίδια] ], 1,5 είναι ενισχύσεις ογκογονιδίων, 1,2 είναι σημειακές μεταλλάξεις σε ογκοκαταστολείς, 2,1 είναι διαγραφές ογκοκαταστολέων, 1,5 είναι οδηγοί απωλειών χρωμοσωμάτων, 1 είναι οδηγός κέρδος χρωμοσώματος, 2 είναι οδηγός απώλειες βραχίονα χρωμοσώματος και το 1,5 είναι οδηγός κέρδη χρωμοσωμικού βραχίονα .[12] Μεταλλάξεις σε γονίδια που ρυθμίζουν την κυτταρική διαίρεση, απόπτωση (κυτταρικός θάνατος) και επιδιόρθωση του DNA μπορεί να οδηγήσουν σε ανεξέλεγκτο κυτταρικό πολλαπλασιασμό και καρκίνο. Ο καρκίνος είναι βασικά μια ασθένεια ρύθμισης της ανάπτυξης των ιστών. Προκειμένου ένα φυσιολογικό κύτταρο να μετασχηματιστεί σε καρκινικό κύτταρο, τα γονίδια που ρυθμίζουν την κυτταρική ανάπτυξη και διαφοροποίηση πρέπει να τροποποιηθούν.[13] Γενετικές και επιγενετικές αλλαγές μπορούν να συμβούν σε πολλά επίπεδα, από κέρδος ή απώλεια ολόκληρων χρωμοσωμάτων, έως μετάλλαξη που επηρεάζει ένα μοναδικό νουκλεοτίδιο DNA, ή στη αποσιώπηση ή ενεργοποίηση ενός microRNA που ελέγχει την έκφραση 100 έως 500 γονιδίων.[14][15] Υπάρχουν δύο μεγάλες κατηγορίες γονιδίων που επηρεάζονται από αυτές τις αλλαγές. Τα ογκογονίδια μπορεί να είναι φυσιολογικά γονίδια που εκφράζονται σε ακατάλληλα υψηλά επίπεδα, ή τροποποιημένα γονίδια που έχουν νέες ιδιότητες. Και στις δύο περιπτώσεις, η έκφραση αυτών των γονιδίων προάγει τον κακοήθη φαινότυπο των καρκινικών κυττάρων. Τα ογκοκατασταλτικά γονίδια είναι γονίδια που αναστέλλουν την κυτταρική διαίρεση, την επιβίωση ή άλλες ιδιότητες των καρκινικών κυττάρων. Τα ογκοκατασταλτικά γονίδια συχνά απενεργοποιούνται από γενετικές αλλαγές που προάγουν τον καρκίνο. Τέλος, ογκοϊοί, ιοί που περιέχουν ένα ογκογονίδιο, κατηγοριοποιούνται ως ογκογονικοί επειδή πυροδοτούν την ανάπτυξη όγκου ιστών στον ξενιστή. Αυτή η διαδικασία αναφέρεται επίσης ως ιικός μετασχηματισμός.
Αιτίες[Επεξεργασία | επεξεργασία κώδικα]
Γενετικές και επιγενετικές[Επεξεργασία | επεξεργασία κώδικα]
Υπάρχει ένα διαφορετικό σχήμα ταξινόμησης για τις διάφορες γονιδιωματικές αλλαγές που μπορεί να συμβάλλουν στη δημιουργία καρκινικών κυττάρων. Πολλές από αυτές τις αλλαγές είναι μεταλλάξεις ή αλλαγές στην νουκλεοτιδική αλληλουχία του γονιδιωματικού DNA. Υπάρχουν επίσης πολλές επιγενετικές αλλαγές που αλλάζουν εάν τα γονίδια εκφράζονται ή όχι. Ανευπλοειδία, η παρουσία ενός μη φυσιολογικού αριθμού χρωμοσωμάτων, είναι μια γονιδιωματική αλλαγή που δεν είναι μετάλλαξη και μπορεί να περιλαμβάνει είτε κέρδος είτε απώλεια ενός ή περισσότερων χρωμοσωμάτων μέσω σφαλμάτων στη μίτωση. Οι μεταλλάξεις μεγάλης κλίμακας περιλαμβάνουν είτε την διαγραφή, είτε το διπλασιασμό ενός τμήματος ενός χρωμοσώματος. Η γονιδιακή ενίσχυση συμβαίνει όταν ένα κύτταρο αποκτά πολλά αντίγραφα (συχνά 20 ή περισσότερα) μιας μικρής χρωμοσωμικής περιοχής, που συνήθως περιέχει ένα ή περισσότερα ογκογονίδια και παρακείμενο γενετικό υλικό. Χρωμοσωμική μετατόπιση συμβαίνει όταν δύο ξεχωριστές χρωμοσωμικές περιοχές συγχωνεύονται ανώμαλα, συχνά σε μια χαρακτηριστική θέση. Ένα πολύ γνωστό παράδειγμα αυτού είναι το χρωμόσωμα της Φιλαδέλφειας, ή η μετατόπιση των χρωμοσωμάτων 9 και 22, που εμφανίζεται στη χρόνια μυελογενή λευχαιμία και έχει ως αποτέλεσμα την παραγωγή της πρωτεΐνης σύντηξης BCR-abl, μιας ογκογόνου κινάσης τυροσίνης. Οι μεταλλάξεις μικρής κλίμακας περιλαμβάνουν σημειακές μεταλλάξεις, διαγραφές και εισαγωγές, που μπορεί να συμβούν στον προαγωγέα ενός γονιδίου και να επηρεάσουν την έκφρασή του, ή μπορεί να εμφανιστεί στην κωδικοποιητική αλληλουχία του γονιδίου και να αλλάξει τη λειτουργία ή τη σταθερότητα του προϊόντος της πρωτεΐνης του. Η διαταραχή ενός μεμονωμένου γονιδίου μπορεί επίσης να προκύψει από ενσωμάτωση γονιδιωματικού υλικού από ιό DNA ή ρετροϊό, και ένα τέτοιο συμβάν μπορεί επίσης να έχει ως αποτέλεσμα την έκφραση ιικών ογκογονιδίων στο προσβεβλημένο κύτταρο και τους απογόνους του.
Βλάβη στο DNA[Επεξεργασία | επεξεργασία κώδικα]

Η βλάβη του DNA θεωρείται η κύρια αιτία καρκίνου.[16] Περισσότερες από 60.000 νέες φυσικές περιπτώσεις βλάβης του DNA προκύπτουν, κατά μέσο όρο, ανά ανθρώπινο κύτταρο, ανά ημέρα, λόγω ενδογενών κυτταρικών διεργασιών. Επιπρόσθετη βλάβη στο DNA μπορεί να προκύψει από την έκθεση σε εξωγενείς παράγοντες. Παράδειγμα εξωγενούς καρκινογόνου παράγοντα, αποτελεί ο καπνός του τσιγάρου που προκαλεί αυξημένη βλάβη στο DNA και αυτή η βλάβη στο DNA πιθανότατα προκαλεί την αύξηση του καρκίνου του πνεύμονα λόγω του καπνίσματος.[17] Σε άλλα παραδείγματα, το υπεριώδες φως από την ηλιακή ακτινοβολία προκαλεί βλάβη στο DNA που είναι σημαντική στο μελάνωμα,[18]η λοίμωξη από το ελικοβακτήριο του πυλωρού παράγει υψηλά επίπεδα δραστικών μορφών οξυγόνου που βλάπτουν το DNA και συμβάλλουν στον γαστρικό καρκίνο,[19] και ο μεταβολίτης Aspergillus flavus thw αφλατοξίνης είναι ένας παράγοντας που καταστρέφει το DNA και προκαλεί τον καρκίνο του ήπατος.[20] Η βλάβη του DNA μπορεί επίσης να προκληθεί από ουσίες που παράγονται στο σώμα. Τα μακροφάγα και τα ουδετερόφιλα σε ένα φλεγμονώδες επιθήλιο του παχέος εντέρου είναι η πηγή δραστικών ειδών οξυγόνου που προκαλούν τη βλάβη του DNA που ξεκινά ογκογένεση,[21] και τα χολικά οξέα, σε υψηλά επίπεδα στο κόλον των ανθρώπων που ακολουθούν δίαιτα πλούσια σε λιπαρά, προκαλούν επίσης βλάβη στο DNA και συμβάλλουν στον καρκίνο του παχέος εντέρου.[22] Τέτοιες εξωγενείς και ενδογενείς πηγές βλάβης του DNA υποδεικνύονται στα πλαίσια στο επάνω μέρος του σχήματος αυτής της ενότητας. Ο κεντρικός ρόλος της βλάβης του DNA στην εξέλιξη του καρκίνου υποδεικνύεται στο δεύτερο επίπεδο του σχήματος. Τα κεντρικά στοιχεία της βλάβης του DNA, οι επιγενετικές αλλοιώσεις και η ανεπαρκής επιδιόρθωση του DNA στην εξέλιξη του καρκίνου φαίνονται με κόκκινο χρώμα. Ανεπάρκεια στην επιδιόρθωση του DNA θα προκαλούσε τη συσσώρευση μεγαλύτερης βλάβης στο DNA και αυξάνει τον κίνδυνο για καρκίνο. Για παράδειγμα, άτομα με κληρονομική βλάβη σε οποιοδήποτε από τα 34 γονίδια επιδιόρθωσης του DNA διατρέχουν αυξημένο κίνδυνο καρκίνου, με ορισμένα ελαττώματα να προκαλούν έως και 100% πιθανότητα του καρκίνου (π.χ. μεταλλάξεις p53).[23] Τέτοιες μετάλλαξεις βλαστικής γραμμής εμφανίζονται σε ένα πλαίσιο στα αριστερά του σχήματος, με ένδειξη της συμβολής τους στην ανεπάρκεια επιδιόρθωσης του DNA. Ωστόσο, τέτοιες μεταλλάξεις βλαστικής σειράς (οι οποίες προκαλούν υψηλά διεισδυτικά καρκινικά σύνδρομα) είναι η αιτία μόνο για το ένα τοις εκατό των καρκίνων.[24] Η πλειοψηφία των καρκίνων ονομάζονται μη κληρονομικοί ή "σποραδικοί καρκίνοι". Περίπου το 30% των σποραδικών καρκίνων έχουν κάποια κληρονομική συνιστώσα που δεν έχει καθοριστεί επί του παρόντος, ενώ η πλειοψηφία, ή το 70% των σποραδικών καρκίνων, δεν έχουν κληρονομικό συστατικό.[25] Σε σποραδικούς καρκίνους, μια ανεπάρκεια στην επιδιόρθωση του DNA οφείλεται περιστασιακά σε μια μετάλλαξη σε ένα γονίδιο επιδιόρθωσης του DNA. Πολύ πιο συχνά, η μειωμένη ή απουσία έκφρασης των γονιδίων επιδιόρθωσης του DNA οφείλεται σε επιγενετικές αλλοιώσεις που μειώνουν ή αποσιωπούν την έκφραση του γονιδίου. Αυτό υποδεικνύεται στο σχήμα στο 3ο επίπεδο από την κορυφή. Για παράδειγμα, για 113 καρκίνους του παχέος εντέρου που εξετάστηκαν διαδοχικά, μόνο τέσσερις είχαν παρανοηματική μετάλλαξη στο γονίδιο επιδιόρθωσης του DNA MGMT, ενώ η πλειονότητα είχε μειωμένη έκφραση MGMT λόγω μεθυλίωσης της περιοχής προαγωγέα του MGMT (επιγενετική αλλαγή).[26] Όταν η έκφραση των γονιδίων επιδιόρθωσης του DNA μειώνεται, αυτό προκαλεί ανεπάρκεια επιδιόρθωσης DNA. Αυτό φαίνεται στο σχήμα στο 4ο επίπεδο από την κορυφή. Με ανεπάρκεια επιδιόρθωσης του DNA, η βλάβη του DNA επιμένει στα κύτταρα σε υψηλότερο από το τυπικό επίπεδο (5ο επίπεδο από την κορυφή στο σχήμα). Αυτή η υπερβολική ζημιά προκαλεί αυξημένη συχνότητα μετάλλαξης και/ή επιμετάλλαξης (6ο επίπεδο από την κορυφή του σχήματος). Πειραματικά, τα ποσοστά μετάλλαξης αυξάνονται σημαντικά σε κύτταρα ελαττωματικά σε επιδιόρθωση ασυμφωνίας DNA,[27][28] ή σε επισκευή ομόλογου ανασυνδυασμού (HRR).[29] οι χρωματοσωμικές αναδιατάξεις και η ανευπλοειδία αυξάνουν επίσης σε ελαττωματικά κύτταρα HRR. [30] Κατά τη διάρκεια της επιδιόρθωσης θραύσεων διπλού κλώνου DNA, ή επιδιόρθωσης άλλων βλαβών στο DNA, οι ελλιπώς καθαρισμένες θέσεις επισκευής μπορεί να προκαλέσουν επιγενετική σίγαση γονιδίου.[31][32] Οι σωματικές μεταλλάξεις και οι επιγενετικές αλλοιώσεις που προκαλούνται από βλάβη του DNA και οι ελλείψεις στην επιδιόρθωση του DNA συσσωρεύονται σε ελαττώματα πεδίου. Τα ελαττώματα πεδίου είναι ιστοί που εμφανίζονται φυσιολογικά με πολλαπλές αλλοιώσεις (που συζητούνται στην ενότητα παρακάτω) και είναι συνήθεις πρόδρομοι για την ανάπτυξη του διαταραγμένου και υπερπολλαπλασιαζόμενου κλώνου του ιστού σε έναν καρκίνο. Τέτοια ελαττώματα πεδίου (δεύτερο επίπεδο από το κάτω μέρος του σχήματος) μπορεί να έχουν πολυάριθμες μεταλλάξεις και επιγενετικές αλλοιώσεις. Είναι αδύνατο να προσδιοριστεί η αρχική αιτία για τους περισσότερους ειδικούς καρκίνους. Σε λίγες περιπτώσεις, υπάρχει μόνο μία αιτία: για παράδειγμα, ο ιός HHV-8 προκαλεί όλα τα σαρκώματα Καπόσι. Ωστόσο, με τη βοήθεια τεχνικών και πληροφοριών επιδημιολογίας του καρκίνου, είναι δυνατό να παραχθεί μια εκτίμηση μιας πιθανής αιτίας σε πολλές περισσότερες περιπτώσεις. Για παράδειγμα, ο καρκίνος του πνεύμονα έχει διάφορες αιτίες, συμπεριλαμβανομένης της χρήσης καπνού και του αερίου ραδονίου. Οι άνδρες που καπνίζουν σήμερα αναπτύσσουν καρκίνο του πνεύμονα σε ποσοστό 14 φορές μεγαλύτερο από εκείνο των ανδρών που δεν έχουν καπνίσει ποτέ καπνό: η πιθανότητα καρκίνου του πνεύμονα σε έναν σημερινό καπνιστή να προκαλείται από το κάπνισμα είναι περίπου 93%. Υπάρχει 7% πιθανότητα ο καρκίνος του πνεύμονα του καπνιστή να προκλήθηκε από αέριο ραδόνιο ή κάποια άλλη αιτία που δεν είναι καπνός.[33] Αυτές οι στατιστικές συσχετίσεις έδωσαν τη δυνατότητα στους ερευνητές να συμπεράνουν ότι ορισμένες ουσίες ή συμπεριφορές είναι καρκινογόνες. Ο καπνός του τσιγάρου προκαλεί αυξημένη εξωγενή βλάβη στο DNA και αυτή η βλάβη στο DNA είναι η πιθανή αιτία καρκίνου του πνεύμονα λόγω του καπνίσματος. Μεταξύ των περισσότερων από τις 5.000 ενώσεις στον καπνό του τσιγάρου, οι γονιδιοτοξικοί παράγοντες που βλάπτουν το DNA που εμφανίζονται και στις υψηλότερες συγκεντρώσεις και έχουν τις ισχυρότερες μεταλλαξιογόνες επιδράσεις είναι οι ακρολεΐνη, φορμαλδεΰδη, ακρυλονιτρίλιο, 1,3-βουταδιένιο, ακεταλδεΰδη, αιθυλενοξείδιο και ισοπρένιο.[17] Χρησιμοποιώντας τις τεχνικές της μοριακής βιολογίας, είναι δυνατός ο χαρακτηρισμός των μεταλλάξεων, των επιμεταλλάξεων ή των χρωμοσωμικών ανωμαλιών εντός ενός όγκου και σημειώνεται ταχεία πρόοδος στον τομέα της πρόγνωσης ορισμένων ασθενών με καρκίνο με βάση το φάσμα των μεταλλάξεων. Για παράδειγμα, έως και οι μισοί όγκοι έχουν ελαττωματικό γονίδιο p53. Αυτή η μετάλλαξη σχετίζεται με κακή πρόγνωση, καθώς αυτά τα καρκινικά κύτταρα είναι λιγότερο πιθανό να περάσουν σε απόπτωση, ή σε προγραμματισμένο κυτταρικό θάνατο όταν υποστούν βλάβη από τη θεραπεία. Οι μεταλλάξεις της τελομεράσης αφαιρούν πρόσθετους φραγμούς, επεκτείνοντας τον αριθμό των φορών που μπορεί να διαιρεθεί ένα κύτταρο. Άλλες μεταλλάξεις επιτρέπουν στον όγκο να αναπτύξει νέα αιμοφόρα αγγεία για να παρέχει περισσότερα θρεπτικά συστατικά, ή να μετασταθεί, εξαπλούμενος σε άλλα μέρη του σώματος. Ωστόσο, μόλις σχηματιστεί ένας καρκίνος, συνεχίζει να εξελίσσεται και να παράγει υποκλώνους. Αναφέρθηκε το 2012 ότι ένα μεμονωμένο δείγμα καρκίνου του νεφρού, που λήφθηκε από εννέα διαφορετικές περιοχές, είχε 40 "πανταχού παρούσες" μεταλλάξεις, που βρέθηκαν και στις εννέα περιοχές, 59 μεταλλάξεις κοινές σε ορισμένες, αλλά όχι και στις εννέα περιοχές, και 29 "ιδιωτικές" μεταλλάξεις που υπήρχαν μόνο σε μια περιοχή.[34] Οι γενεές των κυττάρων στις οποίες συσσωρεύονται όλες αυτές οι αλλοιώσεις του DNA είναι δύσκολο να εντοπιστούν, αλλά δύο πρόσφατες σειρές στοιχείων υποδηλώνουν ότι τα φυσιολογικά βλαστοκύτταρα μπορεί να είναι τα κύτταρα προέλευσης των καρκίνων.[35][36] Πρώτον, υπάρχει μια εξαιρετικά θετική συσχέτιση (Spearman's rho = 0,81, P < 3,5 × 10−8) μεταξύ του κινδύνου ανάπτυξης καρκίνου σε έναν ιστό και του αριθμού των φυσιολογικών διαιρέσεων βλαστοκυττάρων που λαμβάνουν χώρα στον ίδιο ιστό. Ο συσχετισμός εφαρμόστηκε σε 31 τύπους καρκίνου και επεκτάθηκε σε πέντε τάξεις μεγέθους.[37] Αυτή η συσχέτιση σημαίνει ότι εάν τα φυσιολογικά βλαστοκύτταρα από έναν ιστό διαιρεθούν μία φορά, ο κίνδυνος καρκίνου σε αυτόν τον ιστό είναι περίπου 1Χ. Αν διαιρεθούν 1.000 φορές, ο κίνδυνος καρκίνου είναι 1.000Χ. Και αν τα φυσιολογικά βλαστοκύτταρα από έναν ιστό διαιρούνται 100.000 φορές, ο κίνδυνος καρκίνου σε αυτόν τον ιστό είναι περίπου 100.000 φορές. Αυτό υποδηλώνει έντονα ότι ο κύριος παράγοντας στην έναρξη του καρκίνου είναι το γεγονός ότι τα "φυσιολογικά" βλαστοκύτταρα διαιρούνται, πράγμα που σημαίνει ότι ο καρκίνος προέρχεται από φυσιολογικά, υγιή βλαστοκύτταρα.[36] Δεύτερον, οι στατιστικές δείχνουν ότι οι περισσότεροι ανθρώπινοι καρκίνοι διαγιγνώσκονται σε άτομα μεγαλύτερης ηλικίας. Μια πιθανή εξήγηση είναι ότι οι καρκίνοι εμφανίζονται επειδή τα κύτταρα συσσωρεύουν βλάβες με την πάροδο του χρόνου. Το DNA είναι το μόνο κυτταρικό συστατικό που μπορεί να συσσωρεύσει βλάβη σε όλη τη διάρκεια της ζωής και τα βλαστοκύτταρα είναι τα μόνα κύτταρα που μπορούν να μεταδώσουν το DNA από το ζυγώτη στα κύτταρα αργά στη ζωή. Άλλα κύτταρα, που προέρχονται από βλαστοκύτταρα, δεν διατηρούν το DNA από την αρχή της ζωής τους μέχρι να εμφανιστεί ένας πιθανός καρκίνος. Αυτό σημαίνει ότι οι περισσότεροι καρκίνοι προέρχονται από φυσιολογικά βλαστοκύτταρα.[35][36]
Συμβολή ελαττωμάτων πεδίου[Επεξεργασία | επεξεργασία κώδικα]

Ο όρος "καρκινοποίηση πεδίου" χρησιμοποιήθηκε για πρώτη φορά το 1953 για να περιγράψει μια περιοχή ή "πεδίο" του επιθηλίου που είχε προκαθοριστεί από (εκείνη την εποχή) με άγνωστες διεργασίες σε μεγάλο βαθμό ώστε να το προδιαθέσει προς την ανάπτυξη καρκίνου.[38] Έκτοτε, οι όροι "καρκινοποίηση πεδίου (field cancerization)" και "ελάττωμα πεδίου (field defect)" χρησιμοποιούνται για να περιγράψουν τον προκακοήθη ιστό στον οποίο είναι πιθανό να εμφανιστούν νέοι καρκίνοι. Τα ελαττώματα πεδίου έχουν εντοπιστεί σε σχέση με καρκίνους και είναι σημαντικά για την εξέλιξη σε καρκίνο.[39][40] Ωστόσο, όπως επισήμανε ο Ρούμπιν [41] η συντριπτική πλειονότητα των μελετών στην έρευνα του καρκίνου έχει γίνει σε καλά καθορισμένους όγκους in vivo, ή σε διακριτές νεοπλασματικές εστίες in vitro. Ωστόσο, υπάρχουν ενδείξεις ότι περισσότερο από το 80% των σωματικών μεταλλάξεων που βρέθηκαν σε μεταλλακτικούς φαινοτύπους οι ανθρώπινοι ορθοκολικοί όγκοι εμφανίζονται πριν από την έναρξη της τελικής κλωνικής επέκτασης…"[42] Περισσότερες από τις μισές σωματικές μεταλλάξεις που εντοπίστηκαν σε όγκους εμφανίστηκαν σε μια προνεοπλασματική φάση (σε ελάττωμα πεδίου), κατά την ανάπτυξη φαινομενικά φυσιολογικών κυττάρων. Θα ήταν επίσης αναμενόμενο ότι πολλές από τις επιγενετικές αλλοιώσεις που υπάρχουν σε όγκους μπορεί να έχουν συμβεί σε προνεοπλασματικά ελαττώματα του πεδίου.[43] Στο παχύ έντερο, ένα ελάττωμα πεδίου πιθανώς προκύπτει από τη φυσική επιλογή ενός μεταλλαγμένου ή επιγενετικά τροποποιημένου κυττάρου μεταξύ των βλαστοκυττάρων στη βάση μιας από τις εντερικές κρύπτες στην εσωτερική επιφάνεια του παχέος εντέρου. Ένα μεταλλαγμένο ή επιγενετικά τροποποιημένο βλαστοκύτταρο μπορεί να αντικαταστήσει τα άλλα κοντινά βλαστοκύτταρα με φυσική επιλογή. Αυτό μπορεί να προκαλέσει την εμφάνιση ενός επιθέματος μη φυσιολογικού ιστού. Το σχήμα σε αυτήν την ενότητα περιλαμβάνει μια φωτογραφία μιας πρόσφατης εκτομής και κατά μήκος ανοιγμένου τμήματος του παχέος εντέρου που δείχνει έναν καρκίνο του παχέος εντέρου και τέσσερις πολύποδες. Κάτω από τη φωτογραφία υπάρχει ένα σχηματικό διάγραμμα για το πώς μπορεί να έχει σχηματιστεί ένα μεγάλο επίθεμα μεταλλαγμένων ή επιγενετικά τροποποιημένων κυττάρων, που φαίνεται από τη μεγάλη περιοχή με κίτρινο χρώμα στο διάγραμμα. Μέσα σε αυτό το πρώτο μεγάλο επίθεμα στο διάγραμμα (ένας μεγάλος κλώνος κυττάρων), μπορεί να συμβεί μια δεύτερη τέτοια μετάλλαξη ή επιγενετική αλλοίωση, έτσι ώστε ένα δεδομένο βλαστοκύτταρο να αποκτά πλεονέκτημα σε σύγκριση με τα γειτονικά του και αυτό το αλλοιωμένο βλαστοκύτταρο μπορεί να επεκταθεί κλωνικά, σχηματίζοντας ένα δευτερεύον επίθεμα, ή υποκλώνο, μέσα στο αρχικό επίθεμα. Αυτό υποδεικνύεται στο διάγραμμα με τέσσερα μικρότερα μπαλώματα διαφορετικών χρωμάτων εντός της μεγάλης κίτρινης αρχικής περιοχής. Μέσα σε αυτά τα νέα επιθέματα (υποκλώνους), η διαδικασία μπορεί να επαναληφθεί πολλές φορές, υποδεικνύεται από τα ακόμη μικρότερα επιθέματα εντός των τεσσάρων δευτερευόντων επιθεμάτων (με ακόμη διαφορετικά χρώματα στο διάγραμμα) τα οποία διαστέλλονται κλωνικά, έως ότου προκύψουν βλαστοκύτταρα που δημιουργούν είτε μικρούς πολύποδες, ή αλλιώς κακοήθη νεοπλάσματα (καρκίνος). Στη φωτογραφία, ένα φαινομενικό ελάττωμα πεδίου σε αυτό το τμήμα ενός παχέος εντέρου έχει δημιουργήσει τέσσερις πολύποδες (με την ετικέτα το μέγεθος των πολύποδων, 6 mm, 5 mm και δύο των 3 mm, και έναν καρκίνο πλάτους περίπου 3 cm στη μεγαλύτερη διάστασή του). Αυτά τα νεοπλάσματα υποδεικνύονται επίσης (στο διάγραμμα κάτω από τη φωτογραφία) από 4 μικρούς μαύρους κύκλους (πολύποδες) και μια μεγαλύτερη κόκκινη περιοχή (καρκίνος). Ο καρκίνος στη φωτογραφία εμφανίστηκε στην περιοχή του τυφλού του παχέος εντέρου, όπου το παχύ έντερο ενώνεται με το λεπτό έντερο (με ετικέτα) και όπου εμφανίζεται η σκωληκοειδής απόφυση (με ετικέτα). Το λίπος στη φωτογραφία είναι εξωτερικά στο εξωτερικό τοίχωμα του παχέος εντέρου. Στο τμήμα του παχέος εντέρου που φαίνεται εδώ, το παχύ έντερο κόπηκε κατά μήκος για να εκτεθεί η εσωτερική του επιφάνεια και να εμφανιστεί ο καρκίνος και οι πολύποδες που εμφανίζονται μέσα στην εσωτερική επιθηλιακή επένδυση του παχέος εντέρου. Εάν η γενική διαδικασία με την οποία προκύπτουν σποραδικοί καρκίνοι του παχέος εντέρου είναι ο σχηματισμός ενός προνεοπλασματικού κλώνου που εξαπλώνεται με φυσική επιλογή, ακολουθούμενος από σχηματισμό εσωτερικών υποκλώνων εντός του αρχικού κλώνου και υποκλώνων μέσα σε αυτούς, τότε οι καρκίνοι του παχέος εντέρου γενικά θα πρέπει να συνδέονται με, και να προηγούνται από, τα πεδία αυξανόμενης ανωμαλίας, που αντικατοπτρίζουν τη διαδοχή των προκακοηθών συμβάντων. Η πιο εκτεταμένη περιοχή ανωμαλίας (η πιο εξωτερική κίτρινη ακανόνιστη περιοχή στο διάγραμμα) θα αντικατοπτρίζει το πιο πρώιμο συμβάν στο σχηματισμό ενός κακοήθους νεοπλάσματος. Σε πειραματική αξιολόγηση συγκεκριμένων ελλείψεων επιδιόρθωσης DNA σε καρκίνους, πολλές ειδικές ελλείψεις επιδιόρθωσης DNA αποδείχθηκαν επίσης ότι εμφανίζονται στα ελαττώματα πεδίου που περιβάλλουν αυτούς τους καρκίνους. Ο παρακάτω πίνακας δίνει παραδείγματα για τα οποία η ανεπάρκεια επιδιόρθωσης DNA σε έναν καρκίνο αποδείχθηκε ότι προκαλείται από επιγενετική αλλαγή και οι κάπως χαμηλότερες συχνότητες με τις οποίες βρέθηκε η ίδια επιγενετικά προκαλούμενη ανεπάρκεια επιδιόρθωσης του DNA στο ελάττωμα του περιβάλλοντος πεδίου.
| + Συχνότητα επιγενετικών αλλαγών στα γονίδια επιδιόρθωσης του DNA σε σποραδικούς καρκίνους και σε ελαττώματα παρακείμενου πεδίου | Καρκίνος | Γονίδιο | Συχνότητα σε καρκίνο | Συχνότητα σε ελάττωμα | Παραπομπή |
|---|---|---|---|---|---|
| Ορθοκολικός | MGMT | 46% | 34% | [44] | |
| Ορθοκολικός | MGMT | 47% | 11% | [45] | |
| Ορθοκολικός | MGMT | 70% | 60% | [46] | |
| Ορθοκολικός | MSH2 | 13% | 5% | [45] | |
| Ορθοκολικός | ERCC1 | 100% | 40% | [47] | |
| Ορθοκολικός | PMS2 | 88% | 50% | [47] | |
| Ορθοκολικός | XPF | 55% | 40% | [47] | |
| Κεφάλι και Λαιμός | MGMT | 54% | 38% | [48] | |
| Κεφάλι και Λαιμός | MLH1 | 33% | 25% | [49] | |
| Κεφάλι και Λαιμός | MLH1 | 31% | 20% | [50] | |
| Στομάχι | MGMT | 88% | 78% | [51] | |
| Στομάχι | MLH1 | 73% | 20% | [52] | |
| Οισοφάγος | MLH1 | 77%–100% | 23%–79% | [53] |
Μερικοί από τους μικρούς πολύποδες στο ελάττωμα του πεδίου που φαίνεται στη φωτογραφία του ανοιγμένου τμήματος του παχέος εντέρου μπορεί να είναι σχετικά καλοήθη νεοπλάσματα. Σε μια μελέτη του 1996 για πολύποδες μεγέθους μικρότερου από 10 mm που βρέθηκαν κατά τη διάρκεια της κολονοσκόπησης και ακολουθήθηκαν με επαναλαμβανόμενες κολονοσκοπήσεις για 3 χρόνια, το 25% παρέμεινε αμετάβλητο σε μέγεθος, το 35% υποχώρησε ή συρρικνώθηκε σε μέγεθος και το 40% μεγάλωσε σε μέγεθος.[54]
Αστάθεια του γονιδιώματος[Επεξεργασία | επεξεργασία κώδικα]
Οι καρκίνοι είναι γνωστό ότι εμφανίζουν αστάθεια γονιδιώματος, ή "φαινότυπο μεταλλάκτη".[55] Το DNA που κωδικοποιεί την πρωτεΐνη εντός του πυρήνα είναι περίπου το 1,5% του συνολικού γονιδιωματικού DNA.[56] Μέσα σε αυτό το DNA που κωδικοποιεί την πρωτεΐνη (που ονομάζεται εξονίωμα (exome)), ένας μέσος καρκίνος του μαστού ή του παχέος εντέρου μπορεί να έχει περίπου 60 έως 70 μεταλλάξεις που αλλάζουν πρωτεΐνη, από τις οποίες περίπου 3 ή 4 μπορεί να είναι μεταλλάξεις "οδηγοί" και οι υπόλοιπες μπορεί να είναι μεταλλάξεις "επιβάτες (passenger) ".[43] Ωστόσο, ο μέσος αριθμός μεταλλάξεων αλληλουχίας DNA σε ολόκληρο το γονιδίωμα (συμπεριλαμβανομένου των μη κωδικοποιητικών περιοχών πρωτεΐνης) σε ένα δείγμα ιστού καρκίνου του μαστού είναι περίπου 20.000.[57] Σε ένα μέσο δείγμα ιστού μελανώματος (τα μελανώματα έχουν υψηλότερη συχνότητα μετάλλαξης εξονιώματος),[43]) ο συνολικός αριθμός μεταλλάξεων της αλληλουχίας DNA είναι περίπου 80.000.[58] Αυτές οι υψηλές συχνότητες μεταλλάξεων στις συνολικές αλληλουχίες νουκλεοτιδίων εντός των καρκίνων υποδηλώνουν ότι συχνά μια πρώιμη αλλαγή στο ελάττωμα του πεδίου οδηγεί σε καρκίνο (π.χ. η κίτρινη περιοχή στο διάγραμμα στην προηγούμενη ενότητα) είναι ανεπάρκεια στην επιδιόρθωση του DNA. Βρέθηκαν μεγάλα ελαττώματα πεδίου γύρω από καρκίνους του παχέος εντέρου (που εκτείνονται σε περίπου 10 cm σε κάθε πλευρά του καρκίνου)[47] να έχουν συχνά επιγενετικά ελαττώματα σε δύο ή τρεις πρωτεΐνες επιδιόρθωσης DNA (ERCC1, ERCC4 (XPF) και/ή PMS2) σε ολόκληρη την περιοχή του ελαττώματος πεδίου. Όταν η έκφραση των γονιδίων επιδιόρθωσης του DNA μειώνεται, η βλάβη του DNA συσσωρεύεται στα κύτταρα με ρυθμό υψηλότερο από το κανονικό, και αυτή η υπερβολική βλάβη προκαλεί αυξημένη συχνότητα μετάλλαξης ή/και επιμετάλλαξης. Τα ποσοστά μετάλλαξης αυξάνονται έντονα σε κύτταρα ελαττωματικά σε επιδιόρθωση ασυμφωνίας του DNA, [27][28] ή σε επιδιόρθωση με ομόλογο ανασυνδυασμό (homologous recombinational repair, HRR).[29] Μια ανεπάρκεια στην επιδιόρθωση του DNA, από μόνη της, μπορεί να επιτρέψει τη συσσώρευση βλάβης στο DNA και η επιρρεπής σε σφάλματα διαβλαβική σύνθεση (translesion synthesis) ορισμένων από τις κατεστραμμένες περιοχές μπορεί να προκαλέσει μεταλλάξεις. Επιπλέον, η ελαττωματική επιδιόρθωση αυτής της συσσωρευμένης βλάβης του DNA μπορεί να προκαλέσει επιμεταλλάξεις. Αυτές οι νέες μεταλλάξεις ή/και επιμεταλλάξεις μπορεί να παρέχουν πολλαπλασιαστικό πλεονέκτημα, δημιουργώντας ένα ελάττωμα πεδίου. Παρόλο που οι μεταλλάξεις/επιμεταλλάξεις στα γονίδια επιδιόρθωσης του DNA δεν παρέχουν, από μόνες τους, ένα επιλεκτικό πλεονέκτημα, μπορούν να μεταφερθούν ως επιβάτες στα κύτταρα, όταν το κύτταρο αποκτήσει μια πρόσθετη μετάλλαξη/επιμετάλλαξη που παρέχει ένα πολλαπλασιαστικό πλεονέκτημα.
Μη κυρίαρχες θεωρίες[Επεξεργασία | επεξεργασία κώδικα]
Υπάρχει μια σειρά από θεωρίες καρκινογένεσης και θεραπείας του καρκίνου που δεν εμπίπτουν στην επικρατούσα τάση της επιστημονικής γνώμης, λόγω έλλειψης επιστημονικής λογικής, λογικής ή βάσης στοιχείων. Αυτές οι θεωρίες μπορούν να χρησιμοποιηθούν για να δικαιολογήσουν διάφορες εναλλακτικές θεραπείες για τον καρκίνο. Θα πρέπει να διακρίνονται από εκείνες τις θεωρίες καρκινογένεσης που έχουν λογική βάση στην κύρια βιολογία του καρκίνου και από τις οποίες μπορούν να γίνουν συμβατικά ελεγχόμενες υποθέσεις. Ωστόσο, αρκετές εναλλακτικές θεωρίες καρκινογένεσης βασίζονται σε επιστημονικά στοιχεία και αναγνωρίζονται όλο και περισσότερο. Ορισμένοι ερευνητές πιστεύουν ότι ο καρκίνος μπορεί να προκαλείται από ανευπλοειδία (αριθμητικές και δομικές ανωμαλίες στα χρωμοσώματα), [59] παρά με μεταλλάξεις ή επιμεταλλάξεις. Ο καρκίνος έχει επίσης θεωρηθεί ως μια μεταβολική ασθένεια, στην οποία ο κυτταρικός μεταβολισμός του οξυγόνου εκτρέπεται από το μονοπάτι που παράγει ενέργεια (οξειδωτική φωσφορυλίωση) στο μονοπάτι που δημιουργεί δραστικές μορφές οξυγόνου.[60] Αυτό προκαλεί μια ενεργειακή αλλαγή από την οξειδωτική φωσφορυλίωση στην αερόβια γλυκόλυση (φαινόμενο Warburg) και τη συσσώρευση δραστικών μορφών οξυγόνου που οδηγεί σε οξειδωτική καταπόνηση ("θεωρία οξειδωτικής καταπόνησης του καρκίνου").[60] Μια άλλη ιδέα της ανάπτυξης καρκίνου βασίζεται στην έκθεση σε ασθενή μαγνητικά και ηλεκτρομαγνητικά πεδία και τις επιπτώσεις τους στην οξειδωτική καταπόνηση, γνωστή ως μαγνητοκαρκινογένεση.[61] Ορισμένοι συγγραφείς αμφισβήτησαν την υπόθεση ότι οι καρκίνοι προκύπτουν από διαδοχικές τυχαίες μεταλλάξεις ως υπεραπλουστευτική, υποδηλώνοντας ότι ο καρκίνος προκύπτει από την αδυναμία του σώματος να αναστέλλει μια έμφυτη, προγραμματισμένη τάση πολλαπλασιασμού.[62] Μια σχετική θεωρία προτείνει ότι ο καρκίνος είναι ένας αταβισμός, μια εξελικτική επιστροφή σε μια προγενέστερη μορφή πολυκυτταρικής ζωής.[63] Τα γονίδια που είναι υπεύθυνα για την ανεξέλεγκτη κυτταρική ανάπτυξη και τη συνεργασία μεταξύ καρκινικών κυττάρων είναι πολύ παρόμοια με εκείνα που επέτρεψαν στις πρώτες πολυκύτταρες μορφές ζωής να ομαδοποιηθούν και να ανθίσουν. Αυτά τα γονίδια εξακολουθούν να υπάρχουν στα γονιδιώματα πιο πολύπλοκων μεταζωών, όπως των ανθρώπων, αν και τα πιο πρόσφατα εξελιγμένα γονίδια τα κρατούν υπό έλεγχο. Όταν τα νεότερα γονίδια ελέγχου αποτυγχάνουν για οποιονδήποτε λόγο, το κύτταρο μπορεί να επιστρέψει στον πιο πρωτόγονο προγραμματισμό του και να αναπαραχθεί εκτός ελέγχου. Η θεωρία είναι μια εναλλακτική στην αντίληψη ότι οι καρκίνοι ξεκινούν με απρόβλεπτα κύτταρα που υφίστανται εξέλιξη μέσα στο σώμα. Αντίθετα, διαθέτουν έναν σταθερό αριθμό πρωτόγονων γονιδίων που ενεργοποιούνται προοδευτικά, δίνοντάς τους πεπερασμένη μεταβλητότητα.[64] Μια άλλη εξελικτική θεωρία επαναφέρει τις ρίζες του καρκίνου στην προέλευση του ευκαρυωτικού κυττάρου (με πυρήνα) με μαζική οριζόντια μεταφορά γονιδίου, όταν τα γονιδιώματα των μολυσματικών ιών διασπάστηκαν (και ως εκ τούτου εξασθένησαν) από τον ξενιστή, αλλά τα θραύσματά τους ενσωματώθηκαν στο γονιδίωμα του ξενιστή ως ανοσολογική προστασία. Έτσι, ο καρκίνος ξεκινά όταν μια σπάνια σωματική μετάλλαξη ανασυνδυάζει τέτοια θραύσματα σε ένα λειτουργικό οδηγό πολλαπλασιασμού των κυττάρων.[65]
Βιολογία καρκινικών κυττάρων[Επεξεργασία | επεξεργασία κώδικα]

Συχνά, οι πολλαπλές γενετικές αλλαγές που οδηγούν σε καρκίνο μπορεί να χρειαστούν πολλά χρόνια για να συσσωρευτούν. Κατά τη διάρκεια αυτής της περιόδου, η βιολογική συμπεριφορά των προκακοήθων κυττάρων αλλάζει αργά από τις ιδιότητες των φυσιολογικών κυττάρων σε ιδιότητες που μοιάζουν με καρκίνο. Ο προκακοήθης ιστός μπορεί να έχει διακριτή εμφάνιση στο μικροσκόπιο. Μεταξύ των διακριτών χαρακτηριστικών μιας προκακοήθους βλάβης είναι ο αυξημένος αριθμός διαιρούμενων κυττάρων, η διακύμανση στο μέγεθος και το σχήμα του κυτταρικού πυρήνα, διακύμανση του κυττάρου στο μέγεθος και το σχήμα, απώλεια εξειδικευμένων κυτταρικών χαρακτηριστικών και απώλεια οργάνωσης Η δυσπλασία (Dysplasia) είναι ένας μη φυσιολογικός τύπος υπερβολικού κυτταρικού πολλαπλασιασμού που χαρακτηρίζεται από απώλεια φυσιολογικής διάταξης ιστού και κυτταρικής δομής σε προκακοήθη κύτταρα. Αυτές οι πρώιμες νεοπλασματικές αλλαγές πρέπει να διακρίνονται από την υπερπλασία (hyperplasia), μια αναστρέψιμη αύξηση της κυτταρικής διαίρεσης που προκαλείται από ένα εξωτερικό ερέθισμα, όπως μια ορμονική ανισορροπία ή χρόνιος ερεθισμός. Οι πιο σοβαρές περιπτώσεις δυσπλασίας αναφέρονται ως επιτόπιο καρκίνωμα (carcinoma in situ). Το "καρκίνωμα in situ" αναφέρεται σε μια ανεξέλεγκτη ανάπτυξη δυσπλαστικών κυττάρων που παραμένει στην αρχική του θέση και δεν έχει δείξει εισβολή σε άλλους ιστούς. Το καρκίνωμα in situ μπορεί να εξελιχθεί σε διηθητική κακοήθεια και συνήθως αφαιρείται χειρουργικά όταν ανιχνευθεί.
Κλωνική εξέλιξη[Επεξεργασία | επεξεργασία κώδικα]
Ακριβώς όπως ένας πληθυσμός ζώων υφίσταται εξέλιξη, ένας μη ελεγχόμενος πληθυσμός κυττάρων μπορεί επίσης να υποστεί "εξέλιξη". Αυτή η ανεπιθύμητη διαδικασία ονομάζεται σωματική εξέλιξη, και είναι ο τρόπος με τον οποίο ο καρκίνος εμφανίζεται και γίνεται πιο κακοήθης με την πάροδο του χρόνου.[66] Οι περισσότερες αλλαγές στον κυτταρικό μεταβολισμό που επιτρέπουν στα κύτταρα να αναπτύσσονται με άτακτο τρόπο οδηγούν σε κυτταρικό θάνατο. Ωστόσο, μόλις ξεκινήσει ο καρκίνος, τα καρκινικά κύτταρα υποβάλλονται σε μια διαδικασία φυσικής επιλογής: τα λίγα κύτταρα με νέες γενετικές αλλαγές που ενισχύουν την επιβίωση ή την αναπαραγωγή τους πολλαπλασιάζονται γρηγορότερα και σύντομα κυριαρχούν στον αναπτυσσόμενο όγκο ως κύτταρα με λιγότερο ευνοϊκή γενετική αλλαγή.[67] Αυτός είναι ο ίδιος μηχανισμός με τον οποίο παθογόνα είδη όπως ο ανθεκτικός στη μεθικιλλίνη Staphylococcus aureus (Methicillin-resistant Staphylococcus aureus, MRSA) μπορεί να γίνει ανθεκτικός στα αντιβιοτικά και με τον οποίο ο HIV μπορεί να γίνει ανθεκτικός στα φάρμακα, και με τον οποίο οι ασθένειες των φυτών και τα εντόμων μπορούν να γίνουν ανθεκτικές στα φυτοφάρμακα. Αυτή η εξέλιξη εξηγεί γιατί μια υποτροπή καρκίνου περιλαμβάνει συχνά κύτταρα που έχουν αποκτήσει αντίσταση στα φάρμακα του καρκίνου ή αντίσταση στην ακτινοθεραπεία.
Βιολογικές ιδιότητες καρκινικών κυττάρων[Επεξεργασία | επεξεργασία κώδικα]
Σε ένα άρθρο του 2000 από τους Douglas Hanahan και Robert Weinberg, οι βιολογικές ιδιότητες των κυττάρων κακοήθους όγκου συνοψίστηκαν ως εξής:[68]
- Απόκτηση αυτάρκειας σε σήματα ανάπτυξης, που οδηγεί σε ανεξέλεγκτη ανάπτυξη.
- Απώλεια ευαισθησίας στα σήματα κατά της ανάπτυξης, που οδηγεί επίσης σε ανεξέλεγκτη ανάπτυξη.
- Απώλεια ικανότητας για απόπτωση, που επιτρέπει την ανάπτυξη παρά τα γενετικά λάθη και τα εξωτερικά σήματα κατά της ανάπτυξης.
- Απώλεια ικανότητας για γήρανση, που οδηγεί σε απεριόριστες δυνατότητες αναπαραγωγής (αθανασία)
- Απόκτηση διατηρήσιμης αγγειογένεσης, που επιτρέπει στον όγκο να αναπτυχθεί πέρα από τους περιορισμούς της παθητικής διάχυσης θρεπτικών ουσιών.
- Απόκτηση ικανότητας εισβολής σε γειτονικούς ιστούς, η καθοριστική ιδιότητα του διηθητικού καρκινώματος.
- Απόκτηση ικανότητας διασποράς μετάστασης σε απομακρυσμένες θέσεις, ιδιότητα όψιμης εμφάνισης ορισμένων κακοήθων όγκων (καρκινωμάτων ή άλλων).
Η ολοκλήρωση αυτών των πολλαπλών βημάτων θα ήταν ένα πολύ σπάνιο γεγονός χωρίς:
- Απώλεια ικανότητας επιδιόρθωσης γενετικών σφαλμάτων, που οδηγεί σε αυξημένο ποσοστό μεταλλάξεων (γονιδιωματική αστάθεια), επιταχύνοντας έτσι όλες τις άλλες αλλαγές.
Αυτές οι βιολογικές αλλαγές είναι κλασικές στα καρκινώματα. Άλλοι κακοήθεις όγκοι μπορεί να μην χρειάζεται όες αυτές τις αλλαγές για να επιτύχουν. Για παράδειγμα, δεδομένου ότι η εισβολή ιστού και η μετατόπιση σε απομακρυσμένες τοποθεσίες είναι φυσιολογικές ιδιότητες των λευκοκυττάρων, αυτά τα βήματα δεν χρειάζονται για την ανάπτυξη της λευχαιμίας. Ούτε τα διαφορετικά βήματα αντιπροσωπεύουν απαραιτήτως μεμονωμένες μεταλλάξεις. Για παράδειγμα, η αδρανοποίηση ενός μόνο γονιδίου, που κωδικοποιεί την πρωτεΐνη p53, θα προκαλέσει γονιδιωματική αστάθεια, αποφυγή απόπτωσης και αυξημένη αγγειογένεση. Επιπλέον, δεν διαιρούνται όλα τα καρκινικά κύτταρα. Αντίθετα, ένα υποσύνολο των κυττάρων σε έναν όγκο, που ονομάζεται καρκινικά βλαστοκύτταρα, αναπαράγονται καθώς δημιουργούν διαφοροποιημένα κύτταρα.[69]
Ο καρκίνος ως ελάττωμα στις αλληλεπιδράσεις των κυττάρων[Επεξεργασία | επεξεργασία κώδικα]
Κανονικά, μόλις τραυματιστεί ή μολυνθεί ένας ιστός, τα κατεστραμμένα κύτταρα προκαλούν φλεγμονή διεγείροντας συγκεκριμένα μοτίβα ενζυμικής δραστηριότητας και έκφρασης γονιδίου κυτοκίνης στα γύρω κύτταρα.[70][71] Εκκρίνονται διακριτές συστάδες ("συστάδες κυτοκινών") μορίων, τα οποία δρουν ως μεσολαβητές, επάγοντας τη δραστηριότητα των επόμενων καταρρακτών βιοχημικών αλλαγών.[72] Κάθε κυτοκίνη συνδέεται με συγκεκριμένους υποδοχείς σε διάφορους κυτταρικούς τύπους και κάθε κυτταρικός τύπος ανταποκρίνεται με τη σειρά του αλλάζοντας τη δραστηριότητα των ενδοκυτταρικών οδών μεταγωγής σήματος, ανάλογα με τους υποδοχείς που εκφράζει το κύτταρο και τα μόρια σηματοδότησης που υπάρχουν μέσα στο κύτταρο.[73][74] Συλλογικά, αυτή η διαδικασία επαναπρογραμματισμού προκαλεί μια σταδιακή αλλαγή στους φαινοτύπους των κυττάρων, η οποία τελικά θα οδηγήσει στην αποκατάσταση της λειτουργίας των ιστών και στην ανάκτηση της βασικής δομικής ακεραιότητας.[75][76] Ένας ιστός μπορεί έτσι να επουλωθεί, ανάλογα με την παραγωγική επικοινωνία μεταξύ των κυττάρων που υπάρχουν στο σημείο της βλάβης και του ανοσοποιητικού συστήματος.[77] Ένας βασικός παράγοντας στην επούλωση είναι η ρύθμιση της έκφρασης του γονιδίου της κυτοκίνης, η οποία επιτρέπει σε συμπληρωματικές ομάδες κυττάρων να ανταποκρίνονται στους φλεγμονώδεις μεσολαβητές με τρόπο που σταδιακά προκαλεί ουσιαστικές αλλαγές στη φυσιολογία των ιστών.[78][79][80] Τα καρκινικά κύτταρα έχουν είτε μόνιμες (γενετικές), είτε αναστρέψιμες (επιγενετικές) αλλαγές στο γονιδίωμά τους, οι οποίες αναστέλλουν εν μέρει την επικοινωνία τους με τα γύρω κύτταρα και με το ανοσοποιητικό σύστημα.[81][82] Τα καρκινικά κύτταρα δεν επικοινωνούν με το μικροπεριβάλλον των ιστών τους με τρόπο που να προστατεύει την ακεραιότητα των ιστών. Αντίθετα, η κίνηση και η επιβίωση των καρκινικών κυττάρων καθίσταται δυνατή σε θέσεις όπου μπορούν να επηρεάσουν τη λειτουργία των ιστών.[83][84] Τα καρκινικά κύτταρα επιβιώνουν με την "επανακαλωδίωση" των οδών σήματος που κανονικά προστατεύουν τον ιστό από το ανοσοποιητικό σύστημα. Αυτή η μεταβολή της ανοσολογικής απόκρισης είναι εμφανής και στα αρχικά στάδια της κακοήθειας.[85][86] Ένα παράδειγμα επανακαλωδίωσης της λειτουργίας των ιστών στον καρκίνο είναι η δραστηριότητα του μεταγραφικού παράγοντα NF-κB.[87] Το NF-κΒ ενεργοποιεί την έκφραση πολλών γονιδίων που εμπλέκονται στη μετάβαση μεταξύ φλεγμονής και αναγέννησης, τα οποία κωδικοποιούν κυτοκίνες, παράγοντες προσκόλλησης και άλλα μόρια που μπορούν να αλλάξουν τη μοίρα των κυττάρων.[88] Αυτός ο επαναπρογραμματισμός των κυτταρικών φαινοτύπων κανονικά επιτρέπει την ανάπτυξη ενός πλήρως λειτουργικού άθικτου ιστού.[89] Η δραστηριότητα του NF-κΒ ελέγχεται στενά από πολλές πρωτεΐνες, οι οποίες συλλογικά διασφαλίζουν ότι μόνο διακριτές ομάδες γονιδίων επάγονται από το NF-κΒ σε ένα δεδομένο κύτταρο και σε μια δεδομένη στιγμή.[90] Αυτή η αυστηρή ρύθμιση της ανταλλαγής σημάτων μεταξύ των κυττάρων προστατεύει τον ιστό από υπερβολική φλεγμονή και διασφαλίζει ότι διαφορετικοί τύποι κυττάρων αποκτούν σταδιακά συμπληρωματικές λειτουργίες και συγκεκριμένες θέσεις. Η αποτυχία αυτής της αμοιβαίας ρύθμισης μεταξύ του γενετικού επαναπρογραμματισμού και των κυτταρικών αλληλεπιδράσεων επιτρέπει στα καρκινικά κύτταρα να προκαλέσουν μετάσταση. Τα καρκινικά κύτταρα ανταποκρίνονται ανώμαλα στις κυτοκίνες και ενεργοποιούν καταρράκτες σημάτων που μπορούν να τα προστατεύσουν από το ανοσοποιητικό σύστημα.[87][91]
Στα ψάρια[Επεξεργασία | επεξεργασία κώδικα]
Ο ρόλος του ιωδίου στα θαλάσσια ψάρια (πλούσια σε ιώδιο) και στα ψάρια του γλυκού νερού (με έλλειψη ιωδίου) δεν είναι πλήρως κατανοητός, αλλά έχει αναφερθεί ότι τα ψάρια του γλυκού νερού είναι πιο ευαίσθητα σε μολυσματικές και, ειδικότερα, νεοπλασματικές και αθηροσκληρωτικές ασθένειες, από τα θαλάσσια ψάρι.[92][93] Τα θαλάσσια ελασμοβράγχια ψάρια, όπως οι καρχαρίες, τα σαλάχια, κ.λπ. επηρεάζονται πολύ λιγότερο από τον καρκίνο από τα ψάρια του γλυκού νερού, και ως εκ τούτου έχουν τονώσει την ιατρική έρευνα για την καλύτερη κατανόηση της καρκινογένεσης.[94]
Μηχανισμοί[Επεξεργασία | επεξεργασία κώδικα]
Προκειμένου τα κύτταρα να αρχίσουν να διαιρούνται ανεξέλεγκτα, τα γονίδια που ρυθμίζουν την κυτταρική ανάπτυξη πρέπει να απορυθμιστούν.[95] Τα πρωτοογκογονίδια είναι γονίδια που προάγουν την κυτταρική ανάπτυξη και τη μίτωση, ενώ τα ογκοκατασταλτικά γονίδια αποθαρρύνουν την κυτταρική ανάπτυξη ή σταματούν προσωρινά την κυτταρική διαίρεση για να πραγματοποιηθεί επιδιόρθωση του DNA. Τυπικά, απαιτείται μια σειρά πολλών μεταλλάξεων σε αυτά τα γονίδια πριν ένα φυσιολογικό κύτταρο μεταμορφωθεί σε καρκινικό κύτταρο.[10] Αυτή η έννοια μερικές φορές ονομάζεται "ογκοεξέλιξη (oncoevolution)". Οι μεταλλάξεις σε αυτά τα γονίδια παρέχουν τα σήματα για τα καρκινικά κύτταρα να αρχίσουν να διαιρούνται ανεξέλεγκτα. Αλλά η ανεξέλεγκτη κυτταρική διαίρεση που χαρακτηρίζει τον καρκίνο απαιτεί επίσης ότι το διαιρούμενο κύτταρο αντιγράφει όλα τα κυτταρικά συστατικά του για να δημιουργήσει δύο θυγατρικά κύτταρα. Η ενεργοποίηση της αερόβιας γλυκόλυσης (το φαινόμενο Warburg ), η οποία δεν προκαλείται απαραίτητα από μεταλλάξεις σε πρωτοογκογονίδια και ογκοκατασταλτικά γονίδια,[96] παρέχει τα περισσότερα από τα δομικά στοιχεία που απαιτούνται για την αναπαραγωγή των κυτταρικών συστατικών ενός διαιρούμενου κυττάρου και, ως εκ τούτου, είναι επίσης απαραίτητο για την καρκινογένεση.[60]
Ογκογονίδια[Επεξεργασία | επεξεργασία κώδικα]
Τα ογκογονίδια προάγουν την κυτταρική ανάπτυξη με διάφορους τρόπους. Πολλά μπορούν να παράγουν ορμόνες, έναν "χημικό αγγελιοφόρο" μεταξύ των κυττάρων που ενθαρρύνουν τη μίτωση, η επίδραση της οποίας εξαρτάται από τη μετάδοση του σήματος του ιστού ή των κυττάρων που λαμβάνουν. Με άλλα λόγια, όταν διεγείρεται ένας ορμονικός υποδοχέας σε ένα κύτταρο δέκτη, το σήμα διοχετεύεται από την επιφάνεια του κυττάρου στον κυτταρικό πυρήνα για να επηρεάσει κάποια αλλαγή στη ρύθμιση της μεταγραφής γονιδίου σε πυρηνικό επίπεδο. Ορισμένα ογκογονίδια αποτελούν μέρος του ίδιου του συστήματος μεταγωγής σήματος ή του σήματος υποδοχέων στα ίδια τα κύτταρα και τους ιστούς, ελέγχοντας έτσι την ευαισθησία σε τέτοιες ορμόνες. Τα ογκογονίδια συχνά παράγουν μιτογόνα ή εμπλέκονται στη μεταγραφή του DNA στη πρωτεϊνοσύνθεση, η οποία δημιουργεί τις πρωτεΐνες και τα ένζυμα είναι υπεύθυνα για την παραγωγή των προϊόντων και των βιοχημικών κυττάρων που χρησιμοποιούν και αλληλεπιδρούν με αυτά. Οι μεταλλάξεις σε πρωτοογκογονίδια, τα οποία είναι τα κανονικά σε ηρεμία αντίστοιχα των ογκογονιδίων, μπορούν να τροποποιήσουν την γονιδιακή έκφραση και τη λειτουργία τους, αυξάνοντας την ποσότητα ή τη δραστικότητα της παραγόμενης πρωτεΐνης. Όταν συμβεί αυτό, τα πρωτοογκογονίδια γίνονται ογκογονίδια και αυτή η μετάβαση διαταράσσει τη φυσιολογική ισορροπία της ρύθμισης του κυτταρικού κύκλου στο κύτταρο, καθιστώντας δυνατή την ανεξέλεγκτη ανάπτυξη. Η πιθανότητα καρκίνου δεν μπορεί να μειωθεί με την αφαίρεση πρωτοογκογονιδίων από το γονιδίωμα, ακόμη κι αν αυτό ήταν δυνατό, καθώς αυτά είναι κρίσιμα για την ανάπτυξη, την επισκευή και την ομοιόσταση του οργανισμού. Μόνο όταν μεταλλάσσονται τα σήματα για ανάπτυξη γίνονται υπερβολικά. Ένα από τα πρώτα ογκογονίδια που ορίζονται στην έρευνα για τον καρκίνο είναι το ογκογονίδιο ras. Οι μεταλλάξεις στην οικογένεια των πρωτοογκογονιδίων Ras (που περιλαμβάνουν H-Ras, N-Ras και K-Ras) είναι πολύ συχνές, καθώς εντοπίζονται στο 20% έως 30% όλων των ανθρώπινων όγκων.[97]Το Ras αναγνωρίστηκε αρχικά στο γονιδίωμα του ιού σαρκώματος Harvey και οι ερευνητές εξεπλάγησαν ότι όχι μόνο αυτό το γονίδιο υπάρχει στο ανθρώπινο γονιδίωμα, αλλά και όταν απολινωθεί σε ένα διεγερτικό στοιχείο ελέγχου, θα μπορούσε να προκαλέσει καρκίνους σε καλλιέργειες κυτταρικής γραμμής.[98] Νέοι μηχανισμοί προτάθηκαν πρόσφατα ότι ο κυτταρικός μετασχηματισμός κατά τη διάρκεια της καρκινογένεσης αποφασίστηκε από το συνολικό όριο των δικτύων ογκογονιδίων (όπως η σηματοδότηση Ras), αλλά όχι από την κατάσταση του μεμονωμένου ογκογονιδίου.[99]
Πρωτοογκογονίδια[Επεξεργασία | επεξεργασία κώδικα]
Τα πρωτοογκογονίδια προάγουν την κυτταρική ανάπτυξη με διάφορους τρόπους. Πολλά μπορούν να παράγουν ορμόνες, "χημικούς αγγελιοφόρους" μεταξύ των κυττάρων που ενθαρρύνουν τη μίτωση, η επίδραση της οποίας εξαρτάται από την μετάδοση σήματος του ιστού ή των κυττάρων που τη λαμβάνουν. Μερικά είναι υπεύθυνα για το σύστημα μεταγωγής σήματος και το σήμα υποδοχέων στα ίδια τα κύτταρα και τους ιστούς, ελέγχοντας έτσι την ευαισθησία σε τέτοιες ορμόνες. Παράγουν συχνά μιτογόνα ή εμπλέκονται στη μεταγραφή του DNA στην πρωτεϊνοσύνθεση, που δημιουργεί πρωτεΐνες και ένζυμα υπεύθυνα για την παραγωγή των προϊόντων και των βιοχημικών κυττάρων που χρησιμοποιούν και αλληλεπιδρούν με αυτά. Οι μεταλλάξεις στα πρωτοογκογονίδια μπορούν να τροποποιήσουν τη έκφραση και τη λειτουργία τους, αυξάνοντας την ποσότητα ή τη δραστικότητα της παραγόμενης πρωτεΐνης. Όταν συμβεί αυτό, γίνονται ογκογονίδια και, ως εκ τούτου, τα κύτταρα έχουν μεγαλύτερη πιθανότητα να διαιρεθούν υπερβολικά και ανεξέλεγκτα. Η πιθανότητα καρκίνου δεν μπορεί να μειωθεί με την αφαίρεση πρωτοογκογονιδίων από το γονιδίωμα, καθώς είναι κρίσιμα για την ανάπτυξη, την επισκευή και την ομοιόσταση του σώματος. Μόνο όταν μεταλλάσσονται τα σήματα για ανάπτυξη γίνονται υπερβολικά. Είναι σημαντικό να σημειωθεί ότι ένα γονίδιο που έχει έναν ρόλο προαγωγής της ανάπτυξης μπορεί να αυξήσει το καρκινογόνο δυναμικό ενός κυττάρου, υπό την προϋπόθεση ότι ενεργοποιούνται όλοι οι απαραίτητοι κυτταρικοί μηχανισμοί που επιτρέπουν την ανάπτυξη.[100] Αυτή η κατάσταση περιλαμβάνει επίσης την αδρανοποίηση συγκεκριμένων ογκοκατασταλτικών γονιδίων (βλ. παρακάτω). Εάν δεν πληρούται η προϋπόθεση, το κύτταρο μπορεί να σταματήσει να αναπτύσσεται και να πεθάνει. Αυτό καθιστά τον προσδιορισμό του σταδίου και του τύπου του καρκινικού κυττάρου που αναπτύσσεται υπό τον έλεγχο ενός δεδομένου ογκογονιδίου ζωτικής σημασίας για την ανάπτυξη στρατηγικών θεραπείας.
Ογκοκατασταλτικά γονίδια[Επεξεργασία | επεξεργασία κώδικα]

Τα ογκοκατασταλτικά γονίδια κωδικοποιούν κατά του πολλαπλασιασμού σημάτων και πρωτεϊνών που καταστέλλουν τη μίτωση και την ανάπτυξη των κυττάρων. Γενικά, τα ογκοκατασταλτικά είναι παράγοντες μεταγραφής που ενεργοποιούνται από κυτταρική καταπόνηση, ή βλάβη του DNA. Συχνά, η βλάβη του DNA θα προκαλέσει την παρουσία ελεύθερα αιωρούμενου γενετικού υλικού καθώς και άλλων σημάτων, και θα πυροδοτήσει ένζυμα και μονοπάτια που οδηγούν στην ενεργοποίηση των ογκοκατασταλτικών γονιδίων. Οι λειτουργίες τέτοιων γονιδίων είναι να σταματήσουν την εξέλιξη του κυτταρικού κύκλου προκειμένου να πραγματοποιηθεί η επιδιόρθωση του DNA, αποτρέποντας τη μετάδοση μεταλλάξεων στα θυγατρικά κύτταρα. Η πρωτεΐνη p53, ένα από τα πιο σημαντικά μελετημένα ογκοκατασταλτικά γονίδια, είναι ένας μεταγραφικός παράγοντας που ενεργοποιείται από πολλούς κυτταρικούς παράγοντες καταπόνησης, όπως η υποξία και η βλάβη από υπεριώδη ακτινοβολία. Παρά το ότι σχεδόν οι μισοί από όλους τους καρκίνους που πιθανώς περιλαμβάνουν αλλοιώσεις στο p53, η ογκοκατασταλτική του λειτουργία είναι ελάχιστα κατανοητή. Το p53 έχει σαφώς δύο λειτουργίες: η μία έναν πυρηνικό ρόλο ως μεταγραφικός παράγοντας και η άλλη έναν κυτταροπλασματικό ρόλο στη ρύθμιση του κυτταρικού κύκλου, την κυτταρική διαίρεση και την απόπτωση. Το φαινόμενο Warburg είναι η προτιμησιακή χρήση της γλυκόλυσης για ενέργεια ώστε να διατηρηθεί η ανάπτυξης του καρκίνου. Το p53 έχει αποδειχθεί ότι ρυθμίζει τη μετατόπιση από την αναπνευστική στη γλυκολυτική οδό.[101] Ωστόσο, μια μετάλλαξη μπορεί να βλάψει το ίδιο το ογκοκατασταλτικό γονίδιο, ή το μονοπάτι του σήματος που το ενεργοποιεί, "σβήνοντάς το". Η αμετάβλητη συνέπεια αυτού είναι ότι η επιδιόρθωση του DNA παρεμποδίζεται ή αναστέλλεται: η βλάβη του DNA συσσωρεύεται χωρίς επιδιόρθωση, οδηγώντας αναπόφευκτα σε καρκίνο. Οι μεταλλάξεις των ογκοκατασταλτικών γονιδίων που εμφανίζονται σε κύτταρα βλαστικής γραμμής μεταβιβάζονται στον απόγονο και αυξάνουν την πιθανότητα για διαγνώσεις καρκίνου στις επόμενες γενιές. Τα μέλη αυτών των οικογενειών έχουν αυξημένη επίπτωση και μειωμένη καθυστέρηση πολλαπλών όγκων. Οι τύποι όγκων είναι τυπικοί για κάθε τύπο ογκοκατασταλτικής γονιδιακής μετάλλαξης, με ορισμένες μεταλλάξεις να προκαλούν συγκεκριμένους καρκίνους και άλλες μεταλλάξεις να προκαλούν άλλες. Ο τρόπος κληρονομικότητας των μεταλλαγμένων ογκοκατασταλτών είναι ότι ένα προσβεβλημένο μέλος κληρονομεί ένα ελαττωματικό αντίγραφο από τον έναν γονέα και ένα κανονικό αντίγραφο από τον άλλο. Για παράδειγμα, άτομα που κληρονομούν ένα μεταλλαγμένο αλληλόμορφο p53 (και επομένως είναι ετερόζυγα για το μεταλλαγμένο p53) μπορεί να αναπτύξουν μελανώματα και καρκίνο του παγκρέατος, γνωστό ως σύνδρομο Λι-Φραουμένι. Άλλα σύνδρομα κληρονομικών ογκοκατασταλτικπών γονιδίων περιλαμβάνουν μεταλλάξεις του ρετινοβλαστώματος της πρωτεΐνης, που συνδέονται με ρετινοβλάστωμα και γονιδιακές μεταλλάξεις APC, που συνδέονται με αδενοπολυποδίαση καρκίνου του παχέος εντέρου. Ο καρκίνος αδενοπολυποδίασης του παχέος εντέρου σχετίζεται με χιλιάδες πολύποδες στο παχύ έντερο όταν είναι νεαρός, οδηγώντας σε καρκίνο του παχέος εντέρου σε σχετικά νεαρή ηλικία. Τέλος, οι κληρονομικές μεταλλάξεις στα BRCA1 και BRCA2 οδηγούν σε πρώιμη έναρξη του καρκίνου του μαστού. Η ανάπτυξη του καρκίνου προτάθηκε το 1971 να εξαρτάται από τουλάχιστον δύο μεταλλάξεις. Σε αυτό που έγινε γνωστό ως Υπόθεση Knudson (υπόθεση δύο χτυπημάτων, two-hit hypothesis), μια κληρονομική, βλαστικής σειράς μετάλλαξη σε ένα ογκοκατασταλτικό γονίδιο θα προκαλούσε καρκίνο μόνο εάν ένα άλλο γεγονός μετάλλαξης συνέβη αργότερα στη ζωή του οργανισμού, απενεργοποιώντας το άλλο αλληλόμορφο αυτού του ογκοκατασταλτικού γονιδίου.[102] Συνήθως, τα ογκογονίδια είναι επικρατή γονίδια, καθώς περιέχουν μεταλλάξεις αυξημένης λειτουργικότητας (gain-of-function mutations), ενώ τα μεταλλαγμένα ογκοκατασταλτικά είναι υπολειπόμενα γονίδια, καθώς περιέχουν μεταλλάξεις απώλειας λειτουργικότητας (loss-of-function mutations). Κάθε κύτταρο έχει δύο αντίγραφα του ίδιου γονιδίου, ένα από κάθε γονέα, και στις περισσότερες περιπτώσεις η αύξηση των μεταλλάξεων λειτουργικότητας σε ένα μόνο αντίγραφο ενός συγκεκριμένου πρωτοογκογονιδίου είναι αρκετή για να γίνει αυτό το γονίδιο πραγματικό ογκογονίδιο. Από την άλλη πλευρά, οι μεταλλάξεις απώλειας λειτουργικότητας πρέπει να συμβούν και στα δύο αντίγραφα ενός ογκοκατασταλτικού γονιδίου για να καταστεί αυτό το γονίδιο εντελώς μη λειτουργικό. Ωστόσο, υπάρχουν περιπτώσεις στις οποίες ένα μεταλλαγμένο αντίγραφο ενός ογκοκατασταλτικού γονιδίου μπορεί να καταστήσει το άλλο αντίγραφο άγριου τύπου μη λειτουργικό. Αυτό το φαινόμενο ονομάζεται επικρατές αρνητικό αποτέλεσμα (dominant negative effect) και παρατηρείται σε πολλές μεταλλάξεις p53. Το μοντέλο δύο χτυπημάτων του Knudson αμφισβητήθηκε πρόσφατα από αρκετούς ερευνητές. Η αδρανοποίηση ενός αλληλόμορφου ορισμένων ογκοκατασταλτικών γονιδίων είναι αρκετή για να προκαλέσει όγκους. Αυτό το φαινόμενο ονομάζεται απλοανεπάρκεια (haploinsufficiency) και έχει αποδειχθεί από μια σειρά πειραματικών προσεγγίσεων. Οι όγκοι που προκαλούνται από απλοανεπάρκεια έχουν συνήθως μια μεταγενέστερη ηλικία έναρξης σε σύγκριση με εκείνους από μια διαδικασία δύο χτυπημάτων.[103]
Πολλαπλές μεταλλάξεις[Επεξεργασία | επεξεργασία κώδικα]
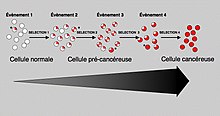
Γενικά, απαιτούνται μεταλλάξεις και στους δύο τύπους γονιδίων για την εμφάνιση καρκίνου. Για παράδειγμα, μια μετάλλαξη που περιορίζεται σε ένα ογκογονίδιο θα καταστέλλεται από τον φυσιολογικό έλεγχο της μίτωσης και τα ογκοκατασταλτικά γονίδια, σύμφωνα με την υπόθεση Knudson.[8] Μια μετάλλαξη σε ένα μόνο ογκοκατασταλτικό γονίδιο δεν θα προκαλούσε επίσης καρκίνο, λόγω της παρουσίας πολλών αντιγράφων ασφαλείας των γονιδίων που διπλασιάζουν τις λειτουργίες του. Μόνο όταν αρκετά πρωτοογκογονίδια έχουν μεταλλαχθεί σε ογκογονίδια και αρκετά ογκοκατασταλτικά γονίδια έχουν απενεργοποιηθεί ή καταστραφεί, τότε τα σήματα για την κυτταρική ανάπτυξη υπερισχύουν των σημάτων για τη ρύθμισή τους και η κυτταρική ανάπτυξη γρήγορα ξεφεύγει από τον έλεγχο.[10] Συχνά, επειδή αυτά τα γονίδια ρυθμίζουν τις διαδικασίες που αποτρέπουν τις περισσότερες βλάβες στα ίδια τα γονίδια, ο ρυθμός των μεταλλάξεων αυξάνεται καθώς μεγαλώνει κανείς, επειδή η βλάβη του DNA σχηματίζει έναν βρόχο ανατροφοδότησης. Η μετάλλαξη των ογκοκατασταλτικών γονιδίων που μεταβιβάζονται στην επόμενη γενιά όχι μόνο κυττάρων, αλλά και στους απογόνους τους, μπορεί να προκαλέσει αυξημένες πιθανότητες κληρονομικότητας των καρκίνων. Τα μέλη αυτών των οικογενειών έχουν αυξημένη επίπτωση και μειωμένη καθυστέρηση πολλαπλών όγκων. Ο τρόπος κληρονομικότητας των μεταλλαγμένων ογκοκατασταλτών είναι ότι το προσβεβλημένο μέλος κληρονομεί ένα ελαττωματικό αντίγραφο από έναν γονέα και ένα κανονικό αντίγραφο από έναν άλλο. Επειδή οι μεταλλάξεις στα ογκοκατασταλτικά δρουν με υπολειπόμενο τρόπο (σημειώστε, ωστόσο, υπάρχουν εξαιρέσεις), η απώλεια του φυσιολογικού αντιγράφου δημιουργεί τον φαινότυπο καρκίνου. Για παράδειγμα, άτομα που είναι ετερόζυγα για μεταλλάξεις p53 είναι συχνά θύματα του συνδρόμου Λι-Φραουμένι και αυτά που είναι ετερόζυγα για μεταλλάξεις πρωτεΐνης αμφιβληστροειδούς αναπτύσσουν ρετινοβλάστωμα. Με παρόμοιο τρόπο, μεταλλάξεις στο γονίδιο αδενωματώδους πολυποδίασης κόλου συνδέονται με αδενοπολυποδισιακό καρκίνο του παχέος εντέρου (adenopolyposis colon cancer), με χιλιάδες πολύποδες στο παχύ έντερο ενώ είναι νέοι, ενώ μεταλλάξεις σε BRCA1 και BRCA2 οδηγούν σε πρώιμη έναρξη του καρκίνου του μαστού. Μια νέα ιδέα που ανακοινώθηκε το 2011 είναι μια ακραία εκδοχή πολλαπλών μεταλλάξεων, που ονομάζεται χρωμοθρύψη (chromothripsis) από τους υποστηρικτές της. Αυτή η ιδέα, που επηρεάζει μόνο το 2-3% των περιπτώσεων καρκίνου, αν και έως και το 25% των καρκίνων των οστών, περιλαμβάνει την καταστροφική συντριβή ενός χρωμοσώματος σε δεκάδες ή εκατοντάδες κομμάτια και στη συνέχεια την εσφαλμένη επανατοποθέτηση. Αυτή η θραύση πιθανώς λαμβάνει χώρα όταν τα χρωμοσώματα συμπιέζονται κατά τη διάρκεια της φυσιολογικής κυτταρικής διαίρεσης, αλλά το έναυσμα για το θρυμματισμό είναι άγνωστο. Σύμφωνα με αυτό το μοντέλο, ο καρκίνος εμφανίζεται ως αποτέλεσμα ενός μεμονωμένου γεγονότος και όχι της αργής συσσώρευσης πολλαπλών μεταλλάξεων.[104]
Μη μεταλλαξιογόνα καρκινογόνα[Επεξεργασία | επεξεργασία κώδικα]
Πολλά μεταλλαξιογόνα είναι επίσης καρκινογόνα, αλλά ορισμένα καρκινογόνα δεν είναι μεταλλαξιογόνα. Παραδείγματα καρκινογόνων που δεν είναι μεταλλαξιογόνα περιλαμβάνουν το οινόπνευμα και οιστρογόνα. Αυτά πιστεύεται ότι προάγουν τους καρκίνους μέσω της διεγερτικής τους δράσης στον ρυθμό της κυτταρικής μίτωσης. Οι ταχύτεροι ρυθμοί μίτωσης αφήνουν όλο και λιγότερες ευκαιρίες για επισκευαστικά ένζυμα να επιδιορθώσουν το κατεστραμμένο DNA κατά την αντιγραφή του DNA, αυξάνοντας την πιθανότητα ενός γενετικού σφάλματος. Ένα σφάλμα που γίνεται κατά τη μίτωση μπορεί να οδηγήσει στο να λάβουν τα θυγατρικά κύτταρα εσφαλμένο αριθμό χρωμοσωμάτων, κάτι που οδηγεί σε ανευπλοειδία και μπορεί να οδηγήσει σε καρκίνο.
Ο ρόλος των λοιμώξεων[Επεξεργασία | επεξεργασία κώδικα]
Βακτηριακός[Επεξεργασία | επεξεργασία κώδικα]
Το Ελικοβακτηρίδιο του πυλωρού μπορεί να προκαλέσει γαστρικό καρκίνωμα. Παρόλο που τα δεδομένα διαφέρουν μεταξύ των διαφόρων χωρών, συνολικά περίπου το 1% έως 3% των ατόμων που έχουν μολυνθεί με το ελικοβακτηρίδιο του πυλωρού αναπτύσσουν γαστρικό καρκίνωμα στη διάρκεια της ζωής τους σε σύγκριση με το 0,13% των ατόμων που δεν είχαν λοίμωξη από ελικοβακτηρίδιο του πυλωρού.[105][106] Η λοίμωξη ελικοβακτηρίου του πυλωρού είναι πολύ διαδεδομένη. Όπως αξιολογήθηκε το 2002, υπάρχει στους γαστρικούς ιστούς στο 74% των μεσήλικων ενηλίκων στις αναπτυσσόμενες χώρες και στο 58% στις ανεπτυγμένες χώρες.[107] Δεδομένου ότι το 1% έως 3% των μολυσμένων ατόμων είναι πιθανό να αναπτύξουν γαστρικό καρκίνο,[108] ο γαστρικός καρκίνος που επάγεται από το ελικοβακτηρίδιο του πυλωρού είναι η τρίτη υψηλότερη αιτία θνησιμότητας από καρκίνο παγκοσμίως από το 2018.[109] Η λοίμωξη από ελικοβακτηρίδιο του πυλωρού δεν προκαλεί συμπτώματα στο 80% περίπου των μολυσμένων.[110] Περίπου το 75% των ατόμων που μολύνθηκαν με ελικοβακτηρίδιο του πυλωρού αναπτύσσουν γαστρίτιδα.[111] Έτσι, η συνήθης συνέπεια της λοίμωξης από ελικοβακτηρίδιο του πυλωρού είναι χρόνια ασυμπτωματική γαστρίτιδα.[112] Λόγω της συνήθους έλλειψης συμπτωμάτων, όταν τελικά διαγνωστεί ο καρκίνος του στομάχου, είναι συχνά αρκετά προχωρημένος. Περισσότεροι από τους μισούς ασθενείς με καρκίνο του στομάχου έχουν μετάσταση στους λεμφαδένες όταν διαγιγνώσκονται αρχικά.[113] Η γαστρίτιδα που προκαλείται από το H. pylori συνοδεύεται από φλεγμονή, που χαρακτηρίζεται από διήθηση ουδετερόφιλων και μακροφάγων στο γαστρικό επιθήλιο, η οποία ευνοεί τη συσσώρευση προφλεγμονωδών κυτοκινών και δραστικών μορφών οξυγόνου/δραστικών μορφών αζώτου (reactive oxygen species/reactive nitrogen species, ROS/RNS).[114] Η ουσιαστική παρουσία ROS/RNS προκαλεί βλάβη στο DNA συμπεριλαμβανομένης της 8-οξο-2'-δεοξυγουανοσίνης. (8-OHdG).[114] Εάν το μολυσματικό H. pylori φέρει το κυτταροτοξικό γονίδιο cagA (υπάρχει σε περίπου 60% των απομονώσεων δυτικών στελεχών και σε υψηλότερο ποσοστό για τις ασιατικές απομονώσεις), μπορεί να αυξήσει το επίπεδο του 8-OHdG στα γαστρικά κύτταρα κατά 8 φορές, ενώ εάν το Η. pylori δεν φέρουν το γονίδιο cagA, η αύξηση του 8-OHdG είναι περίπου 4 φορές.[115] Εκτός από την οξειδωτική βλάβη του DNA της 8-OHdG, η λοίμωξη του ελικοβακτηριδίου του πυλωρού προκαλεί άλλες χαρακτηριστικές βλάβες στο DNA, συμπεριλαμβανομένων των θραύσεων του διπλού κλώνου του DNA.[116] Το ελικοβακτηρίδιο του πυλωρού προκαλεί επίσης πολλές επιγενετικές αλλοιώσεις που σχετίζονται με την ανάπτυξη καρκίνου.[117][118] Αυτές οι επιγενετικές αλλοιώσεις οφείλονται στη μεθυλίωση θέσεων CpG σε προαγωγείς γονιδίων του επαγόμενου H. pylori[117]. και στην αλλοιωμένη έκφραση πολλαπλών μικροRNA του επαγόμενου H. pylori.[118] Όπως αξιολογήθηκε από τους Santos και Ribeiro [119] Η λοίμωξη του ελικοβακτηρίου του πυλωρού σχετίζεται με επιγενετικά μειωμένη αποτελεσματικότητα του μηχανισμού επιδιόρθωσης του DNA, που ευνοεί τη συσσώρευση μεταλλάξεων και τη γονιδιωματική αστάθεια καθώς και τη γαστρική καρκινογένεση. Συγκεκριμένα, οι Raza κ.α.[120] έδειξαν ότι η έκφραση των δύο πρωτεϊνών επιδιόρθωσης του DNA, ERCC1 και PMS2, μειώθηκε σοβαρά μόλις η λοίμωξη του H. pylori είχε εξελιχθεί για να προκαλέσει δυσπεψία. Η δυσπεψία εμφανίζεται σε περίπου 20% των μολυσμένων ατόμων.[121] Επιπλέον, όπως αξιολογείται από τους Raza κ.α.,[120] η ανθρώπινη γαστρική λοίμωξη με H. pylori προκαλεί επιγενετικά μειωμένη πρωτεϊνική έκφραση των πρωτεϊνών επιδιόρθωσης του DNA MLH1, MGMT και MRE11. Η μειωμένη επιδιόρθωση του DNA παρουσία αυξημένης βλάβης του DNA αυξάνει τις καρκινογόνες μεταλλάξεις και είναι πιθανόν μια σημαντική αιτία της καρκινογένεσης του ελικοβακτηρίου του πυλωρού.
Ιογενής[Επεξεργασία | επεξεργασία κώδικα]
Επιπλέον, πολλοί καρκίνοι προέρχονται από μία ιική λοίμωξη. Αυτό ισχύει ιδιαίτερα σε ζώα όπως τα πουλιά, αλλά λιγότερο σε ανθρώπους. Το 12% των ανθρώπινων καρκίνων μπορεί να αποδοθεί σε ιογενή λοίμωξη.[122] Ο τρόπος των όγκων που προκαλούνται από τον ιό μπορεί να χωριστεί σε δύο, σε οξύ μετασχηματισμό ή αργά μετασχηματιζόμενο. Σε ιούς που μετασχηματίζονται οξύτατα, τα ιικά σωματίδια φέρουν ένα γονίδιο που κωδικοποιεί ένα υπερδραστήριο ογκογονίδιο που ονομάζεται ιικό ογκογονίδιο (viral-oncogene, v-onc) και το μολυσμένο κύτταρο μετασχηματίζεται μόλις εκφραστεί το v-onc. Αντίθετα, σε ιούς που μετασχηματίζονται αργά, το γονιδίωμα του ιού εισάγεται, ειδικά καθώς η εισαγωγή ιικού γονιδιώματος είναι υποχρεωτικό μέρος των ρετροϊών, κοντά σε ένα πρωτοογκογονίδιο στο γονιδίωμα του ξενιστή. Ο ιικός προαγωγέας, ή άλλα στοιχεία ρύθμισης της μεταγραφής, με τη σειρά τους, προκαλούν υπερέκφραση αυτού του πρωτοογκογονιδίου, το οποίο, με τη σειρά του, προκαλεί ανεξέλεγκτο κυτταρικό πολλαπλασιασμό. Επειδή η εισαγωγή του ιικού γονιδιώματος δεν είναι ειδική για τα πρωτοογκογονίδια και η πιθανότητα εισαγωγής κοντά σε αυτό το πρωτοογκογονίδιο είναι χαμηλή, οι αργά μετασχηματιζόμενοι ιοί έχουν πολύ μεγάλη καθυστέρηση όγκου σε σύγκριση με τον οξύ μετασχηματιζόμενο ιό, ο οποίος ήδη φέρει το ιικό ογκογονίδιο. Ιοί που είναι γνωστό ότι προκαλούν καρκίνο όπως HPV (καρκίνος του τραχήλου της μήτρας), Ηπατίτιδα Β (καρκίνος του ήπατος) και Ιός Έπσταϊν-Μπαρ (Epstein-Barr virus, EBV) ( ένας τύπος λεμφώματος), είναι όλοι ιοί DNA. Θεωρείται ότι όταν ο ιός μολύνει ένα κύτταρο, εισάγει ένα μέρος του δικού του DNA κοντά στα γονίδια ανάπτυξης των κυττάρων, προκαλώντας κυτταρική διαίρεση. Η ομάδα των αλλαγμένων κυττάρων που σχηματίζονται από την πρώτη κυτταρική διαίρεση έχουν όλες το ίδιο ιικό DNA κοντά στα γονίδια ανάπτυξης των κυττάρων. Η ομάδα των αλλαγμένων κυττάρων είναι πλέον ειδική, επειδή ένας από τους φυσιολογικούς ελέγχους στην ανάπτυξη έχει χαθεί. Ανάλογα με τη θέση τους, τα κύτταρα μπορεί να καταστραφούν μέσω ακτινοβολίας, χημικών ουσιών από τον καπνό του τσιγάρου και φλεγμονής από βακτηριακή μόλυνση ή άλλους ιούς. Κάθε κύτταρο έχει κάποια πιθανότητα βλάβης. Τα κύτταρα συχνά πεθαίνουν εάν καταστραφούν, λόγω αποτυχίας μιας ζωτικής διαδικασίας ή του ανοσοποιητικού συστήματος, ωστόσο, μερικές φορές η βλάβη θα εξαλείψει ένα μόνο γονίδιο του καρκίνου. Σε ένα ηλικιωμένο άτομο, υπάρχουν χιλιάδες, δεκάδες χιλιάδες ή εκατοντάδες χιλιάδες νεκρά κελιά. Η πιθανότητα να εμφανιστεί κάποιος καρκίνος είναι πολύ μικρή. Όταν η βλάβη συμβαίνει σε οποιαδήποτε περιοχή αλλαγμένων κυττάρων, συμβαίνει κάτι διαφορετικό. Κάθε ένα από τα κύτταρα έχει τη δυνατότητα ανάπτυξης. Τα αλλαγμένα κύτταρα θα διαιρούνται γρηγορότερα όταν η περιοχή καταστραφεί από φυσικούς, χημικούς ή ιικούς παράγοντες. Ένας φαύλος κύκλος έχει δημιουργηθεί: Η καταστροφή της περιοχής θα προκαλέσει τη διαίρεση των αλλαγμένων κελιών, προκαλώντας μεγαλύτερη πιθανότητα να αντιμετωπίσουν εξουδετερώσεων. Αυτό το μοντέλο καρκινογένεσης είναι δημοφιλές γιατί εξηγεί γιατί αναπτύσσονται οι καρκίνοι. Θα ήταν αναμενόμενο ότι τα κύτταρα που έχουν υποστεί βλάβη από την ακτινοβολία θα πέθαιναν ή τουλάχιστον θα ήταν χειρότερα επειδή έχουν λιγότερα γονίδια που λειτουργούν. Οι ιοί αυξάνουν τον αριθμό των γονιδίων που λειτουργούν. Μια σκέψη είναι ότι μπορεί να καταλήξουμε με χιλιάδες εμβόλια για να αποτρέψουμε κάθε ιό που μπορεί να αλλάξει τα κύτταρά μας. Οι ιοί μπορούν να έχουν διαφορετικές επιπτώσεις σε διαφορετικά μέρη του σώματος. Μπορεί να είναι δυνατό να αποτραπεί ένας αριθμός διαφορετικών καρκίνων με ανοσοποίηση έναντι ενός ιικού παράγοντα. Είναι πιθανό ότι ο HPV, για παράδειγμα, έχει ρόλο σε καρκίνους των βλεννογόνων του στόματος.
Ελμινθίαση[Επεξεργασία | επεξεργασία κώδικα]
Ορισμένα παρασιτικά σκουλήκια είναι γνωστό ότι είναι καρκινογόνα.[123] Αυτά περιλαμβάνουν:
- Clonorchis sinensis (ο οργανισμός που προκαλεί κλωνορχίαση (Clonorchiasis)) και Opisthorchis viverrini (που προκαλεί οπισθορχίαση (Opisthorchiasis)) σχετίζονται με χολαγγειοκαρκίνωμα (cholangiocarcinoma).[124]
- Το γένος σχιστόσωμα (Schistosoma) (οι οργανισμοί που προκαλούν Σχιστοσωμίαση) σχετίζεται με καρκίνο της ουροδόχου κύστης.
Επιγενετική[Επεξεργασία | επεξεργασία κώδικα]
Η Επιγενετική είναι η μελέτη της ρύθμισης της γονιδιακής έκφρασης μέσω χημικών, μη μεταλλαγμένων αλλαγών στη δομή του DNA. Η θεωρία της επιγενετικής στην παθογένεια του καρκίνου είναι ότι οι μη μεταλλαγμένες αλλαγές στο DNA μπορούν να οδηγήσουν σε αλλαγές στη γονιδιακή έκφραση. Κανονικά, τα ογκογονίδια είναι σιωπηλά, για παράδειγμα, λόγω μεθυλίωσης του DNA. Η απώλεια αυτής της μεθυλίωσης μπορεί να προκαλέσει την ανώμαλη έκφραση των ογκογονιδίων, οδηγώντας σε παθογένεση καρκίνου. Γνωστοί μηχανισμοί επιγενετικής αλλαγής περιλαμβάνουν μεθυλίωση του DNA και μεθυλίωση ή ακετυλίωση πρωτεϊνών ιστόνης που συνδέονται με χρωμοσωμικό DNA σε συγκεκριμένες θέσεις. Οι κατηγορίες φαρμάκων, γνωστές ως αναστολείς HDAC και μεθυλομεταφοράση του DNA, μπορούν να επαναρυθμίσουν την επιγενετική σηματοδότηση στο καρκινικό κύτταρο. Οι επιμεταλλάξεις περιλαμβάνουν μεθυλίωση ή απομεθυλίωση των νησίδων CpG των περιοχών γονιδίων προαγωγέων, που έχουν ως αποτέλεσμα την καταστολή ή την αποκαταστολή, αντίστοιχα, της γονιδιακής έκφρασης.[125][126][127] Οι επιμεταλλάξεις μπορούν επίσης να προκύψουν με ακετυλίωση, μεθυλίωση, φωσφορυλίωση ή άλλες αλλοιώσεις στις ιστόνες, δημιουργώντας έναν κώδικα ιστόνης που καταστέλλει ή ενεργοποιεί την έκφραση γονιδίων και τέτοιες επιμεταλλάξεις ιστόνης μπορεί να είναι σημαντικοί επιγενετικοί παράγοντες στον καρκίνο.[128][129] Επιπρόσθετα, η καρκινογόνος επιμετάλλαξη μπορεί να συμβεί μέσω αλλαγών στην αρχιτεκτονική των χρωμοσωμάτων που προκαλούνται από πρωτεΐνες όπως η HMGA2.[130] Μια περαιτέρω πηγή επιμετάλλαξης οφείλεται στην αυξημένη ή μειωμένη έκφραση των μικροRNA (miRNAs). Για παράδειγμα, η επιπλέον έκφραση του miR-137 μπορεί να προκαλέσει μείωση της έκφρασης 491 γονιδίων και το miR-137 αποσιωπάται επιγενετικά στο 32% των καρκίνων του παχέος εντέρου[15]
Βλαστοκύτταρα καρκίνου[Επεξεργασία | επεξεργασία κώδικα]
Ένας νέος τρόπος εξέτασης της καρκινογένεσης προέρχεται από την ενσωμάτωση των ιδεών της αναπτυξιακής βιολογίας στην ογκολογία. Η υπόθεση των καρκινικών βλαστοκυττάρων προτείνει ότι τα διαφορετικά είδη κυττάρων σε έναν ετερογενή όγκο προέρχονται από ένα μόνο κύτταρο, που ονομάζεται καρκινικό βλαστοκύτταρο. Τα καρκινικά βλαστοκύτταρα μπορεί να προκύψουν από μετασχηματισμό ενηλίκων βλαστοκυττάρων ή διαφοροποιημένων κυττάρων μέσα σε ένα σώμα. Αυτά τα κύτταρα παραμένουν ως υποσυστατικά του όγκου και διατηρούν τις βασικές ιδιότητες των βλαστοκυττάρων. Δημιουργούν μια ποικιλία κυττάρων, είναι ικανά για αυτοανανέωση και ομοιοστατικό έλεγχο.[131] Επιπλέον, η υποτροπή του καρκίνου και η εμφάνιση μετάστασης αποδίδονται επίσης σε αυτά τα κύτταρα. Η υπόθεση του καρκινικού βλαστοκυττάρου δεν έρχεται σε αντίθεση με προηγούμενες έννοιες της καρκινογένεσης. Η υπόθεση των καρκινικών βλαστοκυττάρων είναι ένας προτεινόμενος μηχανισμός που συμβάλλει στην ετερογένεια του όγκου.
Κλωνική εξέλιξη[Επεξεργασία | επεξεργασία κώδικα]
Ενώ οι γενετικές και επιγενετικές αλλοιώσεις στα ογκοκατασταλτικά γονίδια και στα ογκογονίδια αλλάζουν τη συμπεριφορά των κυττάρων, αυτές οι αλλαγές, τελικά, καταλήγουν σε καρκίνο μέσω των επιπτώσεών τους στον πληθυσμό των νεοπλασματικών κυττάρων και στο μικροπεριβάλλον τους.[66] Τα μεταλλαγμένα κύτταρα στα νεοπλάσματα ανταγωνίζονται για χώρο και πόρους. Έτσι, ένας κλώνος με μετάλλαξη σε ένα ογκοκατασταλτικό γονίδιο ή ογκογονίδιο θα επεκταθεί μόνο σε ένα νεόπλασμα εάν αυτή η μετάλλαξη δώσει στον κλώνο ανταγωνιστικό πλεονέκτημα έναντι των άλλων κλώνων και των φυσιολογικών κυττάρων στο μικροπεριβάλλον του.[132] Έτσι, η διαδικασία της καρκινογένεσης είναι τυπικά μια διαδικασία της δαρβινικής εξέλιξης, γνωστή ως σωματική ή κλωνική εξέλιξη.[67] Επιπλέον, υπό το φως των δαρβινιστικών μηχανισμών καρκινογένεσης, έχει θεωρηθεί ότι οι διάφορες μορφές καρκίνου μπορούν να κατηγοριοποιηθούν ως εφηβικοί και γεροντολογικοί. Επί του παρόντος διεξάγεται ανθρωπολογική έρευνα για τον καρκίνο ως μια φυσική εξελικτική διαδικασία μέσω της οποίας η φυσική επιλογή καταστρέφει περιβαλλοντικά κατώτερους φαινοτύπους, ενώ υποστηρίζει άλλους. Σύμφωνα με αυτή τη θεωρία, ο καρκίνος διακρίνεται σε δύο διαφορετικούς τύπους: από τη γέννηση έως το τέλος της εφηβείας (περίπου 20 ετών) τελεολογικά τείνει προς τη δυναμική της υποστηρικτικής ομάδας και από τη μέση ηλικία έως το θάνατο (περίπου ηλικίες 40+) τελεολογικά τείνει μακριά από τη δυναμική της υπερπληθυσμένης ομάδας.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Majérus, Marie-Ange (2022-07-01). «The cause of cancer: The unifying theory» (στα αγγλικά). Advances in Cancer Biology - Metastasis 4: 100034. doi:. ISSN 2667-3940.
- ↑ Nowell, Peter C. (1976-10-01). «The Clonal Evolution of Tumor Cell Populations: Acquired genetic lability permits stepwise selection of variant sublines and underlies tumor progression.» (στα αγγλικά). Science 194 (4260): 23–28. doi:. ISSN 0036-8075. PMID 959840. Bibcode: 1976Sci...194...23N. https://www.science.org/doi/10.1126/science.959840.
- ↑ Hanahan, Douglas; Weinberg, Robert A (2000-01-07). «The Hallmarks of Cancer». Cell 100 (1): 57–70. doi:. ISSN 0092-8674. PMID 10647931.
- ↑ Hahn, William C.; Weinberg, Robert A. (2002-11-14). «Rules for Making Human Tumor Cells» (στα αγγλικά). New England Journal of Medicine 347 (20): 1593–1603. doi:. ISSN 0028-4793. PMID 12432047. http://www.nejm.org/doi/abs/10.1056/NEJMra021902.
- ↑ Calkins, Gary N. (1914-12-11). «Zur Frage der Entstehung maligner Tumoren . By Th. Boveri. Jena, Gustav Fischer. 1914. 64 pages.» (στα αγγλικά). Science 40 (1041): 857–859. doi:. ISSN 0036-8075. https://www.science.org/doi/10.1126/science.40.1041.857.
- ↑ «Stem cell divisions, somatic mutations, cancer etiology, and cancer prevention». Science 355 (6331): 1330–1334. 23 March 2017. doi:. PMID 28336671. Bibcode: 2017Sci...355.1330T.
- ↑ «The genomic landscapes of human breast and colorectal cancers». Science 318 (5853): 1108–13. November 2007. doi:. PMID 17932254. Bibcode: 2007Sci...318.1108W.
- ↑ 8,0 8,1 «Two genetic hits (more or less) to cancer». Nature Reviews. Cancer 1 (2): 157–62. November 2001. doi:. PMID 11905807.
- ↑ «A genetic model for colorectal tumorigenesis». Cell 61 (5): 759–67. June 1990. doi:. PMID 2188735.
- ↑ 10,0 10,1 10,2 «The number of key carcinogenic events can be predicted from cancer incidence». Scientific Reports 7 (1): 12170. September 2017. doi:. PMID 28939880. Bibcode: 2017NatSR...712170B.
- ↑ «The Erlang distribution approximates the age distribution of incidence of childhood and young adulthood cancers». PeerJ 9: e11976. 2021-08-06. doi:. PMID 34434669.
- ↑ Vyatkin, Alexey D.; Otnyukov, Danila V.; Leonov, Sergey V.; Belikov, Aleksey V. (14 January 2022). «Comprehensive patient-level classification and quantification of driver events in TCGA PanCanAtlas cohorts». PLOS Genetics 18 (1): e1009996. doi:. PMID 35030162.
- ↑ «Oncogenes and cancer». The New England Journal of Medicine 358 (5): 502–11. January 2008. doi:. PMID 18234754.
- ↑ «Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs». Nature 433 (7027): 769–73. February 2005. doi:. PMID 15685193. Bibcode: 2005Natur.433..769L.
- ↑ 15,0 15,1 «Epigenetic silencing of miR-137 is an early event in colorectal carcinogenesis». Cancer Research 70 (16): 6609–18. August 2010. doi:. PMID 20682795.
- ↑ «DNA damage responses: mechanisms and roles in human disease: 2007 G.H.A. Clowes Memorial Award Lecture». Molecular Cancer Research 6 (4): 517–24. April 2008. doi:. PMID 18403632.
- ↑ 17,0 17,1 «A novel application of the Margin of Exposure approach: segregation of tobacco smoke toxicants». Food and Chemical Toxicology 49 (11): 2921–33. November 2011. doi:. PMID 21802474.
- ↑ «Ultraviolet radiation and melanoma». Seminars in Cutaneous Medicine and Surgery 30 (4): 222–8. December 2011. doi:. PMID 22123420.
- ↑ «Redox biology and gastric carcinogenesis: the role of Helicobacter pylori». Redox Report 16 (1): 1–7. 2011. doi:. PMID 21605492.
- ↑ «The aflatoxin B(1) formamidopyrimidine adduct plays a major role in causing the types of mutations observed in human hepatocellular carcinoma». Proceedings of the National Academy of Sciences of the United States of America 99 (10): 6655–60. May 2002. doi:. PMID 12011430. Bibcode: 2002PNAS...99.6655S.
- ↑ «Early-stage formation of an epigenetic field defect in a mouse colitis model, and non-essential roles of T- and B-cells in DNA methylation induction». Oncogene 31 (3): 342–51. January 2012. doi:. PMID 21685942.
- ↑ «Carcinogenicity of deoxycholate, a secondary bile acid». Archives of Toxicology 85 (8): 863–71. August 2011. doi:. PMID 21267546.
- ↑ «Li-fraumeni syndrome». Genes & Cancer 2 (4): 475–84. April 2011. doi:. PMID 21779515.
- ↑ «Human cancer syndromes: clues to the origin and nature of cancer». Science 278 (5340): 1043–50. November 1997. doi:. PMID 9353177. Bibcode: 1997Sci...278.1043F.
- ↑ «Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland». The New England Journal of Medicine 343 (2): 78–85. July 2000. doi:. PMID 10891514.
- ↑ «O(6)-methylguanine methyltransferase in colorectal cancers: detection of mutations, loss of expression, and weak association with G:C>A:T transitions». Gut 54 (6): 797–802. June 2005. doi:. PMID 15888787. PMC 1774551. https://archive.org/details/sim_gut_2005-06_54_6/page/797.
- ↑ 27,0 27,1 «Elevated levels of mutation in multiple tissues of mice deficient in the DNA mismatch repair gene Pms2». Proceedings of the National Academy of Sciences of the United States of America 94 (7): 3122–7. April 1997. doi:. PMID 9096356. Bibcode: 1997PNAS...94.3122N.
- ↑ 28,0 28,1 «Differing patterns of genetic instability in mice deficient in the mismatch repair genes Pms2, Mlh1, Msh2, Msh3 and Msh6». Carcinogenesis 27 (12): 2402–8. December 2006. doi:. PMID 16728433.
- ↑ 29,0 29,1 «Disruption of Brca2 increases the spontaneous mutation rate in vivo: synergism with ionizing radiation». EMBO Reports 3 (3): 255–60. March 2002. doi:. PMID 11850397.
- ↑ «Bloom's syndrome. I. Genetical and clinical observations in the first twenty-seven patients». American Journal of Human Genetics 21 (2): 196–227. March 1969. PMID 5770175. PMC 1706430. https://archive.org/details/sim_american-journal-of-human-genetics_1969-03_21_2/page/196.
- ↑ «Double strand breaks can initiate gene silencing and SIRT1-dependent onset of DNA methylation in an exogenous promoter CpG island». PLOS Genetics 4 (8): e1000155. August 2008. doi:. PMID 18704159.
- ↑ «DNA damage, homology-directed repair, and DNA methylation». PLOS Genetics 3 (7): e110. July 2007. doi:. PMID 17616978.
- ↑ «Lifetime probability of developing lung cancer, by smoking status, Canada». Canadian Journal of Public Health 85 (6): 385–8. November 1994. PMID 7895211.
- ↑ «Intratumor heterogeneity and branched evolution revealed by multiregion sequencing». The New England Journal of Medicine 366 (10): 883–92. March 2012. doi:. PMID 22397650.
- ↑ 35,0 35,1 «Stem cell division theory of cancer». Cell Cycle 14 (16): 2547–8. August 2015. doi:. PMID 26090957.
- ↑ 36,0 36,1 36,2 «The migration ability of stem cells can explain the existence of cancer of unknown primary site. Rethinking metastasis». Oncoscience 2 (5): 467–75. May 2015. doi:. PMID 26097879.
- ↑ «Cancer etiology. Variation in cancer risk among tissues can be explained by the number of stem cell divisions». Science 347 (6217): 78–81. January 2015. doi:. PMID 25554788.
- ↑ «Field cancerization in oral stratified squamous epithelium; clinical implications of multicentric origin». Cancer 6 (5): 963–8. September 1953. doi:. PMID 13094644. https://archive.org/details/sim_cancer_1953-09_6_5/page/963.
- ↑ «Field defects in progression to gastrointestinal tract cancers». Cancer Letters 260 (1–2): 1–10. February 2008. doi:. PMID 18164807.
- ↑ «Deficient Pms2, ERCC1, Ku86, CcOI in field defects during progression to colon cancer». Journal of Visualized Experiments (41): 1931. 2010. doi:. PMID 20689513.
- ↑ «Fields and field cancerization: the preneoplastic origins of cancer: asymptomatic hyperplastic fields are precursors of neoplasia, and their progression to tumors can be tracked by saturation density in culture». BioEssays 33 (3): 224–31. March 2011. doi:. PMID 21254148.
- ↑ «Genetic reconstruction of individual colorectal tumor histories». Proceedings of the National Academy of Sciences of the United States of America 97 (3): 1236–41. February 2000. doi:. PMID 10655514. Bibcode: 2000PNAS...97.1236T.
- ↑ 43,0 43,1 43,2 «Cancer genome landscapes». Science 339 (6127): 1546–58. March 2013. doi:. PMID 23539594. Bibcode: 2013Sci...339.1546V.
- ↑ «MGMT promoter methylation and field defect in sporadic colorectal cancer». Journal of the National Cancer Institute 97 (18): 1330–8. September 2005. doi:. PMID 16174854.
- ↑ 45,0 45,1 «Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence». Langenbeck's Archives of Surgery 396 (7): 1017–26. October 2011. doi:. PMID 21706233.
- ↑ «Methylation tolerance due to an O6-methylguanine DNA methyltransferase (MGMT) field defect in the colonic mucosa: an initiating step in the development of mismatch repair-deficient colorectal cancers». Gut 59 (11): 1516–26. November 2010. doi:. PMID 20947886.
- ↑ 47,0 47,1 47,2 47,3 «Deficient expression of DNA repair enzymes in early progression to sporadic colon cancer». Genome Integrity 3 (1): 3. April 2012. doi:. PMID 22494821.
- ↑ «Frequent hypermethylation of DAPK, RARbeta, MGMT, RASSF1A and FHIT in laryngeal squamous cell carcinomas and adjacent normal mucosa». Oral Oncology 47 (2): 104–7. February 2011. doi:. PMID 21147548.
- ↑ «Increased microsatellite instability and epigenetic inactivation of the hMLH1 gene in head and neck squamous cell carcinoma». Otolaryngology–Head and Neck Surgery 141 (4): 484–90. October 2009. doi:. PMID 19786217.
- ↑ «Head and neck squamous cell carcinoma: mismatch repair immunohistochemistry and promoter hypermethylation of hMLH1 gene». American Journal of Otolaryngology 32 (6): 528–36. 2011. doi:. PMID 21353335.
- ↑ «Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions». Human Pathology 40 (11): 1534–42. November 2009. doi:. PMID 19695681. https://archive.org/details/sim_human-pathology_2009-11_40_11/page/1534.
- ↑ «Promoter methylation status of DNA repair gene (hMLH1) in gastric carcinoma patients of the Kashmir valley». Asian Pacific Journal of Cancer Prevention 13 (8): 4177–81. 2012. doi:. PMID 23098428. http://ocean.kisti.re.kr/downfile/volume/apocp/POCPA9/2012/v13n8/POCPA9_2012_v13n8_4177.pdf.
- ↑ «Role of epigenetic alterations in the pathogenesis of Barrett's esophagus and esophageal adenocarcinoma». International Journal of Clinical and Experimental Pathology 5 (5): 382–96. 2012. PMID 22808291. Review.
- ↑ «Growth of colorectal polyps: redetection and evaluation of unresected polyps for a period of three years». Gut 39 (3): 449–56. September 1996. doi:. PMID 8949653. PMC 1383355. https://archive.org/details/sim_gut_1996-09_39_3/page/449.
- ↑ «Implications of genetic heterogeneity in cancer». Annals of the New York Academy of Sciences 1267 (1): 110–6. September 2012. doi:. PMID 22954224. Bibcode: 2012NYASA1267..110S.
- ↑ «Initial sequencing and analysis of the human genome». Nature 409 (6822): 860–921. February 2001. doi:. PMID 11237011. Bibcode: 2001Natur.409..860L.
- ↑ «Identification of high-confidence somatic mutations in whole genome sequence of formalin-fixed breast cancer specimens». Nucleic Acids Research 40 (14): e107. August 2012. doi:. PMID 22492626.
- ↑ «Melanoma genome sequencing reveals frequent PREX2 mutations». Nature 485 (7399): 502–6. May 2012. doi:. PMID 22622578. Bibcode: 2012Natur.485..502B.
- ↑ «How aneuploidy affects metabolic control and causes cancer». The Biochemical Journal 340 (3): 621–30. June 1999. doi:. PMID 10359645.
- ↑ 60,0 60,1 60,2 «A new view of carcinogenesis and an alternative approach to cancer therapy». Molecular Medicine 16 (3–4): 144–53. March 2010. doi:. PMID 20062820.
- ↑ «Magnetocarcinogenesis: is there a mechanism for carcinogenic effects of weak magnetic fields?». Proceedings. Biological Sciences 285 (1879): 20180590. May 2018. doi:. PMID 29794049.
- ↑ «The somatic mutation theory of cancer: growing problems with the paradigm?». BioEssays 26 (10): 1097–107. October 2004. doi:. PMID 15382143.
- ↑ «Cancer tumors as Metazoa 1.0: tapping genes of ancient ancestors». Physical Biology 8 (1): 015001. February 2011. doi:. PMID 21301065. Bibcode: 2011PhBio...8a5001D.
- ↑ Dean, Tim. "Cancer resembles life 1 billion years ago, say astrobiologists", Australian Life Scientist, 8 February 2011. Retrieved 15 February 2011.
- ↑ «Cancer - Mutational Resurrection of Prokaryote Endofossils». Cancer Hypotheses 1 (1): 1–15. August 2016. Αρχειοθετήθηκε από το πρωτότυπο στις 2022-03-03. https://web.archive.org/web/20220303085903/http://www.cancerhypotheses.org.uk/app/download/6246775/SterrerFV.pdf. Ανακτήθηκε στις 8 May 2019.
- ↑ 66,0 66,1 «The clonal evolution of tumor cell populations». Science 194 (4260): 23–8. October 1976. doi:. PMID 959840. Bibcode: 1976Sci...194...23N.
- ↑ 67,0 67,1 «Cancer as an evolutionary and ecological process». Nature Reviews. Cancer 6 (12): 924–35. December 2006. doi:. PMID 17109012.
- ↑ «The hallmarks of cancer». Cell 100 (1): 57–70. January 2000. doi:. PMID 10647931.
- ↑ «Recent advances in cancer stem cells». Current Opinion in Genetics & Development 18 (1): 48–53. February 2008. doi:. PMID 18356041.
- ↑ «A gp130-Src-YAP module links inflammation to epithelial regeneration». Nature 519 (7541): 57–62. March 2015. doi:. PMID 25731159. Bibcode: 2015Natur.519...57T.
- ↑ «JNK is a novel regulator of intercellular adhesion». Tissue Barriers 1 (5): e26845. December 2013. doi:. PMID 24868495.
- ↑ «Glucocorticoids sensitize the innate immune system through regulation of the NLRP3 inflammasome». The Journal of Biological Chemistry 286 (44): 38703–13. November 2011. doi:. PMID 21940629.
- ↑ «Nonredundant roles of keratinocyte-derived IL-34 and neutrophil-derived CSF1 in Langerhans cell renewal in the steady state and during inflammation». European Journal of Immunology 46 (3): 552–9. March 2016. doi:. PMID 26634935.
- ↑ «Role of IL-10 in Resolution of Inflammation and Functional Recovery after Peripheral Nerve Injury». The Journal of Neuroscience 35 (50): 16431–42. December 2015. doi:. PMID 26674868.
- ↑ Seifert AW, Maden M (2014). «New insights into vertebrate skin regeneration». International Review of Cell and Molecular Biology. 310. σελίδες 129–69. doi:10.1016/B978-0-12-800180-6.00004-9. ISBN 978-0-12-800180-6. PMID 24725426. Unknown parameter
|s2cid=ignored (βοήθεια) - ↑ «CCL2 Mediates Neuron-Macrophage Interactions to Drive Proregenerative Macrophage Activation Following Preconditioning Injury». The Journal of Neuroscience 35 (48): 15934–47. December 2015. doi:. PMID 26631474.
- ↑ «Endogenous modulators of inflammatory cell recruitment». Trends in Immunology 34 (1): 1–6. January 2013. doi:. PMID 22951309.
- ↑ «Interleukin 6 and STAT3 regulate p63 isoform expression in keratinocytes during regeneration». Experimental Dermatology 25 (2): 155–7. February 2016. doi:. PMID 26566817.
- ↑ «The role of "anti-inflammatory" cytokines in axon regeneration». Cytokine & Growth Factor Reviews 24 (1): 1–12. February 2013. doi:. PMID 22985997.
- ↑ «Synergy of endothelial and neural progenitor cells from adipose-derived stem cells to preserve neurovascular structures in rat hypoxic-ischemic brain injury». Scientific Reports 5: 14985. October 2015. doi:. PMID 26447335. Bibcode: 2015NatSR...514985H.
- ↑ «Chromatin remodeling: from transcription to cancer». Cancer Genetics 207 (9): 352–7. September 2014. doi:. PMID 24825771.
- ↑ «Genetic Evidence for XPC-KRAS Interactions During Lung Cancer Development». Journal of Genetics and Genomics = Yi Chuan Xue Bao 42 (10): 589–96. October 2015. doi:. PMID 26554912.
- ↑ «Inflammatory cytokines promote the retrodifferentiation of tumor-derived hepatocyte-like cells to progenitor cells». Hepatology 60 (6): 2077–90. December 2014. doi:. PMID 25098666.
- ↑ «Ectopic lymphoid structures function as microniches for tumor progenitor cells in hepatocellular carcinoma». Nature Immunology 16 (12): 1235–44. December 2015. doi:. PMID 26502405.
- ↑ «Molecular subtyping reveals immune alterations associated with progression of bronchial premalignant lesions». Nature Communications 10 (1): 1856. April 2019. doi:. PMID 31015447. Bibcode: 2019NatCo..10.1856B.
- ↑ «Elevated T cell repertoire diversity is associated with progression of lung squamous cell premalignant lesions». Journal for Immunotherapy of Cancer 9 (9): e002647. September 2021. doi:. PMID 34580161.
- ↑ 87,0 87,1 «Dynamic aberrant NF-κB spurs tumorigenesis: a new model encompassing the microenvironment». Cytokine & Growth Factor Reviews 26 (4): 389–403. August 2015. doi:. PMID 26119834.
- ↑ «Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer». Cytokine & Growth Factor Reviews 21 (1): 11–9. February 2010. doi:. PMID 20018552.
- ↑ «The role of nuclear hormone receptors in cutaneous wound repair». Cell Biochemistry and Function 33 (1): 1–13. January 2015. doi:. PMID 25529612.
- ↑ «Negative regulation of RelA phosphorylation: emerging players and their roles in cancer». Cytokine & Growth Factor Reviews 26 (1): 7–13. February 2015. doi:. PMID 25438737.
- ↑ «The Multifaceted Roles Neutrophils Play in the Tumor Microenvironment». Cancer Microenvironment 8 (3): 125–58. December 2015. doi:. PMID 24895166.
- ↑ Venturi, Sebastiano (2011). «Evolutionary Significance of Iodine». Current Chemical Biology 5 (3): 155–162. doi:. ISSN 1872-3136.
- ↑ «Iodine, PUFAs and Iodolipids in Health and Disease: An Evolutionary Perspective». Human Evolution 29 (1–3): 185–205. 2014. ISSN 0393-9375.
- ↑ «Elasmobranch immune cells as a source of novel tumor cell inhibitors: Implications for public health». Integrative and Comparative Biology 46 (6): 1072–1081. December 2006. doi:. PMID 19343108. PMC 2664222. https://archive.org/details/sim_integrative-and-comparative-biology_2006-12_46_6/page/1072.
- ↑ «Cancer genes and the pathways they control». Nature Medicine 10 (8): 789–99. August 2004. doi:. PMID 15286780.
- ↑ «Aerobic glycolysis by proliferating cells: a protective strategy against reactive oxygen species». FASEB Journal 11 (5): 388–95. April 1997. doi:. PMID 9141507. https://archive.org/details/sim_faseb-journal_1997-04_11_5/page/388.
- ↑ «ras oncogenes in human cancer: a review». Cancer Research 49 (17): 4682–9. September 1989. PMID 2547513. http://cancerres.aacrjournals.org/cgi/pmidlookup?view=long&pmid=2547513.
- ↑ «Tumorigenic transformation of mammalian cells induced by a normal human gene homologous to the oncogene of Harvey murine sarcoma virus». Nature 297 (5866): 479–83. June 1982. doi:. PMID 6283358. Bibcode: 1982Natur.297..479C.
- ↑ «An excitable Ras/PI3K/ERK signaling network controls migration and oncogenic transformation in epithelial cells». Developmental Cell 54 (5): 608–623. September 2020. doi:. PMID 32877650.
- ↑ «The role of ATF-2 in oncogenesis». BioEssays 30 (4): 314–27. April 2008. doi:. PMID 18348191.
- ↑ «p53 regulates mitochondrial respiration». Science 312 (5780): 1650–3. June 2006. doi:. PMID 16728594. Bibcode: 2006Sci...312.1650M.
- ↑ «Mutation and cancer: statistical study of retinoblastoma». Proceedings of the National Academy of Sciences of the United States of America 68 (4): 820–3. April 1971. doi:. PMID 5279523. Bibcode: 1971PNAS...68..820K.
- ↑ «Cancer biology. A matter of dosage». Science 298 (5594): 761–3. October 2002. doi:. PMID 12399571.
- ↑ «Massive genomic rearrangement acquired in a single catastrophic event during cancer development». Cell 144 (1): 27–40. January 2011. doi:. PMID 21215367.
- ↑ «Review article: exploring the link between Helicobacter pylori and gastric cancer». Alimentary Pharmacology & Therapeutics 13 (Suppl 1): 3–11. March 1999. doi:. PMID 10209681.
- ↑ «Pathogenesis of Helicobacter pylori infection». Clin. Microbiol. Rev. 19 (3): 449–90. July 2006. doi:. PMID 16847081.
- ↑ «The global health burden of infection-associated cancers in the year 2002». Int. J. Cancer 118 (12): 3030–44. June 2006. doi:. PMID 16404738.
- ↑ «Helicobacter pylori and gastric cancer: factors that modulate disease risk». Clin. Microbiol. Rev. 23 (4): 713–39. October 2010. doi:. PMID 20930071.
- ↑ «Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods». Int. J. Cancer 144 (8): 1941–1953. April 2019. doi:. PMID 30350310.
- ↑ «Management of Helicobacter pylori infection». Am Fam Physician 65 (7): 1327–36. April 2002. PMID 11996414.
- ↑ «Helicobacter pylori in normal gastric mucosa». J Assoc Physicians India 42 (11): 863–4. November 1994. PMID 7868485.
- ↑ «Differential inflammatory response to Helicobacter pylori infection: etiology and clinical outcomes». J Inflamm Res 8: 137–47. 2015. doi:. PMID 26316793.
- ↑ «Clinical significance of lymph node metastasis in gastric cancer». World J. Gastroenterol. 20 (14): 3967–75. April 2014. doi:. PMID 24744586.
- ↑ 114,0 114,1 «Helicobacter pylori-induced inflammation and epigenetic changes during gastric carcinogenesis». World J. Gastroenterol. 21 (45): 12742–56. December 2015. doi:. PMID 26668499.
- ↑ «Oxidative DNA damage as a potential early biomarker of Helicobacter pylori associated carcinogenesis». Pathol. Oncol. Res. 20 (4): 839–46. 2014. doi:. PMID 24664859.
- ↑ «Helicobacter pylori Infection Causes Characteristic DNA Damage Patterns in Human Cells». Cell Rep 11 (11): 1703–13. June 2015. doi:. PMID 26074077.
- ↑ 117,0 117,1 «Helicobacter pylori-induced DNA Methylation as an Epigenetic Modulator of Gastric Cancer: Recent Outcomes and Future Direction». Pathogens 8 (1): 23. February 2019. doi:. PMID 30781778.
- ↑ 118,0 118,1 «The role of microRNAs in Helicobacter pylori pathogenesis and gastric carcinogenesis». Front Cell Infect Microbiol 1: 21. 2011. doi:. PMID 22919587.
- ↑ «Epigenetic regulation of DNA repair machinery in Helicobacter pylori-induced gastric carcinogenesis». World J. Gastroenterol. 21 (30): 9021–37. August 2015. doi:. PMID 26290630.
- ↑ 120,0 120,1 «Helicobacter pylori severely reduces expression of DNA repair proteins PMS2 and ERCC1 in gastritis and gastric cancer». DNA Repair (Amst.) 89: 102836. February 2020. doi:. PMID 32143126.
- ↑ «Dyspepsia: When and How to Test for Helicobacter pylori Infection». Gastroenterol Res Pract 2016: 8463614. 2016. doi:. PMID 27239194.
- ↑ «Viral infections as a cause of cancer (review)». International Journal of Oncology 30 (6): 1521–8. June 2007. doi:. PMID 17487374.
- ↑ Safdar A (2011). Management of Infections in Cancer Patients. Springer. σελ. 478. ISBN 978-1-60761-643-6.
- ↑ «Chronic bacterial and parasitic infections and cancer: a review». Journal of Infection in Developing Countries 4 (5): 267–81. June 2010. doi:. PMID 20539059.
- ↑ «The role of epigenetic transcription repression and DNA methyltransferases in cancer». Cancer 117 (4): 677–87. February 2011. doi:. PMID 20945317. Review.
- ↑ «Epigenetic modifications in cancer». Clinical Genetics 81 (4): 303–11. April 2012. doi:. PMID 22082348.
- ↑ «MAGEB2 is activated by promoter demethylation in head and neck squamous cell carcinoma». PLOS ONE 7 (9): e45534. 2012. doi:. PMID 23029077. Bibcode: 2012PLoSO...745534P.
- ↑ «Histone deacetylases mediate the silencing of miR-15a, miR-16, and miR-29b in chronic lymphocytic leukemia». Blood 119 (5): 1162–72. February 2012. doi:. PMID 22096249.
- ↑ «Epigenetic silencing of SOD2 by histone modifications in human breast cancer cells». Free Radical Biology & Medicine 45 (11): 1573–80. December 2008. doi:. PMID 18845242.
- ↑ «Negative regulation of BRCA1 gene expression by HMGA1 proteins accounts for the reduced BRCA1 protein levels in sporadic breast carcinoma». Molecular and Cellular Biology 23 (7): 2225–38. April 2003. doi:. PMID 12640109. PMC 150734. https://archive.org/details/sim_molecular-and-cellular-biology_2003-04_23_7/page/2225.
- ↑ «Cancer stem cells: models and concepts». Annual Review of Medicine 58: 267–84. 2007. doi:. PMID 17002552.
- ↑ «UVB-induced apoptosis drives clonal expansion during skin tumor development». Carcinogenesis 26 (1): 249–57. January 2005. doi:. PMID 15498793.
Περαιτέρω μελέτη[Επεξεργασία | επεξεργασία κώδικα]
- Tokar EJ, Benbrahim-Tallaa L, Waalkes MP (2011). «Chepter 14. Metal Ions in Human Cancer Development». Στο: Sigel A, Sigel H, Sigel RK. Metal ions in toxicology: effects, interactions, interdependencies. Metal Ions in Life Sciences. 8. RSC Publishing. σελίδες 375–401. doi:10.1039/9781849732116-00375. ISBN 978-1-84973-091-4.
- «Genetic alterations and DNA repair in human carcinogenesis». Seminars in Cancer Biology 14 (6): 441–8. December 2004. doi:. PMID 15489137.
- Kleinsmith LJ (2006). Principles of cancer biology. San Francisco: Pearson Benjamin Cummings. ISBN 978-0-8053-4003-7.
- «An overview of the mechanisms of mutagenesis and carcinogenesis». Mutation Research 544 (2–3): 99–106. November 2003. doi:. PMID 14644312.
- «Advances in cancer epidemiology: understanding causal mechanisms and the evidence for implementing interventions». Annual Review of Public Health 26: 37–60. 2005. doi:. PMID 15760280.
- Tannock I, Hill R, Bristow R, Harrington L (2005). The basic science of oncology (4th έκδοση). New York: McGraw-Hill. ISBN 978-0-07-138774-3.
- «Cancer stem cells: an old idea--a paradigm shift». Cancer Research 66 (4): 1883–90; discussion 1895–6. February 2006. doi:. PMID 16488983.
