Ιμιδαζόλιο
| Ιμιδαζόλιο | |
|---|---|
| |
| |
| Γενικά | |
| Όνομα IUPAC | 1Η-Ιμιδαζόλιο |
| Άλλες ονομασίες | 1,2-διαζακυκλοπεντα-2,4-διένιο, 1,3-διαζόλιο, γλυοξαλίνη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C3H4N2 |
| Μοριακή μάζα | 68,077 g/mol |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 89-91 °C |
| Σημείο βρασμού | 256 °C |
| Πυκνότητα | 1,23 g/cm3 |
| Διαλυτότητα στο νερό |
633 g/l (20 °C) |
| Χημικές ιδιότητες | |
| pKa | 14,5 (ιμιδαζόλιο) και 7,05 (συζυγές οξύ)[1] |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
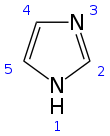
Το ιμιδαζόλιο είναι μια αζωτούχος οργανική ένωση με τον τύπο (CH)2N(NH)CH. Από χημικής άποψης είναι μια αρωματική ετεροκυκλική ένωση που ανήκει στην τάξη των αλκαλοειδών. Σε καθαρή μορφή έχει την όψη άχρωμου στερεού.
Το ιμιδαζόλιο αποτελεί την μητρική ένωση μιας μεγάλης οικογένεια ετεροκυκλικών παραγώγων (τα ιμιδαζόλια), τα οποία έχουν κοινό τον κεντρικό δακτύλιο αλλά διαφορετικούς υποκαταστάτες, είτε στα άτομα αζώτου είτε στα άτομα άνθρακα. Ο ιμιδαζολικός δακτύλιος υπάρχει σε σημαντικά βιομόρια, όπως το αμινοξύ ιστιδίνη και η ορμόνη ισταμίνη, αλλά και σε πολλές φαρμακευτικές ουσίες, όπως για παράδειγμα σε αντιμυκητιακά φάρμακα, στο νιτροϊμιδαζόλιο και στο ηρεμιστικό μιδαζολάμη.[2][3][4][5][6]
Δομή και ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το ιμιδαζόλιο είναι ένας επίπεδος πενταμελής δακτύλιος. Απαντάται σε δύο ταυτομερείς μορφές, γιατί το πρωτόνιο μπορεί να εντοπίζεται είτε στο ένα, είτε στο άλλο άτομο αζώτου. Είναι ισχυρά πολική ένωση, όπως προκύπτει από την υπολογισθείσα διπολική ροπή που ανέρχεται σε 3.61 D, και ως εκ τούτου διαλύεται εύκολα στο νερό. Η ένωση είναι αρωματική λόγω της παρουσίας έξι π ηλεκτρονίων, στα οποία περιλαμβάνονται ένα ζεύγος ηλεκτρονίων από το πρωτονιωμένο άτομο αζώτου και ένα ζεύγος από τον κάθε διπλό δεσμό. Μερικές δομές συντονισμού του δακτυλίου είναι οι ακόλουθες:
Το ιμιδαζόλιο είναι επαμφοτερίζουσα ένωση, δηλαδή μπορεί να συμπεριφερθεί είτε ως οξύ, είτε ως βάση. Ως οξύ το pKa του ιμιδαζολίου είναι 14,5 άρα η ένωση είναι λιγότερο όξινη από τα καρβοξυλικά οξέα, τις φαινόλες και τα ιμίδια, αλλά λίγο πιο όξινο από τις αλκοόλες. Το όξινο πρωτόνιο βρίσκεται στο άζωτο με τον αριθμό θέσης 1. Σαν βάση το pKa του συζυγούς οξέος (δηλαδή του πρωτονιωμένου, θετικά φορτισμένου ιμιδαζολίου) είναι περίπου 7, καθιστώντας το ιμιδαζόλιο σχεδόν εξήντα φορές πιο βασικό από την πυριδίνη. Το άτομο που δρα σαν βάση είναι το άζωτο με τον αριθμό θέσης 3.
Σύνθεση
[Επεξεργασία | επεξεργασία κώδικα]Το ιμιδαζόλιο μπορεί να παρασκευασθεί με διάφορες συνθετικές μεθόδους. Πολλές από αυτές είναι εφαρμόσιμες σε διαφορετικά υποκατεστημένα ιμιδαζολικά παράγωγα, παραλλάσσοντας τις χαρακτηριστικές ομάδες των αντιδρώντων. Οι μέθοδοι κατηγοριοποιούνται συνήθως ανάλογα με το ποιοι και πόσοι δεσμοί σχηματίζονται για να προκύψει ο ιμιδαζολικός δακτύλιος.
- Αντίδραση Debus
Η πρώτη σύνθεση του ιμιδαζολίου ανακοινώθηκε το 1858 από τον Χάινριχ Ντέμπους (Heinrich Debus), αν και διάφορα παράγωγά του είχαν ανακαλυφθεί ήδη στην δεκαετία του 1840. Στη συγκεκριμένη σύνθεση χρησιμοποιήθηκε γλυοξάλη (αιθανοδιάλη) και φορμαλδεΰδη σε αμμωνία.[7] Από την εμπειρική ονομασία του αντιδραστηρίου «γλυοξάλη», το ιμιδαζόλιο ονομάστηκε αρχικά «γλυοξαλίνη». Η αντίδραση Debus σχηματίζει τους (1,2), (3,4), και (1,5) δεσμούς του ιμιδαζολίου, χρησιμοποιώντας κάθε ένα από τα αντιδρώντα ως τμήμα του δακτυλίου, και ως εκ τούτου η μέθοδος αυτή υπάγεται στις συνθέσεις τριών δεσμών.
- Αντίδραση Debus-Radziszewski
Η απόδοση της αρχικής μεθόδου είναι χαμηλή, όμως μια βελτιωμένη παραλλαγή της που βασίζεται σε συμπύκνωση δικετόνης, αλδεΰδης και αμμωνίας χρησιμοποιείται ακόμη και σήμερα για την παρασκευή ιμιδαζολίων με υποκαταστάτες σε άτομα άνθρακα του δακτυλίου.[8] Κατά την αντίδραση σχηματίζονται τέσσερεις από τους δεσμούς του ιμιδαζολικού δακτυλίου.
Η αντίδραση λαμβάνει χώρα σε δύο στάδια. Στο πρώτο στάδιο η δικετόνη αντιδρά με την αμμωνία προς σχηματισμό μιας διιμίνης,
και έπειτα η διιμίνη συμπυκνώνεται με την αλδεΰδη και δίνει το (C-υποκατεστημένο) ιμιδαζόλιο
- Αντίδραση Arduengo
Μια παραλλαγή της παραπάνω μεθόδου με την οποία λαμβάνονται ιμιδαζόλια με υποκαταστάτες σε άζωτο βασίζεται σε αντικατάσταση της αμμωνίας από μια αμίνη:[9]
- Σχηματισμός δύο δεσμών
Οι δεσμοί (1,2) και (2,3) μπορούν να δημιουργηθούν με αντίδραση σε υψηλή θερμοκρασία ενός 1,2-διαμινοαλκανίου με μια αλκοόλη, μια αλδεΰδη ή ένα καρβοξυλικό οξύ. Απαιτείται η παρουσία ενός καταλύτη όπως λευκόχρυσος ή αλουμίνα.
Οι δεσμοί (1,2) και (3,4) μπορούν επίσης να σχηματισθούν με θέρμανση N-υποκατεστημένων α-αμινοκετονών και φορμαμιδίου. Το προϊόν είναι ένα 1,4-διυποκατεστημένο ιμιδαζόλιο, ή η ίδια η μητρική ένωση εφόσον R=R1=H. Η αντίδραση αυτή έχει μέτρια απόδοση αλλά είναι αποτελεσματική για την επίτευξη 1,4 υποκατάστασης στον δακτύλιο.
- Σχηματισμός από άλλες ετεροκυκλικές ενώσεις
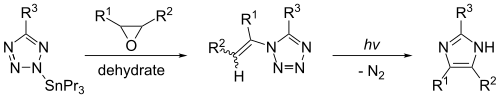
Το ιμιδαζόλιο μπορεί να συντεθεί και με φωτόλυση του 1-βινυλοτετραζολίου. Η αντίδραση δίνει ικανοποιητικές αποδόσεις μόνο εάν το αντιδρών παραχθεί από μια οργανοκασσιτερική ένωση, όπως το 2-τριβουτυλοσταννατετραζόλιο. Η ακόλουθη αντίδραση οδηγεί σε ιμιδαζόλιο όταν R=R1=R2=Η.
Πολύ καθαρό ιμιδαζόλιο σχηματίζεται στην αέρια φάση με αντίδραση φορμαμιδίου, αιθυλενοδιαμίνης και υδρογόνου με καταλύτη λευκόχρυσο ή αλουμίνα, σε θερμοκρασία μεταξύ 340 και 480 °C.
Βιολογική σημασία
[Επεξεργασία | επεξεργασία κώδικα]Το ιμιδαζόλιο είναι τμήμα πολλών σημαντικών βιολογικών μορίων. Το πιο διαδεδομένο είναι το αμινοξύ ιστιδίνη, που έχει έναν ιμιδαζολικό δακτύλιο στην πλευρική αλυσίδα. Η ιστιδίνη είναι ένα από τα δομικά στοιχεία των πρωτεϊνών και ενζύμων και παίζει σημαντικό ρόλο στη δομή και τη χημική συμπεριφορά της αιμοσφαιρίνης. Με αποκαρβοξυλίωση η ιστιδίνη μετατρέπεται σε ισταμίνη, μια επίσης συνήθη βιολογική ένωση:

Χρήσεις και εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Το ιμιδαζόλιο είναι σημαντικό τμήμα πολλών φαρμακευτικών ουσιών. Συνθετικά παράγωγα του ιμιδαζολίου υπάρχουν σε πολλά μυκητοκτόνα και αντιμυκητιακά,[10] αντιπρωτοζωικά και αντιυπερτασικά σκευάσματα. Το ιμιδαζόλιο είναι μέρος του μορίου της θεοφυλλίνης, μιας ουσίας που απαντάται στα φύλλα του τσαγιού και στους κόκκους του καφέ και η οποία δρα ως διεγερτικό του κεντρικού νευρικού συστήματος. Είναι επίσης μέρος του αντικαρκινικού φαρμάκου μερκαπτοπουρίνη, που χρησιμοποιείται στην αντιμετώπιση της λευχαιμίας.
Το ιμιδαζόλιο χρησιμοποιείται ευρέως ως αντιδιαβρωτικό σε κάποια μεταβατικά μέταλλα όπως ο χαλκός. Η προστασία του χαλκού από τη διάβρωση, ιδιαίτερα σε υδατικά συστήματα, είναι σημαντική γιατί η διάβρωση ελαττώνει την αγωγιμότητα του μετάλλου.
Πολλές ενώσεις τεχνολογικής σημασίας περιέχουν παράγωγα του ιμιδαζολίου. Για παράδειγμα η θερμοανθεκτική ένωση πολυβενζιμιδαζόλιο (PBI), που χρησιμοποιείται σαν επιβραδυντής καύσης, περιέχει ιμιδαζόλιο συμπυκνωμένο με έναν δακτύλιο βενζολίου και ενωμένο με βενζόλιο. Το ιμιδαζόλιο απαντάται επίσης σε διάφορες χημικές ενώσεις που χρησιμοποιούνται στη φωτογραφία και στη βιομηχανία ηλεκτρονικών.
Άλατα του ιμιδαζολίου
[Επεξεργασία | επεξεργασία κώδικα]Το ιμιδαζόλιο μπορεί είτε να πάρει ένα επιπλέον πρωτόνιο (στο άζωτο 3) και να φορτισθεί θετικά:
είτε να χάσει το πρωτόνιο από το άζωτο 1 και να φορτισθεί αρνητικά:
Το κατιόν και το ανιόν που σχηματίζονται κατ' αυτόν τον τρόπο είναι χημικώς σταθερά και δίνουν άλατα, συνδυαζόμενα με άλλο αντίθετα φορτισμένο ιόν (π.χ. ανιόν χλωρίου ή κατιόν καλίου). Ιμιδαζολικά άλατα έχουν χρησιμοποιηθεί ως ιοντικά υγρά και ως πρόδρομες ενώσεις σταθερών καρβενίων.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ H. Walba, R. W. Isensee (1961) «Acidity constants of some arylimidazoles and their cations», J. Org. Chem., 26, 2789.
- ↑ A. R. Katritzky (1984) Comprehensive Heterocyclic Chemistry, Vol. 5, σελ. 469-498.
- ↑ M. R. Grimmett (1997) Imidazole and Benzimidazole Synthesis, Academic Press.
- ↑ E. G. Brown (1998) Ring Nitrogen and Key Biomolecules, Kluwer Academic Press.
- ↑ A. F. Pozharskii et al. (1997) Heterocycles in Life and Society, John Wiley & Sons.
- ↑ T. L. Gilchrist (1985) Heterocyclic Chemistry, The Bath Press.
- ↑ H. Debus (1858) Ueber die Einwirkung des Ammoniaks auf Glyoxal, Annalen der Chemie und Pharmacie, 107(2), 199–208 DOI: 10.1002/jlac.18581070209|.
- ↑ B. Radziszewski (1882) Ueber Glyoxalin und seine Homologe, Berichte der deutschen chemischen Gesellschaft, 15(2), 2706 DOI: 10.1002/cber.188201502245|.
- ↑ A. J. Arduengo (2001) Process for Manufacture of Imidazoles, US patent number 6,177,575.
- ↑ L. Shargel, Comprehensive Pharmacy Review, 6η έκδοση, σελ. 930