Βόριο: Διαφορά μεταξύ των αναθεωρήσεων
Χωρίς σύνοψη επεξεργασίας |
Χωρίς σύνοψη επεξεργασίας |
||
| Γραμμή 87: | Γραμμή 87: | ||
===Κρυσταλλική δομή=== |
===Κρυσταλλική δομή=== |
||
[[Εικόνα:Chem_star.png|100px|thumb|right| κρυσταλλική δομή του εικοσάεδρου είναι η πιο συνηθισμένη για το άτομο του βορίου]] |
|||
Η κρυσταλλική δομή του βορίου είναι από τις πιο περίπλοκες ανάμεσα στα χημικά στοιχεία. Αυτό οφείλεται στην ποικιλία των τρόπων με τους οποίους το άτομο προσπαθεί να λύσει το πρόβλημα του ηλεκτρονιακού ελλείμματος. Συνήθως, τα στοιχεία σε αυτή την κατάσταση ακολουθούν την δομή των [[μεταλλικός δεσμός|μεταλλικών δεσμών]] κάτι όμως που δεν συμβαίνει με το βόριο το οποίο προτιμάει τους [[ομοιοπολικός δεσμός|ομοιοπολικούς δεσμούς]], λόγω του μικρού του μεγέθους και της υψηλής ενέργειας ιονισμού. |
|||
Η δομή που κυριαρχεί είναι αυτή του εικοσάεδρου Β<sub>12</sub>, η οποία επίσης παρατηρείται στις δομές πολλών μεταλλικών βοριδίων και βορανίων. Η δομή αυτή αφήνει μεγάλα κενά ανάμεσα στα άτομα, ικανά να φιλοξενήσουν επιπλέον άτομα βορίου ή μετάλλων. Ακόμα και στην πυκνότερη δομή, την α-ρομβοεδρική, το ποσοστό του χώρου που είναι κατειλημμένο είναι μόλις 37% (σε σχέση με το μέγιστο 74% για σφαίρες). Η α-ρομβοεδρική περιλαμβάνει κανονικά εικοσάεδρα Β<sub>12</sub> τοποθετημένα σε μια ελαφρώς παραμορφωμένη κυβική δομή μέγιστης πυκνότητας. Η πιο θερμοδυναμικά σταθερή δομή είναι η β-ρομβοεδρική, αρκετά πιο περίπλοκη και αποτελούμενη από 105 άτομα βορίου. Τέλος, η πρώτη κρυσταλλική δομή που παρασκευάστηκε (1943) ονομάστηκε α-τετραγωνική βορίου και περιέχει 50 άτομα (4Β<sub>12</sub> + 2Β). Στη συνέχεια (1974) όμως ανακαλύφθηκε ότι αυτή η μορφή εμφανίζεται μόνο παρουσία άνθρακα ή αζώτου ως πρόσμιξη, με αποτέλεσμα στην πραγματικότητα να είναι Β<sub>50</sub>C<sub>2</sub> ή Β<sub>50</sub>Ν<sub>2</sub>. |
|||
{{επέκταση-χημεία}} |
{{επέκταση-χημεία}} |
||
Έκδοση από την 17:33, 12 Ιανουαρίου 2008
| Βόριο | |
|---|---|
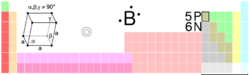
| |
| Γενικά | |
| Όνομα | Βόριο |
| Σύμβολο | Β |
| Ατομικός αριθμός | 5 |
| Χημικός ομάδα | Αμέταλλα (Μεταλλοειδή) |
| Ομάδα Περίοδος Τομέας |
13 2 p |
| Ατομικό βάρος | 10,811(7) g/mol |
| Εμφάνιση | Σκούρο καφέ (κρυσταλλικό) ή μαύρο (άμορφο) στερεό |
| Ηλεκτρονική διαμόρφωση | 1s22s22p1 |
| Ηλεκτρόνια ανά ενεργ. στάθμη |
2, 3 |
| Ιδιότητες | |
| Σημείο τήξης | 2076°C (2349 K) |
| Σημείο βρασμού | 3927°C (4200 K) |
| Πυκνότητα | 2340 kg/m3 (20°C, 1 bar) (κρυσταλλικό) 2370 kg/m3 (άμορφο) |
| Θερμότητα εξατμίσεως | 489,7 kJ/mol |
| Ηλεκτρική αγωγιμότητα | 1,5 10-6 Ω-1 cm-1 (20°C) |
| Θερμική αγωγιμότητα | 27,4 W/(m*K)(27°C) |
| Ηλεκτραρνητικότητα | 2,04 (Pauling) |
| Ενέργεια ιονισμού | 1η: 800,6 kJ/mol 2η: 2427,1 kJ/mol 3η: 3659,7 kJ/mol |
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση εκτός αν σημειώνεται διαφορετικά | |
Το χημικό στοιχείο βόριο είναι το πρώτο μέλος και το μοναδικό αμέταλλο της 13ης ομάδας του περιοδικού πίνακα των στοιχείων. Έχει σύμβολο το Β και ατομικό αριθμό 5. Είναι στερεό, είτε κρυσταλλικό είτε άμορφο, με χημικές ιδιότητες που το κατατάσσουν στην ιδιαίτερη ομάδα των μεταλλοειδών, δηλαδή χημικών στοιχείων που άλλοτε συμπεριφέρονται ως μέταλλα και άλλοτε ως αμέταλλα.
Στη φύση δεν ανευρίσκεται ποτέ ελεύθερο παρά σε ενώσεις με άλλα χημικά στοιχεία κυρίως με τη μορφή του ορυκτού βόρακα (τετραβορικό νάτριο).
Το όνομα του βορίου (boron) υποδεικνύει την κυριότερη πηγή του (βόρακας) και την συγγένειά του με τον άνθρακα: bor(ax + carb)on.
Το στοιχείο βόριο χρησιμοποιείται ως πρόσθετο στη βιομηχανία των ημιαγωγών, ενώ οι ενώσεις του βορίου χρησιμοποιούνται κυρίως στην υαλουργία για την παρασκευή ειδικών τύπων γυαλιού (pyrex, υαλοβάμβακας), στη παρασκευή απορρυπαντικών και εντομοκτόνων αλλά και στην παρασκευή ελαφρών δομικών υλικών με εφαρμογή στην αεροναυπηγική.
Ιστορία
Το στοιχείο βόριο, με τη μορφή των ενώσεών και κυρίως του βόρακα, ήταν γνωστό από τα αρχαία χρόνια όπου χρησιμοποιούνταν για τη κατασκευή γυάλινων αντικειμένων.
Σποραδικές έρευνες κατά το 18ο αιώνα οδήγησαν τελικά στην απομόνωση ακάθαρτου βορίου (~50%) στα 1808 από τον Sir Humphry Davy, Joseph-Louis Gay-Lussac και Louis Jaques Thénard, με αναγωγή βορικού οξέος με νάτριο ή μαγνήσιο. Στη συνέχεια, στα 1892, ο H. Moissan κατάφερε να παραλάβει δείγματα του στοιχείου με καθαρότητα 95-98% με αναγωγή οξειδίου του βορίου με μαγνήσιο. Τέλος, στα 1909, ο Αμερικανός χημικός W. Weintraub ήταν ο πρώτος που παρέλαβε βόριο υψηλής καθαρότητας (>99%).
Ιδιότητες
Το βόριο απαντάται στη φύση σε δύο σταθερά ισότοπα, το 10Β και 11Β, σε αναλογία περίπου 20% και 80% αντίστοιχα. Αυτά τα ισότοπα και η ποικιλία στην αναλογία τους σε σχέση με το κοίτασμα από το οποίο προέρχονται, εμποδίζει τον προσδιορισμό του ατομικού του βάρους με μεγαλύτερη ακρίβεια (10Β=10,012939 και 11Β=11,009305). Παρόμοια προβλήματα στον προσδιορισμό των φυσικών ιδιοτήτων του προκαλούν και οι πολλές και διαφορετικές φυσικές μορφές με τις οποίες εμφανίζεται αλλά και το γεγονός ότι συνήθως περιέχει προσμίξεις ιδιαίτερα δύσκολο να απομακρυνθούν.
Το βόριο σε καθαρή μορφή είναι σκούρο καφέ ή μαύρο στερεό, συνήθως άμορφο (σκόνη) αλλά και κρυσταλλικό. Είναι εξαιρετικά σκληρό και πυρίμαχο στερεό με υψηλό σημείο τήξεως και σχετικά χαμηλή πυκνότητα. Είναι κακός αγωγός του ηλεκτρισμού υπό κανονικές συνθήκες αλλά μετατρέπεται σε καλό αγωγό σε υψηλές θερμοκρασίες.

Όσον αφορά τις χημικές ιδιότητές του, αυτές καθορίζονται σε μεγάλο βαθμό από το μικρό του μέγεθος και την υψηλή ενέργεια ιονισμού. Το βόριο, όπως και οι γείτονές του στον περιοδικό πίνακα άνθρακας και πυρίτιο, παρουσιάζει μια σημαντική προτίμηση στη δημιουργία κυρίως ομοιοπολικών δεσμών. Σε αντίθεση όμως με αυτούς, παρουσιάζει “ηλεκτρονιακό έλλειμμα” δηλαδή διαθέτει ένα λιγότερο ηλεκτρόνιο σθένους (3), τα οποία συνεισφέρουν στη δημιουργία των ομοιοπολικών δεσμών, από ότι τροχιακά σθένους (s, px, py, pz). Αποτέλεσμα αυτού του γεγονότος είναι να λειτουργεί ως δέκτης ηλεκτρονίων (ηλεκτρονιόφιλο) και οι διάφορες ενώσεις του να συμπεριφέρονται ως οξέα κατά Lewis. Επίσης η πολύ μικρή ηλεκτραρνητικότητα του (έχει τι μικρότερη τιμή στα αμέταλλα - 2,04) έχει αποτέλεσμα να οξειδώνεται πολύ εύκολα. Η τιμή αυτή είναι μικρότερη τόσο από την τιμή του υδρογόνου (2,1) όσο και από του άνθρακα (2,5) με αποτέλεσμα ο δεσμός Β-Η να έχει αντίθετη πολικότητα από αυτή του C-H, γεγονός αρκετά σημαντικό στις αντιδράσεις υδροβοριόσεως.
Ενώσεις βορίου
Η χημική δραστικότητα του βορίου εξαρτάται σε μεγάλο βαθμό από την καθαρότητα, την κρυσταλλικότητα αλλά και από την θερμοκρασία. Έτσι, σε θερμοκρασία δωματίου αντιδρά με το φθόριο και προσβάλλεται επιφανειακά από το οξυγόνο αλλά κατά τα άλλα είναι αδρανές. Σε υψηλότερες θερμοκρασίες αντιδρά γρήγορα με όλα τα αμέταλλα στοιχεία εκτός από το H, Ge, Te και τα ευγενή αέρια. Επίσης αντιδρά ταχύτατα σχεδόν με όλα τα μέταλλα με εξαίρεση τα βαρύτερα στοιχεία των ομάδων 11 – 15 του περιοδικού πίνακα.
Από τις ενώσεις που σχηματίζει μπορούμε να ξεχωρίσουμε κάποιες χαρακτηριστικές ομάδες με βάση το είδος των δεσμών:
- Τα βορίδια των μετάλλων, τα οποία μπορεί να κυμαίνονται από Μ5Β μέχρι ΜΒ66. Τα πλούσια σε μέταλλα βορίδια είναι εξαιρετικά σκληρά, χημικώς αδρανή, μη-πτητικά και πυρίμαχα υλικά. Έχουν σημείο τήξεως και ηλεκτρική αγωγιμότητα συχνά πολύ υψηλότερη από τα “πατρικά” μέταλλα. Έτσι, τα διβορίδια του Zr, Hf, Nb και Ta έχουν σημείο τήξεως πάνω από 3000°C ενώ το TiB2 (σ.τ. = 2980°C) έχει αγωγιμότητα πέντε φορές μεγαλύτερη από αυτή του Ti.
- Τα βοράνια ή υδρίδια του βορίου, μια σειρά πτητικών ενώσεων με το υδρογόνο, με γενικό τύπο BnHn+4 ή BnHn+8. Το διβοράνιο, Β2Η6, είναι το απλούστερο και παρασκευάζεται μέ την παρακάτω αντίδραση:
6LiH + 8BF3 → 6LiBF4 + B2H6
Στην ένωση αυτή τα άτομα το βορίου και 4 από τα 6 υδρογόνα βρίσκονται στο ίδιο επίπεδο. Τα υπόλοιπα δύο υδρογόνα καταλαμβάνουν θέσεις με μορφή γέφυρας μεταξύ των δύο ατόμων του βορίου και ο δεσμός τους καθορίζεται σαν δεσμός τριών κέντρων με ένα ζεύγος ηλεκτρονίων. Οι δεσμοί του τύπου αυτού ονομάζονται και δεσμοί “ηλεκτρονιακού ελλείμματος”.
- Τα αλογονίδια του βορίου, από τα οποία τα τριαλογονίδια είναι τα πιο σταθερά και μπορούν να θεωρηθούν ως τα πρώτα μέλη της ομόλογης σειράς BnXn+2. Τα τριαλογονίδια είναι πτητικές και πολύ δραστικές ενώσεις από τα οποία τα BF3 και BCl3 είναι αέρια, το BBr3 είναι πτητικό υγρό και το BI3 είναι στερεό. Και οι 4 ενώσεις είναι επίπεδες με γωνίες 120° μεταξύ των δεσμών.
- Τα οξείδια του βορίου και άλλες ενώσεις του με το οξυγόνο με το οποίο βρίσκεται συνήθως ενωμένο στη φύση. Σημαντικότερος εκπρόσωπος αυτής της ομάδας είναι το οξείδιο του βορίου, Β2Ο3, το οποίο χρησιμοποιείται κυρίως για την κατασκευή πυρίμαχων υάλινων αντικειμένων (Pyrex).
- Οι ενώσεις Β–Ν οι οποίες έχουν ιδιαίτερη σημασία λόγω της ομοιότητάς τους με τις ενώσεις C-C. Τα τρία αυτά άτομα μοιάζουν τόσο από άποψη μεγέθους όσο και από άποψη ηλεκτραρνητικότητας με τον άνθρακα να βρίσκεται ανάμεσα στα άλλα δύο. Μία πολύ ενδιαφέρουσα ένωση είναι το νιτρίδιο του βορίου, ΒΝ, το οποίο σχηματίζεται σαν ένα λευκό κρυσταλλικό στερεό από την αντίδραση του αζώτου με το βόριο με θέρμανση. Είναι ένα μεγαλομόριο με μια δομή τύπου γραφίτη όπου τα άτομα του βορίου και του αζώτου εναλλάσσονται στους δακτυλίους δίνοντας τη δομή:
Ένα άλλο απλό δακτυλικό σύστημα του βορίου και του αζώτου είναι η βοραζόλη, Β3Ν3Η6, το ανόργανο βενζόλιο:

Κρυσταλλική δομή

Η κρυσταλλική δομή του βορίου είναι από τις πιο περίπλοκες ανάμεσα στα χημικά στοιχεία. Αυτό οφείλεται στην ποικιλία των τρόπων με τους οποίους το άτομο προσπαθεί να λύσει το πρόβλημα του ηλεκτρονιακού ελλείμματος. Συνήθως, τα στοιχεία σε αυτή την κατάσταση ακολουθούν την δομή των μεταλλικών δεσμών κάτι όμως που δεν συμβαίνει με το βόριο το οποίο προτιμάει τους ομοιοπολικούς δεσμούς, λόγω του μικρού του μεγέθους και της υψηλής ενέργειας ιονισμού.
Η δομή που κυριαρχεί είναι αυτή του εικοσάεδρου Β12, η οποία επίσης παρατηρείται στις δομές πολλών μεταλλικών βοριδίων και βορανίων. Η δομή αυτή αφήνει μεγάλα κενά ανάμεσα στα άτομα, ικανά να φιλοξενήσουν επιπλέον άτομα βορίου ή μετάλλων. Ακόμα και στην πυκνότερη δομή, την α-ρομβοεδρική, το ποσοστό του χώρου που είναι κατειλημμένο είναι μόλις 37% (σε σχέση με το μέγιστο 74% για σφαίρες). Η α-ρομβοεδρική περιλαμβάνει κανονικά εικοσάεδρα Β12 τοποθετημένα σε μια ελαφρώς παραμορφωμένη κυβική δομή μέγιστης πυκνότητας. Η πιο θερμοδυναμικά σταθερή δομή είναι η β-ρομβοεδρική, αρκετά πιο περίπλοκη και αποτελούμενη από 105 άτομα βορίου. Τέλος, η πρώτη κρυσταλλική δομή που παρασκευάστηκε (1943) ονομάστηκε α-τετραγωνική βορίου και περιέχει 50 άτομα (4Β12 + 2Β). Στη συνέχεια (1974) όμως ανακαλύφθηκε ότι αυτή η μορφή εμφανίζεται μόνο παρουσία άνθρακα ή αζώτου ως πρόσμιξη, με αποτέλεσμα στην πραγματικότητα να είναι Β50C2 ή Β50Ν2.
| Αυτό το λήμμα σχετικά με χημεία χρειάζεται επέκταση. Μπορείτε να βοηθήσετε την Βικιπαίδεια επεκτείνοντάς το. |
