Χρήστης:Emmanuel.karagiorgos/πρόχειρο: Διαφορά μεταξύ των αναθεωρήσεων
Χωρίς σύνοψη επεξεργασίας |
Χωρίς σύνοψη επεξεργασίας |
||
| Γραμμή 2: | Γραμμή 2: | ||
<!-- ΕΠΕΞΕΡΓΑΣΤΕΙΤΕ ΚΑΤΩ ΑΠΟ ΑΥΤΗ ΤΗ ΓΡΑΜΜΗ --> |
<!-- ΕΠΕΞΕΡΓΑΣΤΕΙΤΕ ΚΑΤΩ ΑΠΟ ΑΥΤΗ ΤΗ ΓΡΑΜΜΗ --> |
||
Οι περιοχές μιας μονάδας παραγωγής αιθενίου είναι οι ακόλουθες: |
|||
== Χημικές ιδιότητες και παράγωγα == |
|||
# Κάμινος πυρόλυσης με ατμό. |
|||
# Πρωτεύον και δευτερεύον εναλλάκτης θερμότητας με ψυκτικό πύργο. |
|||
# Σύστημα διάλυσης με ατμό και ανακύκλωσης μεταξύ του καμίνου και των ψυκτικών πύργων. |
|||
# Πρωτεύον συμπιεστής των παραγώμενων αερίων τριών (3) σταδίων. |
|||
# Παγίδα όξινων αερίων για την απομάκρυνση του [[υδρόθειο]]υ και του [[διοξείδιο του άνθρακα|διοξειδίου του άνθρακα]]<ref>Τόσο το φυσικό αέριο, όσο και το αργό πετρέλαιο περιέχουν διάφορες θειούχες και οξυγονούχες ενώσεις, από τις οποίες παράγονται τα αέρια αυτά.</ref>. |
|||
# Δευτερεύον συμπιεστής ενός (1) ή δύο (2) σταδίων. |
|||
# Ξηραντήρας των αερίων που παρέμειναν. |
|||
# Κρυογενική μεταχείρηση: Διαχωρίζει το αέριο μίγμα που απέμεινε σε δύο (2) πύργους: |
|||
:# C<sub>1</sub> διαχωριστής: Απομακρύνει το [[υδρογόνο]] με ψύξη στους −162 °C. Η συγκεκριμένη θερμοκρασία επιλέχθηκε για να κατακρατείται το [[μεθάνιο]] υγρό, γεγονός κρίσιμο για την οικονομική βιοσιμότητα της βιομηχανικής μονάδας. Μπορεί να χρησιμοποιηθεί ως παραπροϊόν, να οδηγηθεί πίσω στην υπομονάδα #1 ή να οδηγηθεί για οξειδωτικό ζευγάρωμα (βλέπετε αντίδραση ενότητας §2.1.3) |
|||
:# C<sub>2</sub> διαχωριστής: Το αέριο μίγμα που οδηγείται σ' αυτόν αποτελείται από όλα τα C<sub>2</sub> αέρια (δηλαδή [[αιθάνιο]], αιθένιο και [[αιθίνιο]] που παρήχθηκαν από την πυρόλυση. Χρειάζεται προσοχή το γεγονός ότι το αιθίνιο που περιέχει είναι εκρηκτικό σε πιέσεις πάνω από 200 kPa).<ref>{{cite book |
|||
|first=Mikołaj |
|||
|last=Korzun |
|||
|title=1000 słów o materiałach wybuchowych i wybuchu |
|||
|isbn=83-11-07044-X |
|||
|year=1986 |
|||
|location=Warszawa |
|||
|publisher=Wydawnictwo Ministerstwa Obrony Narodowej |
|||
|oclc=69535236 |
|||
}}</ref> Αν η μερική πίεση του αιθινίου αναμένεται να υπερβεί αυτές της τιμές, τότε ρεύμα των αερίων C<sub>2</sub> υφίσταται μερική καταλυτική υδρογόνωση (με χρήση του υδρογόνου που παίρνεται παραπάνω), οπότε μέρος του αιθινίου μετατρέπεται σε αιθένιο (βλέπετε την αντίδραση στην ενότητα 2.2.3). Μετά το αέριο μίγμα οδηγείται σε διαχωριστή C<sub>2</sub>, από την οροφή του οποίου συλλέγεται το αιθένιο και από το μέσο του το [[αιθάνιο]] που οδηγείται πίσω στην υπομονάδα #1 (αν είναι ανεπιθύμητο). |
|||
:# C<sub>3</sub> διαχωριστής: Το κατώτερο αέριο στρώμα του διαχωριστή C<sub>2</sub> οδηγείται στο διαχωριστή C<sub>3</sub>, από τον οποίο αποσπούνται τα αέρια C<sub>3</sub>, αυτά δηλαδή με τρία (3) άτομα άνθρακα, δηλαδή οι ενώσεις [[προπάνιο]], [[προπένιο]], [[προπίνιο]], [[προπαδιένιο]] και [[κυκλοπροπάνιο]]. Από τα διαχωριζόμενα αυτά αέρια συνήθως κρατιέται το προπένιο ως χρήσιμο παραπροϊόν, ενώ τα υπόλοιπα (ιδίως το προπάνιο) επιστρέφουν (αν δεν κρατηθούν κι αυτά) στην υπομονάδα #1. |
|||
:# C<sub>4</sub> διαχωριστής: Με όμοια διαδικασία διαχωρίζονται τα αέρια C<sub>4</sub>, δηλαδή αυτά με τέσσερα (4) άτομα άνθρακα, από τα τελευταία, C<sub>5</sub>, δηλαδή με πέντε (5) άτομα άνθρακα, ή και βαρύτερα που απομένουν. Και πάλι όσα θεωρούνται χρήσιμα κρατιούνται και τα υπόλοιπα επιστρέφουν στην υπομονάδα #1<ref name=Keystone/>. |
|||
=== Τέλεια καύση<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, προσαρμογή για αλκένιο =-55 kcal/mole.</ref> === |
|||
* Επειδή η παραγωγή αιθενίου είναι συνολικά εξώθερμη, συνήθως φροντίζεται ώστε να δεσμεύεται η παραγόμενη θερμότητα ώστε να χρησιμοποιηθεί για την παραγωγή υψηλής πίεσης ατμού, που χρησιμοποιείται με τη σειρά του για να οδηγηθεί στις τουρμπίνες και να συμπιέσει το πυρολυώμενο μίγμα. Μέρος από το παραγώμενο προπένιο ή και το αιθένιο μπορεί να χρησιμοποιηθεί ως ψυκτικό αέριο στους ψυκτικούς πύργους. Μια τέτοια μονάδα όσο λειτουργεί δεν χρειάζεται να εισάγει εξωτερικά ατμό στο σύστημα. Ακόμη, μια τυπική τέτοια παγκόσμιου επιπέδου παραγωγής μονάδα με παραγωγή περίπου 3 εκατομμύρια τόννους αιθενίου το χρόνο απαιτεί ένα συμπιεστή πυρολυόμενων αερίων ισχύος 34 MW, ένα συμπιεστή προπενίου ισχύος 22 MW και ένα συμπιεστή αιθενίου ισχύος 11 MW. |
|||
<div style='text-align: center;'> |
|||
=== Εργαστηριακές μέθοδοι === |
|||
<math>CH_2=CH_2 + 3O_2 \xrightarrow{\triangle} 2CO_2 + 2H_2O + 1314 \; kJ </math> |
|||
</div> |
|||
=== Ενυδάτωση === |
|||
==== Με αφυδάτωση αιθανόλης ==== |
|||
Με |
1. Με επίδραση [[θειικό οξύ|θειικού οξέος]] παράγεται αρχικά [[όξινος θειικός αιθυλεστέρας]]. Στη συνέχεια με επίδραση [[νερό|νερού]] ([[ενυδάτωση]]). Παράγεται [[αιθανόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
|||
<math> CH_3CH_2OH \xrightarrow[>150^oC]{\pi .H_2SO_4} CH_2=CH_2 + H_2O </math> |
|||
CH_2=CH_2 + H_2SO_4 \xrightarrow{} CH_3CH_2OSO_3H \xrightarrow{+H_2O} CH_3CH_2OH + H_2SO_4 |
|||
</math> |
|||
</div> |
|||
2. [[βοράνιο|Υδροβορίωση]] και στη συνέχεια επίδραση με [[υπεροξείδιο του υδρογόνου]]. Αρχικά παράγεται [[τριαιθυλοβοράνιο]] και στη συνέχεια αιθανόλη<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + BH_3 \xrightarrow{} CH_3CH_2BH_2 \xrightarrow{+CH_2=CH_2} (CH_3CH_2)_2BH \xrightarrow{+CH_2=CH_2}(CH_3CH_2)_3B \xrightarrow{+3H_2O_2} 3CH_3CH_2OH + H_3BO_3 |
|||
</math> |
|||
</div> |
|||
* Προσθήκη [[διβοράνιο|διβορανίου]] έχει το ίδιο αποτέλεσμα. |
|||
3. Αντίδραση με [[οξικός υδράργυρος|οξικό υδράργυρο]] και έπειτα [[Οξειδοαναγωγή|αναγωγή]]<ref>{{cite book |
|||
| author = Bordwell, Frederick G.; Douglass, Miriam L |
|||
| title = Journal of the American Chemical Society (1966), 88, pg 993-999 |
|||
| chapter = Reduction of Alkylmercuric Hydroxides by Sodium Borohydride. |
|||
}}</ref> : |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + (CH_3COO)_2Hg + H_2O \xrightarrow[-CH_3COOH]{Et_2O} CH_3COOHgCH_2CH_2OH \xrightarrow{+NaBH_4+NaOH} CH_3CH_2OH + Hg + CH_3COONa + Na[BH_3OH] |
|||
</math> |
|||
</div> |
|||
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αιθένιο απουσία [[νερό|νερού]]. Π.χ. με [[μεθανάλη]] προκύπτει [[2-προπεν-1-όλη]]<ref name="J. Prins, Chemisch Weekblad 1072">''Condensation of formaldehyde with some unsaturated compounds'' H. J. Prins, Chemisch Weekblad, 16, 64, 1072, 1510 '''1919'''</ref><ref name="ReferenceB">[[Chemical Abstracts]] 13, 3155 '''1919'''</ref><ref name="Link">''The Olefin-Aldehyde Condensation. The Prins Reaction''. E. Arundale, L. A. Mikeska [[Chem. Rev.]]; '''1952'''; 51(3); 505-555. [http://pubs.acs.org/cgi-bin/abstract.cgi/chreay/1952/51/i03/f-pdf/f_cr60160a004.pdf Link]</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + HCHO \xrightarrow{H_2SO_4} CH_2=CHCH_2OH </math> |
|||
</div> |
</div> |
||
* Πριν την καθιέρωση του πετρελαίου ως βασικής στρατηγικής πρώτης ύλης χρησιμοποιήθηκε και για βιομηχανική παραγωγή αιθενίου. |
|||
=== Προσθήκη υποαλογονώδους οξέως === |
|||
==== Με απόσπαση υδραλογόνου από αιθυλαλογονίδιο ==== |
|||
Με [[ |
Με επίδραση ([[προσθήκη]]) [[υποαλογονώδη οξέα|υποαλογονώδους οξέος]] (HOX) σε αιθένιο παράγεται [[αλκοόλες|2-αλαιθανόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
|||
<math> CH_3CH_2X + NaOH \xrightarrow[\triangle]{ROH} CH_2=CH_2 + NaX + H_2O </math> |
|||
CH_2=CH_2 + HOX \xrightarrow{} XCH_2CH_2OH |
|||
</math> |
|||
</div> |
|||
* Το HOX παράγεται συνήθως επιτόπου με την αντίδραση: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
2H_2O + X_2 \xrightarrow{} 2HOX |
|||
</math> |
|||
</div> |
</div> |
||
=== Καταλυτική υδρογόνωση === |
|||
==== Με απόσπαση αλογόνου από 1,2-διαλαιθάνιο ==== |
|||
Με |
Με καταλυτική [[υδρογόνωση]] αιθενίου σχηματίζεται [[αιθάνιο]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.</ref>: |
||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + H_2 \xrightarrow{Ni\;\acute{\eta}\; Pd \;\acute{\eta}\; Pt} CH_3CH_3 |
|||
</math> |
|||
</div> |
|||
=== Αλογόνωση === |
|||
Με επίδραση [[αλογόνα|αλογόνου]] (X<sub>2</sub>) ([[αλογόνωση]]) σε αιθένιο έχουμε προσθήκη στο διπλό δεσμό. Παράγεται [[οργανοαλογονίδια|1,2-διαλαιθάνιο]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + X_2 \xrightarrow{CCl_4} XCH_2CH_2X |
|||
</math> |
|||
</div> |
|||
=== Υδραλογόνωση === |
|||
Με προσθήκη [[υδραλογόνα|υδραλογόνων]] (HX) ([[υδραλογόνωση]]) σε αιθένιο παράγεται [[αλκυλαλογονίδια|αιθυλαλογονίδιο]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + HX \xrightarrow{} CH_3CH_2X |
|||
</math> |
|||
</div> |
|||
=== Υδροκυάνωση === |
|||
Με προσθήκη [[υδρακυάνιο|υδροκυανίου]] (HCN) ([[υδροκυάνωση]]) σε αιθένιο παράγεται [[προπανονιτρίλιο]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1., X = CN (Το CN δρα ως «ψευδοαλογόνο»).</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + HCN \xrightarrow{} CH_3CH_2CN |
|||
</math> |
|||
</div> |
|||
=== Καταλυτική αμμωνίωση === |
|||
1. Προσθήκη [[αμμωνία]]ς (NH<sub>3</sub>). Παράγεται [[αιθυλαμίνη]]. Π.χ.<ref>{{cite journal | author = Kai C. Hultzsch | title =Catalytic asymmetric hydroamination of non-activated olefins | format = Review | journal = [[Organic & Biomolecular Chemistry]] | year = 2005 | volume = 3 | pages = 1819–1824 | doi = 10.1039/b418521h | pmid = 15889160 | issue = 10}}</ref><ref>{{cite journal | author = Hartwig, J. F. | url = http://www.iupac.org/publications/pac/2004/pdf/7603x0507.pdf | title = Development of catalysts for the hydroamination of olefins | journal = [[Pure Appl. Chem.]] | year = 2004 | volume = 76 | pages = 507–516 | doi = 10.1351/pac200476030507}}</ref><ref>{{cite journal | author = Shi, Y. H.; Hall, C.; Ciszewski, J. T.; Cao, C. S.; Odom, A. L. | title = Titanium dipyrrolylmethane derivatives: rapid intermolecular alkyne hydroamination | journal = [[Chemical Communications]] | year = 2003 | volume = 5 | pages = 586–587 | doi =10.1039/b212423h}}</ref><ref>{{cite journal | author = Pohlki, F., Doye, S. | title = The catalytic hydroamination of alkynes | journal = Chemical Society Reviews | volume = 32 | pages = 104–114 | doi = 10.1039/b200386b | year = 2003 | pmid = 12683107 | issue = 2}}</ref><ref>{{cite journal | author = Odom, A. L. | title = New C–N and C–C bond forming reactions catalyzed by titanium complexes | journal = [[Dalton Trans.]] | year = 2005 | volume = 2 | pages = 225–233 | doi = 10.1039/b415701j | pmid = 15616708 | issue = 2}}</ref>.: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + NH_3 \xrightarrow{Ti \;\acute{\eta}\; Zr} CH_3CH_2NH_2 |
|||
</math> |
|||
</div> |
|||
* Τα παραπάνω μέταλλα που αναφέρονται στη θέση του [[καταλύτης|καταλύτη]] χρησιμοποιούνται με τη μορφή [[σύμπλοκα|συμπλόκων]] τους και όχι σε μεταλλική μορφή. |
|||
2. Προσθήκη πρωτοταγούς [[αμίνες|αμίνης]]. Παράγεται δευτεροταγής [[αμίνες|αιθαλαμίνη]]. Π.χ. με [[μεθυλαμίνη]] παράγεται [[N-μεθυλαιθαναμίνη]]: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + CH_3NH_2 \xrightarrow{Ti \;\acute{\eta}\; Zr} CH_3CH_2NHCH_3 |
|||
</math> |
|||
</div> |
|||
3. Προσθήκη δευτεροταγούς [[αμίνες|αμίνης]]. Παράγεται τριτοταγής [[αμίνες|αιθαλαμίνη]]. Π.χ. με [[διμεθυλαμίνη]] παράγεται [[N,N-διμεθυλαιθαναμίνη]]: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + CH_3NHCH_3 \xrightarrow{Ti \;\acute{\eta}\; Zr} CH_3CH_2N(CH_3)_2 </math> |
|||
</div> |
|||
=== Καταλυτική υδροφορμυλίωση === |
|||
Με προσθήκη [[μεθανάλη]]ς (CO + H<sub>2</sub>) σε αιθένιο παράγεται [[προπανάλη]]. Π.χ.<ref name=Keystone>{{Cite book | last=Kniel | first=Ludwig | authorlink= | coauthors=Winter, Olaf; Stork, Karl | title=Ethylene, keystone to the petrochemical industry | year=1980 | publisher=M. Dekker | location=New York | isbn=0-8247-6914-7 | pages=}}</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + CO + H_2 \xrightarrow[10 - 100 \; atm, 40^oC-100^oC]{Co \;\acute{\eta}\; Rh} CH_3CH_2CHO |
|||
</math> |
|||
</div> |
|||
* Τα παραπάνω μέταλλα που αναφέρονται στη θέση του [[καταλύτης|καταλύτη]] χρησιμοποιούνται με τη μορφή [[σύμπλοκα|συμπλόκων]] τους και όχι σε μεταλλική μορφή. |
|||
=== Προσθήκη αλδεΰδών ή κετονών κατά Prins === |
|||
Με επίδραση περίσσειας [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αιθένιο απουσία [[νερό|νερού]], σε χαμηλή θερμοκρασία παράγεται παράγωγο [[διοξάνιο|διοξανίου]]. Π.χ. με [[μεθανάλη]] παράγεται [[1,3-διοξάνιο]]<ref name="J. Prins, Chemisch Weekblad 1072"/><ref name="ReferenceB"/><ref name="Link"/>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + 2HCHO \xrightarrow[\chi \alpha \mu \eta \lambda \acute{\eta} \; \theta \epsilon \rho \mu o \kappa \rho \alpha \sigma \acute{\iota} \alpha]{H_2SO_4} </math> [[Αρχείο:1 3-dioxane.svg|60 px]] |
|||
</div> |
|||
=== Διυδροξυλίωση === |
|||
Η [[διυδροξυλίωση]] αιθενίου, αντιστοιχεί σε προσθήκη H<sub>2</sub>O<sub>2</sub> και παράγει [[1,2-αιθανοδιόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9. Καλύπτει τις περιπτώσεις 1. και 2.</ref>: <br /> |
|||
1. Επίδραση αραιού διαλύματος [[υπερμαγγανικό κάλιο|υπερμαγγανικού καλίου]]. Π.χ.: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
5CH_2=CH_2 + 4KMnO_4 + 2H_2SO_4 \xrightarrow{} 5HOCH_2CH_2OH + 4MnO + 2K_2SO_4 + 2H_2O </math> |
|||
</div> |
|||
2. Επίδραση [[καρβονικά οξέα|καρβονικού οξέος]] και [[υπεροξείδιο του υδρογόνου|υπεροξείδιου του υδρογόνου]]: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + H_2O_2 \xrightarrow{RCOOH} HOCH_2CH_2OH </math> |
|||
</div> |
|||
3. Μέθοδος Sharpless<ref>Jacobsen, E. N.; Marko, I.; Mungall, W. S.; Schroeder, G.; [[K. Barry Sharpless|Sharpless, K. B.]] ''[[J. Am. Chem. Soc.]]'' '''1988''', ''110'', 1968. ({{DOI|10.1021/ja00214a053}})</ref><ref>Kolb, H. C.; Van Nieuwenhze, M. S.; [[K. Barry Sharpless|Sharpless, K. B.]] ''[[Chem. Rev.]]'' '''1994''', ''94'', 2483-2547. (Review) ({{DOI|10.1021/cr00032a009}})</ref><ref>Gonzalez, J.; Aurigemma, C.; Truesdale, L. ''[[Org. Syn.]]'', Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). ([http://www.orgsyn.org/orgsyn/prep.asp?prep=v79p0093 Article])</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + OsO_4 + 2H_2O + 2KOH \xrightarrow{} HOCH_2CH_2OH + K_2[OsO_2(OH)_4] </math> |
|||
</div> |
|||
4. Μέθοδος Woodward<ref>[[Robert Burns Woodward|Woodward, R. B.]], {{US patent|2687435}}</ref><ref>[[Robert Burns Woodward|Woodward, R. B.]]; Brutcher, F. V. ''[[J. Am. Chem. Soc.]]'' '''1958''', ''80'', 209. ({{DOI|10.1021/ja01534a053}})</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + 2RCOOAg + I_2 \xrightarrow{} HOCH_2CH_2OH + 2AgI + 2RCOOH </math> |
|||
</div> |
|||
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αιθένιο, παρουσία [[νερό|νερού]]. Αντίδραση Prins. Π.χ. με [[μεθανάλη]] παράγεται [[1,3-προπανοδιόλη]]<ref name="J. Prins, Chemisch Weekblad 1072"/><ref name="ReferenceB"/><ref name="Link"/>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + HCHO + H_2O \xrightarrow{H_2SO_4} HOCH_2CH_2CH_2OH </math> |
|||
</div> |
|||
=== Οζονόλυση === |
|||
Με επίδραση [[όζον]]τος ([[οζονόλυση]]) σε αιθένιο, παράγεται ασταθές [[οζονίδια|οζονίδιο]], που τελικά διασπάται σε [[μεθανάλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + \frac{2}{3}O_3 \xrightarrow[Zn]{H_2O} 2HCHO </math> |
|||
</div> |
|||
=== Επίδραση πυκνού υπερμαγγανικού καλίου === |
|||
Με επίδραση πυκνού διαλύματος [[υπερμαγγανικό κάλιο|υπερμαγγανικού καλίου]] (KMnO<sub>4</sub>) παράγεται τελικά [[διοξείδιο του άνθρακα]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.</ref>: |
|||
<div style='text-align: center;'> |
|||
<math> |
|||
CH_2=CH_2 + 4KMnO_4 + 2H_2SO_4 \xrightarrow{} 2CO_2 + 4MnO_2 + 2K_2SO_4 + 4H_2O |
|||
</math> |
|||
</div> |
|||
* Ενδιάμεσα παράγεται [[μεθανικό οξύ]], αλλά είναι ευαίσθητο σε τυχόν περίσσεια υπερμαγγανικού καλίου:<div style='text-align: center;'> |
|||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
|||
<math> XCH_2CH_2X + Zn \xrightarrow{} CH_2=CH_2 + ZnX_2 </math> |
|||
3CH_2=CH_2 + 8KMnO_4 + 4H_2SO_4 \xrightarrow{} 6HCOOH + 8MnO_2 + 4K_2SO_4 + 4H_2O |
|||
</math> |
|||
</div> |
</div> |
||
=== Καταλυτική προσθήκη οξυγόνου === |
|||
==== Με μερική καταλυτική υδρογόνωση αιθινίου ==== |
|||
Κατά την καταλυτική προσθήκη [[οξυγόνο]]υ σε αιθένιο σχηματίζεται [[οξιράνιο]]. Π.χ.<ref name=Ullmann>Siegfried Rebsdat, Dieter Mayer "Ethylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.{{DOI|10.1002/14356007.a10_117}} Article Online Posting Date: March 15, 2001.</ref>: |
|||
Με μερική καταλυτική [[υδρογόνωση]] [[αιθίνιο|αιθινίου]] παράγεται αιθένιο<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.</ref> |
|||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
|||
<math> HC \equiv CH + H_2 \xrightarrow{Ni\;\acute{\eta}\; Pd \;\acute{\eta}\; Pt} CH_2=CH_2 </math> |
|||
CH_2=CH_2 + \frac{1}{2}O_2 \xrightarrow[1-2MPa,\; 280^oC]{Ag} </math> [[Αρχείο:Oxirane.svg|50 px]] |
|||
</div> |
</div> |
||
=== Αντίδραση Diels–Adler === |
|||
==== Με θέρμανση τεταρτοταγών αμμωνιοβάσεων ==== |
|||
Κατά την επίδραση «συζυγούς» [[αλκαδιένια|αλκαδιενίου]] (διένιου) σε αιθένιο (διενόφιλο) έχουμε την ονομαζόμενη ([[αντίδραση Diels–Adler]]) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων [[κυκλοεξένιο|κυκλοεξενίου]]. Π.χ. με [[1,3-βουταδιένιο]] παίρνουμε [[κυκλοεξένιο]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.</ref>: |
|||
Με θέρμανση τεταρτοταγών [[αμίνες|αμμωνιοβάσεων]] (μέθοδος Hoffmann) παράγεται και αιθένιο. Π.χ.<ref name="ReferenceA"/>: |
|||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
|||
<math> [RCH_2CH_2N^+(CH_3)_2CH_2CH_3]OH^- \xrightarrow{\triangle} CH_2=CH_2 + RCH_2CH_2N(CH_3)_2 + H_2O</math> |
|||
CH_2=CH_2 + CH_2=CHCH=CH_2 \xrightarrow{} </math> [[Αρχείο:Cyclohexen - Cyclohexene.svg|40 px]] |
|||
</div> |
</div> |
||
=== Αντίδραση Pauson-Khand === |
|||
==== Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις ==== |
|||
Κατά την επίδραση [[αλκίνια]] και [[μονοξείδιο του άνθρακα|μονοξειδίου του άνθρακα]] σε αιθένιο έχουμε την ονομαζόμενη [[αντίδραση Pauson-Khand]] που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων [[κυκλοπεντενόνη]]ς. Π.χ. με [[αιθίνιο]] παράγεται [[2-κυκλοπεντενόνη]]<ref>P. L. Pauson and I. U. Khand. ''[[Ann. N.Y. Acad. Sci.]]'' '''1977''', ''295'', 2.</ref><ref>Blanco-Urgoiti, J.; Añorbe, L.; Pérez-Serrano, L.; Domínguez, G.; Pérez-Castells, J. ''[[Chem. Soc. Rev.]]'' '''2004''', ''33'', 32. {{DOI|10.1039/b300976a}}</ref><ref>Schore, N. E. ''[[Org. React.]]'', '''1991''', ''40'', 1. (doi:[http://dx.doi.org/10.1002/0471264180.or040.01 10.1002/0471264180.or040.01])</ref><ref>S. E. Gibson and A. Stevenazzi, [[Angewandte Chemie|''Angew. Chem. Int. Ed.'']], '''2003''', 42, 1800-1810. {{DOI|10.1002/anie.200200547}}</ref>: |
|||
Με επίδραση φωσφοροϋλιδίων σε [[μεθανάλη]] (μέθοδος Wittig) παράγεται αιθένιο. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.4.</ref>: |
|||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
|||
<math> Ph_3P^+-^-CH_2 + HCHO \xrightarrow{} CH_2=CH_2 + Ph_3PO </math> |
|||
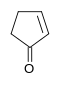
CH_2=CH_2 + HC \equiv CH + CO \xrightarrow{Co_2(CO)_8} </math> [[Αρχείο:Cyclopent-2-enone.svg|60 px]] |
|||
</div> |
</div> |
||
Έκδοση από την 18:15, 28 Ιανουαρίου 2015
 |
Αυτή η σελίδα είναι το κύριο «πρόχειρο χρήστη» του Emmanuel.karagiorgos. Ένα «πρόχειρο χρήστη» είναι υποσελίδα της προσωπικής σελίδας του χρήστη στη Βικιπαίδεια. Εξυπηρετεί ως χώρος πειραματισμών και ανάπτυξης σελίδων και δεν είναι εγκυκλοπαιδικό λήμμα. Επεξεργαστείτε ή δημιουργήστε το δικό σας πρόχειρο εδώ ή κάνετε δοκιμές στο κοινόχρηστο Πρόχειρο Βικιπαίδειας. |
Χημικές ιδιότητες και παράγωγα
Τέλεια καύση[1]
Ενυδάτωση
1. Με επίδραση θειικού οξέος παράγεται αρχικά όξινος θειικός αιθυλεστέρας. Στη συνέχεια με επίδραση νερού (ενυδάτωση). Παράγεται αιθανόλη[2]:
2. Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου. Αρχικά παράγεται τριαιθυλοβοράνιο και στη συνέχεια αιθανόλη[3]:
- Προσθήκη διβορανίου έχει το ίδιο αποτέλεσμα.
3. Αντίδραση με οξικό υδράργυρο και έπειτα αναγωγή[4] :
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε αιθένιο απουσία νερού. Π.χ. με μεθανάλη προκύπτει 2-προπεν-1-όλη[5][6][7]:
Προσθήκη υποαλογονώδους οξέως
Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε αιθένιο παράγεται 2-αλαιθανόλη[8]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
Καταλυτική υδρογόνωση
Με καταλυτική υδρογόνωση αιθενίου σχηματίζεται αιθάνιο. Π.χ.[9]:
Αλογόνωση
Με επίδραση αλογόνου (X2) (αλογόνωση) σε αιθένιο έχουμε προσθήκη στο διπλό δεσμό. Παράγεται 1,2-διαλαιθάνιο. Π.χ.[10]:
Υδραλογόνωση
Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε αιθένιο παράγεται αιθυλαλογονίδιο[11]:
Υδροκυάνωση
Με προσθήκη υδροκυανίου (HCN) (υδροκυάνωση) σε αιθένιο παράγεται προπανονιτρίλιο[12]:
Καταλυτική αμμωνίωση
1. Προσθήκη αμμωνίας (NH3). Παράγεται αιθυλαμίνη. Π.χ.[13][14][15][16][17].:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
2. Προσθήκη πρωτοταγούς αμίνης. Παράγεται δευτεροταγής αιθαλαμίνη. Π.χ. με μεθυλαμίνη παράγεται N-μεθυλαιθαναμίνη:
3. Προσθήκη δευτεροταγούς αμίνης. Παράγεται τριτοταγής αιθαλαμίνη. Π.χ. με διμεθυλαμίνη παράγεται N,N-διμεθυλαιθαναμίνη:
Καταλυτική υδροφορμυλίωση
Με προσθήκη μεθανάλης (CO + H2) σε αιθένιο παράγεται προπανάλη. Π.χ.[18]:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
Προσθήκη αλδεΰδών ή κετονών κατά Prins
Με επίδραση περίσσειας αλδευδών ή κετονών σε αιθένιο απουσία νερού, σε χαμηλή θερμοκρασία παράγεται παράγωγο διοξανίου. Π.χ. με μεθανάλη παράγεται 1,3-διοξάνιο[5][6][7]:
Διυδροξυλίωση
Η διυδροξυλίωση αιθενίου, αντιστοιχεί σε προσθήκη H2O2 και παράγει 1,2-αιθανοδιόλη[19]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Π.χ.:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου:
3. Μέθοδος Sharpless[20][21][22]:
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε αιθένιο, παρουσία νερού. Αντίδραση Prins. Π.χ. με μεθανάλη παράγεται 1,3-προπανοδιόλη[5][6][7]:
Οζονόλυση
Με επίδραση όζοντος (οζονόλυση) σε αιθένιο, παράγεται ασταθές οζονίδιο, που τελικά διασπάται σε μεθανάλη[25]:
Επίδραση πυκνού υπερμαγγανικού καλίου
Με επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγεται τελικά διοξείδιο του άνθρακα[26]:
- Ενδιάμεσα παράγεται μεθανικό οξύ, αλλά είναι ευαίσθητο σε τυχόν περίσσεια υπερμαγγανικού καλίου:
Καταλυτική προσθήκη οξυγόνου
Κατά την καταλυτική προσθήκη οξυγόνου σε αιθένιο σχηματίζεται οξιράνιο. Π.χ.[27]:
Αντίδραση Diels–Adler
Κατά την επίδραση «συζυγούς» αλκαδιενίου (διένιου) σε αιθένιο (διενόφιλο) έχουμε την ονομαζόμενη (αντίδραση Diels–Adler) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοεξενίου. Π.χ. με 1,3-βουταδιένιο παίρνουμε κυκλοεξένιο[28]:
Αντίδραση Pauson-Khand
Κατά την επίδραση αλκίνια και μονοξειδίου του άνθρακα σε αιθένιο έχουμε την ονομαζόμενη αντίδραση Pauson-Khand που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντενόνης. Π.χ. με αιθίνιο παράγεται 2-κυκλοπεντενόνη[29][30][31][32]:
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, προσαρμογή για αλκένιο =-55 kcal/mole.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.
- ↑ Bordwell, Frederick G.; Douglass, Miriam L. «Reduction of Alkylmercuric Hydroxides by Sodium Borohydride.». Journal of the American Chemical Society (1966), 88, pg 993-999.
- ↑ 5,0 5,1 5,2 Condensation of formaldehyde with some unsaturated compounds H. J. Prins, Chemisch Weekblad, 16, 64, 1072, 1510 1919
- ↑ 6,0 6,1 6,2 Chemical Abstracts 13, 3155 1919
- ↑ 7,0 7,1 7,2 The Olefin-Aldehyde Condensation. The Prins Reaction. E. Arundale, L. A. Mikeska Chem. Rev.; 1952; 51(3); 505-555. Link
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1., X = CN (Το CN δρα ως «ψευδοαλογόνο»).
- ↑ Kai C. Hultzsch (2005). «Catalytic asymmetric hydroamination of non-activated olefins» (Review). Organic & Biomolecular Chemistry 3 (10): 1819–1824. doi:. PMID 15889160.
- ↑ Hartwig, J. F. (2004). «Development of catalysts for the hydroamination of olefins». Pure Appl. Chem. 76: 507–516. doi:. http://www.iupac.org/publications/pac/2004/pdf/7603x0507.pdf.
- ↑ Shi, Y. H.; Hall, C.; Ciszewski, J. T.; Cao, C. S.; Odom, A. L. (2003). «Titanium dipyrrolylmethane derivatives: rapid intermolecular alkyne hydroamination». Chemical Communications 5: 586–587. doi:.
- ↑ Pohlki, F., Doye, S. (2003). «The catalytic hydroamination of alkynes». Chemical Society Reviews 32 (2): 104–114. doi:. PMID 12683107.
- ↑ Odom, A. L. (2005). «New C–N and C–C bond forming reactions catalyzed by titanium complexes». Dalton Trans. 2 (2): 225–233. doi:. PMID 15616708.
- ↑ Kniel, Ludwig (1980). Ethylene, keystone to the petrochemical industry. New York: M. Dekker. ISBN 0-8247-6914-7. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9. Καλύπτει τις περιπτώσεις 1. και 2.
- ↑ Jacobsen, E. N.; Marko, I.; Mungall, W. S.; Schroeder, G.; Sharpless, K. B. J. Am. Chem. Soc. 1988, 110, 1968. (doi:10.1021/ja00214a053)
- ↑ Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483-2547. (Review) (doi:10.1021/cr00032a009)
- ↑ Gonzalez, J.; Aurigemma, C.; Truesdale, L. Org. Syn., Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). (Article)
- ↑ Woodward, R. B., U.S. Patent 2.687.435
- ↑ Woodward, R. B.; Brutcher, F. V. J. Am. Chem. Soc. 1958, 80, 209. (doi:10.1021/ja01534a053)
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Siegfried Rebsdat, Dieter Mayer "Ethylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a10_117 Article Online Posting Date: March 15, 2001.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ P. L. Pauson and I. U. Khand. Ann. N.Y. Acad. Sci. 1977, 295, 2.
- ↑ Blanco-Urgoiti, J.; Añorbe, L.; Pérez-Serrano, L.; Domínguez, G.; Pérez-Castells, J. Chem. Soc. Rev. 2004, 33, 32. doi:10.1039/b300976a
- ↑ Schore, N. E. Org. React., 1991, 40, 1. (doi:10.1002/0471264180.or040.01)
- ↑ S. E. Gibson and A. Stevenazzi, Angew. Chem. Int. Ed., 2003, 42, 1800-1810. doi:10.1002/anie.200200547




![{\displaystyle CH_{2}=CH_{2}+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}CH_{3}COOHgCH_{2}CH_{2}OH\xrightarrow {+NaBH_{4}+NaOH} CH_{3}CH_{2}OH+Hg+CH_{3}COONa+Na[BH_{3}OH]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98937319d9206c560e0986ff669fce73fcfa7efb)










![{\displaystyle CH_{2}=CH_{2}+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}CH_{3}CH_{2}CHO}](https://wikimedia.org/api/rest_v1/media/math/render/svg/35a0524e9116d71300750bf81666eb0046e3eacc)
![{\displaystyle CH_{2}=CH_{2}+2HCHO{\xrightarrow[{\chi \alpha \mu \eta \lambda {\acute {\eta }}\;\theta \epsilon \rho \mu o\kappa \rho \alpha \sigma {\acute {\iota }}\alpha }]{H_{2}SO_{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82e0a87482052e538fb3f1ec746494fb0fd53dd1)



![{\displaystyle CH_{2}=CH_{2}+OsO_{4}+2H_{2}O+2KOH\xrightarrow {} HOCH_{2}CH_{2}OH+K_{2}[OsO_{2}(OH)_{4}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d96ae85de97fb6421784ae13a3df906569d99606)


![{\displaystyle CH_{2}=CH_{2}+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}2HCHO}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47f489899e1d5a88192cafe55345e5592f610707)


![{\displaystyle CH_{2}=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f95cf5644b60ae4eb8130c07c91d46249c1cec0)