Οργανιωδιούχες ενώσεις
Οι οργανιωδιούχες ενώσεις ή οργανιωδίδια είναι οργανικές χημικές ενώσεις που περιέχουν ένα ή περισσότερα άτομα ιωδίου ανά μόριο, και επομένως περιέχουν έναν ή περσσότερους, αντίστοιχα, δεσμούς άνθρακα - ιωδίου. Συμμετέχουν ευρύτατα στην οργανική χημεία, αλλά είναι σχετικά σπάνιες στη φύση. Ωστόσο, οι θυροξινορμόνες είναι οργανιωδιούχες ενώσεις που είναι απαραίτητες για την υγεία και γι' αυτόν το λόγο φροντίζεται από τις κυβερνήσεις, ανά τον κόσμο, η ιωδίωση του μαγειρικού αλατιού.
Δομή, δεσμολογία και γενικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Σχεδόν σε όλες τις οργανιωδιούχες ενώσεις, κάθε άτομο ιωδίου ενώνεται με ένα άτομο ενώνεται με ένα άτομο άνθρακα. Οι ενώσεις αυτές ταξινομούνται συνήθως ως παράγωγα του ιωδίου, με το ιώδιο στην βαθμίδα οξείδωσης -1. Υπάρχουν, ωστόσο, μερικές οργανιωδιούχες ενώσεις με το ιώδιο σε υψηλότερους βαθμούς οξείδωσης[1].
Ο δεσμός C-I είναι ο ασθενέσθερος από τους δεσμούς άνθρακα - αλογόνου. Η ισχύς αυτών των δεσμών σχετίζεται με την ηλεκτραρνητικότητα των αλογόνων, οπότε μειώνεται κατά τη σειρά: F > Cl > Br > I. Αυτή η περιοδικότητα επίσης ακολουθεί τις ατομικές ακτίνες των αλογόνων και των μηκών των δεσμών άνθρακα - αλογόνου. Για παράδειγμα, για τις ενώσεις με γενικό τύπο CH3X, όπου X αλογόνο, οι δεσμοί C-X έχουν ενέργειες διάσπασης 115, 83,7, 72,1 και 57,6 kcal/mol, για X = F, Cl, Br και I, αντίστοιχα[2]. Για τα αλογονίδια, το ιώδιο είναι συνήθως η καλύτερη «αποχωρούσα ομάδα». Εξαιτίας ακριβώς της αδυναμίας του δεσμού C-I, τα δείγματα οργανιωδιούχων ενώσεων είναι συχνά κίτρινα, εξαιτίας της συχνής παρουσίας στοιχειακού ιωδίου (I2), ως πρόσμιξη.
Μια αξιοσημείωτη ιδιότητα των οργανιωδιούχων ενώσεων είναι η υψηλή πυκνότητά τους, που αυξάνεται από το υψηλό ατομικό βάρος του ιωδίου. Για παράδειγμα, η πυκνότητα του ιωδομεθάνιου είναι (στις συνηθισμένες συνθήκες) 3.325 kg/m³.
Μέθοδοι παραγωγής[Επεξεργασία | επεξεργασία κώδικα]
Οι οργανιωδιούχες ενώσεις μπορούν να παραχθούν από πολλές παραγωγικές οδούς, που εξαρτώνται από τον αριθμό και την τοποχημεία, των ατόμων ιωδίου που περιέχουν, καθώς και από τη φύση των πρόδρομων ενώσεων που είναι διαθέσιμες. Η απευθείας ιωδίωση με στοιχειακό ιώδιο είναι πρακτικά εφαρμώσιμη σε ακόρεστες ουσίες. Για παράδειγμα[3]:
To ιωδιούχο ανιόν (I-) είναι καλό πυρηνόφιλο και υποκαθιστά χλωριούχες, βρωμιούχες, μεσυλούχες (-SO4CH3), τοσυλούχες (π-CH3C6H4SO2-) και άλλες αποχωρούσες ομάδες, όπως στην αντίδραση Φινκελστάιν (Finkelstein reaction). Για παράδειγμα:
- Όπου το X μπορεί να είναι χλώριο, βρώμιο, μεσυλομάδα, τοσυλομάδα.
Οι αρωματικές ιωδιούχες ενώσεις μπορούν να παραχθούν διαμέσου ενός διαζωνιακού άλατος (ArN2+ X-) και της αντίδραση Σάντμεγιερ (Sandmeyer reaction):
Επειδή τι ιώδιο έχει χαμηλή ενέργεια ιονισμού, μπορεί εύκολα να μετατραπεί σε αντιδραστήρια που αποτελούν χημικά ισοδύναμα του κατιόντος ιωδίου (I+)[4]. Ένα αντιπροσωπευτικό αντιδραστήριο ηλεκτρονιόφιλης ιωδίωσης είναι το μονοχλωριούχο ιώδιο (ClI).
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]

.
Λίγες οργανιωδιούχες ενώσεις είναι σημαντικές βιομηχανικά, τουλάχιστον με όρους μεγάλης κλίμακας παραγωγής. Ιωδιούχα ενδιάμεσα είναι συνηθισμένα στην οργανική σύνθεση, εξαιτίας της ευκολίας σχηματισμού και διάσπασης του δεσμού C-I. Βιομηχανικά σημαντικές οργανιωδιούχες ενώσεις, που συχνά χρησιμοποιήθηκαν ως απολυμαντικά ή εντομοκτόνα, είναι το ιωδοφόρμιο (CHI3), το διιωδομεθάνιο (CH2I2) και το ιωδομεθάνιο (CH3I)[5]. Παρόλο που το ιωδομεθάνιο δεν είναι ένα βιομηχανικά σημαντικό τελικό προϊόν, είναι ωστόσο σημαντικό ενδιάμεσο, που παράγεται ενδιάμεσα στην παραγωγή του αιθανικού οξέος και του αιθανικού ανυδρίτη. Η δυνατότητα του ιωδομεθανίου να αντικαταστήσει τη χρήση του βρωμομεθάνιου ως εδαφικό αποστειρωτικό είναι υπολογίσιμη, αλλά ωστόσο περιορισμένη εξαιτίας των περιορισμένων διαθέσιμων πληροφοριών για την περιβαλλοντική συμπεριφορά του (ιωδομεθανίου)[6]. Το ιωδοξυνύλιο (iodoxynil, δηλαδή το 3,5-διιωδο-4-υδροξυβενζονιτρίλιο), που παρεμποδίζει τη φωτοσύνθεση στο φωτοσύστημα II, είναι ένα από τα πολύ λίγα οργανιωδιούχα ζιζανιοκτόνα. Το ιωδοξυνύλιο είναι μέλος της τάξης των ζιζανιοκτόνων υδροξυβενζονιτριλίων, και πιο συγκεκριμένα το ιωδιούχο ανάλογο του βρωμοξυνύλιου (bromoxynil, 3,5-διβρωμο-4-υδροξυβενζονιτρίλιο), που είναι ένα πιο γνωστό ζιζανιοκτόνο της τάξης των υδροξυβενζονιτριλίων.
Οι ιωδιούχες και οι βρωμιούχες οργανικές ενώσεις παρουσιάζουν ανησυχία ως περιβαλλοντικοί ρύποι, γιατί υπάρχει περιορισμένη διαθέσιμη πληροφόρηση για την περιβαλλοντική τους συμπεριφορά, οπότε δεν έχει καθοριστεί ακόμη η μοίρα τους. Ωστόσο, πρόσφατες αναφορές έχουν δείξει υποσχέσεις για ύπαρξη βιολογικής αποτοξίνωσης αυτών των κατηγοριών ρύπων. Για παράδειγμα, ένα ένζυμο των θηλαστικών, η απιωδάση της ιωδοτυροσίνης, παρέχει την ασυνήθιστη λειτουργία αναγωγικής απαλογόνωσης των ιωδιούχων ή και των βρωμιούχων αλοργανικών παραγώγων[7]. Τα ζιζαντιοκτόνα βρωμοξυνύλιο και ιωδοξυνύλιο έχουν δείξει ότι μπορούν να υποβληθούν σε μια ποικιλία περιβαλλοντολογικών μετατροπών, που περιλαμβάνουν την αναγωγική απαλογόνωση από αναερόβια βακτήρια[8].
Οι πολυιωδιούχες οργανικές ενώσεις χρησιμοποιήθηκαν μερικές φορές ως μέσα αντίθεσης για χρήση ακτίνων X, στην ακτινοσκόπηση, που είναι ένας τύπος ιατρικής απεικόνισης. Αυτή η εφαρμογή εκμεταλλεύεται την ικανότητα των ακτίνων Χ να απορροφούνται από τους βαρείς ατομικούς πυρήνες του ιωδίου. Μια ποικιλία τέτοιων ενώσεων είναι εμπορικά διαθέσιμες, πολλές από τις οποίες είναι παράγωγα του 1,3,5-τριιωδοβενζόλιου και περιέχουν περίπου 50% κατά βάρος ιώδιο. Στις περισσότερες εφαρμογές, η χρησιμοποποιούμενη ένωση πρέπει να είναι υδατοδιαλυτή και φυσικά μη τοξική και να είναι εύκολη η απέκκρισή τους. Ένα συνηθισμένο τέτοιο αντιδραστήριο είναι η ιωβερσόλη (Ioversol)[9], που περιέχει υδοτοδιαλυτούς διικούς υποκαταστάτες. Τυπικές εφαρμογές περιλαμβάνουν την ουρογραφία και την αγγειογραφία.
Βιολογικός ρόλος[Επεξεργασία | επεξεργασία κώδικα]

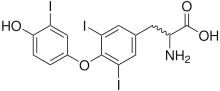
Σε όρους ανθρώπινης υγείας, οι πιο σημαντικές οργανιωδιούχες ενώσεις είναι οι δυο ιωδιούχες ορμόνες του θυροειδούς, δηλαδή η θυροξίνη (T4) και η τριιωδοθυροξίνη (T3)[10]. Τα υδρόβια φυσικά προϊόντα είναι πλούσιες πηγές οργανιιωδιούχων ενώσεων, όπως οι πρόσφατα ανακαλυφθήσες πλακοϋπαφορίνες από το σπόγγο Plakortis simplex.
Το σύνολο του παγκοσμίως φυσικά παραγώμενου ιωδομεθανίου, που παράγεται από υδρόβια περιβάλλοντα, από μικροβιακή δραστηριότητα σε ορυζώνες και από καύση βιολογικού υλικού, εκτιμήθηκε σε 214.000 τόννους ετησίως[11].
Το πτητικό ιωδομεθάνιο διασπάται με αντιδράσεις οξείδωσης στην ατμόσφαιρα και υπάρχει ένας παγκόσμιος «κύκλος ιωδίου».
| CH | He | ||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | ||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | ||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | |
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | |||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | |||
| Πυρήνας της οργανικής χημείας | Πολλές χρήσεις στη χημεία |
| Ακαδημαϊκή έρευνα, όχι ευρεία χρήση | Άγνωστοι δεσμοί |
Παραπομπές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Alex G. Fallis, Pierre E. Tessier, "2-Iodoxybenzoic acid (IBX)1" Encyclopedia of Reagents for Organic Synthesis, 2003 John Wiley. doi:10.1002/047084289X.rn00221
- ↑ Blanksby SJ, Ellison GB (April 2003). "Bond dissociation energies of organic molecules". Acc. Chem. Res. 36 (4): 255–63. doi:10.1021/ar020230d. PMID 12693923.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2, Χ = Ι.
- ↑ F. B. Dains and R. Q. Brewster (1941), "Iodobenzene", Org. Synth.; Coll. Vol. 1: 323
- ↑ Phyllis A. Lyday (2005), "Iodine and Iodine Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a14_381
- ↑ Allard, A.S. and A. H. Neilson. 2003. Degradation and transformation of organic bromine and iodine compounds: comparison with their chlorinated analogues. The Handbook of Environmental Chemistry 3:1-74.
- ↑ McTamney, P.M. and S.E. Rokita . 2010. A mammalian reductive deiodinase has broad power to dehalogenate chlorinated and brominated substrates. J Am Chem Soc. 131(40): 14212–14213.
- ↑ Cupples, A. M., R. A. Sanford, and G. K. Sims. 2005. Dehalogenation of Bromoxynil (3,5-Dibromo-4-Hydroxybenzonitrile) and Ioxynil (3,5-Diiodino-4-Hydroxybenzonitrile) by Desulfitobacterium chlororespirans. Appl. Env. Micro. 71(7):3741-3746.
- ↑ Ulrich Speck, Ute Hübner-Steiner "Radiopaque Media" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a22_593
- ↑ Gribble, G. W. (1996). "Naturally occurring organohalogen compounds - A comprehensive survey". Progress in the Chemistry of Organic Natural Products 68 (10): 1–423. doi:10.1021/np50088a001. PMID 8795309.
- ↑ N. Bell, L. Hsu, D. J. Jacob, M. G. Schultz, D. R. Blake, J. H. Butler, D. B. King, J. M. Lobert, and E. Maier-Reimer (2002). "Methyl iodide: Atmospheric budget and use as a tracer of marine convection in global models". Journal of Geophysical Research 107 (D17): 4340. Bibcode:2002JGRD..107.4340B. doi:10.1029/2001JD001151.



