Απενεργοποίηση του χρωμοσώματος Χ

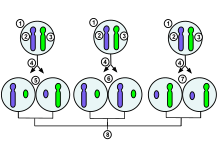
1.Εμβρυϊκό κύτταρο πρώιμου σταδίου μιας γυναίκας
2.Μητρικό χρωμόσωμα Χ
3.Πατρικό χρωμόσωμα Χ
4.Μίτωση και τυχαίο συμβάν απενεργοποίησης του χρωμοσώματος Χ
5. Το πατρικό χρωμόσωμα απενεργοποιείται τυχαία στο ένα θυγατρικό κύτταρο, το μητρικό χρωμόσωμα απενεργοποιείται στο άλλο
6. Το πατρικό χρωμόσωμα απενεργοποιείται τυχαία και στα δύο θυγατρικά κύτταρα
7. Το μητρικό χρωμόσωμα απενεργοποιείται τυχαία και στα δύο θυγατρικά κύτταρα
8.Τρία πιθανά τυχαία αποτελέσματα συνδυασμού

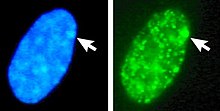
Αριστερά: Βαμμένος πυρήνας με DNA (DAPI). Το βέλος υποδεικνύει τη θέση του σωματιδίου Barr (Xi). Δεξιά: Ανιχνεύτηκε πρωτεΐνη που σχετίζεται με το DNA ιστονών
Η απενεργοποίηση (ή αδρανοποίηση) του χρωμοσώματος Χ (X-inactivation) (επίσης αποκαλούμενη Λυονοποίηση ή υπόθεση της Lyon (Lyonization από την αγγλίδα γενετίστρια Mary Lyon)) είναι μια διαδικασία με την οποία ένα από τα αντίγραφα του χρωμοσώματος X απενεργοποιείται στην υποτάξη θηρίων (therian) των θηλυκών θηλαστικών. Το ανενεργό χρωμόσωμα Χ αποσιωπάται με το να συσκευάζεται σε μια μεταγραφικά ανενεργή δομή που ονομάζεται ετεροχρωματίνη. Καθώς σχεδόν όλα τα θηλυκά θηλαστικά έχουν δύο χρωμοσώματα Χ, η απενεργοποίηση Χ τα εμποδίζει να έχουν διπλάσια γονιδιακά προϊόντα χρωμοσωμάτων Χ από τα αρσενικά, τα οποία διαθέτουν μόνο ένα αντίγραφο του χρωμοσώματος Χ. Η επιλογή του χρωμοσώματος Χ που θα απενεργοποιηθεί σε ένα συγκεκριμένο εμβρυϊκό κύτταρο είναι τυχαία σε πλακουντικά θηλαστικά όπως ο άνθρωπος, αλλά μόλις ένα χρωμόσωμα Χ απενεργοποιηθεί θα παραμείνει ανενεργό καθ' όλη τη διάρκεια ζωής του κυττάρου και των απογόνων του στον οργανισμό (στην κυτταρική του σειρά). Το αποτέλεσμα είναι ότι η επιλογή του απενεργοποιημένου χρωμοσώματος Χ σε όλα τα κύτταρα του οργανισμού είναι μια τυχαία κατανομή, με περίπου τα μισά κύτταρα να έχουν συχνά το πατρικό χρωμόσωμα Χ απενεργοποιημένο και τα μισά με ένα απενεργοποιημένο μητρικό χρωμόσωμα Χ. Αλλά συνήθως, η απενεργοποίηση X κατανέμεται άνισα στις κυτταρικές σειρές ενός οργανισμού (ασύμμετρη απενεργοποίηση του X). Σε αντίθεση με την τυχαία απενεργοποίηση του Χ στα πλακουντικά θηλαστικά, η αδρανοποίηση σε μαρσιποφόρα ισχύει αποκλειστικά για το πατρικά προερχόμενο χρωμόσωμα Χ.
Μηχανισμός
[Επεξεργασία | επεξεργασία κώδικα]Κύκλος ενεργοποίησης χρωμοσώματος Χ σε τρωκτικά
[Επεξεργασία | επεξεργασία κώδικα]Οι παρακάτω παράγραφοι έχουν να κάνουν μόνο με τρωκτικά και δεν αντικατοπτρίζουν την απενεργοποίηση του Χ στην πλειοψηφία των θηλαστικών. Η αδρανοποίηση του Χ είναι μέρος του κύκλου ενεργοποίησης του χρωμοσώματος Χ σε όλη τη θηλυκή ζωή. Το ωάριο και ο γονιμοποιημένος ζυγώτης χρησιμοποιούν αρχικά μητρικά μεταγραφήματα και ολόκληρο το εμβρυϊκό γονιδίωμα αποσιωπάται μέχρι την ενεργοποίηση του ζυγωτικού γονιδιώματος. Στη συνέχεια, όλα τα κύτταρα ποντικού υφίστανται μια πρώιμη, αποτυπωμένη αδρανοποίηση του πατρικά προερχόμενου χρωμοσώματος Χ στο στάδιο 4-8 κυττάρων των εμβρύων.[3][4][5][6] Οι εξωεμβρυϊκοί ιστοί (οι οποίοι δημιουργούν τον πλακούντα και άλλους ιστούς που υποστηρίζουν το έμβρυο) διατηρούν αυτήν την πρώιμη αποτυπωμένη αδρανοποίηση, και έτσι μόνο το μητρικό χρωμόσωμα Χ είναι ενεργό σε αυτούς τους ιστούς. Στην πρώιμη βλαστοκύστη, αυτή η αρχική, εντυπωμένη απενεργοποίηση του Χ αντιστρέφεται στα κύτταρα της εσωτερικής κυτταρικής μάζας (που δημιουργούν το έμβρυο) και σε αυτά τα κύτταρα και τα δύο χρωμοσώματα Χ γίνονται ξανά ενεργά. Στη συνέχεια, καθένα από αυτά τα κύτταρα απενεργοποιεί ανεξάρτητα και τυχαία ένα αντίγραφο του χρωμοσώματος Χ.[5] Αυτό το συμβάν αδρανοποίησης είναι μη αναστρέψιμο κατά τη διάρκεια της ζωής του ατόμου, με εξαίρεση τη βλαστική γραμμή. Στη θηλυκή βλαστική γραμμή πριν από την είσοδο της μειωτικής, η απενεργοποίηση Χ αντιστρέφεται, έτσι ώστε μετά τη μείωση όλα τα απλοειδή ωοκύτταρα να περιέχουν ένα μόνο ενεργό χρωμόσωμα Χ.
Επισκόπηση
[Επεξεργασία | επεξεργασία κώδικα]Το Xi σημαίνει το ανενεργό, το Xa το ενεργό χρωμόσωμα Χ. Το XP υποδηλώνει το πατρικό και το XM το μητρικό χρωμόσωμα Χ. Όταν το ωάριο (που φέρει XM), γονιμοποιείται από ένα σπέρμα (που φέρει ένα Y ή ένα XP) σχηματίζει διπλοειδή ζυγώτο. Από το ζυγωτό, μέχρι το στάδιο του ενήλικα, στην επόμενη γενιά ωαρίων, το χρωμόσωμα Χ υφίσταται τις ακόλουθες αλλαγές:
- XiP XiM ζυγωτό → υφίσταται ενεργοποίηση ζυγωτικού γονιδιώματος, που οδηγεί σε:
- XaP XaM → υφίσταται αποτυπωμένη (πατρική) απενεργοποίηση του Χ, που οδηγεί σε:
- XiP XaM → υφίσταται ενεργοποίηση του Χ στο πρώιμο στάδιο βλαστοκύστης, που οδηγεί σε:
- XaP XaM → υφίσταται τυχαία απενεργοποίηση του Χ στην εμβρυϊκή γραμμή (εσωτερική κυτταρική μάζα) στο στάδιο της βλαστοκύστης, που οδηγεί σε:
- XiP XaM Ή XaP XiM → υφίστανται Επανενεργοποίηση του Χ σε αρχέγονα γεννητικά κύτταρα πριν από τη μείωση, που οδηγεί σε:
- XaM XaP διπλοειδή γεννητικά κύτταρα σε μειωτική ανακοπή. Καθώς η μείωση I ολοκληρώνεται μόνο με ωορρηξία, τα ανθρώπινα γεννητικά κύτταρα υπάρχουν σε αυτό το στάδιο από τις πρώτες εβδομάδες ανάπτυξης μέχρι την εφηβεία. Η ολοκλήρωση της μείωσης οδηγεί σε:
- XaM ΚΑΙ XaP απλοειδή γεννητικά κύτταρα (ωάρια).
Ο κύκλος ενεργοποίησης Χ έχει μελετηθεί καλύτερα σε ποντίκια, αλλά υπάρχουν πολλές μελέτες σε ανθρώπους. Καθώς τα περισσότερα στοιχεία προέρχονται από ποντίκια, το παραπάνω σχήμα αντιπροσωπεύει τα γεγονότα σε ποντίκια. Η ολοκλήρωση της μείωσης απλοποιείται εδώ για λόγους σαφήνειας. Τα βήματα 1-4 μπορούν να μελετηθούν σε γονιμοποιημένα έμβρυα in vitro και στη διαφοροποίηση βλαστοκυττάρων. Η επανενεργοποίηση του Χ συμβαίνει στο αναπτυσσόμενο έμβρυο και τα επόμενα (6-7) βήματα μέσα στο γυναικείο σώμα, επομένως είναι πολύ πιο δύσκολο να μελετηθεί.
Χρονισμός
[Επεξεργασία | επεξεργασία κώδικα]Ο χρονισμός κάθε διαδικασίας εξαρτάται από το είδος και σε πολλές περιπτώσεις ο ακριβής χρόνος συζητείται έντονα. [Ολόκληρο το μέρος του χρόνου της ανθρώπινης αδρανοποίησης του Χ σε αυτόν τον πίνακα είναι πολύ αμφίβολος και θα πρέπει να αφαιρεθεί μέχρι να τεκμηριωθεί σωστά από εμπειρικά δεδομένα]
| Διαδικασία | Ποντίκι | Άνθρωπος | |
| 1 | Ενεργοποίηση ζυγωτικού γονιδιώματος | Στάδιο 2-4 κυττάρων [7] | Στάδιο 2-8 κυττάρων [7] |
| 2 | Εντυπωμένη (πατρική) Χ-αδρανοποίηση | Στάδιο 4-8 κυττάρων [6][8] | Ασαφές εάν λαμβάνει χώρα σε ανθρώπους [9] |
| 3 | Ενεργοποίηση του Χ | Πρώιμο στάδιο βλαστοκύστης | Πρώιμο στάδιο βλαστοκύστης |
| 4 | Τυχαία αδρανοποίηση Χ στην εμβρυϊκή γραμμή (εσωτερική κυτταρική μάζα) | Τελευταίο στάδιο βλαστοκύστης | Τελευταίο στάδιο βλαστοκύστης, μετά την εμφύτευση [9] |
| 5 | Επανενεργοποίηση του Χ σε αρχέγονα γεννητικά κύτταρα πριν από τη μείωση | Από πριν την αναπτυξιακή εβδομάδα 4 έως την εβδομάδα 14[10][11] |
Κληρονομικότητα της κατάστασης αδρανοποίησης μεταξύ των γενεών κυττάρων
[Επεξεργασία | επεξεργασία κώδικα]Οι απόγονοι κάθε κυττάρου που απενεργοποίησαν ένα συγκεκριμένο χρωμόσωμα Χ θα απενεργοποιήσουν επίσης το ίδιο χρωμόσωμα. Αυτό το φαινόμενο, το οποίο μπορεί να παρατηρηθεί στον χρωματισμό της γάτας ταρτούγας όταν τα θηλυκά είναι ετερόζυγα για το γονίδιο χρωστικής που είναι συνδεδεμένο με το Χ και δεν πρέπει να συγχέεται με το μωσαϊκισμό, που είναι ένας όρος που αναφέρεται συγκεκριμένα σε διαφορές στον γονότυπο διαφόρων πληθυσμών κυττάρων στο ίδιο άτομο. Η απενεργοποίηση του Χ, η οποία είναι μια επιγενετική αλλαγή που οδηγεί σε διαφορετικό φαινότυπο, δεν είναι μια αλλαγή στο επίπεδο γονοτύπου. Για ένα μεμονωμένο κύτταρο ή γενεαλογία, η αδρανοποίηση είναι επομένως ασύμμετρη ή 'μη τυχαία', και αυτό μπορεί να προκαλέσει ήπια συμπτώματα σε γυναίκες 'φορείς' γενετικών διαταραχών με συνδεδεμένο Χ.[12]
Επιλογή ενός ενεργού χρωμοσώματος Χ
[Επεξεργασία | επεξεργασία κώδικα]Τα τυπικά θηλυκά διαθέτουν δύο χρωμοσώματα Χ και σε οποιοδήποτε δεδομένο κύτταρο ένα χρωμόσωμα θα είναι ενεργό (που ορίζεται ως Xa) και ένα θα είναι ανενεργό (Xi). Ωστόσο, μελέτες ατόμων με επιπλέον αντίγραφα του χρωμοσώματος Χ δείχνουν ότι σε κύτταρα με περισσότερα από δύο χρωμοσώματα Χ υπάρχει ακόμα μόνο ένα Χα και όλα τα υπόλοιπα χρωμοσώματα Χ είναι απενεργοποιημένα. Αυτό υποδεικνύει ότι η προεπιλεγμένη κατάσταση του χρωμοσώματος Χ στις γυναίκες είναι η αδρανοποίηση, αλλά ένα χρωμόσωμα Χ επιλέγεται πάντα για να παραμείνει ενεργό. Είναι κατανοητό ότι η αδρανοποίηση του χρωμοσώματος Χ είναι μια τυχαία διαδικασία, που συμβαίνει περίπου τη στιγμή της γαστριδίωσης (gastrulation) στην επιβλάστη (κύτταρα που θα δημιουργήσουν το έμβρυο). Το μητρικό και πατρικό χρωμόσωμα Χ έχουν ίση πιθανότητα αδρανοποίησης. Αυτό θα υποδήλωνε ότι οι γυναίκες αναμένεται να υποφέρουν από διαταραχές που συνδέονται με το Χ περίπου 50% εξίσου συχνά με τους άνδρες (επειδή οι γυναίκες έχουν δύο χρωμοσώματα Χ, ενώ οι άνδρες έχουν μόνο ένα). Ωστόσο, στην πραγματικότητα, η εμφάνιση αυτών των διαταραχών στις γυναίκες είναι πολύ μικρότερη από αυτήν. Μια εξήγηση για αυτή τη διαφορά είναι ότι 12-20%[13] των γονιδίων στο αδρανοποιημένο χρωμόσωμα Χ παραμένουν εκφρασμένα, παρέχοντας έτσι στις γυναίκες πρόσθετη προστασία έναντι ελαττωματικών γονιδίων που κωδικοποιούνται από το χρωμόσωμα Χ. Κάποιοι προτείνουν ότι αυτή η διαφορά πρέπει να αποτελεί ένδειξη προτιμησιακής (μη τυχαίας) αδρανοποίησης. Η κατά προτίμηση αδρανοποίηση του πατρικού χρωμοσώματος Χ συμβαίνει τόσο στα μαρσιποφόρα όσο και στις κυτταρικές γενεαλογίες που σχηματίζουν τις μεμβράνες που περιβάλλουν το έμβρυο,[14] ενώ στα θηλαστικά με πλακούντα είτε το μητρικό, είτε το πατρικό χρωμόσωμα Χ μπορεί να απενεργοποιηθεί σε διαφορετικές κυτταρικές γραμμές.[15] Η χρονική περίοδος για την αδρανοποίηση του χρωμοσώματος Χ εξηγεί αυτή τη διαφορά. Η αδρανοποίηση συμβαίνει στην επιβλάστη κατά τη γαστριδίωση, η οποία δημιουργεί το έμβρυο.[16] Η αδρανοποίηση συμβαίνει σε κυτταρικό επίπεδο, με αποτέλεσμα μια έκφραση μωσαϊκού, στην οποία επιρράματα κυττάρων έχουν ένα ανενεργό μητρικό χρωμόσωμα Χ, ενώ άλλα επιρράματα έχουν ένα ανενεργό πατρικό χρωμόσωμα Χ. Για παράδειγμα, μια γυναίκα ετερόζυγη για αιμορροφιλία (μια ασθένεια που συνδέεται με το Χ) θα έχει περίπου τα μισά ηπατικά της κύτταρα να λειτουργούν σωστά, κάτι που τυπικά είναι αρκετό για να εξασφαλίσει φυσιολογική πήξη του αίματος.[17][18] Η πιθανότητα θα μπορούσε να οδηγήσει σε σημαντικά πιο δυσλειτουργικά κύτταρα. Ωστόσο, τέτοιες στατιστικά ακραίες τιμές είναι απίθανες. Οι γενετικές διαφορές στο χρωμόσωμα μπορεί επίσης να καταστήσουν ένα χρωμόσωμα Χ πιο πιθανό να υποστεί αδρανοποίηση. Επίσης, εάν ένα χρωμόσωμα Χ έχει μια μετάλλαξη που εμποδίζει την ανάπτυξή του ή το καθιστά μη βιώσιμο, τα κύτταρα που απενεργοποίησαν τυχαία αυτό το Χ θα έχουν εκλεκτικό πλεονέκτημα έναντι των κυττάρων που απενεργοποίησαν τυχαία το φυσιολογικό αλληλόμορφο. Έτσι, αν και η αδρανοποίηση είναι αρχικά τυχαία, τα κύτταρα που απενεργοποιούν ένα φυσιολογικό αλληλόμορφο (αφήνοντας το μεταλλαγμένο αλληλόμορφο ενεργό) θα αναπτυχθούν τελικά υπερβολικά και θα αντικατασταθούν από λειτουργικά φυσιολογικά κύτταρα στα οποία σχεδόν όλα έχουν ενεργοποιημένο το ίδιο χρωμόσωμα Χ.[17] Υποτίθεται ότι υπάρχει ένας αυτοσωμικά κωδικοποιημένος 'παράγοντας αποκλεισμού' που συνδέεται με το χρωμόσωμα Χ και εμποδίζει την αδρανοποίησή του..[19] Το μοντέλο υποστηρίζει ότι υπάρχει ένας περιοριστικός παράγοντας αποκλεισμού, επομένως από τη στιγμή που το διαθέσιμο μόριο του παράγοντα αποκλεισμού συνδεθεί σε ένα χρωμόσωμα Χ, τα υπόλοιπα χρωμοσώματα Χ δεν προστατεύονται από την αδρανοποίηση. Αυτό το μοντέλο υποστηρίζεται από την ύπαρξη ενός μόνο Χα σε κύτταρα με πολλά χρωμοσώματα Χ και από την ύπαρξη δύο ενεργών χρωμοσωμάτων Χ σε κυτταρικές γραμμές με διπλάσιο αριθμό αυτοσωμάτων από τον κανονικό.[20] Οι αλληλουχίες στο Κέντρο αδρανοποίησης X ( inactivation center, XIC), που υπάρχουν στο χρωμόσωμα Χ, ελέγχουν τη σίγαση του χρωμοσώματος Χ. Ο υποθετικός παράγοντας αποκλεισμού προβλέπεται ότι συνδέεται με αλληλουχίες εντός του XIC.
Έκφραση διαταραχών που συνδέονται με Χ σε ετερόζυγα θηλυκά
[Επεξεργασία | επεξεργασία κώδικα]Η επίδραση της ετεροζυγωτίας του θηλυκού Χ είναι εμφανής σε ορισμένα εντοπισμένα χαρακτηριστικά, όπως το μοναδικό μοτίβο τριχώματος μιας γάτας κάλικο. Μπορεί να είναι πιο δύσκολο, ωστόσο, να κατανοήσουμε πλήρως την έκφραση μη εντοπισμένων χαρακτηριστικών σε αυτά τα θηλυκά, όπως η έκφραση της ασθένειας. Δεδομένου ότι τα αρσενικά έχουν μόνο ένα αντίγραφο του χρωμοσώματος Χ, όλα τα εκφρασμένα χρωμοσωμικά γονίδια (ή αλληλόμορφα, στην περίπτωση πολλαπλών μορφών παραλλαγών για ένα δεδομένο γονίδιο στον πληθυσμό) του Χ βρίσκονται σε αυτό το αντίγραφο του χρωμοσώματος. Τα θηλυκά, ωστόσο, θα εκφράζουν κυρίως τα γονίδια ή τα αλληλόμορφα που βρίσκονται στο αντίγραφο του χρωμοσώματος Χ που παραμένει ενεργό. Λαμβάνοντας υπόψη την κατάσταση για ένα γονίδιο ή πολλαπλά γονίδια που προκαλούν ατομικές διαφορές σε ένα συγκεκριμένο φαινότυπο (δηλαδή προκαλεί διακύμανση που παρατηρείται στον πληθυσμό για αυτόν τον φαινότυπο), στα ομόζυγα θηλυκά δεν έχει ιδιαίτερη σημασία ποιο αντίγραφο του χρωμοσώματος είναι απενεργοποιημένο, καθώς τα αλληλόμορφα και στα δύο αντίγραφα είναι τα ίδια. Ωστόσο, στα θηλυκά που είναι ετερόζυγα στα αιτιολογικά γονίδια, η αδρανοποίηση του ενός αντιγράφου του χρωμοσώματος έναντι του άλλου μπορεί να έχει άμεσο αντίκτυπο στη φαινοτυπική τους τιμή. Εξαιτίας αυτού του φαινομένου, παρατηρείται αύξηση της φαινοτυπικής παραλλαγής στα θηλυκά που είναι ετερόζυγα στο εμπλεκόμενο γονίδιο ή γονίδια σε σχέση με τα θηλυκά που είναι ομόζυγα σε αυτό το γονίδιο ή σε αυτά τα γονίδια.[21] Υπάρχουν πολλοί διαφορετικοί τρόποι με τους οποίους μπορεί να διαδραματιστεί η φαινοτυπική παραλλαγή. Σε πολλές περιπτώσεις, τα ετερόζυγα θηλυκά μπορεί να είναι ασυμπτωματικά ή να παρουσιάζουν μόνο μικρά συμπτώματα μιας δεδομένης διαταραχής, όπως με X-συνδεδεμένη αδρενολευκοδυστροφία.[22] Η διαφοροποίηση του φαινοτύπου στα ετερόζυγα θηλυκά ενισχύεται από την παρουσία ασύμμετρης απενεργοποίησης του Χ. Τυπικά, κάθε χρωμόσωμα Χ αποσιωπάται στα μισά από τα κύτταρα, αλλά αυτή η διαδικασία παραμορφώνεται όταν συμβαίνει προτιμώμενη αδρανοποίηση ενός χρωμοσώματος. Θεωρείται ότι η παραμόρφωση συμβαίνει είτε τυχαία είτε από ένα φυσικό χαρακτηριστικό ενός χρωμοσώματος που μπορεί να προκαλέσει τη σίγασή του περισσότερο ή λιγότερο συχνά, όπως μια δυσμενή μετάλλαξη.[23][24] Κατά μέσο όρο, κάθε χρωμόσωμα Χ αδρανοποιείται στα μισά κύτταρα, αν και το 5-20% των γυναικών εμφανίζουν ασύμμετρη απενεργοποίηση Χ.[23] Σε περιπτώσεις όπου υπάρχει παραμόρφωση, μπορεί να εμφανιστεί ένα ευρύ φάσμα έκφρασης συμπτωμάτων, με αποτέλεσμα η έκφραση να ποικίλλει από ελάχιστη έως σοβαρή, ανάλογα με την αναλογία παραμόρφωσης. Μια ακραία περίπτωση αυτού παρατηρήθηκε όπου τα μονοζυγωτικά θηλυκά δίδυμα είχαν ακραία διακύμανση στην έκφραση της νόσου Menkes (μια διαταραχή που συνδέεται με το Χ) με αποτέλεσμα το θάνατο ενός διδύμου ενώ το άλλο παρέμενε ασυμπτωματικό.[25] Θεωρείται ότι η ασυμμετρία της απενεργοποίησης Χ θα μπορούσε να προκληθεί από προβλήματα στον μηχανισμό που προκαλεί την αδρανοποίηση ή από προβλήματα στο ίδιο το χρωμόσωμα.[23][24] Ωστόσο, ο σύνδεσμος μεταξύ φαινοτύπου και ασυμμετρίας εξακολουθεί να αμφισβητείται και θα πρέπει να εξετάζεται κατά περίπτωση. Μια μελέτη που εξέτασε τόσο συμπτωματικές όσο και ασυμπτωματικές γυναίκες που ήταν ετερόζυγες για μυϊκή δυστροφία Ντουσέν και Μπέκερ (Becker muscular dystrophies, DMD) δεν βρήκε εμφανή σχέση μεταξύ της έκφρασης μεταγραφής και της ασυμμετρίας απενεργοποίησης Χ. Η μελέτη υποδηλώνει ότι και οι δύο μηχανισμοί ρυθμίζονται ανεξάρτητα και ότι παίζουν και άλλοι άγνωστοι παράγοντες.[26]
Χρωμοσωμικό συστατικό
[Επεξεργασία | επεξεργασία κώδικα]Το κέντρο απενεργοποίησης του Χ (X-inactivation center, XIC) στο χρωμόσωμα Χ είναι απαραίτητο και επαρκές για να προκαλέσει την απενεργοποίηση του Χ. Οι χρωμοσωμικές μετατοπίσεις που τοποθετούν το XIC σε ένα αυτόσωμα οδηγούν σε αδρανοποίηση του αυτοσώματος και τα χρωμοσώματα Χ που δεν έχουν το XIC δεν απενεργοποιούνται.[27][28] Το XIC περιέχει τέσσερα μη-μεταφρασμένα γονίδια RNA, το Xist, Tsix, Jpx και το Ftx, που εμπλέκονται στην απενεργοποίηση του Χ. Το XIC περιέχει επίσης θέσεις δέσμευσης τόσο για γνωστές όσο και για άγνωστες ρυθμιστικές πρωτεΐνες.[29]
RNA Xist και Tsix
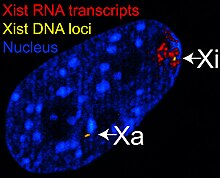
[Επεξεργασία | επεξεργασία κώδικα]Το X-αδρανές ειδικό γονίδιο μεταγραφής (X-inactive specific transcript, Xis) κωδικοποιεί ένα μεγάλο N cRNA που είναι υπεύθυνο για τη μεσολάβηση της ειδικής σίγασης του χρωμοσώματος Χ από το οποίο μεταγράφεται.[30] Το ανενεργό χρωμόσωμα Χ είναι επικαλυμμένο με Xist RNA,[31] ενώ το Xa δεν είναι (Βλ. Εικόνα στα δεξιά). Τα χρωμοσώματα Χ που δεν διαθέτουν το γονίδιο Xist δεν μπορούν να απενεργοποιηθούν.[32] Η τεχνητή τοποθέτηση και έκφραση του γονιδίου Xist σε άλλο χρωμόσωμα οδηγεί σε σίγαση αυτού του χρωμοσώματος.[33][27] Πριν από την αδρανοποίηση, και τα δύο χρωμοσώματα Χ εκφράζουν ασθενώς το RNA του Xist από το γονίδιο Xist. Κατά τη διάρκεια της διαδικασίας αδρανοποίησης, το μελλοντικό Xa παύει να εκφράζει το Xist, ενώ το μελλοντικό Xi αυξάνει δραματικά την παραγωγή RNA του Xist. Στο μελλοντικό Xi, το RNA του Xist επικαλύπτει προοδευτικά το χρωμόσωμα, εξαπλώνοντας προς τα έξω από το XIC.[33] το RNA του Xist δεν εντοπίζεται στο Xa. Η γονιδιακή αποσιώπηση κατά μήκος του Xi συμβαίνει αμέσως μετά την επικάλυψη από το RNA του Xist. Όπως το Xist, το γονίδιο Tsix κωδικοποιεί ένα μεγάλο RNA που δεν πιστεύεται ότι κωδικοποιεί πρωτεΐνες. Το RNA του Tsix μεταγράφεται αντινοηματικά σε Xist, που σημαίνει ότι το γονίδιο Tsix επικαλύπτει το γονίδιο Xist και μεταγράφεται στον αντίθετο κλώνο του DNA από το γονίδιο Xist.[28] Το Tsix είναι ένας αρνητικός ρυθμιστής του Xist. Τα χρωμοσώματα Χ που δεν έχουν έκφραση Tsix (και επομένως έχουν υψηλά επίπεδα μεταγραφής Xist) απενεργοποιούνται πολύ πιο συχνά από τα κανονικά χρωμοσώματα. Όπως το Xist, πριν από την αδρανοποίηση, και τα δύο χρωμοσώματα Χ εκφράζουν ασθενώς το RNA του Tsix από το γονίδιο Tsix. Με την έναρξη της αδρανοποίησης Χ, το μελλοντικό Xi παύει να εκφράζει το RNA του Tsix (και αυξάνει την έκφραση του Xist), ενώ το Xa συνεχίζει να εκφράζει το Tsix για αρκετές ημέρες. Το Rep A είναι ένα μακρύ μη κωδικοποιητικό RNA που λειτουργεί με ένα άλλο μακρύ μη κωδικοποιητικό RNA, το Xist, για την απενεργοποίηση του Χ. Το Rep A αναστέλλει τη λειτουργία του Tsix, του αντινοηματικού του Xist, σε συνδυασμό με την εξάλειψη της έκφρασης του Xite. Προάγει τη μεθυλίωση της περιοχής Tsix προσελκύοντας PRC2 και έτσι απενεργοποιώντας ένα από τα χρωμοσώματα Χ.[29]
Αποσιώπηση
[Επεξεργασία | επεξεργασία κώδικα]Το ανενεργό χρωμόσωμα Χ δεν εκφράζει την πλειοψηφία των γονιδίων του, σε αντίθεση με το ενεργό χρωμόσωμα Χ. Αυτό οφείλεται στη σίγαση του Xi από την κατασταλτική ετεροχρωματίνη, η οποία συμπυκνώνει το DNA του Xi και εμποδίζει την έκφραση των περισσότερων γονιδίων. Σε σύγκριση με το Xa, το Xi έχει υψηλά επίπεδα μεθυλίωσης DNA, χαμηλά επίπεδα ακετυλίωσης ιστόνης, χαμηλά επίπεδα μεθυλίωσης ιστόνης H3 στη λυσίνη-4, και υψηλά επίπεδα μεθυλίωσης ιστόνης Η3 στη λυσίνη-9 και στη λυσίνη-27 που τοποθετείται από το σύμπλοκο PRC2 που στρατολογήθηκε από τον Xist, τα οποία όλα σχετίζονται με τη γονιδιακή αποσιώπηση.[34] Το PRC2 ρυθμίζει τη συμπίεση χρωματίνης και την αναδιαμόρφωση χρωματίνης σε διάφορες διαδικασίες, συμπεριλαμβανομένης της απόκρισης σε Βλάβη DNA.[35] Επιπλέον, μια παραλλαγή ιστόνης που ονομάζεται macroH2A (H2AFY) βρίσκεται αποκλειστικά στα νουκλεοσώματα κατά μήκος του Xi.[36][37]
Σωμάτια Μπαρ
[Επεξεργασία | επεξεργασία κώδικα]Το DNA συσκευασμένο σε ετεροχρωματίνη, όπως το Xi, είναι πιο συμπυκνωμένο από το DNA που συσκευάζεται σε ευχρωματίνη, όπως το Xa. Το ανενεργό Χ σχηματίζει ένα διακριτό σώμα μέσα στον πυρήνα που ονομάζεται σωμάτιο Μπαρ.[38] Το σωμάτιο Barr βρίσκεται γενικά στην περιφέρεια του πυρήνα, καθυστερεί την αντιγραφή εντός του κυτταρικού κύκλου και, καθώς περιέχει το Xi, περιέχει τροποποιήσεις ετεροχρωματίνης και το RNA του Xist.
Εκφρασμένα γονίδια στο ανενεργό χρωμόσωμα Χ
[Επεξεργασία | επεξεργασία κώδικα]Ένα κλάσμα των γονιδίων κατά μήκος του χρωμοσώματος Χ διαφεύγει της αδρανοποίησης στο Xi. Το γονίδιο Xist εκφράζεται σε υψηλά επίπεδα στο Xi και δεν εκφράζεται στο Xa.[39] Πολλά άλλα γονίδια διαφεύγουν της αδρανοποίησης. Μερικά εκφράζονται εξίσου από τα Xa και Xi, και άλλα, ενώ εκφράζονται και από τα δύο χρωμοσώματα, εξακολουθούν να εκφράζονται κυρίως από το Xa.[40][41][42] Έως και το ένα τέταρτο των γονιδίων στο ανθρώπινο Xi μπορούν να διαφύγουν.[40] Μελέτες σε ποντίκια υποδεικνύουν ότι σε οποιονδήποτε δεδομένο τύπο κυττάρου, το 3% έως το 15% των γονιδίων διαφεύγουν της αδρανοποίησης και ότι η διαφυγή της ταυτότητας του γονιδίου ποικίλλει μεταξύ των ιστών.[41][42] Πολλά από τα γονίδια που διαφεύγουν της αδρανοποίησης είναι παρόντα κατά μήκος περιοχών του χρωμοσώματος Χ που, σε αντίθεση με την πλειοψηφία του χρωμοσώματος Χ, περιέχουν γονίδια που υπάρχουν επίσης στο χρωμόσωμα Υ. Αυτές οι περιοχές ονομάζονται ψευδοαυτοσωμικές (pseudoautosomal) περιοχές, καθώς τα άτομα οποιουδήποτε φύλου θα λάβουν δύο αντίγραφα από κάθε γονίδιο σε αυτές τις περιοχές (όπως ένα αυτόσωμα), σε αντίθεση με την πλειοψηφία των γονιδίων κατά μήκος των φυλετικών χρωμοσωμάτων. Δεδομένου ότι τα άτομα οποιουδήποτε φύλου θα λάβουν δύο αντίγραφα από κάθε γονίδιο σε μια ψευδοαυτοσωμική περιοχή, δεν απαιτείται αντιστάθμιση δόσης για τα θηλυκά, επομένως θεωρείται ότι αυτές οι περιοχές του DNA έχουν εξελίξει μηχανισμούς για να ξεφύγουν από την απενεργοποίηση του Χ. Τα γονίδια των ψευδοαυτοσωμικών περιοχών του Xi δεν έχουν τις τυπικές τροποποιήσεις του Xi και έχουν λίγο δεσμευμένο RNA στο Xist. Η ύπαρξη γονιδίων κατά μήκος του ανενεργού Χ που δεν αποσιωπούνται εξηγεί τα ελαττώματα στους ανθρώπους με άτυπους αριθμούς του χρωμοσώματος Χ, όπως στο σύνδρομο Turner (X0, που προκαλείται από το γονίδιο SHOX [43]) ή στο σύνδρομο Klinefelter (XXY). Θεωρητικά, η απενεργοποίηση Χ θα έπερεπε να εξαλείψει τις διαφορές στη δοσολογία των γονιδίων μεταξύ προσβεβλημένων ατόμων και ατόμων με τυπικό συμπλήρωμα χρωμοσώματος. Στα προσβεβλημένα άτομα, ωστόσο, η απενεργοποίηση του Χ είναι ατελής και η δοσολογία αυτών των μη σιγασμένων γονιδίων θα διαφέρει καθώς διαφεύγουν της απενεργοποίησης Χ, παρόμοια με μια αυτοσωμική ανευπλοειδία. Οι ακριβείς μηχανισμοί που ελέγχουν τη διαφυγή από την απενεργοποίηση του Χ δεν είναι γνωστοί, αλλά οι περιοχές αποσιώπησης και διαφυγής έχουν αποδειχθεί ότι έχουν διακριτά σημάδια χρωματίνης.[41][44] Έχει προταθεί ότι η διαφυγή από την απενεργοποίηση του Χ μπορεί να μεσολαβείται από την έκφραση του μακριού μη κωδικοποιητικού RNA (long non-coding RNA, lncRNA) εντός των διαφυγόντων χρωμοσωμικών περιοχών.[2]
Χρήσεις στην πειραματική βιολογία
[Επεξεργασία | επεξεργασία κώδικα]Ο Stanley Michael Gartler χρησιμοποίησε την αδρανοποίηση του χρωμοσώματος Χ για να αποδείξει την κλωνική προέλευση των καρκίνων. Η εξέταση φυσιολογικών ιστών και όγκων από ετερόζυγα θηλυκά για ισοένζυμα του φυλοσύνδετου γονιδίου [[-φωσφορική αφυδρογονάση της 6-γλυκόζης (glucose-6-phosphate dehydrogenase, G6PD) έδειξε ότι τα καρκινικά κύτταρα από τέτοια άτομα εκφράζουν μόνο μία μορφή G6PD, ενώ οι φυσιολογικοί ιστοί αποτελούνται από σχεδόν ίσο μείγμα κυττάρων που εκφράζουν τους δύο διαφορετικούς φαινότυπους. Αυτό το μοτίβο υποδηλώνει ότι ένα μεμονωμένο κύτταρο, και όχι ένας πληθυσμός, αναπτύσσεται σε καρκίνο.[45] Ωστόσο, αυτό το μοτίβο έχει αποδειχθεί λάθος για πολλούς τύπους καρκίνου, υποδηλώνοντας ότι ορισμένοι καρκίνοι μπορεί να είναι πολυκλωνικής προέλευσης.[46] Επιπλέον, η μέτρηση της κατάστασης μεθυλίωσης (αδρανοποίησης) του πολυμορφικού υποδοχέα ανθρώπινου ανδρογόνου (polymorphic human androgen receptor, HUMARA) που βρίσκεται στο χρωμόσωμα Χ θεωρείται η πιο ακριβής μέθοδος για την αξιολόγηση της κλωνικότητας σε γυναικείες βιοψίες καρκίνου.[47] Με αυτή τη μέθοδο δοκιμάστηκε μια μεγάλη ποικιλία όγκων, μερικοί, όπως το νεφρικό καρκίνωμα,[48] βρέθηκαν μονοκλωνικά ενώ άλλα (π.χ. μεσοθηλίωμα [49]) αναφέρθηκαν ως πολυκλωνικά. Οι ερευνητές έχουν επίσης διερευνήσει τη χρήση της αδρανοποίησης των χρωμοσωμάτων Χ για να αποσιωπήσουν τη δραστηριότητα των αυτοσωμικών χρωμοσωμάτων. Για παράδειγμα, οι Jiang κ.α. εισήγαγε ένα αντίγραφο του γονιδίου Xist σε ένα αντίγραφο του χρωμοσώματος 21 σε βλαστικά κύτταρα που προέρχεται από ένα άτομο με τρισωμία 21 (σύνδρομο Down).[50] Το εισαγόμενο γονίδιο Xist προκαλεί σχηματισμό σωματιδίου Μπαρ, ενεργοποιεί σταθερές τροποποιήσεις της ετεροχρωματίνης και αποσιωπά τα περισσότερα γονίδια στο επιπλέον αντίγραφο του χρωμοσώματος 21. Σε αυτά τα τροποποιημένα βλαστοκύτταρα, η γονιδιακή σίγαση με τη μεσολάβηση Xist φαίνεται να αναστρέφει ορισμένα από τα ελαττώματα που σχετίζονται με το σύνδρομο Down.
Ιστορικό
[Επεξεργασία | επεξεργασία κώδικα]Το 1959 ο Susumu Ohno έδειξε ότι τα δύο χρωμοσώματα Χ των θηλαστικών ήταν διαφορετικά: το ένα φαινόταν παρόμοιο με τα αυτοσώματα. το άλλο ήταν συμπυκνωμένο και ετεροχρωματικό.[51] Αυτό το εύρημα υπέδειξε, ανεξάρτητα σε δύο ομάδες ερευνητών, ότι ένα από τα χρωμοσώματα Χ υπέστη αδρανοποίηση. Το 1961, η Mary Lyon πρότεινε την τυχαία αδρανοποίηση ενός θηλυκού χρωμοσώματος Χ για να εξηγήσει τον διάστικτο φαινότυπο των θηλυκών ποντικών που ήταν ετερόζυγα για τα γονίδια του χρώματος του τριχώματος.[52] Η υπόθεση της Λυόν έλαβε επίσης υπόψη τα ευρήματα ότι ένα αντίγραφο του χρωμοσώματος Χ στα θηλυκά κύτταρα ήταν πολύ συμπυκνωμένο και ότι τα ποντίκια με ένα μόνο αντίγραφο του χρωμοσώματος Χ αναπτύχθηκαν ως στείρα θηλυκά. Για αυτό πρότεινε[53], στον Ernest Beutler, μελετώντας ετερόζυγα θηλυκά για ανεπάρκεια στην αφυδρογονάση της 6-φωσφορικής γλυκόζης (G6PD), ότι υπήρχαν δύο πληθυσμοί ερυθροκυττάρων σε τέτοιους ετεροζυγώτες: ελαττωματικά κύτταρα και φυσιολογικά κύτταρα,[54] ανάλογα με το αν το αδρανοποιημένο χρωμόσωμα Χ (στον πυρήνα του πρόδρομου κυττάρου των ερυθρών αιμοσφαιρίων) περιέχει το φυσιολογικό ή το ελαττωματικό αλληλόμορφο G6PD.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «Normal histone modifications on the inactive X chromosome in ICF and Rett syndrome cells: implications for methyl-CpG binding proteins». BMC Biology 2: 21. September 2004. doi:. PMID 15377381.
- ↑ 2,0 2,1 «Female-biased expression of long non-coding RNAs in domains that escape X-inactivation in mouse». BMC Genomics 11: 614. November 2010. doi:. PMID 21047393.
- ↑ «Preferential inactivation of the paternally derived X chromosome in the extra embryonic membranes of the mouse». Nature 256 (5519): 640–2. August 1975. doi:. PMID 1152998. Bibcode: 1975Natur.256..640T.
- ↑ «Silence of the fathers: early X inactivation». BioEssays 26 (8): 821–4. August 2004. doi:. PMID 15273983. http://www3.interscience.wiley.com/cgi-bin/fulltext/109565168/PDFSTART.[νεκρός σύνδεσμος]
- ↑ 5,0 5,1 «Epigenetic dynamics of imprinted X inactivation during early mouse development». Science 303 (5658): 644–9. January 2004. doi:. PMID 14671313. Bibcode: 2004Sci...303..644O.
- ↑ 6,0 6,1 «Single-cell RNA-seq reveals dynamic, random monoallelic gene expression in mammalian cells». Science 343 (6167): 193–6. January 2014. doi:. PMID 24408435. Bibcode: 2014Sci...343..193D.
- ↑ 7,0 7,1 «Genetic programs in human and mouse early embryos revealed by single-cell RNA sequencing» (στα αγγλικά). Nature 500 (7464): 593–7. August 2013. doi:. PMID 23892778. Bibcode: 2013Natur.500..593X.
- ↑ «Xist-dependent imprinted X inactivation and the early developmental consequences of its failure» (στα αγγλικά). Nature Structural & Molecular Biology 24 (3): 226–233. March 2017. doi:. PMID 28134930.
- ↑ 9,0 9,1 «X chromosome regulation: diverse patterns in development, tissues and disease» (στα αγγλικά). Nature Reviews. Genetics 15 (6): 367–78. June 2014. doi:. PMID 24733023.
- ↑ «Parental haplotype-specific single-cell transcriptomics reveal incomplete epigenetic reprogramming in human female germ cells» (στα αγγλικά). Nature Communications 9 (1): 1873. May 2018. doi:. PMID 29760424. Bibcode: 2018NatCo...9.1873V.
- ↑ «The Transcriptome and DNA Methylome Landscapes of Human Primordial Germ Cells». Cell 161 (6): 1437–52. June 2015. doi:. PMID 26046443.
- ↑ «X inactivation in females with X-linked disease». The New England Journal of Medicine 338 (5): 325–8. January 1998. doi:. PMID 9445416.
- ↑ «Derivation of consensus inactivation status for X-linked genes from genome-wide studies». Biology of Sex Differences 6 (35): 35. 30 December 2015. doi:. PMID 26719789.
- ↑ «Mammals that break the rules: genetics of marsupials and monotremes». Annual Review of Genetics 30: 233–60. 1996. doi:. PMID 8982455.
- ↑ «X-chromosome inactivation and developmental patterns in mammals». Biological Reviews of the Cambridge Philosophical Society 47 (1): 1–35. January 1972. doi:. PMID 4554151.
- ↑ «X chromosome inactivation in human cells». The Biomedical & Life Sciences Collection (Henry Stewart Talks, Ltd): 1–54. 2010. http://hstalks.com/main/view_talk.php?t=1676&r=494&c=252. Ανακτήθηκε στις 15 December 2013.
- ↑ 17,0 17,1 Gartler, Stanley M; Goldman, Michael A (2001). «X-Chromosome Inactivation». Encyclopedia of Life Sciences (Nature Publishing Group): 1–2. http://web.udl.es/usuaris/e4650869/docencia/segoncicle/genclin98/recursos_classe_(pdf)/revisionsPDF/XChromoInac.pdf.
- ↑ «Sex-differential selection and the evolution of X inactivation strategies». PLOS Genetics 9 (4): e1003440. April 2013. doi:. PMID 23637618.
- ↑ Avner, Philip; Heard, Edith (January 2001). «X-chromosome inactivation: counting, choice and initiation» (στα αγγλικά). Nature Reviews Genetics 2 (1): 59–67. doi:. ISSN 1471-0064. PMID 11253071. https://www.nature.com/articles/35047580.
- ↑ Barakat, Tahsin Stefan· Gribnau, Joost (2010). «X Chromosome Inactivation and Embryonic Stem Cells». Στο: Meshorer, Eran· Plath, Kathrin, επιμ. The Cell Biology of Stem Cells. Landes Bioscience and Springer Science+Business Media. Unknown parameter
|name-list-style=ignored (βοήθεια) - ↑ «X-inactivation informs variance-based testing for X-linked association of a quantitative trait». BMC Genomics 16 (1): 241. March 2015. doi:. PMID 25880738.
- ↑ «Progression rate of myelopathy in X-linked adrenoleukodystrophy heterozygotes». Metabolic Brain Disease 30 (5): 1279–84. October 2015. doi:. PMID 25920484.
- ↑ 23,0 23,1 23,2 «Genetic control of X inactivation and processes leading to X-inactivation skewing». American Journal of Human Genetics 58 (6): 1101–8. June 1996. PMID 8651285.
- ↑ 24,0 24,1 «Hemophagocytic lymphohistiocytosis in a female patient due to a heterozygous XIAP mutation and skewed X chromosome inactivation». Pediatric Blood & Cancer 62 (7): 1288–90. July 2015. doi:. PMID 25801017.
- ↑ «Menkes disease with discordant phenotype in female monozygotic twins». American Journal of Medical Genetics. Part A 167A (11): 2826–9. November 2015. doi:. PMID 26239182.
- ↑ «Genetic characterization in symptomatic female DMD carriers: lack of relationship between X-inactivation, transcriptional DMD allele balancing and phenotype». BMC Medical Genetics 13: 73. August 2012. doi:. PMID 22894145.
- ↑ 27,0 27,1 «Long-range cis effects of ectopic X-inactivation centres on a mouse autosome». Nature 386 (6622): 275–9. March 1997. doi:. PMID 9069285. Bibcode: 1997Natur.386..275L.
- ↑ 28,0 28,1 «Tsix, a gene antisense to Xist at the X-inactivation centre». Nature Genetics 21 (4): 400–4. April 1999. doi:. PMID 10192391.
- ↑ 29,0 29,1 Mercer, T.R., Dinger, M.E., Mattick, J.S., (2009). Long non-coding RNAs: insight into functions. Nature Reviews Genetics. (10) 155–159.
- ↑ «A proximal conserved repeat in the Xist gene is essential as a genomic element for X-inactivation in mouse». Development 136 (1): 139–46. January 2009. doi:. PMID 19036803.
- ↑ «Xist and the order of silencing» (Review Article). EMBO Reports 8 (1): 34–9. January 2007. doi:. PMID 17203100. «Figure 1 Xist RNA encompasses the X from which it is transcribed.».
- ↑ «Requirement for Xist in X chromosome inactivation». Nature 379 (6561): 131–7. 1996. doi:. PMID 8538762. Bibcode: 1996Natur.379..131P.
- ↑ 33,0 33,1 «Xist has properties of the X-chromosome inactivation centre». Nature 386 (6622): 272–5. March 1997. doi:. PMID 9069284. Bibcode: 1997Natur.386..272H.
- ↑ «Xist and the order of silencing» (Review Article). EMBO Reports 8 (1): 34–9. January 2007. doi:. PMID 17203100. «Table 1 Features of the inactive X territory». – Originated from;
«Silencing of the mammalian X chromosome». Annual Review of Genomics and Human Genetics 6: 69–92. 2005. doi:. PMID 16124854.
«Chromatin remodeling in dosage compensation». Annual Review of Genetics 39: 615–51. 2005. doi:. PMID 16285873. - ↑ «Polycomb Repressor Complex 2 in Genomic Instability and Cancer». Int J Mol Sci 18 (8): 1657. July 2017. doi:. PMID 28758948.
- ↑ «Histone macroH2A1 is concentrated in the inactive X chromosome of female mammals». Nature 393 (6685): 599–601. June 1998. doi:. PMID 9634239. Bibcode: 1998Natur.393..599C.
- ↑ «Histone macroH2A1 is concentrated in the inactive X chromosome of female preimplantation mouse embryos». Development 127 (11): 2283–9. June 2000. doi:. PMID 10804171. http://dev.biologists.org/cgi/reprint/127/11/2283.pdf.
- ↑ «A morphological distinction between neurones of the male and female, and the behaviour of the nucleolar satellite during accelerated nucleoprotein synthesis». Nature 163 (4148): 676–677. April 1949. doi:. PMID 18120749. Bibcode: 1949Natur.163..676B.
- ↑ «Xist RNA and the mechanism of X chromosome inactivation». Annual Review of Genetics 36: 233–78. 2002. doi:. PMID 12429693.
- ↑ 40,0 40,1 «X-inactivation profile reveals extensive variability in X-linked gene expression in females». Nature 434 (7031): 400–4. March 2005. doi:. PMID 15772666. Bibcode: 2005Natur.434..400C.
- ↑ 41,0 41,1 41,2 «Site-specific silencing of regulatory elements as a mechanism of X inactivation». Cell 151 (5): 951–63. November 2012. doi:. PMID 23178118.
- ↑ 42,0 42,1 «Global survey of escape from X inactivation by RNA-sequencing in mouse». Genome Research 20 (5): 614–22. May 2010. doi:. PMID 20363980.
- ↑ «Turner syndrome: MedlinePlus Genetics». medlineplus.gov (στα Αγγλικά). Ανακτήθηκε στις 10 Φεβρουαρίου 2023.
- ↑ «Escape from X inactivation in mice and humans». Genome Biology 11 (6): 213. June 2010. doi:. PMID 20573260.
- ↑ «Glucose-6-phosphate dehydrogenase mosaicism: utilization as a cell marker in the study of leiomyomas». Science 150 (3692): 67–9. October 1965. doi:. PMID 5833538. Bibcode: 1965Sci...150...67L.
- ↑ «Many different tumor types have polyclonal tumor origin: evidence and implications». Mutation Research 659 (3): 232–47. 2008. doi:. PMID 18614394. https://zenodo.org/record/1259237.
- ↑ «X-linked clonality testing: interpretation and limitations». Blood 110 (5): 1411–9. September 2007. doi:. PMID 17435115.
- ↑ «The leiomyomatous stroma in renal cell carcinomas is polyclonal and not part of the neoplastic process». Virchows Archiv 465 (1): 89–96. July 2014. doi:. PMID 24838683.
- ↑ «Evaluation of clonal origin of malignant mesothelioma». Journal of Translational Medicine 12: 301. December 2014. doi:. PMID 25471750.
- ↑ «Translating dosage compensation to trisomy 21». Nature 500 (7462): 296–300. August 2013. doi:. PMID 23863942. Bibcode: 2013Natur.500..296J.
- ↑ «Formation of the sex chromatin by a single X-chromosome in liver cells of Rattus norvegicus». Experimental Cell Research 18 (2): 415–8. October 1959. doi:. PMID 14428474.
- ↑ «Gene action in the X-chromosome of the mouse (Mus musculus L.)». Nature 190 (4773): 372–3. April 1961. doi:. PMID 13764598. Bibcode: 1961Natur.190..372L.
- ↑ «Glucose-6-phosphate dehydrogenase deficiency: a historical perspective». Blood 111 (1): 16–24. January 2008. doi:. PMID 18156501.
- ↑ «The normal human female as a mosaic of X-chromosome activity: studies using the gene for C-6-PD-deficiency as a marker». Proceedings of the National Academy of Sciences of the United States of America 48 (1): 9–16. January 1962. doi:. PMID 13868717. Bibcode: 1962PNAS...48....9B.
Παραπέρα μελέτη
[Επεξεργασία | επεξεργασία κώδικα]- «X-chromosome inactivation: a hypothesis linking ontogeny and phylogeny». Nature Reviews. Genetics 6 (5): 410–8. May 2005. doi:. PMID 15818384.
- «Regulation of X-chromosome inactivation in development in mice and humans» (Review Article). Microbiology and Molecular Biology Reviews 62 (2): 362–78. June 1998. doi:. PMID 9618446.
- «The Lyon and the LINE hypothesis». Seminars in Cell & Developmental Biology 14 (6): 313–8. December 2003. doi:. PMID 15015738.
- «Xist and the order of silencing» (Review Article). EMBO Reports 8 (1): 34–9. January 2007. doi:. PMID 17203100.
- «Xist localization and function: new insights from multiple levels». Genome Biology 16 (1): 166. August 2015. doi:. PMID 26282267.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα] Πολυμέσα σχετικά με το θέμα X chromosome inactivation στο Wikimedia Commons
Πολυμέσα σχετικά με το θέμα X chromosome inactivation στο Wikimedia Commons- Kruszelnicki, Karl (11 Φεβρουαρίου 2004). «Hybrid Auto-Immune Women 3». ABC Science. Unknown parameter
|name-list-style=ignored (βοήθεια)
