Χολαγγειοκαρκίνωμα
| Χολαγγειοκαρκίνωμα | |
|---|---|
 Μικρογραφία ενός χολαγγειοκαρκινώματος (δεξιά στην εικόνα) πλησίον φυσιολογικών ηπατοκυττάρων (αριστερά στην εικόνα). χρώση αιματοξυλίνης-ηωσίνης. | |
| Ειδικότητα | ογκολογία |
| Ταξινόμηση | |
| ICD-10 | C22.1 |
| ICD-9 | 155.1, 156.1 |
| ICD-O | M8160/3 |
| DiseasesDB | 2505 |
| MedlinePlus | 000291 |
| eMedicine | med/343 radio/153 |
| MeSH | D018281 |

Το χολαγγειοκαρκίνωμα είναι μια μορφή καρκίνου η οποία προκύπτει από μεταλλαγμένα επιθηλιακά κύτταρα (ή κύτταρα τα οποία παρουσιάζουν τα χαρακτηριστικά της επιθηλιακής διαφοροποίησης) των χοληφόρων αγγείων τα οποία παροχετεύουν χολή από το ήπαρ μέσα στο λεπτό έντερο. Άλλοι καρκίνοι των χοληφόρων οδών περιλαμβάνουν τον καρκίνο του παγκρέατος,τον καρκίνο της χοληδόχου κύστης, και τον καρκίνο στη λήκυθο του Vater.
Το χολαγγειοκαρκίνωμα είναι ένα σχετικά σπάνιο νεόπλασμα που έχει ταξινομηθεί ως αδενοκαρκίνωμα (ένας καρκίνος που σχηματίζει αδένες ή εκκρίνει σημαντικές ποσότητες βλεννινών). Έχει ετήσια συχνότητα εμφάνισης 1-2 περιπτώσεις ανά 100.000 στο δυτικό κόσμο[1], αλλά τα ποσοστά του χολαγγειοκαρκινώματος έχουν αυξηθεί σε όλο τον κόσμο κατά τη διάρκεια των προηγούμενων αρκετών δεκαετιών[2] .
Εμφανή συμπτώματα του χολαγγειοκαρκινώματος περιλαμβάνουν τη διαπίστωση μη φυσιολογικής ηπατικής λειτουργίας κατά τη διενέργεια δοκιμασιών, κοιλιακό άλγος, ίκτερο και απώλεια βάρους. Γενικευμένος κνησμός, πυρετός, και αλλαγές στο χρώμα των κοπράνων ή ούρων μπορεί επίσης να προκύψουν. Η ασθένεια διαγιγνώσκεται μέσω ενός συνδυασμού των εξετάσεων αίματος, απεικόνισης, ενδοσκόπησης και ενίοτε χειρουργικής διερεύνησης και η επιβεβαίωση επέρχεται όταν ένας παθολογοανατόμος έχει εξετάσει δείγμα κυττάρων του όγκου σε μικροσκόπιο. Στους γνωστούς παράγοντες κινδύνου για χολαγγειοκαρκίνωμα περιλαμβάνονται: η πρωτοπαθής σκληρυντική χολαγγειίτιδα (μια φλεγμονώδης νόσος των χοληφόρων πόρων), οι συγγενείς δυσπλασίες του ήπατος, η μόλυνση του ήπατος με τρηματώδες παράσιτο (Opisthorchis viverrini ή Clonorchis sinensis) και η έκθεση σε διοξείδιο του θορίου, μια χημική ουσία που χρησιμοποιούνταν στο παρελθόν στην πρακτική της ιατρικής απεικόνισης. Πάντως, για τους περισσότερους ασθενείς με χολαγγειοκαρκίνωμα δεν έχουν αναγνωριστεί ειδικοί παράγοντες κινδύνου.
Το χολαγγειοκαρκίνωμα θεωρείται ότι είναι μια ανίατη και ταχέως θανατηφόρα κακοήθεια εκτός εάν τόσο ο πρωτογενής όγκος όσο και τυχόν μεταστάσεις μπορούν να υποστούν πλήρη εκτομή (να αφαιρεθούν χειρουργικά). Δεν υπάρχει ακόμη δυνητικά επιτυχής θεραπευτική αγωγή εκτός από τη χειρουργική επέμβαση. Ωστόσο, οι περισσότεροι ασθενείς βρίσκονται ήδη σε προχωρημένο στάδιο της νόσου κατά την διάγνωση και συνεπώς δεν ενδείκνυται η χειρουργική επέμβαση. Οι ασθενείς με χολαγγειοκαρκίνωμα γενικά αντιμετωπίζονται - αν και ποτέ δεν θεραπεύονται - με χημειοθεραπεία, ακτινοθεραπεία, καθώς και άλλα μέτρα παρηγορητικής φροντίδας. Αυτές χρησιμοποιούνται επίσης σαν ανοσοενισχυτικές θεραπείες (δηλαδή μετεγχειρητικά) σε περιπτώσεις όπου η εκτομή προφανώς ήταν επιτυχής. Ορισμένοι τομείς της συνεχιζόμενης ιατρικής έρευνας πάνω στο χολαγγειοκαρκίνωμα περιλαμβάνουν τη χρήση νεότερων στοχευμένων θεραπειών,όπως φωτοδυναμική θεραπεία για την ίαση, και τις τεχνικές για τη μέτρηση της συγκέντρωσης των παραπροϊόντων του στρώματος των καρκινικών κυττάρων στο αίμα για διαγνωστικούς σκοπούς.
Σταδιοποίηση
[Επεξεργασία | επεξεργασία κώδικα]Αν και υπάρχουν τουλάχιστον τρία συστήματα σταδιοποίησης για το χολαγγειοκαρκίνωμα (π.χ. εκείνα του Bismuth, Blumgart, και της American Joint Committee για τον καρκίνο), κανένα δεν έχει αποδειχθεί χρήσιμο στην πρόβλεψη της επιβίωσης[3] . Το πλέον σημαντικό θέμα που προκύπτει κατά τη σταδιοποίηση είναι αν ο όγκος μπορεί να αφαιρεθεί χειρουργικά, ή αν είναι πολύ προχωρημένος για να είναι επιτυχής η χειρουργική θεραπεία. Συχνά, αυτή η απόφανση μπορεί να γίνει μόνο κατά τη στιγμή της χειρουργικής επέμβασης[4].
Γενικές κατευθυντήριες γραμμές για το αν μπορεί ο όγκος να χειρουργηθεί περιλαμβάνουν:[5][6]
- Απουσία λεμφαδένων ή ηπατικών μεταστάσεων
- Απουσία εμπλοκής της πυλαίας φλέβας
- Απουσία επέκτασης του όγκου σε παρακείμενα όργανα
- Απουσία εκτεταμένης μεταστατικής νόσου
Ενδείξεις και συμπτώματα
[Επεξεργασία | επεξεργασία κώδικα]
Οι πιο συχνές σωματικές ενδείξεις για το χολαγγειοκαρκίνωμα είναι η διαπίστωση μη φυσιολογικής λειτουργίας του ήπατος κατά τη διενέργεια δοκιμασιών, ο ίκτερος (κιτρίνισμα των οφθαλμών και του δέρματος που συμβαίνει όταν οι χοληφόροι πόροι έχουν αποφραχθεί από τον όγκο), το κοιλιακό άλγος (30% -50%), ο γενικευμένος κνησμός (66%),η απώλεια βάρους (30% -50%), ο πυρετός (έως 20%), και οι αλλαγές στα κόπρανα ή στο χρώμα των ούρων.[7][8] Ως ένα βαθμό, τα συμπτώματα εξαρτώνται από την θέση εντόπισης του όγκου: ασθενείς με χολαγγειοκαρκίνωμα σε εξωηπατικές χοληφόρους οδούς είναι περισσότερο πιθανό να εμφανίσουν ίκτερο, ενώ εκείνοι με όγκους των χοληφόρων οδών εντός του ήπατος αισθάνονται πιο συχνά πόνο χωρίς να έχουν ίκτερο[9].
Οι εξετάσεις αίματος για τον έλεγχο της λειτουργίας του ήπατος σε ασθενείς με χολαγγειοκαρκίνωμα αποκαλύπτουν αυξημένα επίπεδα της χολερυθρίνης, της αλκαλικής φωσφατάσης, και της γάμα γλουταμυλικής τρανσφεράσης και σχετικώς φυσιολογικά επίπεδα τρανσαμινασών. Τέτοια εργαστηριακά ευρήματα υποδεικνύουν ως την κύρια αιτία του ικτέρου την απόφραξη των χοληφόρων οδών έναντι της φλεγμονής ή της λοίμωξης του ηπατικού παρεγχύματος[4]. Η συγκέντρωση του καρκινικού αντιγόνου CA19-9 είναι αυξημένη στις περισσότερες περιπτώσεις χολαγγειοκαρκινώματος.
Παράγοντες κινδύνου
[Επεξεργασία | επεξεργασία κώδικα]
Αν και οι περισσότεροι ασθενείς παρουσιάζονται χωρίς εμφανείς παράγοντες κινδύνου, έχουν περιγραφεί αρκετοί από αυτούς για την ανάπτυξη του χολαγγειοκαρκινώματος. Στο δυτικό κόσμο, ο πιο κοινός από αυτούς είναι η πρωτοπαθής σκληρυντική χολαγγειίτιδα (PSC), μια φλεγμονώδης νόσος των χοληφόρων οδών που η ίδια συνδέεται στενά με ελκώδη κολίτιδα (UC)[10]. Επιδημιολογικές μελέτες έχουν δείξει ότι ο κίνδυνος κατά τη διάρκεια ζωής της ανάπτυξης χολαγγειοκαρκινώματος για ένα άτομο με PSC είναι της τάξης του 10% -15%, [11] αν και αρκετές αυτοψίες υποδεικνύουν υψηλότερα ποσοστά, όπως 30% στο συγκεκριμένο πληθυσμό[12]. Ο μηχανισμός με τον οποίο η PSC αυξάνει τον κίνδυνο χολαγγειοκαρκινώματος δεν είναι πλήρως κατανοητός.
Επίσης, ορισμένες παρασιτικές ασθένειες του ήπατος μπορεί να αποτελούν παράγοντες κινδύνου.Συγκεκριμένα, η προσβολή του ήπατος από το τρηματώδες παράσιτο Opisthorchis viverrini (που εντοπίζεται στην Ταϊλάνδη, το Λάος, τη Μαλαισία) ή Clonorchis sinensis (που εντοπίζεται στην Ιαπωνία, την Κορέα και το Βιετνάμ) έχει συνδεθεί με την ανάπτυξη του χολαγγειοκαρκινώματος[13][14][15]. Οι ασθενείς με χρόνια ηπατική νόσο με τη μορφή της ιογενούς ηπατίτιδας (π.χ. ηπατίτιδα Β ή ηπατίτιδα C)[16][17][18] , της αλκοολικής ηπατικής νόσου ή της κίρρωσης του ήπατος που οφείλεται σε άλλες αιτίες, παρουσιάζουν σημαντικά αυξημένο κίνδυνο χολαγγειοκαρκινώματος[19][20]. Η λοίμωξη από τον ιό HIV αναγνωρίστηκε σε μία μελέτη ως δυνητικός παράγοντας κινδύνου για χολαγγειοκαρκίνωμα, αν και δεν ήταν σαφές αν ο ίδιος ο ιός HIV ή άλλοι συνεισφέροντες παράγοντες (π.χ. ηπατίτιδα C) ήταν υπεύθυνοι για τη συσχέτιση του ιού με το χολαγγειοκαρκίνωμα[19].
Οι συγγενείς ανωμαλίες του ήπατος, όπως το σύνδρομο Caroli ή η κυστική διαστολή των χοληφόρων πόρων, έχουν συσχετισθεί με περίπου 15% κίνδυνο κατά τη διάρκεια ζωής για την ανάπτυξη χολαγγειοκαρκινώματος[21][22] . Οι σπάνιες κληρονομικές διαταραχές: σύνδρομο Lynch II και χολική θηλωμάτωση επίσης σχετίζονται με την εμφάνιση χολαγγειοκαρκινώματος[23][24]. Η χολολιθίαση δεν συνδέεται εμφανώς με την ανάπτυξη του χολαγγειοκαρκινώματος. Ωστόσο, η ηπατολιθίαση η οποία απαντάται σπάνια στη Δύση αλλά συχνά σε περιοχές της Ασίας, έχει συσχετισθεί με το χολαγγειοκαρκίνωμα[25][26][27]. Παρομοίως η έκθεση σε thorotrast, μια μορφή διοξειδίου του θορίου το οποίο χρησιμοποιήθηκε σαν ένα μέσο αντίθεσης στην ακτινογραφία, μπορεί να ευθύνεται για την ανάπτυξη της χολαγγειοκαρκινώματος σε διάστημα έως 30-40 χρόνια μετά την έκθεση.Το thorotrast είχε απαγορευθεί στις Ηνωμένες Πολιτείες το 1950, λόγω της καρκινογόνου δράσης του[28][29].
Παθοφυσιολογία
[Επεξεργασία | επεξεργασία κώδικα]Το χολαγγειοκαρκίνωμα μπορεί να επηρεάσει οποιοδήποτε τμήμα των χοληφόρων οδών, είτε εντός είτε εκτός του ήπατος. Οι όγκοι που αναπτύσοονται στα αγγεία της χολής εντός του ήπατος αναφέρονται ως ενδοηπατικοί ενώ αυτοί που παρουσιάζονται στα αγγεία έξω από το ήπαρ είναι εξωηπατικοί. Το χολαγγειοκαρκίνωμα που εντοπίζεται στη διασταύρωση όπου τα αριστερά και δεξιά ηπατικά αγγεία συναντώνται για να σχηματίσουν τον κοινό χοληδόχο πόρο μπορεί να αναφέρεται επωνύμως ως όγκος του Klatskin[30].
Μολονότι είναι γνωστό ότι το χολαγγειοκαρκίνωμα έχει τα ιστολογικά και μοριακά χαρακτηριστικά ενός αδενοκαρκινώματος που προέρχεται από επιθηλιακά κύτταρα που επικαλύπτουν την χολική οδό, η πραγματική κυτταρική του προέλευση είναι άγνωστη. Πρόσφατα στοιχεία έχουν δείξει ότι το αρχικό μετασχηματισμένο κύτταρο που παράγει τον πρωτογενή όγκο μπορεί να προκύψει από ένα πολυδύναμο ηπατικό βλαστοκύτταρο[31][32][33]. Το χολαγγειοκαρκίνωμα πιστεύεται ότι αναπτύσσεται μέσα από μια σειρά σταδίων - από την πρώιμη υπερπλασία και μεταπλασία, μέσω δυσπλασίας, στην ανάπτυξη του καρκινώματος - με μια διαδικασία παρόμοια με εκείνη που παρατηρείται στην ανάπτυξη του καρκίνου του παχέος εντέρου[34]. Η χρόνια φλεγμονή και η απόφραξη των χοληφόρων οδών, μαζί με την προκύπτουσα εξασθενημένη ροή χολής, πιστεύεται ότι παίζουν κάποιο ρόλο σε αυτή την εξέλιξη.[34][35][36]
Ιστολογικά, τα χολαγγειοκαρκινώματα μπορεί να διαφέρουν από αδιαφοροποίητα έως καλά διαφοροποιημένα. Συχνά περιβάλλονται από μία ινωτική ή δεσμοπλαστική απόκριση ιστού. Παρουσία εκτεταμένης ίνωσης, μπορεί να είναι δύσκολο να γίνει διάκριση καλώς διαφοροποιημένων χολαγγειοκαρκινωμάτων από φυσιολογικό αντιδραστικό επιθήλιο. Δεν υπάρχει απολύτως ειδική ανοσοϊστοχημική μέθοδος που μπορεί να διακρίνει τους καλοήθεις από τους κακοήθεις χολικούς πορογενείς ιστούς, αν και η χρώση για κυτταροκερατίνες, καρκινοεμβρυϊκό αντιγόνο, και βλεννίνες ενδέχεται να βοηθήσει στην διάγνωση[37]. Οι περισσότεροι όγκοι (> 90%) είναι αδενοκαρκινώματα.[38]
Διάγνωση
[Επεξεργασία | επεξεργασία κώδικα]
Το χολαγγειοκαρκίνωμα διαγιγνώσκεται οριστικά από τον ιστό, π.χ. αποδεικνύεται με βιοψία ή εξέταση του ιστού που αποκόπτεται σε χειρουργική επέμβαση. Μπορεί να υπάρχουν υποψίες σε έναν ασθενή με αποφρακτικό ίκτερο. Η διάγνωση μπορεί να είναι δύσκολη σε ασθενείς με πρωτογενή σκληρυντική χολαγγειίτιδα (PSC). Τέτοιοι ασθενείς διατρέχουν υψηλό κίνδυνο να αναπτύξουν χολαγγειοκαρκίνωμα, αλλά τα συμπτώματα μπορεί να είναι δύσκολο να διακριθούν από εκείνα των ασθενών με PSC . Επιπλέον, σε ασθενείς με PSC , διαγνωστικές ενδείξεις όπως ορατή μάζα σε απεικόνιση ή χοληφόρος πορογενής διάταση μπορεί να μην είναι προφανής.
Εξετάσεις αίματος
[Επεξεργασία | επεξεργασία κώδικα]Δεν υπάρχουν ειδικές εξετάσεις αίματος που μπορούν να διαγνώσουν χολαγγειοκαρκίνωμα από μόνες τους. Τα επίπεδα του καρκινοεμβρυϊκού αντιγόνου (CEA) και του CA19-9 στον ορό του αίματος είναι συχνά αυξημένα, αλλά δεν είναι ευαίσθητα ή αρκετά ειδικά για να χρησιμοποιηθούν ως ένα γενικό εργαλείο διαλογής. Ωστόσο, μπορούν να είναι χρήσιμα σε συνδυασμό με μεθόδους απεικονίσεως στην υποστήριξη μιας ύποπτης διάγνωσης χολαγγειοκαρκινώματος[39].
Κοιλιακή απεικόνιση
[Επεξεργασία | επεξεργασία κώδικα]
Υπέρηχος του χοληφόρου δέντρου και των χοληφόρων αγγείων χρησιμοποιείται συχνά ως αρχική απεικονιστική μέθοδος σε ασθενείς με υποψία αποφρακτικού ίκτερου[40][41]. Ο υπέρηχος μπορεί να προσδιορίσει την απόφραξη και τη διάταση του πόρου και, σε ορισμένες περιπτώσεις, μπορεί να είναι αρκετός για να διαγνώσει χολαγγειοκαρκίνωμα[42]. Η αξονική τομογραφία (CT) μπορεί επίσης να διαδραματίσει σημαντικό ρόλο στη διάγνωση του χολαγγειοκαρκινώματος [43][44][45].
Απεικόνιση χοληφόρου δέντρου
[Επεξεργασία | επεξεργασία κώδικα]
Ενώ η κοιλιακή απεικόνιση μπορεί να είναι χρήσιμη στη διάγνωση του χολαγγειοκαρκινώματος, η άμεση απεικόνιση των χοληφόρων οδών είναι συχνά απαραίτητη. Η ενδοσκοπική παλίνδρομη χολαγγειοπαγκρεατογραφία (ERCP), μια ενδοσκοπική διαδικασία που εκτελείται από γαστρεντερολόγο ή ειδικά εκπαιδευμένο χειρουργό, έχει χρησιμοποιηθεί ευρέως για το σκοπό αυτό. Παρά το γεγονός ότι η ERCP είναι μια επεμβατική διαδικασία με συναφείς κινδύνους, τα πλεονεκτήματα της περιλαμβάνουν τη δυνατότητα να αποκτηθούν βιοψίες και να τοποθετηθούν stents ή να εκτελεστούν άλλες παρεμβάσεις για την ανακούφιση της απόφραξης των χοληφόρων[4] . Ενδοσκοπικό υπερηχογράφημα μπορεί επίσης να γίνει κατά τη στιγμή της ERCP και αυτό μπορεί να αυξήσει την ακρίβεια της βιοψίας και την απόδοση πληροφοριών σχετικά με την εισβολή των λεμφαδένων και τη δυνατότητα εγχείρησης. Ως εναλλακτική λύση στην ERCP, η διαδερμική διηπατική χολαγγειογραφία (PTC) μπορεί να χρησιμοποιηθεί[46]. Η μαγνητική χολαγγειοπαγκρεατογραφία συντονισμού (MRCP) είναι μία μη επεμβατική εναλλακτική λύση της ERCP[47][48][49] . Μερικοί συγγραφείς έχουν προτείνει ότι η MRCP πρέπει να υποκαταστήσει την ERCP στη διάγνωση των χολικών καρκίνων, καθώς μπορεί να καθορίσει με περισσότερη ακρίβεια τον όγκο και να αποτρέψει τους κινδύνους της ERCP[50][51][52].
Χειρουργική επέμβαση
[Επεξεργασία | επεξεργασία κώδικα]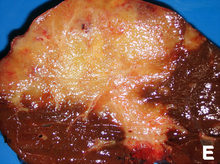
Η χειρουργική διερεύνηση μπορεί να είναι απαραίτητη για να ληφθεί μια κατάλληλη βιοψία και να προσδιοριστεί με ακρίβεια το στάδιο της νόσου που διέρχεται ένας ασθενής με χολαγγειοκαρκίνωμα. Μέσω της λαπαροσκόπησης μπορεί να αποφευχθεί η ανάγκη για μια πιο επεμβατική χειρουργική διαδικασία, όπως λαπαροτομή, σε ορισμένους ασθενείς[53][54]. Η χειρουργική επέμβαση είναι επίσης η μόνη θεραπευτική επιλογή για το χολαγγειοκαρκίνωμα, αν και είναι περιορισμένη σε ασθενείς με πρώιμο στάδιο της νόσου.
Παθολογία
[Επεξεργασία | επεξεργασία κώδικα]Ιστολογικά, τα χολαγγειοκαρκινώματα πικίλουν από καλά έως μέτρια διαφοροποιημένα αδενοκαρκινώματα. Η ανοσοϊστοχημεία είναι χρήσιμη στη διάγνωση και μπορεί να χρησιμοποιηθεί για να βοηθήσει στη διαφοροποίηση ενός χολαγγειοκαρκινώματος από ένα ηπατοκυτταρικό καρκίνωμα και μία μετάσταση των άλλων γαστρεντερικών όγκων[55] . Οι κυτταρολογικές αποξέσεις συχνά δεν μπορούν να οδηγήσουν στη διάγνωση[56], καθώς αυτοί οι όγκοι έχουν συνήθως ένα δεσμοπλαστικό στρώμα και, συνεπώς, δεν απελευθερώνουν διαγνωστικά καρκινικά κύτταρα με ξύσματα.
Θεραπεία
[Επεξεργασία | επεξεργασία κώδικα]Το χολαγγειοκαρκίνωμα θεωρείται ότι είναι μια ανίατη και ταχέως θανατηφόρα ασθένεια εκτός αν όλοι οι όγκοι μπορούν πλήρως να αφαιρεθούν με εκτομή (δηλαδή, να κοπούν χειρουργικά). Δεδομένου ότι η δυνατότητα για εγχείριση του όγκου μπορεί να αξιολογηθεί μόνο κατά τη διάρκεια της χειρουργικής επέμβασης, στις περισσότερες περιπτώσεις[57], η πλειοψηφία των ασθενών υποβάλλονται σε εξερευνητική χειρουργική επέμβαση εκτός εάν υπάρχει ήδη μια σαφής ένδειξη ότι ο όγκος είναι μη χειρουργήσιμος[4].
Η επικουρική θεραπεία μετά από μεταμόσχευση ήπατος μπορεί να διαδραματίσει κάποιο ρόλο στη θεραπεία ορισμένων ανεγχείρητων περιπτώσεων[58].
Επικουρική θεραπεία και θεραπεία με ακτινοβολία
[Επεξεργασία | επεξεργασία κώδικα]Εάν ο όγκος μπορεί να αφαιρεθεί χειρουργικά, οι ασθενείς μπορούν να λάβουν επικουρική χημειοθεραπεία ή ακτινοθεραπεία μετά την εγχείριση για να αυξηθούν οι πιθανότητες της θεραπείας. Εάν τα περιθώρια ιστού είναι αρνητικά (π.χ. ο όγκος έχει αποκοπεί εντελώς), η επικουρική θεραπεία έχει αβέβαιο όφελος. Τόσο θετικά[59][60] όσο και αρνητικά αποτελέσματα[9][61][62] έχουν αναφερθεί με συμπληρωματική θεραπεία ακτινοβολίας σε αυτή τη ρύθμιση, και καμία υποψήφια τυχαιοποιημένη ελεγχόμενη μελέτη δεν έχει διεξαχθεί από τον Μάρτιο του 2007. Η επικουρική χημειοθεραπεία φαίνεται να είναι αναποτελεσματική σε ασθενείς με όγκους που έχουν αφαιρεθεί τελείως με εκτομή[63] . Ο ρόλος της συνδυαστικής χημειοακτινοθεραπείας σε αυτή τη ρύθμιση είναι ασαφής. Ωστόσο, εάν τα καρκινικά περιθώρια ιστού είναι θετικά, υποδεικνύοντας ότι ο όγκος δεν απομακρύνθηκε πλήρως μέσω της χειρουργικής επέμβασης, τότε η επικουρική θεραπεία με ακτινοβολία και ενδεχομένως η χημειοθεραπεία συνιστάται γενικά με βάση τα διαθέσιμα δεδομένα[64].
Η θεραπεία της νόσου σε προχωρημένο στάδιο
[Επεξεργασία | επεξεργασία κώδικα]Η πλειοψηφία των περιπτώσεων χολαγγειοκαρκινώματος παρουσιάζεται ως ακατάλληλη για εγχείρηση (δεν αφαιρούνται με εκτομή) ασθένεια[65] στην οποία οι ασθενείς γενικά φροντίζονται με παρηγορητική χημειοθεραπεία με ή χωρίς ακτινοθεραπεία. Η χημειοθεραπεία έχει αποδειχθεί σε μια τυχαιοποιημένη ελεγχόμενη μελέτη πως βελτιώνει την ποιότητα της ζωής και παρατείνει την επιβίωση σε ασθενείς με ανεγχείρητο χολαγγειοκαρκίνωμα[66]. Δεν υπάρχει ενιαία μέθοδος χημειοθεραπείας που χρησιμοποιείται παγκοσμίως, και η εγγραφή σε κλινικές δοκιμές συχνά συνιστάται όταν είναι δυνατόν[64]. Οι παράγοντες χημειοθεραπείας που χρησιμοποιούνται για τη θεραπεία χολαγγειοκαρκινώματος περιλαμβάνουν 5-φθοριοουρακίλη με λευκοβορίνη[67], γεμσιταβίνη ως μονοθεραπεία[68], ή γεμσιταβίνη σε συνδυασμό με σισπλατίνη[69], ιρινοτεκάνη[70], ή καπεσιταβίνη[71]. Μια μικρή πιλοτική μελέτη προτείνει πιθανό όφελος από τον αναστολέα της κινάσης της τυροσίνης σε ασθενείς με προχωρημένο χολαγγειοκαρκίνωμα[72] .
Η φωτοδυναμική θεραπεία, μια πειραματική προσέγγιση, στην οποία στους ασθενείς γίνεται ένεση με έναν ελαφρύ-ευαισθητοποιητικό παράγοντα και φως κατόπιν εφαρμόζεται ενδοσκοπικά άμεσα στον όγκο, έχει δείξει ελπιδοφόρα αποτελέσματα σε σύγκριση με την υποστηρικτική φροντίδα σε δύο μικρές τυχαιοποιημένες ελεγχόμενες δοκιμές. Ωστόσο, ο τελικός της ρόλος στη διαχείριση του χολαγγειοκαρκινώματος προς το παρόν είναι ασαφής[73][74]. Η φωτοδυναμική θεραπεία έχει αποδειχθεί ότι βελτιώνει την επιβίωση και την ποιότητα της ζωής[75].
Πρόγνωση
[Επεξεργασία | επεξεργασία κώδικα]Η χειρουργική εκτομή προσφέρει τη μοναδική πιθανότητα ίασης σε χολαγγειοκαρκίνωμα. Για περιπτώσεις, στις οποίες δεν έγινε εκτομή, η 5-ετής επιβίωση είναι 0% όπου η νόσος είναι ακατάλληλη για εγχείρηση επειδή οι απώτατοι λεμφαδένες εμφανίζουν μεταστάσεις[76], και λιγότερο από 5% σε γενικές γραμμές[77]. Συνολικά η διάμεση διάρκεια επιβίωσης είναι μικρότερη των 6 μηνών[78] σε μη εγχειρήσιμους, χωρίς θεραπεία, άλλα υγιείς ασθενείς με όγκους που περιλαμβάνουν το ήπαρ μέσω των χοληφόρων οδών και της ηπατικής πυλαίας φλέβας.
Για χειρουργικές περιπτώσεις, οι αποδόσεις της θεραπείας ποικίλουν ανάλογα με την τοποθεσία του όγκου και το κατά πόσο ο όγκος μπορεί, εντελώς ή μόνο μερικώς, να απομακρυνθεί. Τα απώτατα χολαγγειοκαρκινώματα (αυτά που προκύπτουν από το χοληδόχο πόρο) γενικά αντιμετωπίζονται χειρουργικά με μια διαδικασία Whipple. Η μακροπρόθεσμη επιβίωση κυμαίνεται από 15% -25%, αν και μια σειρά ανέφερε πενταετή επιβίωση 54% για τους ασθενείς χωρίς συμμετοχή των λεμφαδένων[79]. Τα ενδοηπατικά χολαγγειοκαρκινώματα (αυτά που προκύπτουν από τους χοληφόρους αγωγούς εντός του ήπατος) αντιμετωπίζονται συνήθως με μερική ηπατεκτομή. Διάφορες σειρές έχουν αναφέρει εκτιμήσεις επιβίωσης μετά την επέμβαση που κυμαίνονται από 22% -66%. Το αποτέλεσμα μπορεί να εξαρτάται από τη συμμετοχή των λεμφαδένων και την πληρότητα της χειρουργικής επέμβασης[80]. Τα πέριξ των πυλών χολαγγειοκαρκινώματα (αυτά που συμβαίνουν κοντά στο σημείο όπου τα χοληφόρα βγαίνουν από το ήπαρ) είναι τουλάχιστον πιθανόν να είναι εγχειρήσιμα. Όταν η χειρουργική επέμβαση είναι δυνατή, γενικά αντιμετωπίζονται με μια επιθετική προσέγγιση που συχνά περιλαμβάνει την αφαίρεση της χοληδόχου κύστης και ενδεχομένως μέρος του ήπατος. Σε ασθενείς με λειτουργικούς πέριξ των πυλών όγκους, αναφέρθηκε 5-ετής επιβίωση με ποσοστά που κυμαίνονται από 20% -50%[81].
Η πρόγνωση μπορεί να είναι χειρότερη για τους ασθενείς με πρωτοπαθή σκληρυντική χολαγγειίτιδα που αναπτύσσουν χολαγγειοκαρκίνωμα, πιθανότατα επειδή ο καρκίνος δεν έχει εντοπιστεί μέχρι που αναπτύχθηκε[12][82]. Ορισμένα στοιχεία δείχνουν ότι τα αποτελέσματα μπορεί να βελτιωθούν με πιο επιθετικές χειρουργικές προσεγγίσεις και με συμπληρωματική θεραπεία[83].
Επιδημιολογία
[Επεξεργασία | επεξεργασία κώδικα]Το χολαγγειοκαρκίνωμα αποτελεί ένα αδενοκαρκίνωμα της χοληφόρου οδού[84] μαζί με τον καρκίνο του παγκρέατος (ο οποίος εμφανίζεται περίπου 20 φορές συχνότερα)[85], τον καρκίνο της χοληδόχου κύστης (ο οποίος εμφανίζεται δύο φορές πιο συχνά), και τον καρκίνο της ληκύθου του Vater. Οι θεραπείες και κλινικές δοκιμές για τον καρκίνο του παγκρέατος, όντας πολύ πιο διαδεδομένες, συχνά λαμβάνονται ως σημείο εκκίνησης για τη διαχείριση χολαγγειοκαρκινώματος, ακόμη και αν οι βιολογίες είναι αρκετά διαφορετικές κι έτσι οι χημειοθεραπείες μπορούν να θέσουν τον καρκίνο του παγκρέατος σε μόνιμη ύφεση, ενώ δεν υπάρχουν αναφορές στην βιβλιογραφία μακράς διαρκείας επιβίωσης χάρις σε χημειοθεραπεία ή ακτινοβολία που εφαρμόστηκε σε ένα ακατάλληλο για εγχείρηση χολαγγειοκαρκίνωμα.
| Χώρα | ΕΝ (άνδρες/γυναίκες) | ΕΞ (άνδρες/γυναίκες) |
|---|---|---|
| Η.Π.Α. | 0.60 / 0.43 | 0.70 / 0.87 |
| Ιαπωνία | 0.23 / 0.10 | 5.87 / 5.20 |
| Αυστραλία | 0.70 / 0.53 | 0.90 / 1.23 |
| Αγγλία/Ουαλία | 0.83 / 0.63 | 0.43 / 0.60 |
| Σκωτία | 1.17 / 1.00 | 0.60 / 0.73 |
| Γαλλία | 0.27 / 0.20 | 1.20 / 1.37 |
| Ιταλία | 0.13 / 0.13 | 2.10 / 2.60 |
Το χολαγγειοκαρκίνωμα είναι μια σχετικά σπάνια μορφή καρκίνου. Κάθε χρόνο, περίπου 2.000 έως 3.000 νέες περιπτώσεις διαγιγνώσκονται στις Ηνωμένες Πολιτείες, που μεταφράζεται σε ετήσια συχνότητα εμφάνισης 1-2 περιπτώσεις ανά 100.000 άτομα[1]. Σειρές αυτοψίας ανέφεραν επιπολασμό από 0,01 % εως 0,46%[87][88]. Υπάρχει μια υψηλότερη επικράτηση του χολαγγειοκαρκινώματος στην Ασία, η οποία έχει αποδοθεί σε ενδημικές χρόνιες παρασιτικές μολύνσεις. Η συχνότητα εμφάνισης αυξάνει με την ηλικία χολαγγειοκαρκινώματος, και η ασθένεια είναι ελαφρώς πιο συχνή σε άνδρες παρά σε γυναίκες (πιθανώς λόγω του υψηλότερου ποσοστού πρωτοπαθούς σκληρυντικής χολαγγειίτιδας, ένας σημαντικός παράγοντας κινδύνου, σε άνδρες)[38]. Η επικράτηση του χολαγγειοκαρκινώματος σε ασθενείς με πρωτοπαθή σκληρυντική χολαγγειίτιδα μπορεί να είναι τόσο υψηλή όπως 30%, με βάση μελέτες αυτοψίας[12].
Πολλαπλές μελέτες έχουν τεκμηριώσει μια σταθερή αύξηση στη συχνότητα εμφάνισης του ενδοηπατικού χολαγγειοκαρκινώματος κατά τη διάρκεια των προηγούμενων αρκετών δεκαετιών. Αυξήσεις έχουν παρατηρηθεί στη Βόρεια Αμερική, την Ευρώπη, την Ασία και την Αυστραλία[89] . Οι λόγοι για την αυξανόμενη εμφάνιση του χολαγγειοκαρκινώματος είναι ασαφείς. Βελτιωμένες διαγνωστικές μέθοδοι μπορεί να είναι εν μέρει υπεύθυνες, αλλά η επικράτηση των δυνητικών παραγόντων κινδύνου για χολαγγειοκαρκίνωμα, όπως μόλυνση από HIV, επίσης αυξάνεται κατά τη διάρκεια αυτού του χρονικού πλαισίου[19].
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 Landis S, Murray T, Bolden S, Wingo P (1998). «Cancer statistics, 1998». CA Cancer J Clin 48 (1): 6–29. doi:. PMID 9449931.
- ↑ Patel T (2002). «Worldwide trends in mortality from biliary tract malignancies». BMC Cancer 2: 10. doi:. PMID 11991810.
- ↑ Zervos E, Osborne D, Goldin S, Villadolid D, Thometz D, Durkin A, Carey L, Rosemurgy A (2005). «Stage does not predict survival after resection of hilar cholangiocarcinomas promoting an aggressive operative approach». Am J Surg 190 (5): 810–5. doi:. PMID 16226963. https://archive.org/details/sim_american-journal-of-surgery_2005-11_190_5/page/810.
- ↑ 4,0 4,1 4,2 4,3 Mark Feldman, Lawrence S. Friedman, Lawrence J. Brandt, επιμ. (21 Ιουλίου 2006). Sleisenger and Fordtran's Gastrointestinal and Liver Disease (8th έκδοση). Saunders. σελίδες 1493–6. ISBN 978-1-4160-0245-1.
- ↑ Tsao J, Nimura Y, Kamiya J, Hayakawa N, Kondo S, Nagino M, Miyachi M, Kanai M, Uesaka K, Oda K, Rossi R, Braasch J, Dugan J (2000). «Management of Hilar Cholangiocarcinoma: Comparison of an American and a Japanese Experience». Ann Surg 232 (2): 166–74. doi:. PMID 10903592. PMC 1421125. https://archive.org/details/sim_annals-of-surgery_2000-08_232_2/page/166.
- ↑ Rajagopalan V, Daines W, Grossbard M, Kozuch P (2004). «Gallbladder and biliary tract carcinoma: A comprehensive update, Part 1». Oncology (Williston Park) 18 (7): 889–96. PMID 15255172.
- ↑ Nagorney D, Donohue J, Farnell M, Schleck C, Ilstrup D (1993). «Outcomes after curative resections of cholangiocarcinoma». Arch Surg 128 (8): 871–7; discussion 877–9. PMID 8393652.
- ↑ «Bile duct cancer: cause and treatment». Αρχειοθετήθηκε από το πρωτότυπο στις 23 Απριλίου 2018. Ανακτήθηκε στις 23 Νοεμβρίου 2012.
- ↑ 9,0 9,1 Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). «Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors». Ann Surg 224 (4): 463–73; discussion 473–5. doi:. PMID 8857851. PMC 1235406. https://archive.org/details/sim_annals-of-surgery_1996-10_224_4/page/463.
- ↑ Chapman R (1999). «Risk factors for biliary tract carcinogenesis». Ann Oncol 10 (Suppl 4): 308–11. PMID 10436847.
- ↑ Epidemiologic studies which have addressed the incidence of cholangiocarcinoma in people with primary sclerosing cholangitis include the following:
- Bergquist A, Ekbom A, Olsson R, Kornfeldt D, Lööf L, Danielsson A, Hultcrantz R, Lindgren S, Prytz H, Sandberg-Gertzén H, Almer S, Granath F, Broomé U (2002). «Hepatic and extrahepatic malignancies in primary sclerosing cholangitis». J Hepatol 36 (3): 321–7. doi:. PMID 11867174.
- Bergquist A, Glaumann H, Persson B, Broomé U (1998). «Risk factors and clinical presentation of hepatobiliary carcinoma in patients with primary sclerosing cholangitis: a case-control study». Hepatology 27 (2): 311–6. doi:. PMID 9462625.
- Burak K, Angulo P, Pasha T, Egan K, Petz J, Lindor K (2004). «Incidence and risk factors for cholangiocarcinoma in primary sclerosing cholangitis». Am J Gastroenterol 99 (3): 523–6. doi:. PMID 15056096. https://archive.org/details/sim_american-journal-of-gastroenterology_2004-03_99_3/page/523.
- ↑ 12,0 12,1 12,2 Rosen C, Nagorney D, Wiesner R, Coffey R, LaRusso N (1991). «Cholangiocarcinoma complicating primary sclerosing cholangitis». Ann Surg 213 (1): 21–5. doi:. PMID 1845927. PMC 1358305. https://archive.org/details/sim_annals-of-surgery_1991-01_213_1/page/n30.
- ↑ Watanapa P (1996). «Cholangiocarcinoma in patients with opisthorchiasis». Br J Surg 83 (8): 1062–64. doi:. PMID 8869303. https://archive.org/details/sim_british-journal-of-surgery_1996-08_83_8/page/1062.
- ↑ Watanapa P, Watanapa W (2002). «Liver fluke-associated cholangiocarcinoma». Br J Surg 89 (8): 962–70. doi:. PMID 12153620. https://archive.org/details/sim_british-journal-of-surgery_2002-08_89_8/page/962.
- ↑ Shin H, Lee C, Park H, Seol S, Chung J, Choi H, Ahn Y, Shigemastu T (1996). «Hepatitis B and C virus, Clonorchis sinensis for the risk of liver cancer: a case-control study in Pusan, Korea». Int J Epidemiol 25 (5): 933–40. doi:. PMID 8921477. https://archive.org/details/sim_international-journal-of-epidemiology_1996-10_25_5/page/933.
- ↑ Kobayashi M, Ikeda K, Saitoh S, Suzuki F, Tsubota A, Suzuki Y, Arase Y, Murashima N, Chayama K, Kumada Η (2000). «Incidence of primary cholangiocellular carcinoma of the liver in Japanese patients with hepatitis C virus-related cirrhosis». Cancer 88 (11): 2471–7. doi:. PMID 10861422.
- ↑ Yamamoto S, Kubo S, Hai S, Uenishi T, Yamamoto T, Shuto T, Takemura S, Tanaka H, Yamazaki O, Hirohashi K, Tanaka T (2004). «Hepatitis C virus infection as a likely etiology of intrahepatic cholangiocarcinoma». Cancer Sci 95 (7): 592–5. doi:. PMID 15245596. https://archive.org/details/sim_cancer-science_2004-07_95_7/page/592.
- ↑ Lu H, Ye M, Thung S, Dash S, Gerber M (2000). «Detection of hepatitis C virus RNA sequences in cholangiocarcinomas in Chinese and American patients». Chin Med J (Engl) 113 (12): 1138–41. PMID 11776153.
- ↑ 19,0 19,1 19,2 Shaib Y, El-Serag H, Davila J, Morgan R, McGlynn K (2005). «Risk factors of intrahepatic cholangiocarcinoma in the United States: a case-control study». Gastroenterology 128 (3): 620–6. doi:. PMID 15765398. https://archive.org/details/sim_gastroenterology_2005-03_128_3/page/620.
- ↑ Sorensen H, Friis S, Olsen J, Thulstrup A, Mellemkjaer L, Linet M, Trichopoulos D, Vilstrup H, Olsen J (1998). «Risk of liver and other types of cancer in patients with cirrhosis: a nationwide cohort study in Denmark». Hepatology 28 (4): 921–5. doi:. PMID 9755226. https://archive.org/details/sim_hepatology_1998-10_28_4/page/921.
- ↑ Lipsett P, Pitt H, Colombani P, Boitnott J, Cameron J (1994). «Choledochal cyst disease. A changing pattern of presentation». Ann Surg 220 (5): 644–52. doi:. PMID 7979612. PMC 1234452. https://archive.org/details/sim_annals-of-surgery_1994-11_220_5/page/644.
- ↑ Dayton M, Longmire W, Tompkins R (1983). «Caroli's Disease: a premalignant condition?». Am J Surg 145 (1): 41–8. doi:. PMID 6295196.
- ↑ Mecklin J, Järvinen H, Virolainen M (1992). «The association between cholangiocarcinoma and hereditary nonpolyposis colorectal carcinoma». Cancer 69 (5): 1112–4. doi:. PMID 1310886.
- ↑ Lee S, Kim M, Lee S, Jang S, Song M, Kim K, Kim H, Seo D, Song D, Yu E, Lee S, Min Y (2004). «Clinicopathologic review of 58 patients with biliary papillomatosis». Cancer 100 (4): 783–93. doi:. PMID 14770435.
- ↑ Lee C, Wu C, Chen G (2002). «What is the impact of coexistence of hepatolithiasis on cholangiocarcinoma?». J Gastroenterol Hepatol 17 (9): 1015–20. doi:. PMID 12167124. https://archive.org/details/sim_journal-of-gastroenterology-and-hepatology_2002_17_9/page/1015.
- ↑ Su C, Shyr Y, Lui W, P'Eng F (1997). «Hepatolithiasis associated with cholangiocarcinoma». Br J Surg 84 (7): 969–73. doi:. PMID 9240138. https://archive.org/details/sim_british-journal-of-surgery_1997-07_84_7/page/969.
- ↑ Donato F, Gelatti U, Tagger A, Favret M, Ribero M, Callea F, Martelli C, Savio A, Trevisi P, Nardi G (2001). «Intrahepatic cholangiocarcinoma and hepatitis C and B virus infection, alcohol intake, and hepatolithiasis: a case-control study in Italy». Cancer Causes Control 12 (10): 959–64. doi:. PMID 11808716.
- ↑ Sahani D, Prasad S, Tannabe K, Hahn P, Mueller P, Saini S (2003). «Thorotrast-induced cholangiocarcinoma: case report». Abdom Imaging 28 (1): 72–4. doi:. PMID 12483389.
- ↑ Zhu A, Lauwers G, Tanabe K (2004). «Cholangiocarcinoma in association with Thorotrast exposure». J Hepatobiliary Pancreat Surg 11 (6): 430–3. doi:. PMID 15619021.
- ↑ Klatskin G (1965). «Adenocarcinoma Of The Hepatic Duct At Its Bifurcation Within The Porta Hepatis. An Unusual Tumor With Distinctive Clinical And Pathological Features». Am J Med 38 (2): 241–56. doi:. PMID 14256720. https://archive.org/details/sim_american-journal-of-medicine_1965-02_38_2/page/241.
- ↑ Roskams T (2006). «Liver stem cells and their implication in hepatocellular and cholangiocarcinoma». Oncogene 25 (27): 3818–22. doi:. PMID 16799623.
- ↑ Liu C, Wang J, Ou Q (2004). «Possible stem cell origin of human cholangiocarcinoma». World J Gastroenterol 10 (22): 3374–6. PMID 15484322.
- ↑ Sell S, Dunsford Η (1989). «Evidence for the stem cell origin of hepatocellular carcinoma and cholangiocarcinoma». Am J Pathol 134 (6): 1347–63. PMID 2474256. PMC 1879951. https://archive.org/details/sim_american-journal-of-pathology_1989-06_134_6/page/1347.
- ↑ 34,0 34,1 Sirica A (2005). «Cholangiocarcinoma: molecular targeting strategies for chemoprevention and therapy». Hepatology 41 (1): 5–15. doi:. PMID 15690474.
- ↑ Holzinger F, Z'graggen K, Büchler M (1999). «Mechanisms of biliary carcinogenesis: a pathogenetic multi-stage cascade towards cholangiocarcinoma». Ann Oncol 10 (Suppl 4): 122–6. PMID 10436802.
- ↑ Gores G (2003). «Cholangiocarcinoma: current concepts and insights». Hepatology 37 (5): 961–9. doi:. PMID 12717374. https://archive.org/details/sim_hepatology_2003-05_37_5/page/961.
- ↑ de Groen P, Gores G, LaRusso N, Gunderson L, Nagorney D (1999). «Biliary tract cancers». N Engl J Med 341 (18): 1368–78. doi:. PMID 10536130.
- ↑ 38,0 38,1 Henson D, Albores-Saavedra J, Corle D (1992). «Carcinoma of the extrahepatic bile ducts. Histologic types, stage of disease, grade, and survival rates». Cancer 70 (6): 1498–501. doi:. PMID 1516001.
- ↑ Studies of the performance of serum markers for cholangiocarcinoma (such as carcinoembryonic antigen and CA19-9) in patients with and without primary sclerosing cholangitis include the following:
- Nehls O, Gregor M, Klump B (2004). «Serum and bile markers for cholangiocarcinoma». Semin Liver Dis 24 (2): 139–54. doi:. PMID 15192787. https://archive.org/details/sim_seminars-in-liver-disease_2004-05_24_2/page/139.
- Siqueira E, Schoen R, Silverman W, Martin J, Rabinovitz M, Weissfeld J, Abu-Elmaagd K, Madariaga J, Slivka A, Martini J (2002). «Detecting cholangiocarcinoma in patients with primary sclerosing cholangitis». Gastrointest Endosc 56 (1): 40–7. doi:. PMID 12085033. https://archive.org/details/sim_gastrointestinal-endoscopy_2002-07_56_1/page/40.
- Levy C, Lymp J, Angulo P, Gores G, Larusso N, Lindor K (2005). «The value of serum CA 19-9 in predicting cholangiocarcinomas in patients with primary sclerosing cholangitis». Dig Dis Sci 50 (9): 1734–40. doi:. PMID 16133981. https://archive.org/details/sim_digestive-diseases-and-sciences_2005-09_50_9/page/1734.
- Patel A, Harnois D, Klee G, LaRusso N, Gores G (2000). «The utility of CA 19-9 in the diagnoses of cholangiocarcinoma in patients without primary sclerosing cholangitis». Am J Gastroenterol 95 (1): 204–7. doi:. PMID 10638584. https://archive.org/details/sim_american-journal-of-gastroenterology_2000-01_95_1/page/204.
- ↑ Saini S (1997). «Imaging of the hepatobiliary tract». N Engl J Med 336 (26): 1889–94. doi:. PMID 9197218.
- ↑ Sharma M, Ahuja V (1999). «Aetiological spectrum of obstructive jaundice and diagnostic ability of ultrasonography: a clinician's perspective». Trop Gastroenterol 20 (4): 167–9. PMID 10769604.
- ↑ Bloom C, Langer B, Wilson S (1999). «Role of US in the detection, characterization, and staging of cholangiocarcinoma». Radiographics 19 (5): 1199–218. PMID 10489176.
- ↑ Valls C, Gumà A, Puig I, Sanchez A, Andía E, Serrano T, Figueras J (2000). «Intrahepatic peripheral cholangiocarcinoma: CT evaluation». Abdom Imaging 25 (5): 490–6. doi:. PMID 10931983.
- ↑ Tillich M, Mischinger H, Preisegger K, Rabl H, Szolar D (1998). «Multiphasic helical CT in diagnosis and staging of hilar cholangiocarcinoma». AJR Am J Roentgenol 171 (3): 651–8. PMID 9725291.
- ↑ Zhang Y, Uchida M, Abe T, Nishimura H, Hayabuchi N, Nakashima Y (1999). «Intrahepatic peripheral cholangiocarcinoma: comparison of dynamic CT and dynamic MRI». J Comput Assist Tomogr 23 (5): 670–7. doi:. PMID 10524843.
- ↑ Sugiyama M, Hagi H, Atomi Y, Saito M (1997). «Diagnosis of portal venous invasion by pancreatobiliary carcinoma: value of endoscopic ultrasonography». Abdom Imaging 22 (4): 434–8. doi:. PMID 9157867.
- ↑ Schwartz L, Coakley F, Sun Y, Blumgart L, Fong Y, Panicek D (1998). «Neoplastic pancreaticobiliary duct obstruction: evaluation with breath-hold MR cholangiopancreatography». AJR Am J Roentgenol 170 (6): 1491–5. PMID 9609160.
- ↑ Zidi S, Prat F, Le Guen O, Rondeau Y, Pelletier G (2000). «Performance characteristics of magnetic resonance cholangiography in the staging of malignant hilar strictures». Gut 46 (1): 103–6. doi:. PMID 10601064. PMC 1727781. https://archive.org/details/sim_gut_2000-01_46_1/page/103.
- ↑ Lee M, Park K, Shin Y, Yoon H, Sung K, Kim M, Lee S, Kang E (2003). «Preoperative evaluation of hilar cholangiocarcinoma with contrast-enhanced three-dimensional fast imaging with steady-state precession magnetic resonance angiography: comparison with intraarterial digital subtraction angiography». World J Surg 27 (3): 278–83. doi:. PMID 12607051. https://archive.org/details/sim_world-journal-of-surgery_2003-03_27_3/page/278.
- ↑ Yeh T, Jan Y, Tseng J, Chiu C, Chen T, Hwang T, Chen M (2000). «Malignant perihilar biliary obstruction: magnetic resonance cholangiopancreatographic findings». Am J Gastroenterol 95 (2): 432–40. doi:. PMID 10685746. https://archive.org/details/sim_american-journal-of-gastroenterology_2000-02_95_2/page/432.
- ↑ Freeman M, Sielaff T (2003). «A modern approach to malignant hilar biliary obstruction». Rev Gastroenterol Disord 3 (4): 187–201. PMID 14668691.
- ↑ Szklaruk J, Tamm E, Charnsangavej C (2002). «Preoperative imaging of biliary tract cancers». Surg Oncol Clin N Am 11 (4): 865–76. doi:. PMID 12607576.
- ↑ Weber S, DeMatteo R, Fong Y, Blumgart L, Jarnagin W (2002). «Staging Laparoscopy in Patients With Extrahepatic Biliary Carcinoma: Analysis of 100 Patients». Ann Surg 235 (3): 392–9. doi:. PMID 11882761. PMC 1422445. https://archive.org/details/sim_annals-of-surgery_2002-03_235_3/page/392.
- ↑ Callery M, Strasberg S, Doherty G, Soper N, Norton J (1997). «Staging laparoscopy with laparoscopic ultrasonography: optimizing resectability in hepatobiliary and pancreatic malignancy». J Am Coll Surg 185 (1): 33–9. PMID 9208958. https://archive.org/details/sim_journal-of-the-american-college-of-surgeons_1997-07_185_1/page/33.
- ↑ Länger F, von Wasielewski R, Kreipe HH (2006). «[The importance of immunohistochemistry for the diagnosis of cholangiocarcinomas]» (στα German). Pathologe 27 (4): 244–50. doi:. PMID 16758167.
- ↑ Darwin PE, Kennedy A. Cholangiocarcinoma στο eMedicine
- ↑ Su C, Tsay S, Wu C, Shyr Y, King K, Lee C, Lui W, Liu T, P'eng F (1996). «Factors influencing postoperative morbidity, mortality, and survival after resection for hilar cholangiocarcinoma». Ann Surg 223 (4): 384–94. doi:. PMID 8633917. PMC 1235134. https://archive.org/details/sim_annals-of-surgery_1996-04_223_4/page/384.
- ↑ Heimbach JK, Gores GJ, Haddock MG, et al. (December 2006). «Predictors of disease recurrence following neoadjuvant chemoradiotherapy and liver transplantation for unresectable perihilar cholangiocarcinoma». Transplantation 82 (12): 1703–7. doi:. PMID 17198263. Αρχειοθετήθηκε από το πρωτότυπο στις 2013-05-22. https://web.archive.org/web/20130522223146/http://meta.wkhealth.com/pt/pt-core/template-journal/lwwgateway/media/landingpage.htm?issn=0041-1337&volume=82&issue=12&spage=1703. Ανακτήθηκε στις 2012-11-24.
- ↑ Todoroki T, Ohara K, Kawamoto T, Koike N, Yoshida S, Kashiwagi H, Otsuka M, Fukao K (2000). «Benefits of adjuvant radiotherapy after radical resection of locally advanced main hepatic duct carcinoma». Int J Radiat Oncol Biol Phys 46 (3): 581–7. doi:. PMID 10701737.
- ↑ Alden M, Mohiuddin M (1994). «The impact of radiation dose in combined external beam and intraluminal Ir-192 brachytherapy for bile duct cancer». Int J Radiat Oncol Biol Phys 28 (4): 945–51. doi:. PMID 8138448.
- ↑ González González D, Gouma D, Rauws E, van Gulik T, Bosma A, Koedooder C (1999). «Role of radiotherapy, in particular intraluminal brachytherapy, in the treatment of proximal bile duct carcinoma». Ann Oncol 10 (Suppl 4): 215–20. PMID 10436826.
- ↑ Pitt H, Nakeeb A, Abrams R, Coleman J, Piantadosi S, Yeo C, Lillemore K, Cameron J (1995). «Perihilar cholangiocarcinoma. Postoperative radiotherapy does not improve survival». Ann Surg 221 (6): 788–97; discussion 797–8. doi:. PMID 7794082. PMC 1234714. https://archive.org/details/sim_annals-of-surgery_1995-06_221_6/page/788.
- ↑ Takada T, Amano H, Yasuda H, Nimura Y, Matsushiro T, Kato H, Nagakawa T, Nakayama T (2002). «Is postoperative adjuvant chemotherapy useful for gallbladder carcinoma? A phase III multicenter prospective randomized controlled trial in patients with resected pancreaticobiliary carcinoma». Cancer 95 (8): 1685–95. doi:. PMID 12365016.
- ↑ 64,0 64,1 National Comprehensive Cancer Network (NCCN) guidelines on evaluation and treatment of hepatobiliary malignancies PDF (216 KB). Accessed March 13, 2007.
- ↑ Vauthey J, Blumgart L (1994). «Recent advances in the management of cholangiocarcinomas». Semin. Liver Dis. 14 (2): 109–14. doi:. PMID 8047893. https://archive.org/details/sim_seminars-in-liver-disease_1994-05_14_2/page/109.
- ↑ Glimelius B, Hoffman K, Sjödén P, Jacobsson G, Sellström H, Enander L, Linné T, Svensson C (1996). «Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer». Ann Oncol 7 (6): 593–600. PMID 8879373. https://archive.org/details/sim_annals-of-oncology_1996-08_7_6/page/593.
- ↑ Choi C, Choi I, Seo J, Kim B, Kim J, Kim C, Um S, Kim J, Kim Y (2000). «Effects of 5-fluorouracil and leucovorin in the treatment of pancreatic-biliary tract adenocarcinomas». Am J Clin Oncol 23 (4): 425–8. doi:. PMID 10955877.
- ↑ Park J, Oh S, Kim S, Kwon H, Kim J, Jin-Kim H, Kim Y (2005). «Single-agent gemcitabine in the treatment of advanced biliary tract cancers: a phase II study». Jpn J Clin Oncol 35 (2): 68–73. doi:. PMID 15709089.
- ↑ Giuliani F, Gebbia V, Maiello E, Borsellino N, Bajardi E, Colucci G (2006). «Gemcitabine and cisplatin for inoperable and/or metastatic biliary tree carcinomas: a multicenter phase II study of the Gruppo Oncologico dell'Italia Meridionale (GOIM)». Ann Oncol 17 (Suppl 7): vii73–7. doi:. PMID 16760299.
- ↑ Bhargava P, Jani C, Savarese D, O'Donnell J, Stuart K, Rocha Lima C (2003). «Gemcitabine and irinotecan in locally advanced or metastatic biliary cancer: preliminary report». Oncology (Williston Park) 17 (9 Suppl 8): 23–6. PMID 14569844.
- ↑ Knox J, Hedley D, Oza A, Feld R, Siu L, Chen E, Nematollahi M, Pond G, Zhang J, Moore M (2005). «Combining gemcitabine and capecitabine in patients with advanced biliary cancer: a phase II trial». J Clin Oncol 23 (10): 2332–8. doi:. PMID 15800324.
- ↑ Philip P, Mahoney M, Allmer C, Thomas J, Pitot H, Kim G, Donehower R, Fitch T, Picus J, Erlichman C (2006). «Phase II study of erlotinib in patients with advanced biliary cancer». J Clin Oncol 24 (19): 3069–74. doi:. PMID 16809731.
- ↑ Ortner M, Caca K, Berr F, Liebetruth J, Mansmann U, Huster D, Voderholzer W, Schachschal G, Mössner J, Lochs Η (2003). «Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study». Gastroenterology 125 (5): 1355–63. doi:. PMID 14598251. https://archive.org/details/sim_gastroenterology_2003-11_125_5/page/1355.
- ↑ Zoepf T, Jakobs R, Arnold J, Apel D, Riemann J (2005). «Palliation of nonresectable bile duct cancer: improved survival after photodynamic therapy». Am J Gastroenterol 100 (11): 2426–30. doi:. PMID 16279895. https://archive.org/details/sim_american-journal-of-gastroenterology_2005-11_100_11/page/2426.
- ↑ Talreja JP, Kahaleh M (September 2010). «Photodynamic therapy for cholangiocarcinoma». Gut Liver 4 Suppl 1: S62–6. doi:. PMID 21103297. PMC 2989550. http://gutnliver.org/journal/journal_view.html?year=2010&vol=4%20Suppl%201&num=00&page=S62.
- ↑ Yamamoto M, Takasaki K, Yoshikawa T (1999). «Lymph Node Metastasis in Intrahepatic Cholangiocarcinoma». Japanese Journal of Clinical Oncology 29 (3): 147–150. doi:. PMID 10225697.
- ↑ Farley D, Weaver A, Nagorney D (1995). «"Natural history" of unresected cholangiocarcinoma: patient outcome after noncurative intervention». Mayo Clin Proc 70 (5): 425–9. doi:. PMID 7537346. https://archive.org/details/sim_mayo-clinic-proceedings_1995-05_70_5/page/425.
- ↑ Grove MK, Hermann RE, Vogt DP, Broughan TA (1991). «Role of radiation after operative palliation in cancer of the proximal bile ducts». Am J Surg 161 (4): 454–458. doi:. PMID 1709795. https://archive.org/details/sim_american-journal-of-surgery_1991-04_161_4/page/454.
- ↑ Studies of surgical outcomes in distal cholangiocarcinoma include:
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). «Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors». Ann Surg 224 (4): 463–73; discussion 473–5. doi:. PMID 8857851. PMC 1235406. https://archive.org/details/sim_annals-of-surgery_1996-10_224_4/page/463.
- Nagorney D, Donohue J, Farnell M, Schleck C, Ilstrup D (1993). «Outcomes after curative resections of cholangiocarcinoma». Arch Surg 128 (8): 871–7; discussion 877–9. PMID 8393652.
- Jang J, Kim S, Park D, Ahn Y, Yoon Y, Choi M, Suh K, Lee K, Park Y (2005). «Actual Long-term Outcome of Extrahepatic Bile Duct Cancer After Surgical Resection». Ann Surg 241 (1): 77–84. PMID 15621994. PMC 1356849. https://archive.org/details/sim_annals-of-surgery_2005-01_241_1/page/77.
- Bortolasi L, Burgart L, Tsiotos G, Luque-De León E, Sarr M (2000). «Adenocarcinoma of the distal bile duct. A clinicopathologic outcome analysis after curative resection». Dig Surg 17 (1): 36–41. doi:. PMID 10720830.
- Fong Y, Blumgart L, Lin E, Fortner J, Brennan M (1996). «Outcome of treatment for distal bile duct cancer». Br J Surg 83 (12): 1712–5. doi:. PMID 9038548. https://archive.org/details/sim_british-journal-of-surgery_1996-12_83_12/page/1712.
- ↑ Studies of outcome in intrahepatic cholangiocarcinoma include:
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). «Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors». Ann Surg 224 (4): 463–73; discussion 473–5. doi:. PMID 8857851. PMC 1235406. https://archive.org/details/sim_annals-of-surgery_1996-10_224_4/page/463.
- Lieser M, Barry M, Rowland C, Ilstrup D, Nagorney D (1998). «Surgical management of intrahepatic cholangiocarcinoma: a 31-year experience». J Hepatobiliary Pancreat Surg 5 (1): 41–7. doi:. PMID 9683753.
- Valverde A, Bonhomme N, Farges O, Sauvanet A, Flejou J, Belghiti J (1999). «Resection of intrahepatic cholangiocarcinoma: a Western experience». J Hepatobiliary Pancreat Surg 6 (2): 122–7. doi:. PMID 10398898.
- Nakagohri T, Asano T, Kinoshita H, Kenmochi T, Urashima T, Miura F, Ochiai T (2003). «Aggressive surgical resection for hilar-invasive and peripheral intrahepatic cholangiocarcinoma». World J Surg 27 (3): 289–93. doi:. PMID 12607053. https://archive.org/details/sim_world-journal-of-surgery_2003-03_27_3/page/289.
- Weber S, Jarnagin W, Klimstra D, DeMatteo R, Fong Y, Blumgart L (2001). «Intrahepatic cholangiocarcinoma: resectability, recurrence pattern, and outcomes». J Am Coll Surg 193 (4): 384–91. doi:. PMID 11584966. https://archive.org/details/sim_journal-of-the-american-college-of-surgeons_2001-10_193_4/page/384.
- ↑ Estimates of survival after surgery for perihilar cholangiocarcinoma include:
- Burke E, Jarnagin W, Hochwald S, Pisters P, Fong Y, Blumgart L (1998). «Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system». Ann Surg 228 (3): 385–94. doi:. PMID 9742921. PMC 1191497. https://archive.org/details/sim_annals-of-surgery_1998-09_228_3/page/385.
- Tsao J, Nimura Y, Kamiya J, Hayakawa N, Kondo S, Nagino M, Miyachi M, Kanai M, Uesaka K, Oda K, Rossi R, Braasch J, Dugan J (2000). «Management of Hilar Cholangiocarcinoma: Comparison of an American and a Japanese Experience». Ann Surg 232 (2): 166–74. doi:. PMID 10903592. PMC 1421125. https://archive.org/details/sim_annals-of-surgery_2000-08_232_2/page/166.
- Chamberlain R, Blumgart L (2000). «Hilar cholangiocarcinoma: a review and commentary». Ann Surg Oncol 7 (1): 55–66. doi:. PMID 10674450.
- Washburn W, Lewis W, Jenkins R (1995). «Aggressive surgical resection for cholangiocarcinoma». Arch Surg 130 (3): 270–6. PMID 7534059.
- Nagino M, Nimura Y, Kamiya J, Kanai M, Uesaka K, Hayakawa N, Yamamoto H, Kondo S, Nishio Η (1998). «Segmental liver resections for hilar cholangiocarcinoma». Hepatogastroenterology 45 (19): 7–13. PMID 9496478.
- Rea D, Munoz-Juarez M, Farnell M, Donohue J, Que F, Crownhart B, Larson D, Nagorney D (2004). «Major hepatic resection for hilar cholangiocarcinoma: analysis of 46 patients». Arch Surg 139 (5): 514–23; discussion 523–5. doi:. PMID 15136352.
- Launois B, Reding R, Lebeau G, Buard J (2000). «Surgery for hilar cholangiocarcinoma: French experience in a collective survey of 552 extrahepatic bile duct cancers». J Hepatobiliary Pancreat Surg 7 (2): 128–34. doi:. PMID 10982604.
- ↑ Kaya M, de Groen P, Angulo P, Nagorney D, Gunderson L, Gores G, Haddock M, Lindor K (2001). «Treatment of cholangiocarcinoma complicating primary sclerosing cholangitis: the Mayo Clinic experience». Am J Gastroenterol 96 (4): 1164–9. doi:. PMID 11316165. https://archive.org/details/sim_american-journal-of-gastroenterology_2001-04_96_4/page/1164.
- ↑ Nakeeb A, Tran K, Black M, Erickson B, Ritch P, Quebbeman E, Wilson S, Demeure M, Rilling W, Dua K, Pitt Η (2002). «Improved survival in resected biliary malignancies». Surgery 132 (4): 555–63; discission 563–4. doi:. PMID 12407338. https://archive.org/details/sim_surgery_2002-10_132_4/page/555.
- ↑ «Introduction». Αρχειοθετήθηκε από το πρωτότυπο στις 12 Μαρτίου 2009. Ανακτήθηκε στις 24 Νοεμβρίου 2012.
- ↑ http://seer.cancer.gov/csr/1975_2005/results_single/sect_01_table.01.pdf
- ↑ Khan S, Taylor-Robinson S, Toledano M, Beck A, Elliott P, Thomas Η (2002). «Changing international trends in mortality rates for liver, biliary and pancreatic tumours». J Hepatol 37 (6): 806–13. doi:. PMID 12445422.
- ↑ Vauthey J, Blumgart L (1994). «Recent advances in the management of cholangiocarcinomas». Semin Liver Dis 14 (2): 109–14. doi:. PMID 8047893. https://archive.org/details/sim_seminars-in-liver-disease_1994-05_14_2/page/109.
- ↑ Cancer Statistics Home Page — National Cancer Institute
- ↑ Multiple independent studies have documented a steady increase in the worldwide incidence of cholangiocarcinoma. Some relevant journal articles include:
- Patel T (2002). «Worldwide trends in mortality from biliary tract malignancies». BMC Cancer 2: 10. doi:. PMID 11991810.
- Patel T (2001). «Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States». Hepatology 33 (6): 1353–7. doi:. PMID 11391522. https://archive.org/details/sim_hepatology_2001-06_33_6/page/1353.
- Shaib Y, Davila J, McGlynn K, El-Serag Η (2004). «Rising incidence of intrahepatic cholangiocarcinoma in the United States: a true increase?». J Hepatol 40 (3): 472–7. doi:. PMID 15123362.
- West J, Wood H, Logan R, Quinn M, Aithal G (2006). «Trends in the incidence of primary liver and biliary tract cancers in England and Wales 1971–2001». Br J Cancer 94 (11): 1751–8. doi:. PMID 16736026.
- Khan S, Taylor-Robinson S, Toledano M, Beck A, Elliott P, Thomas Η (2002). «Changing international trends in mortality rates for liver, biliary and pancreatic tumours». J Hepatol 37 (6): 806–13. doi:. PMID 12445422.
- Welzel T, McGlynn K, Hsing A, O'Brien T, Pfeiffer R (2006). «Impact of classification of hilar cholangiocarcinomas (Klatskin tumors) on the incidence of intra- and extrahepatic cholangiocarcinoma in the United States». J Natl Cancer Inst 98 (12): 873–5. doi:. PMID 16788161.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- American Cancer Society Detailed Guide to Bile Duct Cancer Αρχειοθετήθηκε 2007-03-10 στο Wayback Machine..
- Patient information on extrahepatic bile duct tumors, from the National Cancer Institute.
- Cancer.Net: Bile Duct Cancer Αρχειοθετήθηκε 2012-08-25 στο Wayback Machine.
- The Cholangiocarcinoma Foundation: a resource for patients, friends, caregivers and loved ones of those affected by bile duct cancer.
- The Alan Morement Memorial Fund, the UK's only charity dedicated to the disease
- Macmillan/Cancerbackup page on Cholangiocarcinoma

