Ινωδογόνο

Το ινωδογόνο (παράγοντας Ι) είναι σύμπλεγμα γλυκοπρωτεϊνών, που παράγεται στο ήπαρ και κυκλοφορεί στο αίμα όλων των σπονδυλωτών.[1] Κατά τη διάρκεια τραυματισμού ιστών και αγγείων, μετατρέπεται από το ένζυμο θρομβίνη σε ινική και στη συνέχεια σε θρόμβο αίματος με βάση ινώδεςτην ινική. Οι θρόμβοι ινικής λειτουργούν κυρίως για να φράξουν τα αιμοφόρα αγγεία για να σταματήσουν την αιμορραγία. Η ινική δεσμεύει επίσης και μειώνει τη δραστηριότητα της θρομβίνης. Αυτή η δραστηριότητα, μερικές φορές αναφέρεται ως αντιθρομβίνη Ι, περιορίζει την πήξη.[2] Η ινική μεσολαβεί επίσης στην εξάπλωση των αιμοπεταλίων και των ενδοθηλιακών κυττάρων, στον πολλαπλασιασμό των ινοβλαστών των ιστών, στον σχηματισμό τριχοειδών σωλήνων και στην αγγειογένεση και επομένως προάγει την επαναγγείωση και την επούλωση των πληγών.[3]
Μειωμένο και / ή δυσλειτουργικό ινωδογόνο εμφανίζεται σε διάφορες συγγενείς και επίκτητες διαταραχές που σχετίζονται με το ινωδογόνο. Αυτές οι διαταραχές αντιπροσωπεύουν μια ομάδα σπάνιων καταστάσεων στις οποίες τα άτομα μπορεί να παρουσιάσουν σοβαρά επεισόδια παθολογικής αιμορραγίας και θρόμβωσης. Αυτές οι καταστάσεις αντιμετωπίζονται συμπληρώνοντας τα επίπεδα ινωδογόνου στο αίμα και αναστέλλοντας την πήξη του αίματος, αντίστοιχα.[4][5] Αυτές οι διαταραχές μπορεί επίσης να είναι η αιτία ορισμένων παθήσεων του ήπατος και των νεφρών.[2]
Το ινωδογόνο είναι μια «θετική» πρωτεΐνη οξείας φάσης, δηλαδή τα επίπεδα στο αίμα της αυξάνονται ως απόκριση σε συστηματική φλεγμονή, τραυματισμό ιστού και σε ορισμένα άλλα συμβάντα. Είναι επίσης αυξημένο σε διάφορους καρκίνους. Τα αυξημένα επίπεδα ινωδογόνου στη φλεγμονή καθώς και στον καρκίνο και άλλες καταστάσεις έχουν προταθεί ως η αιτία της θρόμβωσης και του αγγειακού τραυματισμού που συνοδεύει αυτές τις καταστάσεις.[6][7]
Γονίδια[Επεξεργασία | επεξεργασία κώδικα]
Το ινωδογόνο παράγεται και εκκρίνεται στο αίμα κυρίως από τα ηπατοκυττάρα. Τα κύτταρα του ενδοθηλίου αναφέρεται επίσης ότι παράγουν μικρές ποσότητες ινωδογόνου, αλλά αυτό το ινωδογόνο δεν έχει χαρακτηριστεί πλήρως. Τα αιμοπετάλια και οι πρόδρομοι τους, τα μεγακαρυοκύτταρα του μυελού των οστών, ενώ κάποτε θεωρούταν ότι παράγουν ινωδογόνο, είναι πλέον γνωστό ότι λαμβάνουν και αποθηκεύουν αλλά δεν παράγουν τη γλυκοπρωτεΐνη.[4][7] Η τελική εκκρινόμενη, γλυκοπρωτεΐνη που προέρχεται από ηπατοκύτταρα αποτελείται από δύο τριμερή, με κάθε τριμερές να αποτελείται από τρεις διαφορετικές αλυσίδες πολυπεπτιδίου, την άλφα αλυσίδα ινωδογόνου (που ονομάζεται επίσης αλυσίδα Αα ή α) που κωδικοποιείται από το γονίδιο FGA, την βήτα αλυσίδα ινωδογόνου (ονομάζεται επίσης η αλυσίδα Ββ ή β) που κωδικοποιείται από το γονίδιο FGB και τη γάμμα αλυσίδα ινωδογόνου (επίσης ονομάζεται αλυσίδα γ) που κωδικοποιείται από το γονίδιο FGG. Και τα τρία γονίδια βρίσκονται στον μακρύ ή «q» βραχίονα του ανθρώπινου χρωμοσώματος 4 (στις θέσεις 4q31.3, 4q31.3 και 4q32.1, αντίστοιχα).[2]
Το εναλλακτικό μάτισμα του γονιδίου FGA παράγει ένα μικρό διογκωμένο ισόμορφο του Αα που ονομάζεται ΑαΕ το οποίο αντικαθιστά το Αα στο 1-3% του κυκλοφορούντος ινωδογόνου. το εναλλακτικό μάτισμα του FGG παράγει μια ελάσσονα ισομορφή του γ που ονομάζεται γ ' που αντικαθιστά το γ στο 8-10% του κυκλοφορούντος ινωδογόνου. Το FGB δεν είναι εναλλακτικά συνδεδεμένο. Ως εκ τούτου, το τελικό ινωδογόνο προϊόν αποτελείται κυρίως από αλυσίδες Αα, Ββ και γ με ένα μικρό ποσοστό από αυτές να περιέχει αλυσίδες ΑαΕ και / ή γ' στη θέση των αλυσίδων Αα και / ή γ, αντίστοιχα. Τα τρία γονίδια μεταγράφονται και μεταφράζονται σε συντονισμό από έναν μηχανισμό/ους που παραμένει ανεπαρκώς κατανοητός.[8][9][10][11][12] Η συντονισμένη μεταγραφή αυτών των τριών γονιδίων ινωδογόνου αυξάνεται ταχύτατα και πολύ από συστημικές καταστάσεις όπως φλεγμονή και τραυματισμός ιστού. Οι κυτοκίνες που παράγονται κατά τη διάρκεια αυτών των συστημικών καταστάσεων, όπως η ιντερλευκίνη 6 και η ιντερλευκίνη 1β, φαίνονται υπεύθυνες για την αναπροσαρμογή αυτής της μεταγραφής.
Δομή[Επεξεργασία | επεξεργασία κώδικα]

Οι αλυσίδες Αα, Ββ και γ μεταγράφονται και μεταφράζονται συντονισμένα στο ενδοπλασματικό δίκτυο (ΕΔ), με τις πεπτιδικές αλυσίδες τους να περνούν στο ΕΔ ενώ τα τμήματα του σηματοδοτικού πεπτιδίου τους αφαιρούνται. Μέσα στο ΕΔ, οι τρεις αλυσίδες συναρμολογούνται αρχικά σε διμερή Ααγ και Ββγ, έπειτα σε τριμερή ΑαΒβγ, και τέλος σε εξαμερή (ΑαΒβγ)2, δηλαδή δύο τριμερή ΑαΒβγ ενωμένα μεταξύ τους με πολλούς δεσμούς δισουλφιδίου. Το εξαμερές μεταφέρεται στο σωμάτιο Γκόλτζι όπου είναι γλυκοζυλιωμένο, υδροξυλιωμένο, θειικό και φωσφορυλιωμένο για να σχηματίσει την ώριμη γλυκοπρωτεΐνη ινωδογόνου που εκκρίνεται στο αίμα.[10][12] Το ώριμο ινωδογόνο είναι διατεταγμένο ως μια μακρά εύκαμπτη πρωτεϊνική συστοιχία τριών οζιδίων που συγκρατούνται από ένα πολύ λεπτό νήμα που εκτιμάται ότι έχει διάμετρο μεταξύ 8 και 15 Ångstrom (Å). Τα δύο ακραία οζίδια (που ονομάζονται περιοχές D ή περιοχές) είναι όμοια αποτελούμενα από αλυσίδες Ββ και γ, ενώ το κεντρικό ελαφρώς μικρότερο οζίδιο (που ονομάζεται περιοχή ή περιοχή Ε) αποτελείται από δύο αλληλένδετες αλυσίδες Αα. Οι μετρήσεις των μηκών σκιάς δείχνουν ότι οι διάμετροι των οζιδίων κυμαίνονται από 50 έως 70 ΕΝΑ. Το μήκος του ξηρού μορίου είναι 475 ± 25 ΕΝΑ.[14]
Το μόριο ινωδογόνου κυκλοφορεί ως διαλυτή γλυκοπρωτεΐνη πλάσματος με τυπικό μοριακό βάρος (ανάλογα με την περιεκτικότητά του σε Αα στίχους ΑαΕ και γ έναντι αλυσίδων γ ') ~ 340 kDa. Έχει σχήμα ράβδου με διαστάσεις 9 × 47,5 × 6 nm και έχει αρνητικό καθαρό φορτίο σε φυσιολογικό pH (το ισοηλεκτρικό σημείο του είναι pH 5,8).[15][16] Η φυσιολογική συγκέντρωση του ινωδογόνου στο πλάσμα του αίματος είναι 150-400 mg / dl, με επίπεδα αισθητά κάτω ή πάνω από αυτό το εύρος που σχετίζεται με παθολογική αιμορραγία και / ή θρόμβωση. Το ινωδογόνο έχει ημιζωή κυκλοφορίας περίπου 4 ημέρες.[12]
Σχηματισμός θρόμβων αίματος[Επεξεργασία | επεξεργασία κώδικα]
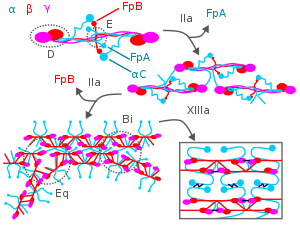
Κατά τη διάρκεια της πήξης του αίματος, η θρομβίνη προσβάλλει το Ν-άκρο των αλυσίδων Αα και Ββ στο ινωδογόνο για να σχηματίσει μεμονωμένους κλώνους ινώδους συν δύο μικρά πολυπεπτίδια, τα ινωδοπεπτίδια Α και Β που προέρχονται από αυτές τις αντίστοιχες αλυσίδες. Οι μεμονωμένοι κλώνοι ινώδους στη συνέχεια πολυμερίζονται και διασυνδέονται με άλλους κλώνους ινώδους από τον παράγοντα αίματος XIIIa για να σχηματίσουν ένα εκτεταμένο διασυνδεδεμένο δίκτυο ινικής που αποτελεί τη βάση για τον σχηματισμό ενός ώριμου θρόμβου ινικής.[3][7][17] Εκτός από τον σχηματισμό ινικής, το ινωδογόνο προάγει επίσης την πήξη του αίματος σχηματίζοντας γέφυρες μεταξύ και ενεργοποιώντας, τα αιμοπετάλια μέσω σύνδεσης στον επιφανειακό μεμβρανικό υποδοχέα ινωδογόνου GpIIb / IIIa.
Η ινική συμμετέχει στον περιορισμό του σχηματισμού θρόμβων αίματος και στην αποδόμηση των σχηματισμένων θρόμβων αίματος με τουλάχιστον δύο σημαντικούς μηχανισμούς. Πρώτον, διαθέτει τρεις θέσεις δέσμευσης χαμηλής συγγένειας (δύο στον τομέα Ε ινώδους, μία στον τομέα D της) για τη θρομβίνη. Αυτός ο δεσμευτής δεσμεύει τη θρομβίνη και έτσι δεν προσβάλλει το ινωδογόνο.[17] Δεύτερον, η αλυσίδα Αα ινώδους επιταχύνει τουλάχιστον 100 φορές την ποσότητα της πλασμίνης που ενεργοποιείται από τον ενεργοποιητή πλασμινογόνου ιστού. Η πλασμίνη διασπά τους θρόμβους αίματος.[5][3][7] Η επίθεση της πλασμίνης στο ινώδες απελευθερώνει D-dimers (ονομάζονται επίσης DD dimers). Η ανίχνευση αυτών των διμερών στο αίμα χρησιμοποιείται ως κλινική δοκιμή για την ινωδόλυση.
Διαταραχές του ινωδογόνου[Επεξεργασία | επεξεργασία κώδικα]
Αρκετές διαταραχές στην ποσότητα και / ή την ποιότητα του ινωδογόνου προκαλούν παθολογική αιμορραγία, παθολογική πήξη του αίματος ή / και την απόθεση του ινωδογόνου στο ήπαρ, στα νεφρά και σε άλλους ιστούς. Υπάρχουν διάφορες γενετικές διαταραχές, οι οποίες κυμαίνονται από παντελή έλλειψη (συγγενής ανινωδογοναιμία) μέχρι συγγενείς διαταραχές στην δομή και στην αποθήκευση του ινωδογόνου, καθώς και επίκτητες διαταραχές.
Επίκτητη δυσινωδογοναιμία[Επεξεργασία | επεξεργασία κώδικα]
Η επίκτητη δυσινωδογοναιμία είναι μια σπάνια διαταραχή στην οποία το κυκλοφορούν ινωδογόνο συντίθεται τουλάχιστον σε μέρος ενός δυσλειτουργικού ινωδογόνου λόγω διαφόρων επίκτητων ασθενειών. Μία καλά μελετημένη αιτία της διαταραχής είναι η σοβαρή ηπατική νόσος όπως το ηπάτωμα, η χρόνια ενεργός ηπατίτιδα, η κίρρωση και ο ίκτερος λόγω απόφραξης των χολικών οδών. Το ασθενές ήπαρ συνθέτει ινωδογόνο το οποίο έχει μία κανονικά λειτουργική αλληλουχία αμινοξέων αλλά δεν είναι σωστά γλυκοζυλιωμένη (δηλαδή έχει μία λανθασμένη ποσότητα των καταλοίπων σακχάρου) μετά τη διέλευσή της μέσα από το Golgi. Το λανθασμένα γλυκοζυλιωμένο ινωδογόνο είναι δυσλειτουργικό και μπορεί να προκαλέσει παθολογικά επεισόδια αιμορραγίας ή / και πήξης του αίματος. Άλλες, λιγότερο καλά κατανοητές αιτίες είναι οι δυσκρασίες των κυττάρων του πλάσματος και οι αυτοάνοσες διαταραχές στις οποίες μια ανώμαλη κυκλοφορούσα ανοσοσφαιρίνη ή άλλη πρωτεΐνη παρεμβαίνει στη λειτουργία του ινωδογόνου και σπάνιες περιπτώσεις καρκίνου και τοξικότητας φαρμάκων (ισοτρετινοΐνη, γλυκοκορτικοειδή και αντιλευχαιμικά φάρμακα).[17]
Κρυοϊνωδογοναιμία[Επεξεργασία | επεξεργασία κώδικα]
Η κρυοινωδογοναιμία είναι μια επίκτητη διαταραχή στην οποία το ινωδογόνο καθιζάνει σε κρύες θερμοκρασίες και μπορεί να οδηγήσει στην ενδοαγγειακή καταβύθιση ινωδογόνου, ινώδους και άλλων κυκλοφορούντων πρωτεϊνών, προκαλώντας έτσι ισχαιμία διαφόρων ιστών και σωματικών άκρων. Η κρυοσφαιριναιμία μπορεί να εμφανιστεί χωρίς ενδείξεις σχετικών διαταραχών, δηλαδή πρωτοπαθής κρυοσφαιριναιμία (επίσης ονομαζόμενη ουσιώδης κρυοσφαιριναιμία) ή, πολύ πιο συχνά, με ενδείξεις υποκείμενης νόσου, δηλαδή δευτερογενή κρυοσφαιριναιμία. Η δευτερογενής κρυοϊνωριναιμία μπορεί να αναπτυχθεί σε άτομα που πάσχουν από λοίμωξη (περίπου 12% των περιπτώσεων), κακοήθεις ή προ-κακοήθεις διαταραχές (21%), αγγειίτιδα (25%) και αυτοάνοσες ασθένειες (42%). Σε αυτές τις περιπτώσεις, το κρυοϊνωδόγωμα δύναται να προκαλέσει τραυματισμό ιστού ή / και άλλα συμπτώματα και η πραγματική σχέση αιτίας-αποτελέσματος μεταξύ αυτών των ασθενειών και της ανάπτυξης κρυοϊνωδογένεσης είναι ασαφής. Η κρυοϊνωδογοναιμία μπορεί επίσης να εμφανιστεί σε συνδυασμό με τη λήψη ορισμένων φαρμάκων.[18][19][20][21]
Επίκτητη υποϊνωδογοναιμία[Επεξεργασία | επεξεργασία κώδικα]
Η επίκτητη υποϊνωδογοναιμία είναι μια ανεπάρκεια στην κυκλοφορία του ινωδογόνου λόγω υπερβολικής κατανάλωσης που μπορεί να συμβεί ως αποτέλεσμα τραύματος, ορισμένων φάσεων διάχυτης ενδοαγγειακής πήξης και σήψης. Μπορεί επίσης να συμβεί ως αποτέλεσμα αιμοαραίωσης ως αποτέλεσμα απώλειας αίματος και / ή μεταγγίσεων με συσκευασμένα ερυθρά αιμοσφαίρια ή άλλες αντικαταστάσεις πλήρους αίματος φτωχού σε ινωδογόνο.[22]
Εργαστηριακές δοκιμές[Επεξεργασία | επεξεργασία κώδικα]
Οι κλινικές αναλύσεις των διαταραχών του ινωδογόνου συνήθως μετρούν την πήξη του αίματος χρησιμοποιώντας τα ακόλουθα διαδοχικά βήματα:[23] Τα υψηλότερα επίπεδα σχετίζονται, μεταξύ άλλων, με καρδιαγγειακές παθήσεις (> 3,43 g / l). Μπορεί να αυξηθεί σε οποιαδήποτε μορφή φλεγμονής, καθώς είναι πρωτεΐνη οξείας φάσης. Για παράδειγμα, είναι ιδιαίτερα εμφανές στον ανθρώπινο ουλώδη ιστό κατά την αρχική φάση της περιοδοντικής νόσου.[24][25]
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ «The evolution of vertebrate blood coagulation as viewed from a comparison of puffer fish and sea squirt genomes». Proceedings of the National Academy of Sciences of the United States of America 100 (13): 7527–7532. 2003. doi:. ISSN 0027-8424. PMID 12808152.
- ↑ 2,0 2,1 2,2 «Congenital fibrinogen disorders: an update». Seminars in Thrombosis and Hemostasis 39 (6): 585–95. 2013. doi:. PMID 23852822.
- ↑ 3,0 3,1 3,2 «Fibrinogen and fibrin structure and functions». Journal of Thrombosis and Haemostasis 3 (8): 1894–904. 2005. doi:. PMID 16102057.
- ↑ 4,0 4,1 «Clinical Features and Management of Congenital Fibrinogen Deficiencies». Seminars in Thrombosis and Hemostasis 42 (4): 366–74. 2016. doi:. PMID 27019462.
- ↑ 5,0 5,1 «Acquired dysfibrinogenemia in atherosclerotic vascular disease». Polskie Archiwum Medycyny Wewnetrznej 121 (9): 310–9. 2011. PMID 21952526.
- ↑ «Fibrinogen as a key regulator of inflammation in disease». Seminars in Immunopathology 34 (1): 43–62. 2012. doi:. PMID 22037947.
- ↑ 7,0 7,1 7,2 7,3 «Coagulation and fibrinolysis in gastric cancer». Annals of the New York Academy of Sciences 1404 (1): 27–48. 2017. doi:. PMID 28833193.
- ↑ «Laboratory and Genetic Investigation of Mutations Accounting for Congenital Fibrinogen Disorders». Seminars in Thrombosis and Hemostasis 42 (4): 356–65. 2016. doi:. PMID 27019463.
- ↑ «Fibrinogen splice variation and cross-linking: Effects on fibrin structure/function and role of fibrinogen γ' as thrombomobulin II». Matrix Biology 60–61: 8–15. 2017. doi:. PMID 27784620. http://eprints.whiterose.ac.uk/106660/1/1-s2.0-S0945053X16302293-main.pdf.
- ↑ 10,0 10,1 «Molecular mechanisms accounting for fibrinogen deficiency: from large deletions to intracellular retention of misfolded proteins». Journal of Thrombosis and Haemostasis 5 Suppl 1: 125–31. 2007. doi:. PMID 17635718.
- ↑ «Fibrinogen gene regulation». Thrombosis and Haemostasis 108 (3): 419–26. 2012. doi:. PMID 22836683.
- ↑ 12,0 12,1 12,2 «The molecular basis of quantitative fibrinogen disorders». Journal of Thrombosis and Haemostasis 4 (10): 2115–29. 2006. doi:. PMID 16999847.
- ↑ 13,0 13,1 Cardiovascular thrombus. Academic Press. 2018. σελίδες 31–43. ISBN 9780128126165.
- ↑ «The fibrinogen molecule: its size, shape, and mode of polymerization». The Journal of Biophysical and Biochemical Cytology 5 (1): 11–6. January 1959. doi:. PMID 13630928.
- ↑ «Interaction of fibrinogen and albumin with titanium dioxide nanoparticles of different crystalline phases». Journal of Physics. Conference Series 429 (1). 2013. http://iopscience.iop.org/1742-6596/429/1/012014/pdf/1742-6596_429_1_012014.pdf. Ανακτήθηκε στις 24 May 2014.
- ↑ «Mechanisms of fibrinogen adsorption at solid substrates at lower pH». Langmuir: The ACS Journal of Surfaces and Colloids 29 (23): 7005–16. 2013. doi:. PMID 23621148.
- ↑ 17,0 17,1 17,2 «Acquired hypofibrinogenemia: current perspectives». Journal of Blood Medicine 7: 217–225. 2016. doi:. PMID 27713652.
- ↑ «Cryofibrinogenemia-Induced Cutaneous Ulcers: A Review and Diagnostic Criteria». American Journal of Clinical Dermatology 18 (1): 97–104. 2017. doi:. PMID 27734332.
- ↑ «Cryofibrinogenemia After a Liver Transplant: First Reported Case Posttransplant and a Case-Based Review of the Nontransplant Literature». Experimental and Clinical Transplantation 13 (3): 290–4. 2015. doi:. PMID 24679054.
- ↑ «Clinical conditions responsible for hyperviscosity and skin ulcers complications». Clinical Hemorheology and Microcirculation 67 (1): 25–34. 2017. doi:. PMID 28550239.
- ↑ «Cryofibrinogenemia». Journal of Clinical Rheumatology 19 (3): 142–8. 2013. doi:. PMID 23519183.
- ↑ «Time for changing coagulation management in trauma-related massive bleeding». Current Opinion in Anesthesiology 22 (2): 267–74. April 2009. doi:. PMID 19390253.
- ↑ «The effects of fibrinogen levels on thromboelastometric variables in the presence of thrombocytopenia». Anesthesia and Analgesia 108 (3): 751–8. March 2009. doi:. PMID 19224779. https://archive.org/details/sim_anesthesia-and-analgesia_2009-03_108_3/page/751.
- ↑ «Pathogenesis of inflammatory periodontal disease. A summary of current work». Lab. Invest. 34 (3): 235–49. March 1976. PMID 765622.
- ↑ «Thromboembolism in patients with congenital afibrinogenaemia. Long-term observational data and systematic review». Thrombosis and Haemostasis 116 (4): 722–32. 2016. doi:. PMID 27384135. https://boris.unibe.ch/92529/7/2016-05-20%20rev_Ms%20afibrinogenemia.pdf.
