Βάμμα ηλιοτροπίου
| Βάμμα ηλιοτροπίου | |||
|---|---|---|---|
| Γενικά | |||
| Χημικά αναγνωριστικά | |||
| Αριθμός CAS | 1393-92-6 | ||
| Αριθμός EINECS | 215-739-6 | ||
| Φυσικές ιδιότητες | |||
| Πυκνότητα | περίπου 1 g/mL | ||
| Διαλυτότητα στο νερό |
διαλυτό | ||
| Εμφάνιση | ιώδες, καφέ ή κόκκινο υδ/κό διάλυμα | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
 
| |||
| Φράσεις κινδύνου | 40-36/37/38 | ||
| Φράσεις ασφαλείας | 24/25-36/37-36-26 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||


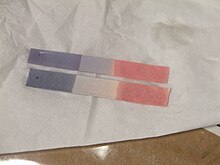
Το βάμμα ηλιοτροπίου (αγγλικά: litmus tincture) είναι σκούρο ιώδες-μαύρο υδατικό διάλυμα που προκύπτει από την διάλυση της φυσικής χρωστικής ουσίας ηλιοτρόπιο (αγγλικά: litmus)[Σημ. 1] και χρησιμοποιείται ως δείκτης για έλεγχο του pH ενός διαλύματος. Σταγόνες βάμματος ηλιοτροπίου, στους 25°C, χρωματίζουν κόκκινο ένα όξινο διάλυμα με pH < 4,5 και γαλάζιο ένα αλκαλικό διάλυμα με pH > 8,3. Σε ενδιάμεσες τιμές pH το βάμμα διατηρεί το αρχικό του χρώμα[1]. Τις ιδιότητές του ως δείκτη, το βάμμα ηλιοτροπίου, τις οφείλει στη χρωμοφόρα ουσία 7-υδροξυ-φαινοξαζόνη[2].
Το ηλιοτρόπιο είναι σκόνη με χρώμα μπλε-μαύρο και είναι μίγμα 10 έως 15 φυσικών χρωστικών ουσιών οι οποίες εξάγονται από τις λειχήνες και ειδικότερα από το είδος Roccella tinctoria. Τα περισσότερα από τα χημικά συστατικά του ηλιοτροπίου είναι πιθανό να είναι οι ίδια με εκείνα του παραπλήσιου μίγματος που είναι γνωστό ως ορσεΐνη[Σημ. 2] αλλά σε διαφορετικές αναλογίες. Σε αντίθεση με την ορσεΐνη, το ηλιοτρόπιο έχει μέσο μοριακό βάρος 3300[3]. Ορισμένα παράγωγα (κλάσματα) που προκύπτουν από το ηλιοτρόπιο έχουν ιδιαίτερα ονόματα όπως ερυθρολείνη, αζολιτμίνη, σπανιολιτμίνη κ.α. Η αζολιτμίνη μάλιστα έχει σχεδόν τα ίδια αποτελέσματα με το ηλιοτρόπιο.[4].
Η σκόνη ηλιοτροπίου πολλές φορές προσρροφάται πάνω σε διηθητικό χαρτί το οποίο έχει δύο χρώματα. Το μπλε χαρτί ηλιοτροπίου χρησιμοποιείται για έλεγχο της οξύτητας αφού παίρνει χρώμα κόκκινο σε όξινο περιβάλλον και το κόκκινο χαρτί ηλιοτροπίου χρησιμοποιείται για έλεγχο της αλκαλικότητας ενός διαλύματος αφού παίρνει μπλε χρώμα σε βασικό περιβάλλον.
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Το ηλιοτρόπιο χρησιμοποιήθηκε για πρώτη φορά περίπου το 1300 μ.Χ. από τον Ισπανό αλχημιστή Αρνάλντο ντε Βίλλα Νόβα (Arnaldus de Villa Nova, 1235–1311). Από το 16ο αιώνα και μετά, η μπλε χρωστική εξαγόταν από κάποια είδη λειχηνών, ειδικά στην Ολλανδία. Το όνομα litmus προέρχεται από την αρχαία Σκανδιναυική λέξη για τα έγχρωμα βρύα. Στις τιτλοδοτήσεις, και ειδικότερα στον προσδιορισμό του καλίου, χρησιμοποιήθηκε για πρώτη φορά από τον Lewis[5]
Παρασκευή - Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Από τις λειχήνες, το ηλιοτρόπιο εξάγεται με κατεργασία με αμμωνία, ποτάσα και ασβέστη και με την παρουσία αέρα παράγονται τα διάφορα χρωμοφόρα συστατικά του ηλιοτροπίου. Το 1840, το ηλιοτρόπιο διαχωρίστηκε εν μέρει σε σειρά ουσιών που ονομάζονται ερυθρολείνη, αζολιτμίνη, σπανιολιτμίνη κλπ.[6]
Για την παρασκευή εργαστηριακού βάμματος ηλιοτροπίου 4 % w/v, διαλύονται 4 g σκόνης ηλιοτροπίου σε 100 mL νερού[7].
Η κυριότερη χρήση του βάμματος ηλιοτροπίου αλλά και του χαρτιού είναι οι δοκιμές οξύτητας και αλκαλικότητας (litmus test). Υγρό χαρτί ηλιοτροπίου μπορεί να χρησιμοποιηθεί επίσης σε δοκιμές υδατοδιαλυτών αερίων : το αέριο διαλύεται στο νερό και το διάλυμα χρωματίζει το χαρτί. Έτσι, για παράδειγμα, η αέρια αμμωνία, που είναι βάση, χρωματίζει κόκκινο το μπλε χαρτί ηλιοτροπίου.
Κι άλλες όμως χημικές αντιδράσεις, εκτός από αυτές μεταξύ οξέων-βάσεων μπορούν να προκαλέσουν αλλαγή του χρώματος στο χαρτί ηλιοτροπίου. Για παράδειγμα, το αέριο χλώριο μετατρέπει σε άσπρο το μπλε χαρτί ηλιοτροπίου[8]. Η αντίδραση αυτή είναι μη αναστρέψιμη και, συνεπώς, το χαρτί ηλιοτροπίου δεν ενεργεί ως δείκτης σ' αυτή την περίπτωση.
Τοξικότητα - Προφυλάξεις
[Επεξεργασία | επεξεργασία κώδικα]Παρόλο που δεν υπάρχουν ακριβή στοιχεία για την τοξικότητα του βάμματος ηλιοτροπίου και τα αραιά διαλύματά του (< 1% w/v) δεν είναι τοξικά[9], το διάλυμα πρέπει να θεωρηθεί επικίνδυνο σε περίπτωση επαφής με το δέρμα (ερεθιστικό), επαφής με τα μάτια (ερεθιστικό), κατάποσης, εισπνοής[10]. Το διάλυμα δεν είναι εύφλεκτο, αλλά όταν αποσυντίθεται εκλύονται οξείδια του άνθρακα από την καύση των οργανικών ουσιών που περιέχονται[9].
Το βάμμα ηλιοτροπίου ως δείκτης
[Επεξεργασία | επεξεργασία κώδικα]Το ηλιοτρόπιο συμπεριφέρεται ως ασθενές οξύ και επειδή δεν έχει συγκεκριμένο χημικό τύπο, για απλοποίηση θα συμβολιστεί HLit. Το Η είναι το κατιόν υδρογόνου που μπορεί να αποδοθεί σε μια βάση και το Lit είναι το υπόλοιπο τμήμα του μορίου του ασθενούς οξέος. Όταν το ηλιοτρόπιο διαλυθεί στο νερό και δημιουργηθεί το βάμμα ηλιοτροπίου, αποκαθίσταται η ισορροπία[11] :
- HLit(aq)(κόκκινο) + H2O(l) Η3Ο+(aq) + Lit—(aq)(μπλε)
Όταν στο διάλυμα προστεθεί μια βάση, τα υδροξυλιόντα (ΟΗ—) δεσμεύουν τα κατιόντα υδρογόνου (υδροξώνια, Η3Ο+) και η παραπάνω ισορροπία μετατοπίζεται προς τα δεξιά σύμφωνα με την αρχή Le Chatelier, οπότε το διάλυμα αποκτά μπλε χρώμα. Για να υπάρξει αλλαγή χρώματος του βάμματος ηλιοτροπίου, η βάση που θα προστεθεί πρέπει να δώσει διάλυμα με pH > 8,3.
Όταν στο διάλυμα προστεθεί ένα οξύ, τα κατιόντα υδρογόνου πλεονάζουν και η παραπάνω ισορροπία μετατοπίζεται προς τα αριστερά σύμφωνα πάλι με την ίδια αρχή, οπότε το διάλυμα αποκτά κόκκινο χρώμα. Για να υπάρξει αλλαγή χρώματος του βάμματος ηλιοτροπίου, το οξύ που θα προστεθεί πρέπει να δώσει διάλυμα με pH < 4,5.
Σε ενδιάμεσες τιμές pH, το χρώμα του βάμματος είναι μεταξύ κόκκινου και μπλε. Κάποια στιγμή κατά τη διάρκεια της μετατόπισης της ισορροπίας, οι συγκεντρώσεις του HLit και των Η3Ο+ θα γίνουν ίσες. Τότε το χρώμα του διαλύματος είναι ιώδες, μια μίξη κόκκινου και μπλε. Για το ηλιοτρόπιο αυτό συμβαίνει σε pH κοντά στο 7 δηλ. σ' αυτό που συνήθως αποκαλείται "ουδέτερο" σημείο. Γι'αυτό το λόγο το βάμμα αλλά και το χαρτί ηλιοτροπίου χρησιμοποιούνται ευρύτατα στον έλεγχο του αν ένα διάλυμα είναι όξινο (pH < 7) ή βασικό (pH > 7).
| Χρώμα (pH < 4,5) |
Χρώμα (4,5 < pH < 8,3) |
Χρώμα (pH > 8,3) |
|---|---|---|
| . |
Σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Δεν πρέπει να γίνεται σύγχυση με τα φυτά ηλιοτρόπιο και ηλίανθος ή με άλλους παρόμοιους όρους
- ↑ Η ορσεΐνη είναι καστανέρυθρη χρωστική που προέρχεται από διάφορα είδη λειχήνων. Χρησιμοποιείται για την παρατήρηση σε ιστολογικές χρώσεις του ελαστικού ιστού, των συνδεόμενων με χαλκό πρωτεϊνών και των επιφανειακών αντιγόνων της ηπατίτιδας B. Είναι απαγορευμένη χρωστική στα τρόφιμα με κωδικό E121
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Römpp Chemie Lexikon - Version 1.0, Stuttgart/New York: Georg Thieme Verlag 1995 (Germany)
- ↑ Thomas H. Nash (1996). Thomas H. Nash, επιμ. Lichen biology (εικονογραφημένη, επανεκτύπωση έκδοση). Cambridge University Press. ISBN 0521459745.
- ↑ Beecken, H., E-M. Gottschalk, U. v Gizycki, H. Krämer, D. Maassen, H-G. Matthies, H. Musso, C. Rathjen, Ul. Zdhorszky (2003). «Orcein and Litmus». Biotechnic & Histochemistry 78 (6): 289–302.
- ↑ E.T. Wolf: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S.450-453, veröffentlicht 1846, Verlag E. Anton (Germany)
- ↑ Ferenc Szabadváry (1993). History of analytical chemistry (επανεκτύπωση, εικονογραφημένη έκδοση). Taylor & Francis. ISBN 2881245692.
- ↑ Encyclopædia Britannica
- ↑ «2o EKΦΕ ΗΡΑΚΛΕΙΟΥ» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 18 Σεπτεμβρίου 2020. Ανακτήθηκε στις 21 Ιουλίου 2011.
- ↑ UCC - Chlorine
- ↑ 9,0 9,1 MSDS Litmus Solution, 0.5% aqueous. For educational use only[νεκρός σύνδεσμος]
- ↑ «Material Safety Data Sheet (MSDS) Litmus». Αρχειοθετήθηκε από το πρωτότυπο στις 16 Οκτωβρίου 2012. Ανακτήθηκε στις 21 Ιουλίου 2011.
- ↑ ACID-BASE INDICATORS
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- titrations
- Acid-base titration. Indicators preparation
- ΟΓΚΟΜΕΤΡΙΑ ΕΞΟΥΔΕΤΕΡΩΣΗΣ (ΟΞΥΜΕΤΡΙΑ - ΑΛΚΑΛΙΜΕΤΡΙΑ)
- Acid-base titration » End point indicators


