Χλωριούχο βισμούθιο
| Χλωριούχο βισμούθιο | |
|---|---|

| |

| |
| Γενικά | |
| Όνομα IUPAC | Χλωριούχο βισμούθιο |
| Άλλες ονομασίες | τριχλωριούχο βισμούθιο, τριχλωροβισμούθιο |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | BiCl3 |
| Μοριακή μάζα | 315,34 amu |
| Αριθμός CAS | 7787-60-2 |
| SMILES | Cl[Bi](Cl)Cl |
| InChI | 1/Bi.3ClH/h;3*1H/q+3;;;/p-3 |
| Αριθμός RTECS | EB2690000 |
| ChemSpider ID | 22993 |
| Δομή | |
| Κρυσταλλική δομή στερεού |
ορθορομβικό |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 227 °C |
| Σημείο βρασμού | 447 °C |
| Πυκνότητα | 4,75 gr/cm3 |
| Διαλυτότητα στο νερό |
Διασπάται σε οξυχλωριούχο βισμούθιο (BiOCl) |
| Διαλυτότητα σε άλλους διαλύτες |
διαλυτό στη μεθανόλη, τον διαιθυλαιθέρα και την ακετόνη |
| Εμφάνιση | λευκό ή υποκίτρινο κρυσταλλικό στερεό |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Το χλωριούχο βισμούθιο (γνωστό και ως «βούτυρο του βισμουθίου») είναι ανόργανη χημική ένωση, άλας του βισμουθίου με χημικό τύπο BiCl3. Αποτελεί συνηθισμένη πηγή του ιόντος Bi3+. Στον κρύσταλλό του, αλλά και ως αέριο, το μόριό του υιοθετεί μια πυραμιδική δομή, σε συμφωνία με τη θεωρία VSEPR.
Παρασκευή
[Επεξεργασία | επεξεργασία κώδικα]Το χλωριούχο βισμούθιο μπορεί να παρασκευασθεί με απευθείας σύνθεση, περνώντας αέριο χλώριο πάνω από βισμούθιο:
- 2 Bi + 3 Cl2 → 2 BiCl3
Επίσης, διαλύοντας βισμούθιο σε «βασιλικό νερό», εξατμίζοντας το διάλυμα για να πάρουμε BiCl3·2H2O, το οποίο μπορεί να αποσταχθεί για να σχηματίσει το άνυδρο BiCl3.[1]
Μπορεί επίσης να παρασκευασθεί προσθέτοντας υδροχλωρικό οξύ σε τριοξείδιο του βισμουθίου και εξατμίζοντας το διάλυμα:
- Bi2O3 + 6 HCl → 2 BiCl3 + 3 H2O
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Στην αέρια φάση το μόριο του BiCl3 έχει σχήμα πυραμίδας με γωνία Cl-Bi-Cl ίση με 97,5 μοίρες και μήκος δεσμού 242 pm.[2] Στη στερεά κατάσταση το κάθε άτομο Bi έχει τρεις εγγύτατους γείτονες σε απόσταση 250 pm, δύο σε 324 pm και τρία σε μέση απόσταση 336 pm[3] Αυτή η δομή είναι παρόμοια με εκείνη του AsCl3, του AsBr3, του SbCl3 και του SbBr3.
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το χλωριούχο βισμούθιο υδρολύεται εύκολα σε οξυχλωριούχο βισμούθιο (BiOCl)[4]:
- Bi3+ + Cl− + H2O → BiOCl (s) + 2 H+
Αυτή η αντίδραση μπορεί να αναστραφεί προσθέτοντας ένα οξύ, όπως το υδροχλωρικό.[5]
Η αντίδραση του στερεού BiCl3 με υδρατμούς σε θερμοκρασίες κάτω των 50 °C παράγει μονοένυδρο χλωριούχο βισμούθιο, BiCl3.H2O.[6]
Το χλωριούχο βισμούθιο είναι οξειδωτικός παράγοντας, αναγόμενος εύκολα σε μεταλλικό βισμούθιο από αναγωγικούς παράγοντες.
Οξύ κατά Lewis
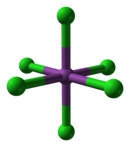
[Επεξεργασία | επεξεργασία κώδικα]Σε αντίθεση με την αναμενόμενη συμμόρφωση με τον χαρακτήρα από τον περιοδικό πίνακα, το BiCl3 είναι οξύ κατά Lewis, σχηματίζοντας ποικιλία κρυσταλλικών μορφωμάτων, όπως το [BiCl6]3− , κάτι που παραβιάζει ισχυρά τον κανόνα συμπλήρωσης της στιβάδας σθένους. Επιπλέον, η οκταεδρική δομή αυτής της κρυσταλλικής μονάδας δεν ακολουθεί τις προβλέψεις της θεωρίας VSEPR, καθώς το μοναχικό ζεύγος στο βισμούθιο είναι απροσδόκητα στερεοχημικώς αδρανές. Το διανιονικό σύμπλεγμα [BiCl5]2− ωστόσο, υιοθετεί την αναμενόμενη δομή τετραγωνικής πυραμίδας.[7]
 |
 |
 |
Οργανική κατάλυση
[Επεξεργασία | επεξεργασία κώδικα]Το χλωριούχο βισμούθιο χρησιμεύει ως καταλύτης στην οργανική σύνθεση. Ειδικότερα, καταλύει την αντίδραση Michael και την αντίδραση Mukaiyama-αλδόλης. Η προσθήκη ιωδιούχων αλάτων άλλων μετάλλων αυξάνει την καταλυτική του δράση.[8]
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Το χλωριούχο βισμούθιο είναι τοξικό. Προκαλεί ερεθισμό στο γαστρεντερικό και στο αναπνευστικό σύστημα. Η παρατεταμένη επαφή του με το δέρμα προκαλεί εγκαύματα.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Godfrey, S.M.· McAuliffe, C.A.· Mackie, A.G.· Pritchard, R.G. (1998). Nicholas C. Norman, επιμ. Chemistry of arsenic, antimony, and bismuth. Springer. σελ. 90. ISBN 0-7514-0389-X.
- ↑ Töke, Orsolya, & Magdolna Hargittai: «Molecular structure of bismuth trichloride from combined electron diffraction and vibrational spectroscopic study», Structural Chemistry 6.2 (1995), σσ. 127-130.
- ↑ Wells A.F. (1984): Structural Inorganic Chemistry, 5η έκδ., σσ. 879-884, Oxford Science Publications, ISBN 0-19-855370-6
- ↑ Joel Henry Hildebrand (2008). Principles of Chemistry. BiblioBazaar, LLC. σελ. 191. ISBN 0-559-31877-4.
- ↑ Frank Welcher (2008). Chemical Solutions. READ BOOKS. σελ. 48. ISBN 1-4437-2907-8.
- ↑ Wosylus, Aron; Hoffmann, Stefan; Schmidt, Marcus; Ruck, Michael (2010). «In-situ Study of the Solid-Gas Reaction of BiCl3 to BiOCl via the Intermediate Hydrate BiCl3·H2O». European Journal of Inorganic Chemistry 2010 (10): 1469–1471. doi:. ISSN 1434-1948.
- ↑ Holleman, A.F. και Wiberg, E.: Inorganic Chemistry, Academic Press, San Diego 2001, ISBN 0-12-352651-5.
- ↑ Hitomi Suzuki· Yoshihiro Matano (2001). Organobismuth chemistry. Elsevier. σελίδες 403–404. ISBN 0-444-20528-4.
