Ανακρυστάλλωση (χημεία)
Στη χημεία, η ανακρυστάλλωση (recrystallization) είναι μια τεχνική που χρησιμοποιείται για τον καθαρισμό χημικών ουσιών. Διαλύοντας ένα μείγμα μιας ένωσης και ακαθαρσιών σε έναν κατάλληλο διαλύτη, η επιθυμητή ένωση ή ακαθαρσίες μπορούν να αφαιρεθούν από το διάλυμα, αφήνοντας την άλλη πίσω. Το όνομα προέρχεται από το κρύσταλλο που σχηματίζεται συχνά όταν η ένωση κατακρημνίζεται. Εναλλακτικά, η «ανακρυστάλλωση» μπορεί να αναφέρεται στη φυσική ανάπτυξη μεγαλύτερων κρυστάλλων πάγου σε βάρος μικρότερων.
Χημεία
[Επεξεργασία | επεξεργασία κώδικα]Στην χημεία, η ανακρυστάλλωση [1](pp127-132) είναι μια διαδικασία για τον καθαρισμό ενώσεων. Η πιο χαρακτηριστική κατάσταση είναι ότι μια επιθυμητή «ένωση Α» μολύνεται από μια μικρή ποσότητα «ακαθαρσίας Β». Υπάρχουν διάφορες πιθανές μέθοδοι καθαρισμού (δείτε Μέθοδοι διαχωρισμού μιγμάτων), με μία από αυτές να είναι η ανακρυστάλλωση. Υπάρχουν επίσης διάφορες τεχνικές ανακρυστάλλωσης που μπορούν να χρησιμοποιηθούν όπως:
Ανακρυστάλλωση με ένα διαλύτη
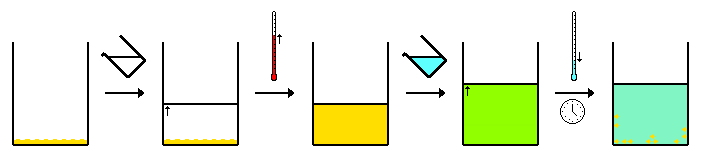
[Επεξεργασία | επεξεργασία κώδικα]Τυπικά, το μείγμα της «ένωσης Α» και της «ακαθαρσίας Β» διαλύεται στη μικρότερη ποσότητα θερμού διαλύτη για να διαλυθεί πλήρως το μείγμα, δημιουργώντας έτσι ένα κορεσμένο διάλυμα. Το διάλυμα στη συνέχεια αφήνεται να κρυώσει. Καθώς το διάλυμα ψύχεται, η διαλυτότητα των ενώσεων στο διάλυμα πέφτει. Αυτό έχει ως αποτέλεσμα την πτώση της επιθυμητής ένωσης (ανακρυστάλλωση) από το διάλυμα. Όσο πιο αργός είναι ο ρυθμός ψύξης, τόσο μεγαλύτεροι κρύσταλλοι σχηματίζονται.


Σε μια ιδανική κατάσταση το προϊόν διαλυτότητας της ακαθαρσίας, Β, δεν ξεπερνιέται σε καμία θερμοκρασία. Σε αυτή την περίπτωση, οι στερεοί κρύσταλλοι θα αποτελούνται από καθαρό Α και όλες οι ακαθαρσίες θα παραμείνουν στο διάλυμα. Οι στερεοί κρύσταλλοι συλλέγονται με διήθηση και το διήθημα απορρίπτεται. Εάν το προϊόν διαλυτότητας της ακαθαρσίας ξεπεραστεί, μερικές από τις προσμίξεις θα συγκαθιζάνουν. Ωστόσο, λόγω της σχετικά χαμηλής συγκέντρωσης της ακαθαρσίας, η συγκέντρωσή της στους καταβυθισμένους κρυστάλλους θα είναι μικρότερη από τη συγκέντρωσή της στο αρχικό στερεό. Η επαναλαμβανόμενη ανακρυστάλλωση θα έχει ως αποτέλεσμα ένα ακόμη πιο καθαρό κρυσταλλικό ίζημα. Η καθαρότητα ελέγχεται μετά από κάθε ανακρυστάλλωση με μέτρηση του σημείου τήξης, καθώς οι ακαθαρσίες μειώνουν το σημείο τήξης. Η φασματοσκοπία NMR μπορεί επίσης να χρησιμοποιηθεί για τον έλεγχο του επιπέδου της ακαθαρσίας. Η επαναλαμβανόμενη ανακρυστάλλωση έχει ως αποτέλεσμα κάποια απώλεια υλικού λόγω της μη μηδενικής διαλυτότητας της ένωσης Α. Η διαδικασία κρυστάλλωσης απαιτεί ένα στάδιο έναρξης, όπως η προσθήκη ενός "σπόρου" κρυστάλλου. Στο εργαστήριο, ένα μικροσκοπικό θραύσμα γυαλιού, που παράγεται με το ξύσιμο της πλευράς του γυάλινου δοχείου ανακρυστάλλωσης, μπορεί να παρέχει τον πυρήνα στον οποίο μπορούν να αναπτυχθούν οι κρύσταλλοι. Η επιτυχής ανακρυστάλλωση εξαρτάται από την εύρεση του σωστού διαλύτη. Αυτός είναι συνήθως ένας συνδυασμός πρόβλεψης/εμπειρίας και δοκιμής/λάθους. Οι ενώσεις πρέπει να είναι πιο διαλυτές σε υψηλότερες θερμοκρασίες παρά σε χαμηλότερες θερμοκρασίες. Οποιαδήποτε αδιάλυτη ακαθαρσία αφαιρείται με την τεχνική της θερμής διήθησης.
Ανακρυστάλλωση με πολλαπλούς διαλύτες
[Επεξεργασία | επεξεργασία κώδικα]Αυτή η μέθοδος είναι ίδια με την παραπάνω, αλλά χρησιμοποιούνται δύο (ή περισσότεροι) διαλύτες.[1] Αυτό βασίζεται στο ότι τόσο η "ένωση Α" και η "ακαθαρσία Β" είναι διαλυτές σε έναν πρώτο διαλύτη. Ένας δεύτερος διαλύτης προστίθεται αργά. Είτε η "ένωση Α" είτε η "ακαθαρσία Β" θα είναι αδιάλυτες σε αυτόν τον διαλύτη και θα κατακρημνιστεί, ενώ η άλλη της "ένωσης Α"/"ακαθαρσίας Β" θα παραμείνει σε διάλυμα. Έτσι η αναλογία του πρώτου και του δεύτερου διαλύτη είναι κρίσιμη. Τυπικά ο δεύτερος διαλύτης προστίθεται αργά έως ότου μια από τις ενώσεις αρχίσει να κρυσταλλώνεται από το διάλυμα και στη συνέχεια το διάλυμα ψύχεται. Η θέρμανση δεν απαιτείται για αυτήν την τεχνική, αλλά μπορεί να χρησιμοποιηθεί.
Το αντίστροφο αυτής της μεθόδου μπορεί να χρησιμοποιηθεί όταν ένα μείγμα διαλυτών διαλύει τόσο τον Α όσο και τον Β. Ένας από τους διαλύτες απομακρύνεται στη συνέχεια με απόσταξη ή με εφαρμογή κενού. Αυτό έχει ως αποτέλεσμα μια αλλαγή στις αναλογίες του διαλύτη που προκαλεί την κατακρήμνιση είτε της "ένωσης Α" είτε της "ακαθαρσίας Β".

Θερμή διήθηση-ανακρυστάλλωση
[Επεξεργασία | επεξεργασία κώδικα]Η θερμή διήθηση [1](p74) μπορεί να χρησιμοποιηθεί για τον διαχωρισμό της «ένωσης Α» τόσο από την «ακαθαρσία Β» όσο και από κάποια «αδιάλυτη ουσία Γ». Αυτή η τεχνική χρησιμοποιεί συνήθως ένα σύστημα ενός διαλύτη όπως περιγράφεται παραπάνω. Όταν τόσο η «ένωση Α» όσο και η «προσμίξη Β» διαλύονται στην ελάχιστη ποσότητα θερμού διαλύτη, το διάλυμα διηθείται για να απομακρυνθεί η «αδιάλυτη ουσία C». Αυτή η ουσία μπορεί να είναι οτιδήποτε από μια τρίτη ένωση ακαθαρσιών έως θραύσματα σπασμένου γυαλιού. Για μια επιτυχημένη διαδικασία, πρέπει να διασφαλιστεί ότι η συσκευή διήθησης είναι ζεστή για να σταματήσει η κρυστάλλωση των διαλυμένων ενώσεων από το διάλυμα κατά τη διάρκεια της διήθησης, σχηματίζοντας έτσι κρυστάλλους στο διηθητικό χαρτί ή στο χωνί. Ένας τρόπος για να επιτευχθεί αυτό είναι να θερμανθεί μια κωνική φιάλη που περιέχει μια μικρή ποσότητα καθαρού διαλύτη σε μια θερμή πλάκα. Μια διηθητική χοάνη στηρίζεται στο στόμιο και οι θερμοί ατμοί του διαλύτη κρατούν το στέλεχος ζεστό. Μπορούν επίσης να χρησιμοποιηθούν χοάνες φίλτρου με μανδύα. Το διηθητικό χαρτί είναι κατά προτίμηση αυλακωμένο, αντί να διπλώνεται σε ένα τέταρτο. Αυτό επιτρέπει ταχύτερη διήθηση, επομένως λιγότερες ευκαιρίες για την επιθυμητή ένωση να κρυώσει και να κρυσταλλωθεί από το διάλυμα. Συχνά, είναι πιο απλό να γίνει η διήθηση και η ανακρυστάλλωση ως δύο ανεξάρτητα και ξεχωριστά βήματα. Δηλαδή, διαλύεται η «ένωση Α» και η «ακαθαρσία Β» σε κατάλληλο διαλύτη σε θερμοκρασία δωματίου, διηθείται (για να αφαιρεθεί η αδιάλυτη ένωση/γυαλί), αφαιρείται ο διαλύτης και στη συνέχεια ανακρυσταλλώνεται χρησιμοποιώντας οποιαδήποτε από τις μεθόδους που αναφέρονται παραπάνω.

Σπορά
[Επεξεργασία | επεξεργασία κώδικα]Η κρυστάλλωση απαιτεί ένα βήμα εκκίνησης. Αυτό μπορεί να είναι αυθόρμητο ή μπορεί να γίνει με την προσθήκη μικρής ποσότητας της καθαρής ένωσης (ένας σπόρος κρυστάλλου)[1] στο κορεσμένο διάλυμα ή μπορεί να γίνει απλά ξύνοντας τη γυάλινη επιφάνεια για να δημιουργηθεί μια επιφάνεια σποράς για την κρυσταλλική ανάπτυξη. Θεωρείται ότι ακόμη και τα σωματίδια σκόνης μπορούν να λειτουργήσουν ως απλοί σπόροι.
Απλοί τέλειοι κρύσταλλοι (για ανάλυση ακτίνων Χ)
[Επεξεργασία | επεξεργασία κώδικα]Η ανάπτυξη κρυστάλλων για κρυσταλλογραφία ακτίνων Χ μπορεί να είναι δύσκολη. Για ανάλυση ακτίνων Χ, απαιτούνται απλοί τέλειοι κρύσταλλοι. Συνήθως χρησιμοποιείται μια μικρή ποσότητα (5–100 mg) μιας καθαρής ένωσης και οι κρύσταλλοι αφήνονται να αναπτυχθούν πολύ αργά. Διάφορες τεχνικές μπορούν να χρησιμοποιηθούν για την ανάπτυξη αυτών των τέλειων κρυστάλλων:
- Αργή εξάτμιση ενός μόνο διαλύτη - τυπικά η ένωση διαλύεται σε κατάλληλο διαλύτη και ο διαλύτης αφήνεται να εξατμιστεί αργά. Όταν το διάλυμα γίνει κορεσμένο, μπορούν να σχηματιστούν κρύσταλλοι.

- Αργή εξάτμιση ενός συστήματος πολλαπλών διαλυτών - το ίδιο όπως παραπάνω, ωστόσο καθώς η σύνθεση του διαλύτη αλλάζει λόγω της εξάτμισης του πιο πτητικού διαλύτη. Η ένωση είναι πιο διαλυτή στον πτητικό διαλύτη, και έτσι η ένωση γίνεται όλο και πιο αδιάλυτη στο διάλυμα και κρυσταλλώνεται.

- Αργή διάχυση - παρόμοια με τα παραπάνω. Ωστόσο, ένας δεύτερος διαλύτης αφήνεται να εξατμιστεί από ένα δοχείο σε ένα δοχείο που περιέχει το διάλυμα της ένωσης (διάχυση αερίου). Καθώς η σύνθεση του διαλύτη αλλάζει λόγω της αύξησης του διαλύτη που έχει διαχεόμενο αέριο στο διάλυμα, η ένωση γίνεται όλο και πιο αδιάλυτη στο διάλυμα και κρυσταλλώνεται.
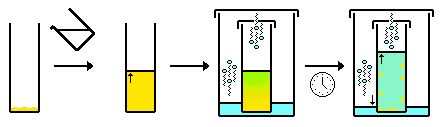
- Διεπαφή/αργή ανάμειξη (συχνά εκτελείται σε σωλήνα NMR). Παρόμοια με τα παραπάνω, αλλά αντί να διαχέεται ένας αέριος διαλύτης σε έναν άλλο, οι δύο διαλύτες αναμιγνύονται (διαχέονται) με διάχυση υγρού-υγρού. Τυπικά ένας δεύτερος διαλύτης "στρώνεται" προσεκτικά πάνω από το διάλυμα που περιέχει την ένωση. Με την πάροδο του χρόνου τα δύο διαλύματα αναμειγνύονται. Καθώς η σύνθεση του διαλύτη αλλάζει λόγω της διάχυσης, η ένωση γίνεται όλο και πιο αδιάλυτη στο διάλυμα και κρυσταλλώνεται, συνήθως στη διεπιφάνεια. Επιπλέον, είναι προτιμότερο να χρησιμοποιείτε ένας πιο πυκνός διαλύτη ως το κάτω στρώμα και/ή ένας πιο ζεστός διαλύτης ως το ανώτερο στρώμα επειδή αυτό έχει ως αποτέλεσμα την πιο αργή ανάμειξη των διαλυτών.

- Ο εξειδικευμένος εξοπλισμός μπορεί να χρησιμοποιηθεί σε σχήμα "Η" για την εκτέλεση των παραπάνω, όπου μία από τις κάθετες γραμμές του "Η" είναι ένας σωλήνας που περιέχει ένα διάλυμα της ένωσης και η άλλη κάθετη γραμμή του "Η" είναι ένας σωλήνας που περιέχει έναν διαλύτη στον οποίο η ένωση δεν είναι διαλυτή, και η οριζόντια γραμμή του "Η" είναι ένας σωλήνας που ενώνει τους δύο κατακόρυφους σωλήνες, ο οποίος έχει επίσης ένα λεπτό συντηγμένο γυαλί που περιορίζει την ανάμειξη των δύο διαλυτών.

- Μόλις ληφθούν μεμονωμένοι τέλειοι κρύσταλλοι, συνιστάται οι κρύσταλλοι να φυλάσσονται σε σφραγισμένο δοχείο με λίγο από το υγρό κρυστάλλωσης για να αποφευχθεί η «ξήρανση» του κρυστάλλου. Οι απλοί τέλειοι κρύσταλλοι μπορεί να περιέχουν διαλύτη κρυστάλλωσης στο κρυσταλλικό πλέγμα. Η απώλεια αυτού του εσωτερικού διαλύτη από τους κρυστάλλους μπορεί να έχει ως αποτέλεσμα τη διάσπαση του κρυσταλλικού πλέγματος και τη μετατροπή των κρυστάλλων σε σκόνη.
Πάγος
[Επεξεργασία | επεξεργασία κώδικα]Για τον πάγο, η ανακρυστάλλωση αναφέρεται στην ανάπτυξη μεγαλύτερων κρυστάλλων σε βάρος μικρότερων. Ορισμένες βιολογικές αντιπηκτικές πρωτεΐνες έχουν αποδειχθεί ότι αναστέλλουν αυτή τη διαδικασία και το αποτέλεσμα μπορεί να είναι σχετικό σε οργανισμούς που αντέχουν στον παγετό.[2]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 1,3 Πρότυπο:Cite q
- ↑ Kumar Verma, Ashok (2014). «Recrystallization of Ice». Encyclopedia of Snow, Ice and Glaciers. Encyclopedia of Earth Sciences Series. σελ. 932. doi:10.1007/978-90-481-2642-2_439. ISBN 978-90-481-2641-5.
Βιβλία παραπομπής
[Επεξεργασία | επεξεργασία κώδικα]- Laurence M. Harwood· Christopher J. Moody· Jonathan M. Percy (1999). Experimental organic chemistry: standard and microscaling. Wiley. ISBN 9780632048199.
- John Leonard· B. Lygo· Garry Procter (2 Ιουνίου 1994). Advanced practical organic chemistry. CRC Press. ISBN 9780748740710.
