Υδρομεταλλουργία: Διαφορά μεταξύ των αναθεωρήσεων
μ προσθήκη παραπομπής με διδακτορική διατριβή με αντικείμενο την βιοεκχύλιση σε αναδευόμενες συσκευές |
μ προσθήκη συνδέσμου από την πύλη για τον ελληνικό ορυκτό πλούτο (www.oryktosploutos.net) με αντικείμενο την υδρομεταλλουργία |
||
| Γραμμή 85: | Γραμμή 85: | ||
*[http://www.sciencedirect.com/science/journal/0304386X ''Hydrometallurgy''], διεθνές επιστημονικό περιοδικό {{en}} |
*[http://www.sciencedirect.com/science/journal/0304386X ''Hydrometallurgy''], διεθνές επιστημονικό περιοδικό {{en}} |
||
* [http://www.metal.ntua.gr/uploads/1418/HYDROMETALLURGY_BOOK.pdf Ειδικά Θέματα Υδρομεταλλουργίας]. |
* [http://www.metal.ntua.gr/uploads/1418/HYDROMETALLURGY_BOOK.pdf Ειδικά Θέματα Υδρομεταλλουργίας]. |
||
* [http://www.oryktosploutos.net/2010/01/blog-post.html Υδρομεταλλουργία: το μέλλον της Μεταλλουργίας;] |
|||
* |
|||
===<nowiki/>=== |
===<nowiki/>=== |
||
Έκδοση από την 20:39, 21 Νοεμβρίου 2014

Η υδρομεταλλουργία είναι ο κλάδος της εξαγωγικής μεταλλουργίας που ασχολείται με την παραγωγή (εξαγωγή) μετάλλων, κραμάτων ή καθαρών χημικών ενώσεων μεταλλικών στοιχείων από ορυκτά ή άλλες πρώτες ύλες, με την χρήση υδατικών διαλυμάτων σε σχετικά χαμηλές θερμοκρασίες. Το μέταλλο ή κράμα ή χημική ένωση συνήθως ανακτάται με ηλεκτρόλυση ή με κατακρήμνιση εντός του διαλύματος.
Υδρομεταλλουργικές διεργασίες χρησιμοποιούνται μόνον για την παραγωγή μη σιδηρούχων μετάλλων, όπως χαλκός, νικέλιο, κοβάλτιο, μόλυβδος, χρυσός, άργυρος, κ.ά. Σε μερικές περιπτώσεις υδρομεταλλουργικές διεργασίες χρησιμοποιούνται σε συνδυασμό με πυρομεταλλουργικές, όπως συμβαίνει στην περίπτωση του αλουμινίου ή του ψευδαργύρου.
Η πρώτη εφαρμογή της υδρομεταλλουργίας σε βιομηχανική κλίμακα πραγματοποιήθηκε στα μέσα του 18ου αι. στην Ισπανία, για την εκμετάλλευση μεταλλευμάτων χαλκού κοντά στον ποταμό Ρίο Τίντο («Κόκκινος Ποταμός»). Ήδη από την εποχή της Αναγέννησης, οι μεταλλωρύχοι του Ρίο Τίντο είχαν παρατηρήσει ότι όταν άφηναν τα θειούχα χαλκομεταλλεύματα που εξορύσσαν στην περιοχή για καιρό εκτιθέμενα στον αέρα, τότε από τα νερά της βροχής δημιουργούνταν κοντά στους σωρούς των χαλκομεταλλευμάτων «βιτριόλι», δηλ. ένα υδατικό διάλυμα θειικού οξέος (H2SO4), δισθενούς θειικού σιδήρου (FeSO4) και θειικού χαλκού (CuSO4). Στα 1752, οι ισπανοί μεταλλωρύχοι άρχισαν να παράγουν συστηματικά μεταλλικό χαλκό από το «βιτριόλι» με την προσθήκη μεταλλικού σιδήρου[1]:
Fe°(s) + CuSO4(aq) → Cu°(s) + FeSO4(aq).
Η υδρομεταλλουργία πήρε τον χαρακτήρα επιστήμης προς τα τέλη του 19ου αι., όταν σημειώθηκαν σημαντικές πρόοδοι στην ανόργανης υδατική χημεία. Η κατεργασία μεταλλευμάτων χρυσού με κυανιούχα διαλύματα για την εξαγωγή του πολύτιμου μετάλλου άρχισε το 1887. Την ίδια χρονιά, ο αυστριακός Karl Bayer ανακάλυψε την ομώνυμη μέθοδο για την εκχύλιση βωξίτη σε διαλύματα καυστικού νατρίου (NaOH).
Οι υδρομεταλλουργικές κατεργασίες περιλαμβάνουν
- την εκχύλιση (διαλυτοποίηση των ορυκτών με οικονομικό ενδιαφέρον),
- τον καθαρισμό του διαλύματος που προκύπτει από την εκχύλιση, και
- την ανάκτηση του μετάλλου στην μορφή καθαρού στοιχείου ή καθαρού άλατος.
Βασικές αρχές
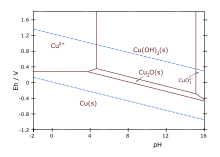
Τα μέταλλα, όπως και όλα τα στοιχεία, είναι διαλυτά ως ιόντα σε υδατικά διαλύματα. Η υδρομεταλλουργία, λοιπόν, είναι ο κλάδος της εξαγωγικής μεταλλουργίας που χρησιμοποιεί υδατικά διαλύματα προκειμένου να επιτύχει την εξαγωγή μετάλλων από ορυκτές πρώτες ύλες και την ανάκτηση αυτών των μετάλλων[2].
Οι συνθήκες της εκχύλισης εξαρτώνται από την οξύτητα (pH) και το οξειδοαναγωγικό δυναμικό (Eh) του διαλύματος, καθώς και από την παρουσία συμπλοκοποιητών (ιόντων με ισχυρή ικανότητα δημιουργίας συμπλόκων). Με βάση τα θερμοδυναμικά διαγράμματα Pourbaix (Πουρμπαί) ή διαγράμματα επικρατούντος ιόντος, ο υδρομεταλλουργός επιλέγει τις πλέον κατάλληλες συνθήκες προκειμένου να επιτύχει την διαλυτοποίηση ενός ορυκτού. Με βάση τα ίδια διαγράμματα, γίνεται και η επιλογή των συνθηκών για την ανάκτηση ενός μετάλλου.
Υδρομεταλλουργικές διεργασίες
Εκχύλιση
Η εκχύλιση γίνεται συνήθως σε δεξαμενές που μπορεί να είναι αναδευόμενες ή μη αναδευόμενες. Οι αναδευόμενες δεξαμενές είναι κυλινδρικές και η ανάδευση γίνεται μηχανικά ή με την εμφύσηση αέρα (δεξαμενές Pachuca). Οι μη αναδευόμενες δεξαμενές χρησιμοποιούνταν στο παρελθόν για την εκχύλιση οξειδωμένων μεταλλευμάτων χαλκού, αλλά σήμερα δεν χρησιμοποιούνται πλέον.
Η εκχύλιση υπό πίεση γίνεται σε αυτόκλειστα με ή χωρίς την εμφύσηση αερίων. Τα αυτόκλειστα μπορεί να είναι οριζόντια, όπως συμβαίνει στην οξειδωτική εκχύλιση σφαλερίτη (ZnS), ή κατακόρυφα, όπως συμβαίνει στην εκχύλιση βωξίτη.
Μία άλλη πολύ διαδεδομένη τεχνική εκχύλισης είναι η εκχύλιση σε σωρούς (αγγλ., heap leaching). Το μετάλλευμα προς εκχύλιση συγκεντρώνεται σε σωρούς. Κάτω από τους σωρούς τοποθετείται αδιαπέρατη γεωμεμβράνη. Οι σωροί καταβρέχονται με διάλυμα οξέος και το μεταλλοφόρο διάλυμα συγκεντρώνεται στην απορροή των σωρών. Η εκχύλιση σε σωρούς χρησιμοποιείται πολύ για την παραγωγή χρυσού, χαλκού και ουρανίου από φτωχά αλλά μεγάλα σε όγκο κοιτάσματα[3].
Παρεμφερής είναι και η επιτόπια εκχύλιση (αγγλ., in-situ leaching), μόνον που το μετάλλευμα δεν εξορύσσεται. Στην επιτόπια εκχύλιση, διάλυμα οξέος διοχετεύεται στον όγκο του κοιτάσματος μέσω φρεάτων με αντλίες υψηλής πίεσης, και συγκεντρώνεται ή αντλείται φορτωμένο με μέταλλο από κάποιο άλλο σημείο του κοιτάσματος. Το κοίτασμα πρέπει να είναι σχετικώς πορώδες και τα υποκείμενα πετρώματα να είναι πρακτικώς αδιαπέρατα. Η τεχνική της επιτόπιας εκχύλισης εφαρμόζεται εκτενώς στην εξόρυξη ουρανίου[4].

Η τεχνική της εκχύλισης σε σωρούς συνδυάζεται και μην χρήση βακτηρίων που οξειδώνουν τον δισθενή σίδηρο ή το θείο και έτσι επιταχύνεται η εκχύλιση. Η τεχνική της βιοεκχύλισης σε σωρούς χρησιμοποιείται στην εξαγωγή χαλκού[5], χρυσού και ουρανίου. Η βιοεκχύλιση γίνεται επίσης και σε αναδευόμενες δεξαμενές[6].
Καθαρισμός του μεταλλοφόρου διαλύματος
Ο καθαρισμός του μεταλλοφόρου διαλύματος από άλλες διαλυμένες ακαθαρσίες γίνεται με αντιδράσεις κατακρήμνισης, εξουδετέρωσης ή απλής αντικατάστασης. Για παράδειγμα, ο καθαρισμός διαλύματος θειικού ψευδαργύρου από τον περιεχόμενο τρισθενή θειικό σίδηρο (Fe2(SO4)3)γίνεται με την κατακρήμνιση ζαροσίτη ((NH4)Fe3(SO4)2(OH)6):
3Fe2(SO4)3(aq) + 12NH3(aq) + 12H2O → 2(NH4)Fe3(SO4)2(OH)6(s) + 5(NH4)2SO4(aq).
Στην συνέχεια, το διάλυμα θειικού ψευδαργύρου καθαρίζεται από τον περιεχόμενο θειικό χαλκό με την προσθήκη σκόνης μεταλλικού ψευδαργύρου που προκαλεί την αντίδραση αντικατάστασης:
Zn°(s) + CuSO4(aq) → ZnSO4(aq) + Cu°(s).
Μία άλλη πιο σύγχρονη τεχνική καθαρισμού του μεταλλοφόρου διαλύματος είναι με την χρήση οργανικών διαλυτών γνωστή ως εξαγωγή με οργανικό διαλύτη. Το μεταλλοφόρο διάλυμα έρχεται σε επαφή με μία οργανική φάση, η οποία περιέχει κάποιο οργανικό οξύ RH (ή άλλη οργανική ένωση) με μεγάλη ικανότητα δημιουργίας οργανομεταλλικών συμπλόκων και πολύ μικρή διαλυτότητα στο νερό. Το μέταλλο — έστω χαλκός — ενώνεται με τον οργανικό διαλύτη και περνάει στην οργανική φάση (φόρτιση):
CuSO4(aq) + 2RH(o) → R2Cu(o) + H2SO4(aq).
Κατόπιν η μεταλλοφόρος οργανική φάση έρχεται σε επαφή με ένα καθαρό υδατικό διάλυμα κατάλληλης οξύτητας, ώστε να αποδεσμευτεί το μέταλλο από την οργανική φάση και να μεταφερθεί στο καθαρό διάλυμα και να αναγεννηθεί ο οργανικός διαλύτης (αποφόρτιση).
R2Cu(o) + H2SO4(aq) → CuSO4(aq) + 2RH(o).
Παρομοίως επιτυγχάνεται ο καθαρισμός μεταλλοφόρων διαλυμάτων εκχύλισης με την χρήση ιοντεναλλακτικών ρητινών.
Ο καθαρισμός του μεταλλοφόρου διαλύματος με κατακρήμνιση των ακαθαρσιών γίνεται επίσης σε αναδευόμενες δεξαμενές, ενώ τα κατακρημνίσματα απομακρύνονται με πυκνωτές και διηθητήρες. Ειδικές μικρές ορθογώνιες δεξαμενές χρησιμοποιούνται για τον καθαρισμό με οργανικούς διαλύτες, ενώ για τον καθαρισμό με ιοντοεναλλακτικές ρητίνες χρησιμοποιούνται κλειστές δεξαμενές με το διάλυμα να διέρχεται μέσα από στρώμα ρητίνης.
Ανάκτηση του μετάλλου

Η τελική ανάκτηση του μετάλλου γίνεται συνήθως με ηλεκτρόλυση, οπότε γίνεται λόγος για ηλεκτρολυτική ανάκτηση. Έτσι ανακτώνται π.χ. καθαρός χαλκός και καθαρός ψευδάργυρος από αντίστοιχα θειικά διαλύματα. Μέταλλα τα οποία δεν ανακτώνται με ηλεκτρόλυση υδατικών διαλυμάτων, ανακτώνται με ηλεκτρόλυση τηγμάτων. Το αλουμίνιο παράγεται με ηλεκτρόλυση ευτηκτικού τήγματος κρυολίθου (Na3AlF6) – αλουμίνας (Al2O3). Το μαγνήσιο παράγεται με ηλεκτρόλυση τήγματος χλωριούχου μαγνησίου (MgCl2). Η ηλεκτρόλυση χρησιμοποιείται και για τον καθαρισμό ακάθαρτων μετάλλων, όπως αργό χαλκό (άνοδοι), αργό χρυσό (bullion), κ.ά. Στην περίπτωση αυτή, γίνεται λόγος για ηλεκτρολυτικό καθαρισμό.
Η ηλεκτρόλυση γίνεται σε μεγάλα ηλεκτρολυτικά κελιά που έχουν πολλές μεταλλικές πλάκες για ανόδους και καθόδους. Για παράδειγμα, η ηλεκτρολυτική ανάκτηση ψευδαργύρου από θειικά διαλύματα γίνεται με ανόδους μολύβδου και καθόδους αλουμινίου. Ο ηλεκτρολυτικός καθαρισμός αργού χαλκού γίνεται με καθόδους λεπτά φύλλα καθαρού χαλκού και ανόδους φτιαγμένες από τον ίδιο τον αργό χαλκό.
Ορισμένα μέταλλα ανακτώνται ως καθαρές χημικές ενώσεις. Π.χ., καθαρό θειούχο νικέλιο (NiS) παράγεται με την εμφύσηση υδροθείου (H2S) σε διαλύματα καθαρού θειικού νικελίου (NiSO4):
NiSO4(aq) + H2S(g) → NiS(s) + H2SO4(aq).
Βιβλιογραφία και άλλες σημειώσεις
- ↑ G. D. Van Arsdale, Hydrometallurgy of Base Metals, McGraw–Hill, New York, USA 1953.
- ↑ F. Habashi, Principles of Extractive Metallurgy, vol. 2, Hydrometallurgy. Gordon & Breach, New York, USA 1970.
- ↑ BioMineWiki, "Heap leaching", 24 August 2007.
- ↑ Australian Uranium Asociation, "In situ leach (ISL) mining of uranium.", Briefing Paper 40, October 2007.
- ↑ «Υδρομεταλλουργία και βιοεκχύλιση μεταλλευμάτων χαλκού: Σκουριώτισσα Κύπρου».
- ↑ «Διδακτορική διατριβή: ΒΙΟΕΚΧΥΛΙΣΗ ΟΞΕΙΔΩΜΕΝΩΝ ΜΕΤΑΛΛΕΥΜΑΤΩΝ ΝΙΚΕΛΙΟΥ ΜΕ ΤΗ ΧΡΗΣΗ ΕΤΕΡΟΤΡΟΦΩΝ ΜΙΚΡΟΟΡΓΑΝΙΣΜΩΝ».
Δείτε επίσης
Εξωτερικές συνδέσεις
- Εθνικό Μετσόβιο Πολυτεχνείο, Εργαστήριο Μεταλλουργίας.
- Society for Mining, Metallurgy and Exploration, USA (Αγγλικά).
- The Minerals, Metals and Materials Society, USA (Αγγλικά).
- Hydrometallurgy, διεθνές επιστημονικό περιοδικό (Αγγλικά)
- Ειδικά Θέματα Υδρομεταλλουργίας.
- Υδρομεταλλουργία: το μέλλον της Μεταλλουργίας;
