Ταυτομέρεια
Η ταυτομέρεια είναι μια μη ειδική περίπτωση ισομέρειας, κατά την οποία το μόριο μιας χημικής ένωσης βρίσκεται σε εκατομμύρια μορφές (ταυτομερείς μορφές ή ταυτομερή) που μετατρέπονται ταχύτατα η μία στην άλλη με μετακίνηση ενός ατόμου ή μιας χαρακτηριστικής ομάδας μεταξύ δύο θέσεων, και ταυτόχρονη ανταλλαγή της θέσης ενός διπλού και ενός γειτονικού απλού δεσμού.[1] Η συνηθέστερη περίπτωση ταυτομέρειας αφορά την μετακίνηση ενός πρωτονίου. Στην περίπτωση αυτή χρησιμοποιείται συχνά και ο πιο εξειδικευμένος όρος «πρωτοτροπία». Η γενική περίπτωση ταυτομέρειας μπορεί να αποδοθεί ως
A–X–Y=Z X=Y–Z–A
όπου το άτομο Α αλλάζει θέση σχηματίζοντας δεσμό είτε με το άτομο Χ είτε με το άτομο Ζ, ενώ ταυτόχρονα ο διπλός δεσμός μετατοπίζεται από μεταξύ των Υ και Ζ, στα Χ και Υ. Κύριο χαρακτηριστικό της ταυτομέρειας είναι ότι οι δύο μορφές αλληλομετατρέπονται τόσο γρήγορα και τόσο εύκολα ώστε κατά κανόνα είναι αδύνατη η απομόνωση μιας από τις δύο.
Είδη ταυτομέρειας
[Επεξεργασία | επεξεργασία κώδικα]Η ταυτομέρεια απαντάται κυρίως στην οργανική χημεία. Μερικά από τα συνηθέστερα ζεύγη ταυτομερών είναι τα ακόλουθα:[2][3]
Ταυτομέρεια κετο–ενόλης
[Επεξεργασία | επεξεργασία κώδικα]Από τις δύο ταυτομερείς μορφές η μία περιέχει μια ομάδα καρβονυλίου (κετόνη ή αλδεΰδη) με το πρωτόνιο που μετακινείται να βρίσκεται στο γειτονικό άτομο άνθρακα (H–C–C=O), και η άλλη μορφή είναι μια ενόλη, δηλαδή μια αλκοόλη με διπλό δεσμό στο άτομο άνθρακα που φιλοξενεί την υδροξυλομάδα (C=C–O–H). Για παράδειγμα, σε διάλυμα η ακετόνη βρίσκεται σε δύο ταχέως αλληλομετατρέψιμες μορφές, την κετονική (αριστερά) και την ενολική (δεξιά):
Το γεγονός ότι οι δύο μορφές συνυπάρχουν και μετατρέπονται η μία στην άλλη συνεχώς, δεν σημαίνει απαραίτητα ότι βρίσκονται και σε ίσες ποσότητες. Το ποσοστό της κάθε μορφής σε διάλυμα που βρίσκεται σε κατάσταση χημικής ισορροπίας εξαρτάται από τη φύση της ένωσης, τη θερμοκρασία, τον διαλύτη και την οξύτητα του διαλύματος (pH).
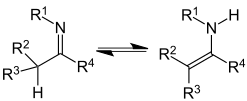
Ταυτομέρεια ιμίνης–εναμίνης
[Επεξεργασία | επεξεργασία κώδικα]Η ταυτομέρεια εδώ λαμβάνει χώρα μεταξύ μιας ιμίνης και της ισομερούς μορφής στην οποία ο διπλός δεσμός άνθρακα–αζώτου έχει μετατοπισθεί στο γειτονικό άτομο άνθρακα με ταυτόχρονη πρωτονίωση του αζώτου (H–C–C=N C=C–N–H). Η μορφή αυτή ονομάζεται εναμίνη.
Ταυτομέρεια αμιδίου–ιμιδίου
[Επεξεργασία | επεξεργασία κώδικα]Στην περίπτωση αυτή ένα πρωτόνιο μεταπηδά από το άτομο αζώτου στο καρβονύλιο της αμιδικής ομάδας ενός αμιδίου, μετατοπίζοντας τον διπλό δεσμό από τα άτομα C=Ο στα N=C (δηλαδή H–N–C=Ο N=C–O–H). Η ταυτομερής μορφή που προκύπτει ονομάζεται ιμίδιο.
Ταυτομέρεια λακτάμης–λακτίμης
[Επεξεργασία | επεξεργασία κώδικα]Μια παραλλαγή της ταυτομέρειας αμιδίου–ιμιδίου είναι η ταυτομέρεια μεταξύ ενός κυκλικού αμιδίου (λακτάμη) και της ιμιδικής του μορφής (λακτίμη), η οποία περιέχει ενδοκυκλικό διπλό δεσμό άνθρακα–αζώτου:
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ IUPAC Gold Book tautomerism
- ↑ J. McMurry (2005). Οργανική Χημεία. Πανεπιστημιακές Εκδόσεις Κρήτης.
- ↑ M. B. Smith, J. March (2007). March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 6η Έκδοση, Wiley.