Κανόνας Μαρκόβνικοφ
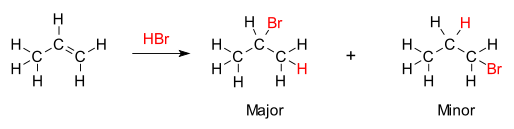
Στην οργανική χημεία, ο κανόνας του Μαρκόβνικοφ περιγράφει το αποτέλεσμα ορισμένων αντιδράσεων προσθήκης. Ο κανόνας διατυπώθηκε από τον Ρώσο χημικό Βλαδίμηρο Μαρκόβνικοφ το 1870.[1][2][3]
Εξήγηση
[Επεξεργασία | επεξεργασία κώδικα]Ο κανόνας δηλώνει ότι με την προσθήκη ενός πρωτικού οξέος HX ή άλλου πολικού αντιδραστηρίου σε ένα ασύμμετρο αλκένιο, το όξινο υδρογόνο (Η) ή το ηλεκτροθετικό τμήμα συνδέεται με τον άνθρακα με περισσότερους υποκαταστάτες υδρογόνου, και η ομάδα αλογονιδίου (Χ) ή το ηλεκτραρνητικό μέρος προσκολλάται στον άνθρακα με τους περισσότερους αλκυλικούς υποκαταστάτες. Αυτό έρχεται σε αντίθεση με τον αρχικό ορισμό του Markovnikov, στον οποίο αναφέρεται ο κανόνας ότι το συστατικό Χ προστίθεται στον άνθρακα με τα λιγότερα άτομα υδρογόνου, ενώ το άτομο υδρογόνου προστίθεται στον άνθρακα με τον μεγαλύτερο αριθμό ατόμων υδρογόνου.[4]

Το ίδιο ισχύει όταν ένα αλκένιο αντιδρά με νερό σε μια αντίδραση προσθήκης για να σχηματίσει μια αλκοόλη που περιλαμβάνει σχηματισμό καρβοκατιόντων. Το υδροξύλιο (ΟΗ) συνδέεται με τον άνθρακα που έχει τον μεγαλύτερο αριθμό δεσμών άνθρακα-άνθρακα, ενώ το υδρογόνο συνδέεται με τον άνθρακα στο άλλο άκρο του διπλού δεσμού, που έχει περισσότερους δεσμούς άνθρακα-υδρογόνου. Η χημική βάση για τον κανόνα του Markovnikov είναι ο σχηματισμός του πιο σταθερού καρβοκατιόντος κατά τη διαδικασία προσθήκης. Η προσθήκη του ιόντος υδρογόνου σε ένα άτομο άνθρακα στο αλκένιο δημιουργεί ένα θετικό φορτίο στο άλλο άνθρακα, σχηματίζοντας ένα ενδιάμεσο καρβοκατιόν. Όσο πιο υποκατεστημένο το καρβοκατιόν, τόσο πιο σταθερό είναι, λόγω του επαγωγικού φαινομένου και υπερσυζυγίας. Το κύριο προϊόν της αντίδρασης προσθήκης θα είναι αυτό που σχηματίζεται από το πιο σταθερό ενδιάμεσο. Επομένως, το κύριο προϊόν της προσθήκης ΗΧ (όπου το Χ είναι κάποιο άτομο πιο ηλεκτραρνητικό από το Η) σε ένα αλκένιο έχει το άτομο υδρογόνου στη λιγότερο υποκατεστημένη θέση και το Χ στην πιο υποκατεστημένη θέση. Αλλά το άλλο λιγότερο υποκατεστημένο, λιγότερο σταθερό καρβοκατιόν θα εξακολουθεί να σχηματίζεται σε κάποια συγκέντρωση και θα συνεχίσει να είναι το δευτερεύον προϊόν με την αντίθετη, συζυγή προσάρτηση του Χ.
Αντι-Μαρκόβνικοφ αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Ονομάζεται επίσης φαινόμενο Κάρας (Kharasch) (που πήρε το όνομά του από τον Morris S. Kharasch), αυτές οι αντιδράσεις που δεν περιλαμβάνουν ένα ενδιάμεσο καρβοκατιόν ενδέχεται να αντιδράσουν μέσω άλλων μηχανισμών που έχουν τοποεκλεκτικότητες (regioselectivities) που δεν υπαγορεύεται από τον κανόνα του Markovnikov, όπως η προσθήκη ελεύθερων ριζών. Τέτοιες αντιδράσεις λέγεται ότι είναι αντι-Μαρκόβνικοφ, αφού το αλογόνο προστίθεται στον λιγότερο υποκατεστημένο άνθρακα, το αντίθετο από μια αντίδραση Μαρκόβνικοφ. Ο κανόνας αντι-Μαρκόβνικοφ μπορεί να απεικονιστεί χρησιμοποιώντας την προσθήκη υδροβρωμίου σε ισοβουτυλένιο παρουσία υπεροξειδίου του βενζολίου ή υπεροξειδίου του υδρογόνου. Η αντίδραση του HBr με υποκατεστημένα αλκένια ήταν πρωτότυπη στη μελέτη των προσθηκών ελεύθερων ριζών. Οι πρώτοι χημικοί ανακάλυψαν ότι ο λόγος για τη μεταβλητότητα της αναλογίας του Μαρκόβνικοφ στα προϊόντα αντίδρασης αντιΜαρκόβνικοφ οφειλόταν στην απροσδόκητη παρουσία ουσιών ιονιζουσών ελεύθερων ριζών όπως τα υπεροξείδια. Η εξήγηση είναι ότι ο δεσμός Ο-Ο στα υπεροξείδια είναι σχετικά ασθενής. Με τη βοήθεια του φωτός, της θερμότητας ή μερικές φορές ακόμη και ενεργώντας από μόνος του, ο δεσμός O-O μπορεί να διασπαστεί για να σχηματίσει 2 ρίζες. Οι ομάδες ριζών μπορούν στη συνέχεια να αλληλεπιδράσουν με το HBr για να παράξουν μια ρίζα Br, η οποία στη συνέχεια αντιδρά με τον διπλό δεσμό. Δεδομένου ότι το άτομο βρωμίου είναι σχετικά μεγάλο, είναι πιο πιθανό να συναντήσει και να αντιδράσει με τον λιγότερο υποκατεστημένο άνθρακα, καθώς αυτή η αλληλεπίδραση παράγει λιγότερες στατικές αλληλεπιδράσεις μεταξύ του άνθρακα και της ρίζας βρωμίου. Επιπλέον, παρόμοια με ένα θετικά φορτισμένο είδος, το είδος της ρίζας είναι πιο σταθερό όταν το ασύζευκτο ηλεκτρόνιο βρίσκεται στην πιο υποκατεστημένη θέση. Το ριζικό ενδιάμεσο σταθεροποιείται με υπερσυζυγία. Στην πιο υποκατεστημένη θέση, περισσότεροι δεσμοί άνθρακα-υδρογόνου ευθυγραμμίζονται με το μοριακό τροχιακό της ρίζας με έλλειψη ηλεκτρονίων. Αυτό σημαίνει ότι υπάρχουν μεγαλύτερα φαινόμενα υπερσυζυγίας, οπότε αυτή η θέση είναι πιο ευνοϊκή.[5] Στην περίπτωση αυτή, ο τελικός άνθρακας είναι ένα αντιδραστήριο που παράγει ένα πρωτογενές προϊόν προσθήκης αντί για ένα δευτερεύον προϊόν προσθήκης.


Μια νέα μέθοδος προσθήκης αντι-Μαρκόβνικοφ έχει περιγραφεί από τους Hamilton και Nicewicz, οι οποίοι χρησιμοποίησαν αρωματικά μόρια και φωτεινή ενέργεια από μια δίοδο χαμηλής ενέργειας για να μετατρέψουν το αλκένιο σε ρίζα κατιόντων.[6][7] Η συμπεριφορά αντι-Μαρκόβνικοφ επεκτείνεται σε περισσότερες χημικές αντιδράσεις παρά σε προσθήκες σε αλκένια. Η συμπεριφορά αντι-Μαρκόβνικοφ παρατηρείται στην ενυδάτωση του φαινυλακετυλενίου με κατάλυση από τρισθενή χρυσό, η οποία δίνει ακετοφαινόνη. Με ειδικό καταλύτη ρουθηνίου[8] δίνει το άλλο ισομερές θέσης της 2-φαινυλακεταλδεΰδης:[9]

Η συμπεριφορά αντι-Μαρκόβνικοφ μπορεί επίσης να εκδηλωθεί αφ' εαυτής σε ορισμένες αντιδράσεις αναδιάταξης. Σε μια τυπική πυρηνόφιλη υποκατάσταση που καταλύεται από χλωριούχο τιτάνιο(IV) στο εναντιοκαθαρό 1 στο παρακάτω σχήμα, σχηματίζονται δύο προϊόντα - 2a και 2b Λόγω των δύο χειρόμορφων κέντρων στο μόριο στόχο, του άνθρακα που φέρει χλώριο και του άνθρακα που φέρει την μεθυλομάδα και ακετοξυαιθυλίου, πρέπει να σχηματιστούν τέσσερις διαφορετικές ενώσεις: 1R,2R- (σχεδιασμένη ως 2b) 1R,2S- 1S,2R- (σχεδιασμένη ως 2a) και 1S,2S- . Επομένως, και οι δύο απεικονιζόμενες δομές θα υπάρχουν σε μορφή D και L. :[10]

Αυτή η κατανομή προϊόντος μπορεί να εξορθολογιστεί υποθέτοντας ότι η απώλεια του υδροξυλίου στο 1 δίνει το τριτοταγές καρβοκατιόν Α, που αναδιατάσσεται στο φαινομενικά λιγότερο σταθερό δευτερεύον καρβοκατιόν Β. Το χλώριο μπορεί να προσεγγίσει αυτό το κέντρο από δύο όψεις που οδηγούν στο παρατηρούμενο μείγμα ισομερών. Ένα άλλο αξιοσημείωτο παράδειγμα προσθήκης αντι-Μαρκόβνικοφ είναι η υδροβορίωση (hydroboration).
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ W. Markownikoff (1870). «Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radical wasserstoffs in den isomeren Buttersäuren». Annalen der Chemie 153 (1): 228–259. doi:. https://zenodo.org/record/1427295.
- ↑ Hughes, Peter (2006). «Was Markovnikov's Rule an Inspired Guess?». Journal of Chemical Education 83 (8): 1152. doi:. Bibcode: 2006JChEd..83.1152H.
- ↑ Lewis, David E. (2021). «The Logic Behind Markovnikov's Rule: Was It an Inspired Guess? …No!». Angewandte Chemie International Edition 60 (9): 4412–4421. doi:.
- ↑ McMurry, John. «Section 7.8: Orientation of Electrophilic Reactions: Markovnikov's Rule». Organic Chemistry (8th έκδοση). σελ. 240. ISBN 9780840054548.
- ↑ Clayden, Jonathan (2012). Organic Chemistry. Oxford University Press. σελίδες 977, 985.
- ↑ Drahl, Carmen. «Light-Driven Reaction Modifies Double Bonds With Unconventional Selectivity – April 15, 2013 Issue – Vol. 91 Issue 15 – Chemical & Engineering News». cen.acs.org.
- ↑ Hamilton, David S.; Nicewicz, David A. (2012). «Direct Catalytic Anti-Markovnikov Hydroetherification of Alkenols». Journal of the American Chemical Society 134 (45): 18577–18580. doi:. PMID 23113557.
- ↑ catalyst system based on in-situ reaction of ruthenocene with Cp and naphthalene ligands and a second bulky pyridine ligand
- ↑ Labonne, Aurélie; Kribber, Thomas; Hintermann, Lukas (2006). «Highly Active in Situ Catalysts for Anti-Markovnikov Hydration of Terminal Alkynes». Organic Letters 8 (25): 5853–6. doi:. PMID 17134289.
- ↑ Nishizawa, Mugio; Asai, Yumiko; Imagawa, Hiroshi (2006). «TiCl4 Induced Anti-Markovnikov Rearrangement». Organic Letters 8 (25): 5793–6. doi:. PMID 17134274..
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- Markovnikov's rule and carbocations – Khan Academy. 25 Αυγούστου 2010.
