Οξειδοαναγωγικά σώματα
Οξειδωτικά σώματα (ή αλλιώς οξειδωτικά μέσα) είναι εκείνα που μπορούν να προκαλέσουν οξείδωση, δηλαδή τα σώματα που περιέχουν χημικά στοιχεία που μπορούν να αποσπάσουν ηλεκτρόνια από άλλα στοιχεία. Τα χημικά στοιχεία των οξειδωτικών σωμάτων παθαίνουν αναγωγή. Συνήθως λέμε ότι τα οξειδωτικά σώματα ανάγονται (παρόλο που δεν ανάγονται ή οξειδώνονται χημικές ενώσεις αλλά άτομα μέσα σ'αυτές). Επειδή το άτομο προσλαμβάνει ηλεκτρόνια, ελαττώνεται, αλγεβρικά, ο αριθμός οξείδωσής του.
Έτσι, π.χ. στην αντίδραση:
Ag+ + Fe2+ → Ag + Fe3+
Ο Ag+ χαρακτηρίζεται ως οξειδωτικό σώμα γιατί προκαλεί την οξείδωση του Fe2+ σε Fe3+ (αύξηση του αριθμού οξείδωσης από +2 σε +3) , ενώ ο ίδιος ανάγεται προς Ag (μείωση του αριθμού οξείδωσης από +1 σε 0).

Ένα οξειδωτικό σώμα είναι τόσο ισχυρότερο, όσο μεγαλύτερη τάση έχει για πρόσληψη ηλεκτρονίων.[1] Άρα τα περισσότερο ηλεκτραρνητικά στοιχεία είναι γενικά τα περισσότερο οξειδωτικά.
Τα οξειδωτικά σώματα περιέχουν κατά κανόνα, στοιχείο με σχετικά μεγάλο αριθμό οξείδωσης.
Σε μια ομάδα του περιοδικού πίνακα ο οξειδωτικός χαρακτήρας μειώνεται από πάνω προς τα κάτω, ενώ σε μιά περίοδο αυξάνεται από αριστερά προς τα δεξιά.
| Τα κυριώτερα οξειδωτικά μέσα | |||
| Στα αντιδρώντα | Στα προϊόντα | Ημιαντίδραση | |
|---|---|---|---|
| Αλογόνα (Χ2) | ΗΧ ή X- | Χ2 + 2e → 2Χ- | |
| Οξυγόνο (Ο2) | Οξείδια | Ο2 + 4e → 2O2- | |
| Όζον (Ο3) | Ο2 + Ο2- | O3 + 2 H+ + 2 e → O2 + H2O | |
| Υπεροξείδιο υδρογόνου (Η2Ο2)[2] | Η2Ο + Ο2- | H2O2 + 2 H+ + 2 e → 2 H2O | |
| Διοξείδιο του θείου (SO2)[2] | S | SO2 + 4H+ + 4e → S + 2H2O | |
| Οξείδιο αργύρου (Ag2O) | 2Ag | Ag2Ο + 2 H+ + 2 e → 2 Ag + H2O | |
| Οξείδιο υδραργύρου (HgO) | Hg | HgO + H2Ο + 2 e → Hg + 2 OH− | |
| Οξείδιο μαγγανίου (MnO2)[3] | Mn2+ | MnO2 + 4H+ + 2e → Mn2+ + 2H2O | |
| Οξείδιο μολύβδου (PbO2)[3] | Pb2+ | PbO2 + 4H+ + 2e → Pb2+ + 2H2O | |
| Πυκνό-θερμό θειικό οξύ[4] (H2SO4) | SO2 | SO42- + 4H+ + 2e → SO2 + H2O | |
| Αραιό νιτρικό οξύ (ΗΝΟ3)[5] | ΝΟ | ΝΟ3- + 4Η+ + 3e → NO + 2H2O | |
| Πυκνό νιτρικό οξύ (ΗΝΟ3)[6] | ΝΟ2 | ΝΟ3- + 2Η+ + e → NO2 + H2O | |
| Υπερμαγγανικό κάλιο (KMnO4)[7] | Mn2+ | MnO4- + 8H+ + 5e → Mn2+ +4 H2O | |
| Διχρωμικό κάλιο (K2Cr2O7)[8] | Cr3+ | Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O | |
| Υποχλωριώδη άλατα (π.χ. NaClO) | Cl- | ClO- + 2H+ + 2e → Cl- + H2O | |
| Χλωρικά άλατα (π.χ. NaClO3) | Cl- | ClO3- + 6H+ + 6e → Cl- + 3H2O | |
| Υπερχλωρικά άλατα (π.χ. NaClO4) | Cl- | ClO4- + 8H+ + 8e → Cl- + 4H2O | |
| Χλωράσβεστος (CaOCl2)[9] | Ca2+ + 2Cl- | CaOCl2 + 2H+ + 2e → Ca2+ + 2Cl- + H2O | |
| Άλατα Fe3+(π.χ. FeCl3) | Fe2+ | Fe3+ + e → Fe2+ | |
| Άλατα Sn4+(π.χ. SnCl4) | Sn2+ | Sn4+ + 2e → Sn2+ | |
| Αντιδραστήριο Fehling (Cu2+)[10] | Cu2O | 2Cu2+ + H2Ο + 2e → Cu2Ο + 2H+ | |
| Αντιδραστήριο Tollens (Ag+)[11] | Ag | Ag+ + e → Ag | |
Αναγωγικά σώματα[Επεξεργασία | επεξεργασία κώδικα]
Αναγωγικά σώματα (λέγονται και αναγωγικά μέσα ή και αντιοξειδωτικά) είναι εκείνα που μπορούν να προκαλέσουν αναγωγή, δηλαδή τα σώματα που περιέχουν χημικά στοιχεία που μπορούν να προσφέρουν ηλεκτρόνια σε άλλα στοιχεία. Τα χημικά στοιχεία των αναγωγικών σωμάτων παθαίνουν οξείδωση. Συνήθως λέμε ότι τα αναγωγικά σώματα οξειδώνονται (παρόλο που δεν ανάγονται ή οξειδώνονται χημικές ενώσεις αλλά άτομα μέσα σ'αυτές). Επειδή το άτομο αποβάλλει ηλεκτρόνια, αυξάνεται αλγεβρικά ο αριθμός οξείδωσής του.
Έτσι, π.χ. στην αντίδραση :
Ag+ + Fe2+ → Ag + Fe3+
Ο Fe2+ χαρακτηρίζεται ως αναγωγικό σώμα γιατί προκαλεί αναγωγή του Ag+ σε Ag (μείωση του αριθμού οξείδωσης από +1 σε 0), ενώ ο ίδιος οξειδώνεται προς Fe3+ (αύξηση του αριθμού οξείδωσης από +2 σε +3).
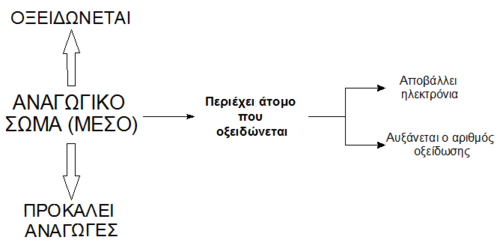
Ένα αναγωγικό είναι τόσο ισχυρότερο, όσο μεγαλύτερη τάση έχει για απόδοση ηλεκτρονίων.
Τα αναγωγικά περιέχουν στοιχείο με σχετικά μικρό αριθμό οξείδωσης.
Σε μια ομάδα του περιοδικού πίνακα ο αναγωγικός χαρακτήρας μειώνεται από πάνω προς τα κάτω, ενώ σε μιά περίοδο μειώνεται από αριστερά προς τα δεξιά.
Μια ουσία που περιέχει στοιχείο με ενδιάμεσο αριθμό οξείδωσης μπορεί να συμπεριφέρεται είτε σαν αναγωγικό (παρουσία ισχυρότερου οξειδωτικού) είτε σαν οξειδωτικό (παρουσία ισχυρότερου αναγωγικού).
| Τα κυριώτερα αναγωγικά μέσα | |||
| Στα αντιδρώντα | Στα προϊόντα | Ημιαντίδραση | |
|---|---|---|---|
| Υδρογόνο (Η2)[12] | Η+ | Η2 → 2Η+ + 2e | |
| Αναγωγικά μέταλλα (Μ) (π.χ Na,Li,K,Ca,Al κ.ά.) | Άλατα Μx+ | M → Mx+ + xe | |
| Μονοξείδιο του άνθρακα (CΟ) | CΟ2 | CO + H2Ο → CO2 + 2H+ + 2e | |
| Οξείδιο του αρσενικού (ΙΙΙ) (As2Ο3) | As2Ο5 | As2O3 + H2Ο → As2O5 + 2H+ + 2e | |
| Υπεροξείδιο υδρογόνου (Η2Ο2)[2] | Ο2 | Η2Ο2 → Ο2 + 2H+ + 2e | |
| Διοξείδιο θείου (SO2)[2] | H2SO4 | SO2 + 2H2Ο → H2SO4 + 2H+ + 2e | |
| Υδραλογόνα (ΗΧ) | Χ2 | 2ΗΧ → Χ2 + 2Η+ + 2e | |
| Υδρόθειο (H2S) | S | H2S → S + 2H+ + 2e | |
| Θειώδες οξύ (H2SO3) | H2SO4 | H2SO3 + H2Ο → H2SO4 + 2H+ + 2e | |
| Άλατα Fe2+(π.χ. FeCl2) | Fe3+ | Fe2+ → Fe3+ + e | |
| Άλατα Sn2+(π.χ. SnCl2) | Sn4+ | Sn2+ → Sn4+ + 2e | |
| Νιτρώδες νάτριο (ΝaΝΟ2) | ΝaΝΟ3 | ΝaΝΟ2 + Η2Ο → ΝaΝΟ3 + 2Η+ + 2e | |
| Θειώδες κάλιο (K2SO3) | K2SO4 | K2SO3 + H2Ο → K2SO4 + 2H+ + 2e | |
| Αμμωνία (NH3) | N2 | 2NH3 → N2 + 6H+ + 6e | |
| Μεθανικό οξύ (HCOOH) | CO2 | HCOOH → CO2 + 2H+ + 2e | |
| 1°ταγείς αλκοόλες (RCH2OH)[13] | RCH=O | RCH2OH → RCH=Ο + 2H+ + 2e | |
| 1°ταγείς αλκοόλες (RCH2OH)[13] | RCOOH | RCH2OH + H2Ο → RCOOH + 4H+ + 4e | |
| Μεθανόλη[14] (CH3OH) | CO2 | CH3OH + H2Ο → CO2 + 6H+ + 6e | |
| 2°ταγείς αλκοόλες (R2CΗOH) | R2C=O | R2CHOH → R2C=Ο + 2H+ + 2e | |
| Αλδεύδες (RCHO)[15] | RCOOH | RCHO + H2Ο → RCOOH + 2H+ + 2e | |
| Οξαλικό οξύ [(COOH)2] | CO2 | (COOH)2 → 2CO2 + 2H+ + 2e | |
Υπάρχουν και ειδικά αναγωγικά σώματα που χρησιμοποιούνται συχνά όπως :

- Διάφορα υδρίδια όπως το LiAlH4 (υδρίδιο λιθίου-αργιλίου), NaAlH4 (μικτό υδρίδιο λιθίου-νατρίου), Mg(AlH4)2 (μικτό υδρίδιο μαγνησίου-αργιλίου), NaBH4 (μικτό υδρίδιο βορίου-νατρίου) κ.ά. Χρησιμοποιούνται στις οργανικές συνθέσεις.
- Το ατομικό υδρογόνο (|Η|) που ανάγει τα νιτρικά και αρσενικικά ιόντα σε αμμωνία (ΝΗ3) και αρσίνη (AsH3) αντίστοιχα.
- Τα αμαλγάματα νατρίου και ψευδαργύρου, που σημειώνονται συχνά ως Na(Hg) και Zn(Hg) αντίστοιχα. Χρησιμοποιούνται ως ισχυρά αναγωγικά στην οργανική χημεία.
- Η υδραζίνη (Ν2H4) που χρησιμοποιείται στην οργανική χημεία των ετεροκυκλικών ενώσεων, στην αναγωγή Wolff-Kishner κ.λ.π.
Σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Η οξειδωτική και αναγωγική ισχύς των σωμάτων εκφράζεται με το κανονικό δυναμικό οξειδοαναγωγής των ημιστοιχείων των οξειδοαναγωγικών ζευγών και μετριέται με μεγάλη ακρίβεια πειραματικά.
- ↑ 2,0 2,1 2,2 2,3 Επειδή δρα και ως οξειδωτικό και ως αναγωγικό, το πώς θα αντιδράσει κάθε φορά εξαρτάται από το άλλο σώμα με το οποίο αντιδρά. Αν αντιδρά π.χ. με οξειδωτικό, τότε θα δράσει ως αναγωγικό κ.ο.κ.
- ↑ 3,0 3,1 Σε όξινο περιβάλλον, συνήθως από H2SO4, μετατρέπονται σε θειικά άλατα των Mn2+ ή Pb2+
- ↑ Τα μέταλλα στα οποία επιδρά λαμβάνονται με το μεγαλύτερο α.ο. τους και μετατρέπονται σε θειικά άλατα
- ↑ Τα μέταλλα στα οποία επιδρά λαμβάνονται με το μεγαλύτερο α.ο. τους και μετατρέπονται σε νιτρικά άλατα. Όταν επιδρά πάνω σε P, I2 και σε S τα μετατρέπει σε H3PO4, HIO3 και σε H2SO4 αντίστοιχα
- ↑ Τα μέταλλα στα οποία επιδρά λαμβάνονται με το μεγαλύτερο α.ο. τους και μετατρέπονται σε νιτρικά άλατα.
- ↑ Δρα σε όξινο περιβάλλον που δημιουργείται από H2SO4 ή HCl και μετατρέπεται σε MnSO4+K2SO4 ή MnCl2+KCl.
- ↑ Δρα σε όξινο περιβάλλον που δημιουργείται από H2SO4 ή HCl και μετατρέπεται σε Cr2(SO4)3+K2SO4 ή CrCl3+KCl
- ↑ Μετατρέπεται σε CaCl2
- ↑ Λέγεται και φελίγγειο υγρό. Είναι αλκαλικό διάλυμα ιόντων Cu2+ γαλάζιου χρώματος και το οποίο ανάγεται σε καστανέρυθρο ίζημα Cu2O. χρησιμοποιείται για τη διάκριδη αλδεϋδών και κετονών. Οι μονοσακχαρίτες (όπως η φρουκτόζη) επίσης οξειδώνονται απ'αυτό. Το αντιδραστήριο Fehling συχνά αντικαθίσταται από το αντιδραστήριο Benedict. Το αντιδραστήριο Benedict περιέχει επίσης ιόντα Cu2+ γαλάζιου χρώματος που μεττρέπονται σε κόκκινο ίζημα οξειδίου του χαλκού (Ι)
- ↑ Eίναι αμμωνικό διάλυμα AgNO3. Όταν οξειδώνει τις αλδεΰδες σε οξέα, ο Ag+ μετατρέπεται σε Ag οποίος σχηματίζει στα τοιχώματα του δοχείου της αντίδρασης κάτοπτρο (καθρέφτη).
- ↑ Μετατρέπεται συνήθως σε Η2Ο, ΗΧ
- ↑ 13,0 13,1 Οι 1οταγείς αλκοόλες έχουν δύο στάδια οξείδωσης προς αλδεύδες (RCHO) και προς καρβοξυλικά οξέα (RCOOH)
- ↑ Η μεθανόλη μπορεί να οξειδωθεί προς HCHO, HCOOH και CO2
- ↑ Οξειδώνονται και από τα ήπια οξειδωτικά όπως το φελίγγειο υγρό και το αντιδραστήριο Tollens
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Μανωλκίδης Κ., Μπέζας Κ. "Στοιχεία Ανόργανης Χημείας", Έκδοση 14η, Αθήνα 1984.
- Γιαννακουδάκης Δ. Α. "Φυσική Χημεία Ιονικών και Ηλεκτροδιακών Δράσεων", Θεσσαλονίκη 1986.
- Μανωλκίδης Κ., Μπέζας Κ. "Στοιχεία οργανικής χημείας", Έκδοση 13η, Αθήνα 1985.
- Morrison R. T., Boyd R. N. "Οργανική Χημεία" Τόμοι 1ος,2ος,3ος, Μετάφραση:Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991.
- Δημητριάδης Θ. Γ. "Test Οξειδοαναγωγής", Αθήνα 1989.
- Γεωργάτσος Ι. Ε. "Βιοχημεία, Τόμος Α', Δομή μακρομορίων-Ένζυμα-Βιολογικές Οξειδώσεις", Θεσσαλονίκη 1985.
- Τσίπης Κ. Α. "Εισαγωγή στην Κβαντική Χημεία, Τόμος Ι, Στοιχειώδης Μεθοδολογία και Ατομική Δομή", Θεσσαλονίκη 1984.
- Τοσσίδης Ι. "Χημεία Ενώσεων Συναρμογής", Θεσσαλονίκη 1986.
- Μάτης Κ. Α., Γιαννακουδάκης Δ. Α. "Μαθήματα Χημικής Μηχανικής", Θεσσαλονίκη 1985.
- Βασιλικιώτης Γ. Σ. "Ποιοτική Ανάλυση", Θεσσαλονίκη 1980.
