Αποσιωπητής (γενετική)

Στη γενετική, ένας αποσιωπητής (silencer) είναι μια αλληλουχία DNA ικανή να δεσμεύει παράγοντες ρύθμισης μεταγραφής, που ονομάζεται καταστολείς. Το DNA περιέχει γονίδια και παρέχει το πρότυπο για την παραγωγή αγγελιοφόρου RNA (mRNA). Αυτό το mRNA στη συνέχεια μεταφράζεται σε πρωτεΐνες. Όταν μια πρωτεΐνη καταστολέα δεσμεύεται στην περιοχή αποσιωπητή του DNA, η RNA πολυμεράση αποτρέπεται από τη μεταγραφή της αλληλουχίας DNA σε RNA. Με αποκλεισμό της μεταγραφής, η μετάφραση του RNA σε πρωτεΐνες είναι αδύνατη. Έτσι, οι αποσιωπητές εμποδίζουν τα γονίδια να εκφραστούν ως πρωτεΐνες.[1] Η RNA πολυμεράση, ένα ένζυμο που εξαρτάται από το DNA, μεταγράφει τις αλληλουχίες DNA, που ονομάζονται νουκλεοτίδια στην κατεύθυνση από 3' προς 5', ενώ το συμπληρωματικό RNA συντίθεται στην κατεύθυνση από 5' προς 3'. Το RNA είναι παρόμοιο με το DNA, με τη διαφορά ότι το RNA περιέχει ουρακίλη, αντί για θυμίνη, η οποία σχηματίζει ένα ζεύγος βάσεων με την αδενίνη. Μια σημαντική περιοχή για τη δραστηριότητα της γονιδιακής καταστολής και έκφρασης που βρίσκεται στο RNA είναι η αμετάφραστη περιοχή 3'. Αυτή είναι μια περιοχή στο 3' άκρο του RNA που δεν θα μεταφραστεί σε πρωτεΐνη, αλλά περιλαμβάνει πολλές ρυθμιστικές περιοχές. Δεν είναι ακόμη γνωστά πολλά για τους αποσιωπητές, αλλά οι επιστήμονες συνεχίζουν να μελετούν με την ελπίδα να ταξινομήσουν περισσότερους τύπους, τοποθεσίες στο γονιδίωμα και ασθένειες που σχετίζονται με τους αποσιωπητές.[2][3]
Λειτουργικότητα[Επεξεργασία | επεξεργασία κώδικα]
Θέσεις μέσα στο γονιδίωμα[Επεξεργασία | επεξεργασία κώδικα]

Ο αποσιωπητής είναι ένα ειδικό για την αλληλουχία στοιχείο που προκαλεί αρνητική επίδραση στη μεταγραφή του συγκεκριμένου γονιδίου του. Υπάρχουν πολλές θέσεις στις οποίες μπορεί να εντοπιστεί ένα στοιχείο αποσιωπητή στο DNA. Η πιο κοινή θέση βρίσκεται ανοδικά στο γονίδιο-στόχο, όπου μπορεί να βοηθήσει στην καταστολή της μεταγραφής του γονιδίου.[4] Αυτή η απόσταση μπορεί να ποικίλλει πολύ μεταξύ περίπου -20 έως -2000 ζεύγη βάσεων ανάντη ενός γονιδίου. Ορισμένοι αποσιωπητές μπορούν να βρεθούν κατάντη ενός προαγωγέα που βρίσκεται εντός του εσωνίου ή του εξωνίου του ίδιου του γονιδίου. Αποσιωπητές έχουν επίσης βρεθεί εντός της αμετάφραστης περιοχής 3' (3' UTR) του mRNA.[5]
Τύποι[Επεξεργασία | επεξεργασία κώδικα]
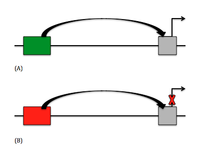
Επί του παρόντος, υπάρχουν δύο κύριοι τύποι αποσιωπητών στο DNA, οι οποίοι είναι το κλασικό στοιχείο αποσιωπητή και το μη κλασικό αρνητικό ρυθμιστικό στοιχείο (negative regulatory element, NRE). Στους κλασικούς αποσιωπητές, το γονίδιο καταστέλλεται ενεργά από το στοιχείο του αποσιωπητή, παρεμβαίνοντας κυρίως στη συγκρότηση του γενικού παράγοντα μεταγραφής (general transcription factor, GTF).[5] Οι NRE καταστέλλουν παθητικά το γονίδιο, συνήθως αναστέλλοντας άλλα στοιχεία που βρίσκονται ανάντη του γονιδίου. Από τους NRE, υπάρχουν ορισμένοι αποσιωπητές που εξαρτώνται από τον προσανατολισμό που σημαίνει ότι ο παράγοντας δέσμευσης συνδέεται σε μια συγκεκριμένη κατεύθυνση σε σχέση με άλλες αλληλουχίες. Οι αποσιωπητές που εξαρτώνται από τον προαγωγέα νοούνται ως στοιχεία αποσιωπητή, επειδή εξαρτώνται από τη θέση και τον προσανατολισμό, αλλά πρέπει επίσης να χρησιμοποιούν έναν ειδικό παράγοντα προαγωγέα.[5] Έχει γίνει μια πρόσφατη ανακάλυψη στοιχείων απόκρισης πολυκομβικής ομάδας (Polycomb-group Response Elements, PREs), τα οποία μπορούν να επιτρέψουν και να αναστείλουν την καταστολή ανάλογα με την πρωτεΐνη που είναι δεσμευμένη σε αυτά και την παρουσία μη κωδικοποιητικής μεταγραφής..[4]
Μηχανισμοί[Επεξεργασία | επεξεργασία κώδικα]

Για τους κλασικούς αποσιωπητές, η οδός σηματοδότησης είναι σχετικά απλή. Δεδομένου ότι η καταστολή είναι ενεργή, τα στοιχεία αποσιωπητή στοχεύουν το συγκρότημα των GTF, που είναι απαραίτητα για τη μεταγραφή του γονιδίου. Αυτά τα στοιχεία αποσιωπητή βρίσκονται ως επί το πλείστον ανάντη του γονιδίου και μπορεί να ποικίλλουν μεταξύ μικρών και μεγάλων αποστάσεων. Για τους αποσιωπητές μεγάλης εμβέλειας, έχει παρατηρηθεί ότι το DNA θα σχηματίσει έναν βρόχο προκειμένου να φέρει τον αποσιωπητή πιο κοντά στον προαγωγέα και να αποσπάσει από το βρόχο το παρεμβαλλόμενο DNA.[4] Οι αποσιωπητές στοχεύουν επίσης τις θέσεις της ελικάσης στο DNA που είναι πλούσιες σε αδενίνη και θυμίνη (AT) και επιρρεπείς στο ξετύλιγμα του DNA, αφήνοντας χώρο για την έναρξη της μεταγραφής. Η παρεμποδιζόμενη δραστηριότητα της ελικάσης οδηγεί στην αναστολή της μεταγραφής. Αυτό παρατηρείται συνήθως στον προαγωγέα του γονιδίου της ανθρώπινης θυρεοτροπίνης-β. Τα NRE μπορούν να προκαλέσουν μια κάμψη στην περιοχή του προαγωγέα για να μπλοκάρουν τις αλληλεπιδράσεις, όπως φαίνεται όταν ένα NRE δεσμεύεται στο Yin-Yang 1 (YY1),[5] και στα πλευρικά ρυθμιστικά σήματα ή στις περιοχές προαγωγέα επίσης. Όταν η περιοχή του αποσιωπητή βρίσκεται μέσα σε ένα εσώνιο, μπορεί να υπάρχουν δύο τύποι καταστολών. Πρώτον, μπορεί να υπάρξει φυσική απόφραξη μιας θέσης ματίσματος. Δεύτερον, μπορεί να υπάρξει μια κάμψη στο DNA που θα αναστείλει την επεξεργασία του RNA.[5] Όταν βρίσκεται στο εξώνιο ή στην αμετάφραστη περιοχή, ο αποσιωπητής θα είναι κυρίως κλασικός ή εξαρτάται από τη θέση. Ωστόσο, αυτοί οι αποσιωπητές μπορούν να πραγματοποιήσουν τη δραστηριότητά τους πριν από τη μεταγραφή.[5] Οι περισσότεροι αποσιωπητές εκφράζονται συστατικά σε οργανισμούς, επιτρέποντας μόνο την ενεργοποίηση ενός γονιδίου, είτε αναστέλλοντας τον αποσιωπητή, είτε ενεργοποιώντας μια περιοχή ενισχυτή. Το καλύτερο παράδειγμα αυτού είναι ο παράγοντας αποσιωπητή περιοριστικός του νευρώνα (Neuronal-restrictive Silencer Factor, NRSF) που παράγεται από το γονίδιο "REST". Το γονίδιο REST παράγει NRSF προκειμένου να καταστείλει τη μεταγραφή των νευρωνικών γονιδίων που είναι απαραίτητα για τον εντοπισμό του νευρωνικού ιστού. Όταν ένας αποσιωπητής καταστέλλει το REST, το NRSF αναστέλλεται επίσης, επιτρέποντας τη μεταγραφή των νευρωνικών γονιδίων.[5]
Ομοιότητες με ενισχυτές[Επεξεργασία | επεξεργασία κώδικα]
Ένα άλλο ρυθμιστικό στοιχείο που βρίσκεται ανάντη του γονιδίου είναι ένας ενισχυτής. Οι ενισχυτές λειτουργούν ως διακόπτες "ενεργοποίησης" στη γονιδιακή έκφραση και θα ενεργοποιήσουν την περιοχή προαγωγέα ενός συγκεκριμένου γονιδίου ενώ οι αποσιωπητές λειτουργούν ως διακόπτες "απενεργοποίησης". Αν και αυτά τα δύο ρυθμιστικά στοιχεία λειτουργούν αντίθετα μεταξύ τους, και οι δύο τύποι αλληλουχιών επηρεάζουν την περιοχή του προαγωγέα με πολύ παρόμοιους τρόπους.[4] Επειδή οι αποσιωπητές δεν έχουν εντοπιστεί και αναλυθεί διεξοδικά, η εκτεταμένη έρευνα για τους ενισχυτές έχει βοηθήσει τους βιολόγους να κατανοήσουν τη μηχανική του αποσιωπητή. Οι ενισχυτές μπορούν να βρεθούν σε πολλές από τις ίδιες περιοχές που βρίσκονται οι αποσιωπητές, όπως ανάντη του προαγωγέα από πολλές χιλιάδες ζεύγη βάσης ή ακόμα και κατάντη εντός του εσωνίου του γονιδίου.[4] Ο βρόχος DNA είναι επίσης μια λειτουργία μοντέλου που χρησιμοποιείται από τους ενισχυτές προκειμένου να συντομεύσει την εγγύτητα του προαγωγέα στον ενισχυτή. Οι ενισχυτές λειτουργούν επίσης με μεταγραφικούς παράγοντες προκειμένου να εκκινήσουν την έκφραση, όπως και οι αποσιωπητές με τους καταστολείς.[4]
Σε προκαρυώτες και ευκαρυώτες[Επεξεργασία | επεξεργασία κώδικα]
Προκαρυώτες[Επεξεργασία | επεξεργασία κώδικα]

Υπάρχουν αρκετές διαφορές στη ρύθμιση του μεταβολικού ελέγχου στους ευκαρυώτες και στους προκαρυώτες. Οι προκαρυώτες ποικίλλουν τον αριθμό των ειδικών ενζύμων που παράγονται στα κύτταρά τους προκειμένου να ρυθμίσουν την έκφραση γονιδίων, η οποία είναι αργός μεταβολικός έλεγχος, και επίσης ρυθμίζουν ενζυματικές οδούς μέσω μηχανισμών όπως αναστολή ανάδρασης και αλλοστερική ρύθμιση, που είναι ο γρήγορος μεταβολικός έλεγχος.[6] Τα γονίδια των προκαρυωτών ομαδοποιούνται με βάση παρόμοιες λειτουργίες σε μονάδες που ονομάζονται οπερόνια και αποτελούνται από έναν προαγωγέα (υποκινητή) και έναν χειριστή. Ο χειριστής είναι η θέση δέσμευσης για τον καταστολέα και επομένως έχει μια λειτουργία ισοδύναμη με την περιοχή αποσιωπητή στο ευκαρυωτικό DNA. Όταν μια πρωτεΐνη καταστολέα δεσμεύεται στον χειριστή, η RNA πολυμεράση δεν μπορεί να συνδεθεί με τον προαγωγέα για να ξεκινήσει η μεταγραφή του οπερονίου.
Καταστολή του οπερονίου lac[Επεξεργασία | επεξεργασία κώδικα]
Το οπερόνιο lac στον προκαρυώτη Εσερίχια κόλι αποτελείται από γονίδια που παράγουν ένζυμα για τη διάσπαση της λακτόζης. Το οπερόνιο του είναι ένα παράδειγμα προκαρυωτικού αποσιωπητή. Τα τρία λειτουργικά γονίδια σε αυτό το οπερόνιο είναι τα lacZ, lacY και lacA.[6] Το κατασταλτικό γονίδιο, lacI, θα παράγει την κατασταλτική πρωτεΐνη LacI που βρίσκεται υπό αλλοστερική ρύθμιση. Αυτά τα γονίδια ενεργοποιούνται από την παρουσία λακτόζης στο κύτταρο η οποία δρα ως μόριο τελεστή που συνδέεται με το LacI. Όταν ο καταστολέας είναι δεσμευμένος στη λακτόζη, δεν θα συνδεθεί με τον χειριστή, γεγονός που επιτρέπει στην πολυμεράση RNA να συνδεθεί με τον προαγωγέα για να ξεκινήσει η μεταγραφή του οπερονίου. Όταν η αλλοστερική θέση του καταστολέα δεν είναι συνδεδεμένη με τη λακτόζη, η ενεργή του θέση θα συνδεθεί με τον χειριστή για να αποτρέψει την πολυμεράση RNA από τη μεταγραφή των γονιδίων του οπερονίου lac.
Ευκαρυώτες[Επεξεργασία | επεξεργασία κώδικα]
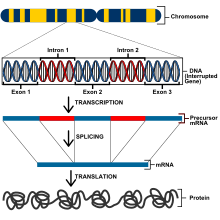
Οι ευκαρυώτες έχουν πολύ μεγαλύτερο γονιδίωμα και επομένως έχουν διαφορετικές μεθόδους γονιδιακής ρύθμισης από ό,τι οι προκαρυώτες. Όλα τα κύτταρα σε έναν ευκαρυωτικό οργανισμό έχουν το ίδιο DNA, αλλά προσδιορίζονται μέσω της διαφορικής έκφρασης γονιδίων, ένα φαινόμενο γνωστό ως γενετική παντοδυναμία (genetic totipotency).[7] Ωστόσο, για να μπορέσει ένα κύτταρο να εκφράσει τα γονίδια για τη σωστή λειτουργία, τα γονίδια πρέπει να ρυθμιστούν στενά για να εκφράσουν τις σωστές ιδιότητες. Τα γονίδια στους ευκαρυώτες ελέγχονται στα μεταγραφικά, μετα-μεταγραφικά, μεταφραστικά και μετα-μεταφραστικά επίπεδα.[8] Σε μεταγραφικό επίπεδο, η γονιδιακή έκφραση ρυθμίζεται με την αλλαγή των ρυθμών μεταγραφής. Τα γονίδια που κωδικοποιούν πρωτεΐνες περιλαμβάνουν εξώνια που θα κωδικοποιήσουν τα πολυπεπτίδια, εσώνια που αφαιρούνται από το mRNA πριν από τη μετάφραση των πρωτεϊνών, μια θέση έναρξης μεταγραφής στην οποία συνδέεται η RNA πολυμεράση και ένας προαγωγέας.[9]
Καταστολή του πλαισίου (κουτιού) TATA[Επεξεργασία | επεξεργασία κώδικα]
Τα ευκαρυωτικά γονίδια περιέχουν έναν ανάντη προαγωγέα και έναν πυρήνα προαγωγέα που αναφέρεται επίσης ως βασικός προαγωγέας. Ένας κοινός βασικός προαγωγέας είναι η αλληλουχία ΤΑΤΑΑΑΑΑΑ γνωστή ως πλαίσιο ΤΑΤΑ. Το πλαίσιο TATA είναι ένα σύμπλεγμα με πολλές διαφορετικές πρωτεΐνες συμπεριλαμβανομένου του μεταγραφικού παράγοντα II D (transcription factor II D, TFIID) που περιλαμβάνει την πρωτεΐνη δέσμευσης TATA (TBP) που συνδέεται με το πλαίσιο TATA μαζί με άλλες 13 πρωτεΐνες που συνδέονται με την TBP. Οι πρωτεΐνες δέσμευσης πλαισίου TATA περιλαμβάνουν επίσης τον παράγοντα μεταγραφής II Β (transcription factor II B, TFIIB) που συνδέεται τόσο με τις πολυμεράσες DNA όσο και με τις πολυμεράσες RNA.[9] Οι αποσιωπητές σε ευκαρυώτες ελέγχουν την έκφραση γονιδίων σε επίπεδο μεταγραφής στο οποίο το mRNA δεν μεταγράφεται. Αυτές οι αλληλουχίες DNA μπορεί να δρουν είτε ως αποσιωπητές, είτε ως ενισχυτές με βάση τον μεταγραφικό παράγοντα που συνδέεται με την αλληλουχία και η δέσμευση αυτής της αλληλουχίας θα αποτρέψει τους προαγωγείς όπως το πλαίσιο ΤΑΤΑ από τη δέσμευση στην πολυμεράση RNA.[7] Μια κατασταλτική πρωτεΐνη μπορεί να έχει περιοχές που συνδέονται με την αλληλουχία DNA καθώς και περιοχές που συνδέονται με τους μεταγραφικούς παράγοντες που συναρμολογούνται στον προαγωγέα του γονιδίου που θα δημιουργούσε έναν μηχανισμό βρόχου χρωμοσώματος.[9] Η δημιουργία βρόχου φέρνει τους αποσιωπητές σε άμεση γειτνίαση με τους προαγωγείς για να διασφαλίσει ότι οι ομάδες πρωτεϊνών που χρειάζονται για τη βέλτιστη γονιδιακή έκφραση θα συνεργαστούν.

== Μεταλλαγμένοι αποσιωπητές, κληρονομικές ασθένειες και τα αποτελέσματά τους ==
Γενετικές μεταλλάξεις συμβαίνουν όταν αλλοιώνονται οι αλληλουχίες νουκλεοτιδίων σε έναν οργανισμό. Αυτές οι μεταλλάξεις οδηγούν όχι μόνο σε παρατηρήσιμες φαινοτυπικές επιρροές σε ένα άτομο, αλλά και σε αλλοιώσεις που είναι μη ανιχνεύσιμες φαινοτυπικά. Οι πηγές αυτών των μεταλλάξεων μπορεί να είναι σφάλματα κατά την αντιγραφή, αυθόρμητες μεταλλάξεις καθώς και χημικά και φυσικά μεταλλαξιογόνα (υπεριώδης ακτινοβολία και ιονίζουσα ακτινοβολία, θερμότητα).[10] Οι αποσιωπητές, που κωδικοποιούνται στο γονιδίωμα, είναι επιρρεπείς σε τέτοιες αλλοιώσεις οι οποίες, σε πολλές περιπτώσεις, μπορούν να οδηγήσουν σε σοβαρές φαινοτυπικές και λειτουργικές ανωμαλίες. Σε γενικές γραμμές, οι μεταλλάξεις σε στοιχεία ή περιοχές αποσιωπητή θα μπορούσαν να οδηγήσουν είτε στην αναστολή της δράσης του αποσιωπητή είτε στην επίμονη καταστολή ενός απαραίτητου γονιδίου. Αυτό μπορεί στη συνέχεια να οδηγήσει στην έκφραση ή την καταστολή ενός ανεπιθύμητου φαινοτύπου που μπορεί να επηρεάσει την κανονική λειτουργικότητα ορισμένων συστημάτων στον οργανισμό. Μεταξύ των πολλών αποσιωπητικών στοιχείων και πρωτεϊνών, το REST/NSRF είναι ένας σημαντικός αποσιωπητικός παράγοντας που έχει ποικίλες επιπτώσεις, όχι μόνο στις νευρικές πτυχές της ανάπτυξης. Στην πραγματικότητα, σε πολλές περιπτώσεις, το REST/NSRF δρα σε συνδυασμό με το RE-1/NRSE για την καταστολή και την επίδραση των μη νευρωνικών κυττάρων.[11] Τα αποτελέσματά του κυμαίνονται από βατράχους (Xenopus laevis) έως ανθρώπους, με αμέτρητα αποτελέσματα στον φαινότυπο αλλά και στην ανάπτυξη. Στο Xenopus laevis, δυσλειτουργία ή βλάβη του REST/NRSF έχει συσχετιστεί με μη φυσιολογικό εξωδερμικό μοτίβο κατά την ανάπτυξη και σημαντικές συνέπειες στον νευρικό σωλήνα, τα κρανιακά γάγγλια και την ανάπτυξη των ματιών.[12] Στους ανθρώπους, μια ανεπάρκεια στο αποσιωπητικό στοιχείο REST/NSRF έχει συσχετιστεί με τη νόσο του Χάντινγκτον λόγω της μείωσης της μεταγραφής του εγκεφαλικού νευροτροφικού παράγοντα (Brain-derived neurotrophic factor, BDNF). Επιπλέον, συνεχιζόμενες μελέτες υποδεικνύουν ότι το NRSE εμπλέκεται στη ρύθμιση του γονιδίου ANP, το οποίο όταν υπερεκφράζεται, μπορεί να οδηγήσει σε κοιλιακή υπερτροφία.[13] Οι μεταλλάξεις στα σύμπλοκα της πολυκομβικής ομάδας (PcG) παρουσίασαν επίσης σημαντικές τροποποιήσεις στα φυσιολογικά συστήματα των οργανισμών. Ως εκ τούτου, η τροποποίηση σε στοιχεία και αλληλουχίες αποσιωπητή μπορεί να οδηγήσει σε καταστροφικές ή απαρατήρητες αλλαγές.
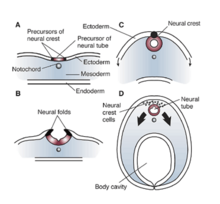
REST/NRSF στο Xenopus laevis[Επεξεργασία | επεξεργασία κώδικα]
Οι επιπτώσεις και οι επιρροές των RE1/NRSE και REST/NRSF είναι σημαντικές σε μη νευρωνικά κύτταρα που απαιτούν την καταστολή ή τη σίγαση των νευρωνικών γονιδίων. Αυτά τα αποσιωπητικά στοιχεία ρυθμίζουν επίσης την έκφραση γονιδίων που δεν επάγουν πρωτεΐνες ειδικές για τους νευρώνες και μελέτες έχουν δείξει την εκτεταμένη επίδραση που έχουν αυτοί οι παράγοντες στις κυτταρικές διεργασίες. Στο Xenopus laevis, η δυσλειτουργία ή η μετάλλαξη των RE1/NRSE και REST/NRSF κατέδειξε σημαντική επίδραση στον νευρικό σωλήνα (neural tube), στα κρανιακά γάγγλια και στην ανάπτυξη των ματιών.[12] Όλες αυτές οι αλλαγές μπορούν να ανιχνευθούν σε ακατάλληλη διαμόρφωση του εξωδέρματος (ectoderm) κατά την ανάπτυξη του Xenopus. Έτσι, μια μετάλλαξη ή αλλοίωση είτε στην περιοχή αποσιώπησης RE1/NRSE είτε στον παράγοντα αποσιώπησης REST/NRSF μπορεί να διαταράξει τη σωστή διαφοροποίηση και εξειδίκευση της νευροεπιθηλιακής περιοχής και επίσης να εμποδίσει το σχηματισμό δέρματος ή του εξωδέρματος.[12] Η έλλειψη αυτών των παραγόντων οδηγεί σε μειωμένη παραγωγή μορφογενετικής πρωτεΐνης οστών (bone morphogenetic protein, BMP), η οποία μεταφράζεται σε ανεπαρκή ανάπτυξη της νευρικής ακρολοφίας (neural crest).[12] Ως εκ τούτου, οι επιδράσεις του NRSE και του NRSF είναι θεμελιώδους σημασίας για τη νευρογένεση του αναπτυσσόμενου εμβρύου, καθώς και στα αρχικά στάδια του εξωδερμικού σχηματισμού. Τελικά, η ανεπαρκής λειτουργία αυτών των παραγόντων μπορεί να οδηγήσει σε ανώμαλο νευρικό σωλήνα, κρανιακά γάγγλια και ανάπτυξη των ματιών στο Xenopus.
REST/NSRF και η νόσος του Χάντιγκτον[Επεξεργασία | επεξεργασία κώδικα]
Η νόσος του Χάντινγκτον (HD) είναι μια κληρονομική νευροεκφυλιστική διαταραχή, με συμπτώματα που εμφανίζονται κατά τη μέση της ενηλικίωσης ενός ατόμου. Τα πιο αισθητά συμπτώματα αυτής της προοδευτικής νόσου είναι οι γνωστικές και κινητικές βλάβες, καθώς και οι αλλαγές στη συμπεριφορά.[14] Αυτές οι βλάβες μπορεί να εξελιχθούν σε άνοια, χορεία (chorea) και τελικά σε θάνατο. Σε μοριακό επίπεδο, η HD προκύπτει από μια μετάλλαξη στην πρωτεΐνη χαντινγκτίνη (huntingtin, Htt). Πιο συγκεκριμένα, υπάρχει μια ανώμαλη επανάληψη μιας αλληλουχίας CAG προς το 5'-άκρο του γονιδίου, η οποία στη συνέχεια οδηγεί στην ανάπτυξη μιας τοξικής διάτασης της πολυγλουταμίνη (polyQ) στην πρωτεΐνη. Η μεταλλαγμένη πρωτεΐνη Htt επηρεάζει τις σωστές νευρικές λειτουργίες ενός ατόμου αναστέλλοντας τη δράση του REST/NRSF. Το REST/NRSF είναι ένα σημαντικό στοιχείο αποσιωπητή που συνδέεται με ρυθμιστικές περιοχές για τον έλεγχο της έκφρασης ορισμένων πρωτεϊνών που εμπλέκονται στις νευρικές λειτουργίες. Οι μηχανιστικές δράσεις της χαντινγκτίνης δεν είναι ακόμα πλήρως κατανοητές, αλλά υπάρχει συσχέτιση μεταξύ Htt και REST/NRSF στην ανάπτυξη HD. Με την προσκόλληση στο REST/NRSF, η μεταλλαγμένη πρωτεΐνη χαντινγκτίνης αναστέλλει τη δράση του αποσιωπητικού στοιχείου και το διατηρεί στο κυτταροδιάλυμα. Έτσι, το REST/NRSF δεν μπορεί να εισέλθει στον πυρήνα και να συνδεθεί με το ρυθμιστικό στοιχείο 21 ζευγών βάσεων RE-1/NRSE. Η επαρκής καταστολή συγκεκριμένων γονιδίων-στόχων είναι θεμελιώδους σημασίας, καθώς πολλά εμπλέκονται στη σωστή ανάπτυξη νευρωνικών υποδοχέων, νευροδιαβιβαστών, πρωτεϊνών συναπτικών κυστιδίων και πρωτεϊνών καναλιού. Μια ανεπάρκεια στη σωστή ανάπτυξη αυτών των πρωτεϊνών μπορεί να προκαλέσει τις νευρικές δυσλειτουργίες που παρατηρούνται στη νόσο του Huntington. Εκτός από την έλλειψη καταστολής λόγω του ανενεργού REST/NRSF, η μεταλλαγμένη πρωτεΐνη χαντινγκτίνη μπορεί επίσης να μειώσει τη μεταγραφή του γονιδίου του εγκεφαλικού νευροτροφικού παράγοντα (brain-derived neurotrophic factor, BDNF). Το BDNF επηρεάζει την επιβίωση και την ανάπτυξη των νευρώνων στο κεντρικό νευρικό σύστημα καθώς και στο περιφερικό νευρικό σύστημα. Αυτή η ανώμαλη καταστολή συμβαίνει όταν η περιοχή RE1/NRSE εντός της περιοχής του προαγωγέα BDNF ενεργοποιείται από τη δέσμευση REST/NRSF, η οποία οδηγεί στην έλλειψη μεταγραφής του γονιδίου BDNF.[15] Ως εκ τούτου, η ανώμαλη καταστολή της πρωτεΐνης BDNF υποδηλώνει σημαντική επίδραση στη νόσο του Χάντινγκτον.
Τρέχουσα έρευνα για το REST/NRSF και την κοιλιακή υπερτροφία σε θηλαστικά[Επεξεργασία | επεξεργασία κώδικα]
Τα REST/NRSF σε συνδυασμό με τα RE1/NRSE δρουν επίσης εκτός του νευρικού συστήματος ως ρυθμιστές και καταστολείς. Η τρέχουσα έρευνα έχει συνδέσει τη δραστηριότητα RE1/NRSE με τη ρύθμιση της έκφρασης του γονιδίου κολπικό νατριουρητικό πεπτίδιο (atrial natriuretic peptide, ANP).[13] Μια ρυθμιστική περιοχή NRSE υπάρχει στην 3' αμετάφραστη περιοχή του γονιδίου ANP και δρα ως μεσολαβητής για την κατάλληλη έκφρασή του. Η πρωτεΐνη που κωδικοποιείται από το γονίδιο ANP είναι σημαντική κατά την εμβρυϊκή ανάπτυξη για την ωρίμανση και την ανάπτυξη των καρδιακών μυϊκών κυττάρων. Ωστόσο, κατά την πρώιμη παιδική ηλικία και σε όλη την ενήλικη ζωή, η έκφραση του ANP καταστέλλεται ή περιορίζεται στο ελάχιστο στην κοιλία. Έτσι, μια ανώμαλη επαγωγή του γονιδίου ANP μπορεί να οδηγήσει σε κοιλιακή υπερτροφία και σοβαρές καρδιακές συνέπειες. Προκειμένου να διατηρηθεί η καταστολή του γονιδίου, ο NRSF (νευροπεριοριστικός παράγοντας αποσιωπητή), ή το REST δεσμεύεται στην περιοχή NRSE στην αμετάφραστη περιοχή 3 του γονιδίου ANP. Επιπλέον, το σύμπλεγμα NRSF-NRSE στρατολογεί έναν μεταγραφικό συνκατασταλτικό παράγοντα γνωστό ως mSin3.[13] Αυτό οδηγεί στη δραστηριότητα της αποακετυλάσης της ιστόνης στην περιοχή και στην καταστολή του γονιδίου. Επομένως, μελέτες έχουν αποκαλύψει τη συσχέτιση μεταξύ REST/NRSF και RE1/NRSE στη ρύθμιση της έκφρασης του γονιδίου ANP στα κοιλιακά μυοκύτταρα. Μια μετάλλαξη είτε στο NRSF είτε στο NRSE μπορεί να οδηγήσει σε ανεπιθύμητη ανάπτυξη κοιλιακών μυοκυττάρων, λόγω έλλειψης καταστολής, η οποία μπορεί στη συνέχεια να προκαλέσει κοιλιακή υπερτροφία. Η υπερτροφία της αριστερής κοιλίας, για παράδειγμα, αυξάνει την πιθανότητα αιφνίδιου θανάτου ενός ατόμου λόγω κοιλιακής αρρυθμίας που προκύπτει από την αυξημένη κοιλιακή μάζα.[16] Εκτός από την επίδραση στο γονίδιο ANP, η αλληλουχία NRSE ρυθμίζει άλλα καρδιακά εμβρυϊκά γονίδια, όπως το εγκεφαλικό νατριουρητικό πεπτίδιο (brain natriuretic peptide, BNP), τη σκελετική α-ακτίνη και την υπομονάδα Na, K – ATPase α3.[13] Ως εκ τούτου, η ρυθμιστική δραστηριότητα τόσο του NRSE όσο και του NRSF στα θηλαστικά αποτρέπει όχι μόνο νευρικές δυσλειτουργίες αλλά και φυσιολογικές και φαινοτυπικές ανωμαλίες σε άλλες μη νευρωνικές περιοχές του σώματος.

Μεταλλάξεις σε στοιχεία απόκρισης πολυκομβικής ομάδας (PREs)[Επεξεργασία | επεξεργασία κώδικα]
Τα ρυθμιστικά σύμπλοκα της πολυκομβικής ομάδας (PcG) είναι γνωστά για την επιρροή τους στη επιγενετική ρύθμιση των βλαστοκυττάρων, ιδιαίτερα στα αιματοποιητικά βλαστοκύτταρα. Το κατασταλτικό πολυκομβικό σύμπλεγμα 1 (PRC 1) εμπλέκεται άμεσα στη διαδικασία της αιμοποίησης και λειτουργεί μαζί, για παράδειγμα, με το γονίδιο PcG Bmi1. Μελέτες σε ποντίκια δείχνουν ότι οι οργανισμοί με μεταλλαγμένο Bmi1 επιδεικνύουν ανεπαρκή μιτοχονδριακή λειτουργία και επίσης παρεμποδίζουν την ικανότητα των αιμοποιητικών κυττάρων να αυτοανανεώνονται. Ομοίως, οι μεταλλάξεις στα γονίδια PRC2 σχετίζονταν με αιματολογικές καταστάσεις όπως η οξεία λεμφοβλαστική λευχαιμία (acute lymphoblastic leukemia, ALL), που είναι μια μορφή λευχαιμίας. Ως εκ τούτου, τα γονίδια και οι πρωτεΐνες της πολυκομβικής ομάδας εμπλέκονται στη σωστή διατήρηση της αιμοποίησης στο σώμα.[17]
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Pang B, van Weerd JH, Hamoen FL, Snyder MP. "Identification of non-coding silencer elements and their regulation of gene expression". Nature Reviews Molecular Cell Biology (2022) https://doi.org/10.1038/s41580-022-00549-9
- ↑ Jayavelu ND, Jajodia A, Mishra A, Hawkins RD. "Candidate silencer elements for the human and mouse genomes". Nature communications11:1061 (2020) https://doi.org/10.1038/s41467-020-14853-5
- ↑ Pang, B., Snyder, M.P. "Systematic identification of silencers in human cells". Nat Genet 52, 254–263 (2020). https://doi.org/10.1038/s41588-020-0578-5
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Maston, Glenn; Sarah Evans; Michael Green (23 May 2006). «Transcriptional regulatory elements in the Human Genome». Annual Review of Genomics and Human Genetics 7: 29–59. doi:. PMID 16719718. http://bejerano.stanford.edu/readings/public/10_Intro_TxRegReview.pdf. Ανακτήθηκε στις 2 April 2013.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 Ogbourne, Steven; Toni Antalis (1998). «Transcriptional control and the role of silencers in transcriptional regulation in eukaryotes». Biochem. J. 331 (1): 1–14. doi:. PMID 9512455.
- ↑ 6,0 6,1 «Control of Genetic Systems in Prokaryotes and Eukaryotes». University of Illinois at Chicago. Ανακτήθηκε στις 2 Απριλίου 2013.
- ↑ 7,0 7,1 «Eukaryotic Gene Control». Kenyon College. Ανακτήθηκε στις 1 Απριλίου 2013.
- ↑ «Gene Regulation in Eukaryotes». Eastern Michigan University. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Μαΐου 2013. Ανακτήθηκε στις 7 Απριλίου 2013.
- ↑ 9,0 9,1 9,2 «Gene Regulation in Eukaryotes». Kimball's Biology Pages. Αρχειοθετήθηκε από το πρωτότυπο στις 4 Ιουνίου 2011. Ανακτήθηκε στις 7 Απριλίου 2013.
- ↑ Brown, TA (2002). Genomes. Oxford: Wiley-Liss.
- ↑ Schoenherr, CJ; Anderson DJ (3 March 1995). «The neuron-restrictive silencer factor (NRSF): a coordinate repressor of multiple neuron-specific genes.». Science 267 (5202): 1360–3. doi:. PMID 7871435. Bibcode: 1995Sci...267.1360S. https://archive.org/details/sim_science_1995-03-03_267_5202/page/1360.
- ↑ 12,0 12,1 12,2 12,3 Olguín, Patricio; Pablo Oteíza; Eduardo Gamboa; José Luis Gómez-Skármeta; Manuel Kukuljan (8 March 2006). «RE-1 Silencer of Transcription/Neural Restrictive Silencer Factor Modulates Ectodermal Patterning during Xenopus Development». The Journal of Neuroscience 26 (10): 2820–2829. doi:. PMID 16525062. PMC 6675167. http://www.jneurosci.org/content/26/10/2820.full.pdf. Ανακτήθηκε στις 3 April 2013.
- ↑ 13,0 13,1 13,2 13,3 Kuwahara, Koichiro; Yoshihiko Saito; Emiko Ogawa; Nobuki Takahashi; Yasuaki Nakagawa; Yoshihisa Naruse; Masaki Harada; Ichiro Hamanaka και άλλοι. (21 March 2001). «The Neuron-Restrictive Silencer Element–Neuron-Restrictive Silencer Factor System Regulates Basal and Endothelin 1-Inducible Atrial Natriuretic Peptide Gene Expression in Ventricular Myocytes». Molecular and Cellular Biology 21 (6): 2085–97. doi:. PMID 11238943. PMC 86819. https://archive.org/details/sim_molecular-and-cellular-biology_2001-03_21_6/page/2085.
- ↑ Walker, FO (20 January 2007). «Huntington's disease.». Lancet 369 (9557): 218–28. doi:. PMID 17240289.
- ↑ Zuccato, C; Belyaev N; Conforti P; Ooi L; Tartari M; Papadimou E; MacDonald M; Fossale E και άλλοι. (27 June 2007). «Widespread disruption of repressor element-1 silencing transcription factor/neuron-restrictive silencer factor occupancy at its target genes in Huntington's disease.». The Journal of Neuroscience 27 (26): 6972–6983. doi:. PMID 17596446. PMC 6672230. http://www.jneurosci.org/content/27/26/6972.long. Ανακτήθηκε στις 21 March 2013.
- ↑ Rials, Seth; Ying Wu; Nancy Ford; Ferrel J. Pauletto; Sandra V. Abramson; Andrew M. Rubin; Roger A. Marinchak; Peter R. Kowey (1995). «Effect of Left Ventricular Hypertrophy and Its Regression on Ventricular Electrophysiology and Vulnerability to Inducible Arrhythmia in the Feline Heart». American Heart Association. PMID 7805247. http://circ.ahajournals.org/content/91/2/426.full. Ανακτήθηκε στις 3 April 2013.
- ↑ Sashida, Goro; Iwama, Atsushi (2012). «Epigenetic regulation of hematopoiesis». International Journal of Hematology 96 (4): 405–412. doi:. PMID 23054647.
