Ανασυνδυασμός V(D)J
Ο ανασυνδυασμός V(D)J (V(D)J recombination) είναι ο μοναδικός μηχανισμός γενετικού ανασυνδυασμού που συμβαίνει στην ανάπτυξη λεμφοκυττάρων κατά τα πρώιμα στάδια ωρίμανσης των κυττάρων T και B. Εμπεριέχει σωματικό ανασυνδυασμό (somatic recombination) και καταλήγει σε ποικίλο απόθεμα αντισωμάτων/ανοσοσφαιρινών (Igs) και υποδοχέων Τ-λεμφοκυττάρων (T cell receptors ή TCRs) που βρέθηκαν σε Β κύτταρα (B cells) και Τ κύτταρα (T cells), αντίστοιχα. Η διεργασία είναι ένα καθοριστικό γνώρισμα του επίκτητου ανοσοποιητικού συστήματος (adaptive immune system).
Ο ανασυνδυασμός V(D)J συμβαίνει στα πρωτογενή λεμφικά όργανα (primary lymphoid organs) (μυελός των οστών (bone marrow) για τα κύτταρα B και στον θύμο αδένα για τα κύτταρα T) και με ένα σχεδόν τυχαίο τρόπο αναδιατάσσει τα μεταβλητά (V), συνδετικά (J), και σε κάποιες περιπτώσεις ετερογενή (D) γονιδιακά τμήματα. Η διεργασία καταλήγει τελικά σε καινοτόμες αλληλουχίες αμινοξέος στις περιοχές σύνδεσης αντιγόνου των Igs και TCRs που επιτρέπουν την αναγνώριση των αντιγόνων από σχεδόν όλα τα παθογόνα, συμπεριλαμβανομένων των βακτηρίων, ιών, παρασίτων (parasites) και ελμίνθων (Helminths) καθώς και των "τροποποιημένων αυτοκυττάρων" όπως φαίνεται στον καρκίνο. Η αναγνώριση μπορεί επίσης να είναι αλλεργικής φύσης (π.χ. σε γύρη ή άλλα αλλεργιογόνα) ή μπορεί να ταιριάζει με ιστούς του ξενιστή και να οδηγεί σε αυτοανοσία.
Το 1987, ο Susumu Tonegawa τιμήθηκε με το Βραβείο Νόμπελ Φυσιολογίας και Ιατρικής[1] "για την ανακάλυψη της γενετικής αρχής δημιουργίας της ποικιλότητας των αντισωμάτων".
Υπόβαθρο[Επεξεργασία | επεξεργασία κώδικα]
Τα ανθρώπινα μόρια αντισωμάτων (συμπεριλαμβανομένων των υποδοχέων Β κυττάρων (B cell receptors) αποτελούνται από βαριές και ελαφριές αλυσίδες, που καθεμιά τους περιέχει και σταθερές (C) και μεταβλητές (V) περιοχές, γενετικά κωδικοποιημένες σε τρεις θέσεις:
- Τη θέση της βαριάς ανοσοσφαιρίνης (IGH@) στο χρωμόσωμα 14, που περιέχει γονιδιακά τμήματα για την βαριά αλυσίδα της ανοσοσφαιρίνης.
- Τη θέση κάπα (κ) της ανοσοσφαιρίνης (IGK@) στο χρωμόσωμα 2, που περιέχει γονιδιακά τμήματα για το τμήμα της ελαφριάς αλυσίδας της ανοσοσφαιρίνης.
- Τη θέση λάμδα (λ) της ανοσοσφαιρίνης (IGL@) στο χρωμόσωμα 22, που περιέχει τα γονιδιακά τμήματα για το υπόλοιπο της ελαφριάς αλυσίδας της ανοσοσφαιρίνης.
Κάθε γονίδιο βαριάς ή ελαφριάς αλυσίδας περιέχει πολλαπλά αντίγραφα των τριών διαφορετικών τύπων γονιδιακών τμημάτων για τις μεταβλητές περιοχές των πρωτεϊνών αντισώματος. Παραδείγματος χάρη, η ανθρώπινη περιοχή βαριάς αλυσίδας ανοσοσφαιρίνης περιέχει 2 σταθερά (Cμ και Cδ) γονιδιακά τμήματα και 44 μεταβλητά (V) γονιδιακά τμήματα,[2] συν 27 γονιδιακά τμήματα ετερογένειας (Diversity (D)) και 6 συνδετικά γονιδιακά τμήματα (Joining (J) gene segments).[3] Οι ελαφριές αλυσίδες έχουν επίσης 2 σταθερά (Cμ και Cδ) γονιδιακά τμήματα και πολυάριθμα V και J γονιδιακά τμήματα, αλλά δεν έχουν γονιδιακά τμήματα D. Η αναδιάταξη του DNA προκαλεί τη μετακίνηση ενός αντιγράφου κάθε τύπου γονιδιακού τμήματος σε οποιοδήποτε δεδομένο λεμφοκύτταρο, δημιουργώντας ένα τεράστιο απόθεμα αντισωμάτων· χονδρικά είναι δυνατοί 3×1011 συνδυασμοί, αν και κάποιοι αφαιρούνται λόγω αυτοδραστικότητας (self reactivity).
Οι περισσότεροι υποδοχείς κυττάρων Τ (T-cell receptors) αποτελούνται από μια αλυσίδα άλφα και μια αλυσίδα βήτα. Τα γονίδια υποδοχέων κυττάρων Τ, παρόμοια με τα γονίδια ανοσοσφαιρινών, περιέχουν επίσης πολλά γονιδιακά τμήματα V, D και J στις βήτα αλυσίδες τους (και γονιδιακά τμήματα V και J στις άλφα αλυσίδες τους) που αναδιατάσσονται κατά την ανάπτυξη των λεμφοκυττάρων για να δώσουν αυτό το κύτταρο με έναν μοναδικό υποδοχέα αντιγόνου. Ο υποδοχέας κυττάρου T σε αυτήν την έννοια είναι το τοπολογικό ισοδύναμο με ένα τμήμα σύνδεσης αντιγόνου του αντισώματος, που και τα δυο τους είναι τμήματα της υπεροικογένειας των ανοσοσφαιρινών.
Η αποτυχία του κυττάρου να δημιουργήσει ένα πετυχημένο προϊόν που δεν αυτοαντιδρά οδηγεί σε απόπτωση. Η αυτοανοσία αποτρέπεται εξουδετερώνοντας τα λεμφοκύτταρα που αυτοαντιδρούν στον θύμο ελέγχοντας τα ως προς μια διάταξη αυτοαντιγόνων που εκφράζονται μέσω της λειτουργίας του ρυθμιστή αυτοανοσίας (Autoimmune regulator ή Aire). Η θέση ελαφριάς αλυσίδας λάμδα ανοσοσφαιρινών περιέχει γονίδια κωδικοποιητικά πρωτεΐνης που μπορούν να χαθούν με την αναδιάταξή της. Αυτό βασίζεται σε έναν φυσιολογικό μηχανισμό και δεν είναι παθογενές για λευχαιμίες ή λεμφώματα.
Ανοσοσφαιρίνες[Επεξεργασία | επεξεργασία κώδικα]
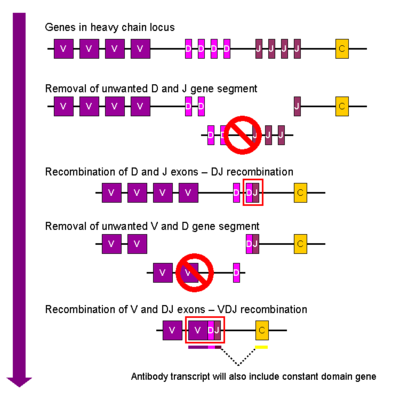
Βαριά αλυσίδα[Επεξεργασία | επεξεργασία κώδικα]
Στην ανάπτυξη του κυττάρου Β, το πρώτο γεγονός ανασυνδυασμού που συμβαίνει είναι μεταξύ ενός γονιδιακού τμήματος D και ενός J της θέσης της βαριάς αλυσίδας. Οποιοδήποτε DNA μεταξύ αυτών των δύο γονιδιακών τμημάτων διαγράφεται. Αυτός ο ανασυνδυασμός D-J ακολουθείται από την σύνδεση ενός γονιδιακού τμήματος V, από μια ανοδική περιοχή του νεοσχηματιζόμενου συμπλόκου DJ, σχηματίζοντας ένα αναδιαταγμένο γονιδιακό τμήμα VDJ. Όλα τα άλλα γονιδιακά τμήματα μεταξύ των τμημάτων V και D διαγράφονται τώρα από το γονιδίωμα του κυττάρου. Η πρωτογενής μεταγραφή αμάτιστου RNA ( unspliced RNA) δημιουργείται περιέχοντας την περιοχή VDJ της βαριάς αλυσίδας και τις δύο σταθερές αλυσίδες μ και δ (Cμ και Cδ). (δηλαδή, η πρωτογενής μεταγραφή περιέχει τα τμήματα: V-D-J-Cμ-Cδ). Το πρωτογενές RNA επεξεργάζεται για να προσθέσει μια πολυαδενυλιωμένη ουρά (poly-A) ουρά μετά την αλυσίδα Cμ και να αφαιρέσει την αλληλουχία μεταξύ του τμήματος VDJ και αυτού του σταθερού γονιδιακού τμήματος. Η μετάφραση αυτού του mRNA οδηγεί στην παραγωγή της Ig M βαριάς πρωτεϊνικής αλυσίδας.
Ελαφριά αλυσίδα[Επεξεργασία | επεξεργασία κώδικα]
Οι αλυσίδες (κ) και (λ) των θέσεων της ελαφριάς αλυσίδας της ανοσοσφαιρίνης αναδιατάσσονται με πολύ παρόμοιο τρόπο, με την εξαίρεση ότι στις ελαφριές αλυσίδες λείπει ένα τμήμα D. Με άλλα λόγια, το πρώτο βήμα του ανασυνδυασμού των ελαφριών αλυσίδων περιλαμβάνει τη σύνδεση των αλυσίδων V και J για να δώσουν ένα σύμπλοκο VJ πριν την προσθήκη του γονιδίου σταθερής αλυσίδας κατά την πρωτογενή μεταγραφή. Η μετάφραση του ματισμένου mRNA είτε για την κ, είτε για τη λ αλυσίδα καταλήγει στον σχηματισμό της Ig κ ή της Ig λ ελαφριάς πρωτεϊνικής αλυσίδας.
Το συγκρότημα της Ig μ βαριάς αλυσίδας και μιας από τις ελαφριές αλυσίδες καταλήγει στον σχηματισμό δεσμευμένης μορφής μεμβράνης της ανοσοσφαιρίνης Μ που εκφράζεται στην επιφάνεια του ανώριμου κυττάρου B.
Υποδοχείς κυττάρων Τ (T cell receptors)[Επεξεργασία | επεξεργασία κώδικα]
Κατά την ανάπτυξη του θυμοκυττάρου (thymocyte), οι αλυσίδες υποδοχέα κυττάρου Τ (T cell receptor ή TCR) υφίστανται ουσιαστικά την ίδια αλληλουχία συμβάντων στη διάταξη ανασυνδυασμού όπως περιγράφηκε για τις ανοσοσφαιρίνες. Ο ανασυνδυασμός D προς J συμβαίνει πρώτα στη β-αλυσίδα του TCR. Αυτή η διεργασία μπορεί να περιλάβει είτε τη σύνδεση του τμήματος γονιδίου του Dβ1 με ένα από τα έξι τμήματα Jβ1, είτε τη σύνδεση του τμήματος γονιδίου του Dβ2 με ένα από τα έξι τμήματα Jβ2.[4] Ο ανασυνδυασμός DJ ακολουθείται (όπως πιο πάνω) με αναδιατάξεις Vβ προς DβJβ. Όλα τα τμήματα του γονιδίου μεταξύ τμημάτων γονιδίου Vβ-Dβ-Jβ στο νεοσχηματιζόμενο σύμπλοκο διαγράφονται και συντίθεται το πρωτογενές μεταγράφημα που ενσωματώνει το σταθερό γονίδιο τομέα (Vβ-Dβ-Jβ-Cβ). Η μεταγραφή mRNA αφήνει εκτός οποιαδήποτε παρεμβαλλόμενη αλληλουχία και επιτρέπει τη μετάφραση ολόκληρου του μήκους της πρωτεΐνης για την β-αλυσίδα των TCR.
Η αναδιάταξη της αλυσίδας άλφα (α) των TCR ακολουθείται από αναδιάταξη της αλυσίδας β και μοιάζει με την αναδιάταξη V προς J που περιγράφηκε για τις ελαφριές αλυσίδες (δείτε πιο πάνω). Το συγκρότημα των αλυσίδων β- και α- καταλήγει στον σχηματισμό της αβ-TCR που εκφράζεται στην πλειοψηφία των Τ κυττάρων.
Μηχανισμός[Επεξεργασία | επεξεργασία κώδικα]
Βασικά ένζυμα και συστατικά[Επεξεργασία | επεξεργασία κώδικα]
Η διεργασία του ανασυνδυασμού του V(D)J μεσολαβείται από την ανασυνδυασμάση VDJ, που είναι μια ποικίλη συλλογή ενζύμων. Τα κύρια ένζυμα που περιλαμβάνονται είναι: τα γονίδια ενεργοποίησης ανασυνδυασμού 1 και 2 (recombination activating genes 1 and 2 ή RAG), η ακροτελική δεοξυνουκλεοτιδυλική μεταφοράση (terminal deoxynucleotidyl transferase ή TdT) και η νουκλεάση Artemis, μέλος της ευρέως διαδεδομένης οδού μη ομόλογης τελικής σύνδεσης (non-homologous end joining ή NHEJ) για την επισκευή του DNA.[5] Αρκετά άλλα ένζυμα είναι γνωστό ότι εμπλέκονται στη διεργασία και περιλαμβάνουν πρωτεϊνικές κινάσες εξαρτώμενες από το DNA (DNA-dependent protein kinase ή DNA-PK), την επισκευαστική πρωτεΐνη του DNA XRCC4, λιγάση DNA IV, μη ομόλογο παράγοντα 1 τελικής σύνδεσης (NHEJ1; γνωστό και ως Cernunnos ή παράγοντα XRCC4-οειδή [XLF]), το πρόσφατα ανακαλυφθέν παράλογο του XRCC4 και XLF (PAXX) καθώς και τις πολυμεράσες λ και μ του DNA.[6] Κάποια από τα εμπλεκόμενα ένζυμα είναι ειδικά για λεμφοκύτταρα (π.χ., RAG, TdT), ενώ άλλα βρίσκονται σε άλλους τύπους κυττάρων και ακόμα ευρέως διαδεδομένα (π.χ., συστατικά NHEJ).
Για να διατηρηθεί η εξειδίκευση του ανασυνδυασμού, η ανασυνδυασμάση V(D)J αναγνωρίζει και συνδέει με τις αλληλουχίες σηματοδότες ανασυνδυασμού (Recombination Signal Sequences ή RSSs) συνοδεύοντας τα μεταβλητά (V), ετερογενή(D) και συνδετικά (J) γονιδιακά τμήματα. Οι RSSs αποτελούνται από τρία στοιχεία: ένα επταμερές από επτά διατηρούμενα νουκλεοτίδια, μια περιοχή διαχωρισμού από 12 ή 23 ζεύγη βάσεων σε μήκος και ένα εννεαμερές από εννέα διατηρούμενα νουκλεοτίδια. Ενώ η πλειοψηφία των RSSs ποικίλει στην αλληλουχία, οι συναινετικές επταμερής και εννεαμερής αλληλουχία είναι CACAGTG και ACAAAAACC, αντίστοιχα· και αν και η αλληλουχία της περιοχής διαχωρισμού διατηρείται λίγο, το μήκος διατηρείται πολύ.[7][8] Το μήκος της περιοχής διαχωρισμού αντιστοιχεί σε περίπου μια (12 ζεύγη βάσεων) ή δύο στροφές (23 ζεύγη βάσεων) της έλικας του DNA. Ακολουθώντας αυτό που είναι γνωστό ως ο κανόνας 12/23, τα γονιδιακά τμήματα προς ανασυνδυασμό είναι συνήθως γειτονικά με τα RSSs διαφορετικών μηκών διαχωρισμού (δηλαδή, ένα έχει "12RSS" και ένα έχει "23RSS").[9] Αυτό είναι σημαντικό χαρακτηριστικό στη ρύθμιση του ανασυνδυασμού V(D)J.[10]
Διαδικασία[Επεξεργασία | επεξεργασία κώδικα]
Ο ανασυνδυασμός V(D)J ξεκινά όταν η ανασυνδυασμάση V(D)J (μέσω της δραστηριότητας του RAG1) συνδέει ένα πλευρικό RSS με ένα τμήμα κωδικοποιητικού γονιδίου (V, D, ή J) και δημιουργεί μια μονόκλωνη εντομή στο DNA μεταξύ της πρώτης βάσης του RSS (ακριβώς πριν το επταμερές) και του κωδικοποιητικού τμήματος. Αυτό είναι ουσιαστικά από πλευράς ενέργειας ουδέτερο (δεν χρειάζεται για την υδρόλυση ATP) και καταλήγει στον σχηματισμό ενός ελεύθερου 3' υδροξυλίου και ενός 5' φωσφορικού ανιόντος στην ίδια αλυσίδα. Η δραστική υδροξυλομάδα τοποθετείται από την ανασυνδυασμάση για να προσβάλει τον φωσφοδιεστερικό δεσμό της αντίθετης αλυσίδας, σχηματίζοντας δύο άκρα DNA: μια φουρκέτα (hairpin) (κορμό-θηλιά stem-loop) στο κωδικοποιητικό τμήμα και ένα αμβλύ άκρο στο τμήμα σήματος.[11] Το τρέχον πρότυπο είναι ότι το κόψιμο του DNA και ο σχηματισμός φουρκέτας συμβαίνει και στις δύο αλυσίδες ταυτόχρονα (ή σχεδόν ταυτόχρονα) σε ένα σύμπλοκο γνωστό ως κέντρο ανασυνδυασμού.[12][13][14][15]
Τα αμβλέα άκρα του σήματος ενώνονται μαζί για να σχηματίσουν ένα κυκλικό κομμάτι DNA που περιέχει όλες τις παρεμβαλλόμενες αλληλουχίες μεταξύ των κωδικοποιητικών τμημάτων γνωστών ως σύνδεση σήματος (αν και είναι κυκλικής φύσης και δεν πρέπει να συγχέεται με το πλασμίδιο). Ενώ αρχικά θεωρήθηκε ότι χάνεται κατά τις διαδοχικές διαιρέσεις του κυττάρου, υπάρχουν στοιχεία ότι οι συνδέσεις σήματος μπορεί να επανέλθουν στο γονιδίωμα και να οδηγήσουν σε παθολογίες ενεργοποιώντας ογκογόνα ή διακόπτοντας τις λειτουργίες ογκοκατασταλτικού γονιδίου (tumor suppressor gene).
Τα κωδικοποιητικά άκρα επεξεργάζονται παραπέρα πριν την σύνδεσή τους με αρκετά συμβάντα που τελικά οδηγούν σε συνδεσμική ποικιλία.[16] Η επεξεργασία ξεκινά όταν το DNA-PK συνδέει κάθε κομμένο άκρο DNA και μαζεύει αρκετές άλλες πρωτεΐνες συμπεριλαμβανομένων των Artemis, XRCC4, λιγάση IV του DNA, Cernunnos και αρκετές πολυμεράσες DNA.[17] Το DNA-PK σχηματίζει ένα σύμπλοκο που οδηγεί στην αυτοφωσφορυλίωσή του, με αποτέλεσμα την ενεργοποίηση του Artemis. Οι κωδικοποιητικές φουρκέτες άκρου ανοίγονται από τη δραστικότητα του Artemis.[18] Εάν ανοιχτούν στο κέντρο, θα έχει ως αποτέλεσμα ένα αμβλύ άκρο DNA· όμως σε πολλές περιπτώσεις, το άνοιγμα είναι "εκτός κέντρου" και καταλήγει στην παραμονή επιπρόσθετων βάσεων σε μία αλυσίδα (μια προεξοχή). Αυτά είναι γνωστά ως παλινδρομικά (P) νουκλεοτίδια λόγω της παλινδρομικής φύσης της αλληλουχίας που παράγεται όταν τα ένζυμα επιδιόρθωσης του DNA αναλύουν την προεξοχή.[19] Η διεργασία του ανοίγματος της φουρκέτας από το Artemis είναι ένα βασικό βήμα του ανασυνδυασμού V(D)J και είναι ελαττωματική σε βαρεία συνδυασμένη ανοσοανεπάρκεια τύπου ποντικιών (severe combined immunodeficiency (scid) mouse model).
Στη συνέχεια, XRCC4, Cernunnos και DNA-PK στοιχίζουν τα άκρα του DNA και μαζεύουν την ακροτελική δεοξυνουκλεοτιδική μεταφοράση (terminal deoxynucleotidyl transferase ή TdT), μια πολυμεράση DNA ανεξάρτητη από το καλούπι που προσθέτει (N) νουκλεοτίδια χωρίς καλούπι στο κωδικοποιητικό άκρο. Η προσθήκη είναι κυρίως τυχαία, αλλά η TdT παρουσιάζει μια προτίμηση για τα νουκλεοτίδια G/C.[20] Όπως με όλες τις γνωστές πολυμεράσες DNA, η TdT προσθέτει νουκλεοτίδια στον ένα κλώνο με κατεύθυνση 5' προς 3'.[21]
Τέλος, οι εξωνουκλεάσες μπορούν να αφαιρέσουν βάσεις από τα κωδικοποιητικά άκρα (συμπεριλαμβανομένων οποιονδήποτε νουκλεοτιδίων P ή N που μπορεί να έχουν σχηματιστεί). Οι πολυμεράσες λ και μ του DNA εισάγουν τότε πρόσθετα νουκλεοτίδια όπως απαιτείται για να καταστήσουν τα δύο άκρα συμβατά για σύνδεση. Αυτή είναι μια στοχαστική διεργασία, συνεπώς οποιοσδήποτε συνδυασμός της προσθήκης των νουκλεοτιδίων P και N και η εξωνουκλεολυτική αφαίρεση μπορούν να συμβούν (ή και τίποτα απολύτως). Τέλος, τα επεξεργασμένα κωδικοποιητικά άκρα συνδέονται μαζί από την λιγάση IV του DNA.[22]
Όλα αυτά τα συμβάντα επεξεργασίας καταλήγουν σε μια περιοχή σύνδεσης αντιγόνου που είναι πολύ μεταβλητή, ακόμα και όταν ανασυνδυάζονται τα ίδια τμήματα γονιδίου. Ο ανασυνδυασμός V(D)J επιτρέπει τη δημιουργία ανοσοσφαιρινών και υποδοχέων κυττάρων Τ σε αντιγόνα όπου, ούτε ο οργανισμός, ούτε οι πρόγονοί του χρειάζεται να έχουν προηγουμένως αντιμετωπίσει, επιτρέποντας μια προσαρμοστική ανοσοαπόκριση adaptive στα νέα παθογόνα που αναπτύσσονται ή σε αυτά που αλλάζουν συχνά (π.χ., εποχική γρίπη). Όμως, ένας μεγάλος περιορισμός σε αυτήν τη διεργασία είναι ότι η αλληλουχία DNA πρέπει να παραμείνει σε ανοιχτό πλαίσιο ανάγνωσης (Open reading frame) για να διατηρήσει τη σωστή αλληλουχία αμινοξέων στο τελικό προϊόν της πρωτεΐνης. Εάν η τελική αλληλουχία είναι εκτός πλαισίου (out-of-frame), η ανάπτυξη του κυττάρου θα σταματήσει και το κύτταρο δεν θα επιβιώσει για να ωριμάσει. Ο ανασυνδυασμός V(D)J είναι συνεπώς μια πολύ ακριβής διεργασία που πρέπει να είναι (και είναι) αυστηρά ρυθμισμένη και ελεγχόμενη.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ «The Nobel Prize in Physiology or Medicine 1987». nobelprize.org. Ανακτήθηκε στις 26 Δεκεμβρίου 2014.
- ↑ Matsuda, F; Ishii, K; Bourvagnet, P; Kuma, K; Hayashida, H; Miyata, T; Honjo, T (1998). «The complete nucleotide sequence of the human immunoglobulin heavy chain variable region locus». The Journal of Experimental Medicine 188 (11): 2151–62. doi:. PMID 9841928.
- ↑ Li A; Rue M; Zhou J και άλλοι. (June 2004). «Utilization of Ig heavy chain variable, diversity, and joining gene segments in children with B-lineage acute lymphoblastic leukemia: implications for the mechanisms of VDJ recombination and for pathogenesis». Blood 103 (12): 4602–9. doi:. PMID 15010366.
- ↑ K. Abbas, Abul (2015). Cellular and Molecular Immunology, 8e. ELSEVIER. σελίδες 192. ISBN 978-0323222754.
- ↑ Ma, Yunmei; Lu, Haihui; Schwarz, Klaus; Lieber, Michael (September 2005). «Repair of Double-Strand DNA Breaks by the Human Nonhomologous DNA End Joining Pathway: the Iterative Processing Model». Cell Cycle 4 (9): 1193–1200. doi:. PMID 16082219.
- ↑ Malu, Shruti; Malshetty, Vidyasagar; Francis, Dailia; Cortes, Patricia (2012). «Role of non-homologous end joining in V(D)J recombination.». Immunologic Research 54 (1–3): 233–246. doi:. PMID 22569912.
- ↑ Ramsden, Dale; Baetz, Kristin; Wu, Gillian (1994). «Conservation of Sequence in Recombination Signal Sequence Spacers». Nucleic Acids Research 22 (10): 1785–1796. doi:. PMID 8208601.
- ↑ Cowell, Lindsay; Davila, Marco; Ramsden, Dale; Kelsoe, Garnett (2004). «Computational tools for understanding sequence variability in recombination signals.». Immunological Reviews 200: 57–69. doi:. PMID 15242396.
- ↑ van Gent, Dik; Ramsden, Dale; Gellert, Martin (1996). «The RAG1 and RAG2 Proteins Establish the 12/23 Rule in V(D)J Recombination». Cell 85 (1): 107–13. doi:. PMID 8620529.
- ↑ Hiom, Kevin; Gellert, Martin (1998). «Assembly of a 12/23 Paired Signal Complex: a Critical Control Point in V(D)J Recombination». Molecular Cell 1 (7): 1011–1019. doi:. PMID 9651584.
- ↑ Schatz, David; Swanson, Patrick (2011). «V(D)J Recombination: Mechanisms of Initiation». Annual Review of Genetics 45: 167–202. doi:. PMID 21854230.
- ↑ Schatz, David; Ji, Yanhong (2011). «Recombination Centres and the Orchestration of V(D)J Recombination». Nature Reviews Immunology 11 (4): 251–263. doi:. PMID 21394103.
- ↑ Curry, John; Geier, Jamie; Schlissel, Mark (2005). «Single-Strand Recombination Signal Sequence Nicks in vivo: Evidence for a Capture Model of Synapsis». Nature Immunology 6 (12): 1272–1279. doi:. PMID 16286921.
- ↑ Agrawal, Alka; Schatz, David (1997). «RAG1 and RAG2 Form a Stable Postcleavage Synaptic Complex with DNA Containing Signal Ends in V(D)J Recombination». Cell 89 (1): 43–53. doi:. PMID 9094713.
- ↑ Fugmann, Sebastian; Lee, AIfred; Shockett, Penny; Villey, Isabelle; Schatz, David (2000). «The RAG Proteins and V(D)J Recombination: Complexes, Ends, and Transposition». Annual Review of Immunology 18: 495–527. doi:. PMID 10837067.
- ↑ Lewis, Susanna (1994). The Mechanism of V(D)J Joining: Lessons from Molecular, Immunological, and Comparative Analyses. Advances in Immunology. 56. σελίδες 27–150. doi:10.1016/s0065-2776(08)60450-2. ISBN 9780120224562. PMID 8073949.
- ↑ Helmink, Beth; Sleckman, Barry (2012). «The response to and repair of RAG-mediated DNA double-strand breaks.». Annual Review of Immunology 30: 175–202. doi:. PMID 22224778.
- ↑ Ma, Yunmei; Schwarz, Klaus; Lieber, Michael (2005). «The Artemis:DNA-PKcs Endonuclease Cleaves DNA Loops, Flaps, and Gaps». DNA Repair 4 (7): 845–851. doi:. PMID 15936993.
- ↑ Lu, Haihui; Schwarz, Klaus; Lieber, Michael (2007). «Extent to Which Hairpin Opening by the Artemis:DNA-PKcs Complex can Contribute to Junctional Diversity in V(D)J Recombination». Nucleic Acids Research 35 (20): 6917–6923. doi:. PMID 17932067.
- ↑ Gauss, George; Lieber, Michael (1996). «Mechanistic Constraints on Diversity in Human V(D)J Recombination». Molecular and Cellular Biology 16 (1): 258–269. doi:. PMID 8524303. PMC 230999. https://archive.org/details/sim_molecular-and-cellular-biology_1996-01_16_1/page/258.
- ↑ Benedict, Cindy; Gilfillan, Susan; Thai, To-Ha; Kearney, John (2000). «Terminal Deoxynucleotidyl Transferase and Repertoire Development.». Immunological Reviews 175: 150–157. doi:. PMID 10933600.
- ↑ D.C. van Gent ; M. van der Burg (2007). «Non-Homologous End-Joining, a Sticky Affair». Oncogene 26 (56): 7731–7740. doi:. PMID 18066085.
Παραπέρα μελέτη[Επεξεργασία | επεξεργασία κώδικα]
- Hartwell LH, Hood L, Goldberg ML, Reynolds AE, Silver LM, Veres RC (2000). Chapter 24, Evolution at the molecular level. In: Genetics. New York: McGraw-Hill. σελίδες 805–807. ISBN 978-0-07-299587-9.
- V(D)J Recombination. Series: Advances in Experimental Medicine and Biology, Vol. 650 Ferrier, Pierre (Ed.) Landes Bioscience 2009, XII, 199 p. (ISBN 978-1-4419-0295-5)
