Τριφαροτένη
 | |
| Ονομασία IUPAC | |
|---|---|
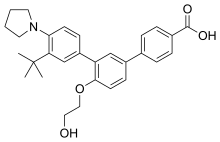
4-[3-(3-tert-Butyl-4-pyrrolidin-1-ylphenyl)-4-(2-hydroxyethoxy)phenyl]benzoic acid | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Aklief |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a620004 |
| Δεδομένα άδειας |
|
| Κατηγορία ασφαλείας κύησης | |
| Οδοί χορήγησης | Τοπικά |
| Κυκλοφορία | |
| Κυκλοφορία | |
| Κωδικοί | |
| Αριθμός CAS | 895542-09-3 |
| Κωδικός ATC | D10AD06 |
| PubChem | CID 11518241 |
| DrugBank | DB12808 |
| ChemSpider | 9693029 |
| UNII | 0J8RN2W0HK |
| KEGG | D11225 |
| ChEMBL | CHEMBL3707313 |
| Συνώνυμα | CD5789 |
| Χημικά στοιχεία | |
| Χημικός τύπος | C29H33NO4 |
| Μοριακή μάζα | 459,59 g·mol−1 |
CC(C)(C)c1cc(-c2cc(-c3ccc(C(=O)O)cc3)ccc2OCCO)ccc1N1CCCC1 | |
InChI=1S/C29H33NO4/c1-29(2,3)25-19-23(10-12-26(25)30-14-4-5-15-30)24-18-22(11-13-27(24)34-17-16-31)20-6-8-21(9-7-20)28(32)33/h6-13,18-19,31H,4-5,14-17H2,1-3H3,(H,32,33) Key:MFBCDACCJCDGBA-UHFFFAOYSA-N | |
Η τριφαροτένη, που πωλείται με την επωνυμία Aklief, είναι φάρμακο για την τοπική θεραπεία της κοινής ακμής.[6] Είναι ένα ρετινοειδές,[7] συγκεκριμένα, ένας εκλεκτικός αγωνιστής τέταρτης γενιάς του υποδοχέα ρετινοϊκού οξέος (RAR)-γάμμα.[8]
Η τριφαροτένη ονομάστηκε ορφανό φάρμακο για τη θεραπεία της συγγενούς ιχθύασης τόσο από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) όσο και από τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA).[9][10] Εγκρίθηκε για ιατρική χρήση στις Ηνωμένες Πολιτείες τον Οκτώβριο του 2019.[6][11][12] Το Δεκέμβριο του 2019, το κείμενο της επισήμανσης και του φύλλου οδηγιών έλαβε αποκεντρωμένη έγκριση για 16 ευρωπαϊκές χώρες.[13]
Ιατρικές χρήσεις[Επεξεργασία | επεξεργασία κώδικα]
Στις Ηνωμένες Πολιτείες, η τριφαροτένη ενδείκνυται για την τοπική θεραπεία της κοινής ακμής σε άτομα ηλικίας 9 ετών και άνω.
Τόσο στον Καναδά όσο και στην Αυστραλία, ενδείκνυται για την τοπική θεραπεία της κοινής ακμής του προσώπου ή/και του κορμού σε άτομα ηλικίας 12 ετών και άνω.
Κοινωνία και πολιτισμός[Επεξεργασία | επεξεργασία κώδικα]
Νομική υπόσταση[Επεξεργασία | επεξεργασία κώδικα]
Η τριφαροτένη εγκρίθηκε για ιατρική χρήση στις Ηνωμένες Πολιτείες τον Οκτώβριο του 2019,[12] στον Καναδά τον Νοέμβριο του 2019 και στην Αυστραλία τον Ιανουάριο του 2021.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ 1,0 1,1 «Trifarotene Product Information». Therapeutic Goods Administration (TGA). Ανακτήθηκε στις 23 Μαΐου 2021.
- ↑ 2,0 2,1 «Aklief». Therapeutic Goods Administration (TGA). 28 Ιανουαρίου 2021. Ανακτήθηκε στις 8 Σεπτεμβρίου 2021.
- ↑ https://pdf.hres.ca/dpd_pm/00054047.PDF Πρότυπο:Bare URL PDF
- ↑ «Summary Basis of Decision (SBD) for Aklief». Health Canada. 23 Οκτωβρίου 2014. Ανακτήθηκε στις 29 Μαΐου 2022.
- ↑ «Aklief- trifarotene cream». DailyMed. Ανακτήθηκε στις 22 Μαΐου 2021.
- ↑ 6,0 6,1 «Drug Trials Snapshots: Aklief». Οργανισμός Τροφίμων και Φαρμάκων (ΗΠΑ) (FDA). 11 Οκτωβρίου 2019. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Νοεμβρίου 2019. Ανακτήθηκε στις 18 Νοεμβρίου 2019.
- ↑ «Trifarotene Monograph for Professionals». Drugs.com. 28 Οκτωβρίου 2019. Ανακτήθηκε στις 23 Μαΐου 2021.
- ↑ «Trifarotene: First Approval». Drugs 79 (17): 1905–09. November 2019. doi:. PMID 31713811. http://link.springer.com/10.1007/s40265-019-01218-6.
- ↑ «Trifarotene Orphan Drug Designations and Approvals». Οργανισμός Τροφίμων και Φαρμάκων (ΗΠΑ) (FDA). 24 Δεκεμβρίου 1999. Ανακτήθηκε στις 19 Αυγούστου 2020.
- ↑ «EU/3/20/2264». Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA). 12 Αυγούστου 2020. Ανακτήθηκε στις 19 Αυγούστου 2020.
- ↑ «Aklief (trifarotene) FDA Approval History». Drugs.com. 7 Οκτωβρίου 2019. Ανακτήθηκε στις 19 Νοεμβρίου 2019.
- ↑ 12,0 12,1 «Drug Approval Package: Aklief». Οργανισμός Τροφίμων και Φαρμάκων (ΗΠΑ) (FDA). 21 Οκτωβρίου 2019. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Νοεμβρίου 2019. Ανακτήθηκε στις 18 Νοεμβρίου 2019.
- ↑ (20 December 2019). Galderma receives a positive outcome through the European Decentralised Procedure for AKLIEF (trifarotene 50 mcg/g cream), the first new retinoid molecule for acne in the European Union in 25 years. Δελτίο τύπου.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
- «Trifarotene». Drug Information Portal. Αμερικανική Εθνική Ιατρική Βιβλιοθήκη (NLM).
