Πυρηνίσκος
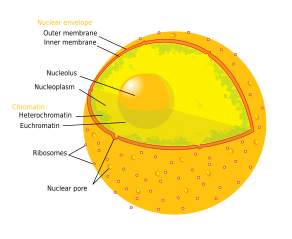
Ο πυρηνίσκος είναι η μεγαλύτερη δομή στον πυρήνα των ευκαρυωτικών κυττάρων[1] Είναι περισσότερο γνωστό ως η τοποθεσία βιογένεσης του ριβοσώματος. Ο πυρηνίσκος συμμετέχει επίσης στο σχηματισμό σωματιδίων αναγνώρισης σήματος (signal recognition particles) και παίζει ρόλο στην απόκριση του κυττάρου στο άγχος.[2] Οι πυρηνίσκοι αποτελούνται από πρωτεΐνες, DNA και RNA και σχηματίζονται γύρω από συγκεκριμένες χρωμοσωμικές περιοχές που ονομάζονται περιοχές οργάνωσης του πυρηνίσκου (nucleolar organizing regions). Η δυσλειτουργία των πυρηνίσκων μπορεί να είναι η αιτία πολλών ανθρώπινων καταστάσεων που ονομάζονται "πυρηνοπάθειες"[3][4] και ο πυρηνίσκος διερευνάται ως στόχος για χημειοθεραπείας του καρκίνου.[5][6]
Ιστορικό[Επεξεργασία | επεξεργασία κώδικα]
Ο πυρηνίσκος αναγνωρίστηκε με μικροσκοπία φωτεινού πεδίου (bright-field microscopy) κατά τη δεκαετία του 1830.[7] Λίγα ήταν γνωστά για τη λειτουργία του πυρηνίσκου μέχρι το 1964, όταν μια μελέτη [8] των πυρηνίσκων από τους John Gurdon και Donald Brown στον ονυχοφόρο αφρικανικό βάτραχο Xenopus laevis προκάλεσε αυξανόμενο ενδιαφέρον για τη λειτουργία και τη λεπτομερή δομή του πυρηνίσκου. Διαπίστωσαν ότι το 25% των αυγών βατράχου δεν είχαν πυρηνίσκο και ότι τέτοια αυγά δεν ήταν ικανά να ζήσουν. Τα μισά από τα αυγά είχαν έναν πυρηνίσκο και το 25% είχαν δύο. Κατέληξαν στο συμπέρασμα ότι ο πυρηνίσκος είχε μια λειτουργία απαραίτητη για τη ζωή. Το 1966 ο Max L. Birnstiel και οι συνεργάτες του έδειξαν μέσω πειραμάτων υβριδοποίησης νουκλεϊκού οξέος ότι το DNA εντός των πυρηνίσκων κωδικοποιεί το ριβοσωμικό RNA.[9][10]
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Τρία κύρια συστατικά του πυρηνίσκου αναγνωρίζονται: το ινιδικό κέντρο (fibrillar center, FC), το πυκνό ινιδικό συστατικό (dense fibrillar component, DFC) και το κοκκώδες συστατικό (granular component, GC).[1] Η μεταγραφή του ριβοσωμικού DNA συμβαίνει στο FC.[11] Το DFC περιέχει την πρωτεΐνη φιμπριλλαρίνη (fibrillarin),[11] η οποία είναι σημαντική για την επεξεργασία του rRNA. Το GC περιέχει την πρωτεΐνη νουκλεοφωσμίνη (NPM1),[11] (Β23 στην εξωτερική εικόνα) που εμπλέκεται επίσης στη βιογένεση του ριβοσώματος. Ωστόσο, έχει προταθεί ότι αυτή η συγκεκριμένη οργάνωση παρατηρείται μόνο σε ανώτερους ευκαρυώτες και ότι εξελίχθηκε από μια διμερή οργάνωση με τη μετάβαση από αναμνιωτά (anamniotes) σε αμνιωτά (amniotes). Αντικατοπτρίζοντας την ουσιαστική αύξηση στη διαγονιδιακή περιοχή του DNA, ένα αρχικό ινιδικό συστατικό θα είχε διαχωριστεί στο FC και στο DFC.[12]
Μια άλλη δομή που αναγνωρίζεται σε πολλούς πυρηνίσκους (ιδιαίτερα στα φυτά) είναι μια καθαρή περιοχή στο κέντρο της δομής που αναφέρεται ως πυρηνικό κενοτόπιο.[13] Πυρηνίσκοι διαφόρων φυτικών ειδών έχει αποδειχθεί ότι έχουν πολύ υψηλές συγκεντρώσεις σιδήρου [14] αντίθετα από τους πυρηνίσκους ανθρώπινων και ζωικών κυττάρων. H υπερδομή του πυρηνίσκου μπορεί να φανεί μέσω ηλεκτρονικού μικροσκοπίου, ενώ η οργάνωση και η δυναμική μπορούν να μελετηθούν μέσω φθορίζουσα σήμανσης πρωτεΐνης (fluorescent protein tagging) και φθορίζουσας ανάκτησης μετά από φωτολεύκανση (ανάκτηση φθορισμού μετά από φωτολεύκανση (Fluorescence recovery after photobleaching, FRAP)). Τα αντισώματα κατά της πρωτεΐνης PAF49 μπορούν επίσης να χρησιμοποιηθούν ως δείκτης για τον πυρηνίσκο σε πειράματα ανοσοφθορισμού.[15] Αν και συνήθως μόνο ένας ή δύο πυρηνίσκοι μπορούν να φανούν, ένα διπλοειδές ανθρώπινο κύτταρο έχει δέκα περιοχές οργανωτή πυρηνίσκου (NORs) και θα μπορούσε να έχει περισσότερους πυρηνίσκους. Τις περισσότερες φορές πολλά NOR συμμετέχουν σε κάθε πυρηνίσκο.[16]
Λειτουργία και συγκρότηση ριβοσώματος[Επεξεργασία | επεξεργασία κώδικα]

Στη βιογένεση ριβοσώματος, απαιτούνται δύο από τα τρεις ευκαρυωτικές RNA πολυμεράσες (Pol I και Pol III) και αυτές λειτουργούν σε συντονισμένο τρόπο. Σε ένα αρχικό στάδιο, τα γονίδια rRNA μεταγράφονται ως μία μονάδα εντός του πυρηνίσκου από την RNA πολυμεράση Ι. Προκειμένου να συμβεί αυτή η μεταγραφή, απαιτούνται αρκετοί παράγοντες που σχετίζονται με την pol I και παράγοντες trans ειδικοί για το DNA. Στη ζύμη, οι πιο σημαντικοί είναι: ο παράγοντας ενεργοποίησης (upstream activating factor UAF), η πρωτεΐνη δέσμευσης TATA (TBP) και o παράγοντας δέσμευσης (core binding factor, CBF) που δεσμεύουν στοιχεία προαγωγέα και σχηματίζουν το σύμπλοκο προέναρξης (preinitiation complex, PIC), το οποίο με τη σειρά του αναγνωρίζεται από τη pol του RNA. Στους ανθρώπους, ένα παρόμοιο PIC συναρμολογείται με τον επιλεκτικό παράγοντα 1 (SL1), τον παράγοντα εκλεκτικότητας προαγωγέα (που αποτελείται από TBP και παράγοντες που σχετίζονται με TBP (TAF), παράγοντες έναρξης μεταγραφής και παράγοντα δέσμευσης (UBF). Η RNA πολυμεράση Ι μεταγράφει τα περισσότερα μεταγραφήματα rRNA (28S, 18S και 5.8S), αλλά η υπομονάδα 5S rRNA (συστατικό της ριβοσωμικής υπομονάδας 60S) μεταγράφεται από την RNA πολυμεράση III.[17] Η μεταγραφή του rRNA αποδίδει ένα μακρύ πρόδρομο μόριο (45S προ-rRNA) το οποίο εξακολουθεί να περιέχει τα ITS και ETS. Απαιτείται περαιτέρω επεξεργασία για τη δημιουργία των μορίων RNA 18S, 5.8S και 28S RNA. Στους ευκαρυώτες, τα ένζυμα που τροποποιούν το RNA μεταφέρονται στις αντίστοιχες θέσεις αναγνώρισης τους μέσω αλληλεπίδρασης με οδηγούς RNA, που δεσμεύουν αυτές τις συγκεκριμένες αλληλουχίες. Αυτά τα καθοδηγητικά RNA ανήκουν στην κατηγορία των μικρών πυρηνισκικών RNA (small nucleolar RNAs, snoRNAs) που είναι συμπλεγμένα με πρωτεΐνες και υπάρχουν ως μικροπυρηνισκικές-ριβονουκλεοπρωτεΐνες (small-nucleolar-ribonucleoproteins, snoRNP]]s). Μόλις επεξεργαστούν οι υπομονάδες rRNA, είναι έτοιμες να συνδυαστούν σε μεγαλύτερες ριβοσωμικές υπομονάδες. Ωστόσο, ένα επιπλέον μόριο rRNA, το 5S rRNA, είναι επίσης απαραίτητο. Στη ζύμη, η αλληλουχία 5S rDNA εντοπίζεται στο διαγονιδιακό διαχωριστή και μεταγράφεται στον πυρηνίσκο από τη pol RNA. Σε ανώτερα ευκαρυωτικά κύτταρα και φυτά, η κατάσταση είναι πιο περίπλοκη, γιατί η αλληλουχία DNA 5S βρίσκεται εκτός του NOR και μεταγράφεται από τη pol RNA III στο πυρηνόπλασμα, μετά από το οποίο βρίσκει το δρόμο της στον πυρηνίσκο ώστε να συμμετάσχει στη συναρμολόγηση του ριβοσώματος. Αυτό το συγκρότημα δεν περιλαμβάνει μόνο το rRNA, αλλά και ριβοσωμικές πρωτεΐνες. Τα γονίδια που κωδικοποιούν αυτές τις r-πρωτεΐνες μεταγράφονται από την pol II στο νουκλεόπλασμα μέσω μιας "συμβατικής" οδού πρωτεϊνικής σύνθεσης (μεταγραφή, επεξεργασία προ-mRNA, πυρηνική εξαγωγή ώριμου mRNA και μετάφραση σε κυτταροπλασματικά ριβοσώματα). Οι ώριμες ριβοσωμικές πρωτεΐνες στη συνέχεια εισάγονται στον πυρήνα και τελικά στον πυρηνίσκο. Η σύνδεση και η ωρίμανση του rRNA και των ριβοσωμικών πρωτεϊνών έχει ως αποτέλεσμα το σχηματισμό των 40S (μικρών) και 60S (μεγάλων) υπομονάδων του πλήρους ριβοσώματος. Αυτές εξάγονται μέσω των συμπλεγμάτων πυρηνικών πόρων στο κυτταρόπλασμα, όπου παραμένουν ελεύθερες ή συνδέονται με το ενδοπλασματικό δίκτυο, σχηματίζοντας το αδρό ενδοπλασματικό δίκτυο (rough endoplasmic reticulum, RER).[18][19] Στα ανθρώπινα ενδομήτρια κύτταρα, μερικές φορές σχηματίζεται ένα δίκτυο πυρηνισκικών καναλιών. Η προέλευση και η λειτουργία αυτού του δικτύου δεν έχουν ακόμη προσδιοριστεί με σαφήνεια.[20]
Απομόνωση πρωτεϊνών[Επεξεργασία | επεξεργασία κώδικα]
Εκτός από το ρόλο του στη ριβοσωματική βιογένεση, ο πυρηνίσκος είναι γνωστό ότι συλλαμβάνει και ακινητοποιεί πρωτεΐνες, μια διαδικασία γνωστή ως πυρηνισκική κράτηση. Οι πρωτεΐνες που συγκρατούνται στον πυρηνίσκο δεν είναι σε θέση να διαχυθούν και να αλληλεπιδράσουν με τους δεσμευτικούς τους εταίρους. Οι στόχοι αυτού του μετα-μεταφραστικού ρυθμιστικού μηχανισμού περιλαμβάνουν τον ογκοκατασταλτικό Von Hippel–Lindau (Von Hippel–Lindau tumor suppressor, VHL), την πρωτεΐνη προμυελοκυτταρικής λευχαιμίας (Promyelocytic leukemia protein, PML), το MDM2, το POLD1, το RelA, το HAND1 και την αντίστροφη μεταγραφάση της τελομεράσης (Telomerase reverse transcriptase, TERT), μεταξύ πολλών άλλων. Είναι πλέον γνωστό ότι τα μακριά μη κωδικοποιητικά RNA που προέρχονται από διαγονιδιακές περιοχές του πυρήνα είναι υπεύθυνα για αυτό το φαινόμενο.[21]
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ 1,0 1,1 «The nucleolus: a raft adrift in the nuclear sea or the keystone in nuclear structure?». Biomolecular Concepts 4 (3): 277–86. June 2013. doi:. PMID 25436580.
- ↑ Olson, Mark OJ· Dundr, Miroslav (16 Φεβρουαρίου 2015). «Nucleolus: Structure and Function». Encyclopedia of Life Sciences (eLS). doi:10.1002/9780470015902.a0005975.pub3. ISBN 978-0-470-01617-6.
- ↑ «Role of the nucleolus in human diseases. Preface». Biochimica et Biophysica Acta 1842 (6): 757. June 2014. doi:. PMID 24631655.
- ↑ Bahadori, M; Azizi, MH; Dabiri, S; Bahadori, N (2022). «Effects of Human Nucleolus Upon Guest Viral-Life, Focusing in COVID-19 Infection: A Mini- Review.». Iranian Journal of Pathology 17 (1): 1–7. doi:. PMID 35096082.
- ↑ «Targeting the nucleolus for cancer intervention». Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease 1842 (6): 802–16. June 2014. doi:. PMID 24389329.
- ↑ «The nucleolus as a fundamental regulator of the p53 response and a new target for cancer therapy». Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms 1849 (7): 821–9. July 2015. doi:. PMID 25464032.
- ↑ «The nucleolus». Cold Spring Harbor Perspectives in Biology 3 (3): a000638. March 2011. doi:. PMID 21106648.
- ↑ «Absence of ribosomal rna synthesis in the anucleolate mutant of xenopus laevis». Proceedings of the National Academy of Sciences of the United States of America 51 (1): 139–46. January 1964. doi:. PMID 14106673. Bibcode: 1964PNAS...51..139B.
- ↑ «Localization of the ribosomal DNA complements in the nucleolar organizer region of Xenopus laevis». National Cancer Institute Monograph 23: 431–47. December 1966. PMID 5963987.
- ↑ «Ribosomal cistrons and the nucleolar organizer». Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis 114 (2): 296–310. February 1966. doi:. PMID 5943882.
- ↑ 11,0 11,1 11,2 «Nucleolus: the fascinating nuclear body». Histochemistry and Cell Biology 129 (1): 13–31. January 2008. doi:. PMID 18046571.
- ↑ «Birth of a nucleolus: the evolution of nucleolar compartments». Trends in Cell Biology 15 (4): 194–9. April 2005. doi:. PMID 15817375. as PDF Αρχειοθετήθηκε 17 December 2008 στο Wayback Machine.
- ↑ «The organization of ribosomal RNA processing correlates with the distribution of nucleolar snRNAs». Journal of Cell Science 109 ( Pt 6) (6): 1241–51. June 1996. doi:. PMID 8799814. http://jcs.biologists.org/cgi/content/short/109/6/1241.
- ↑ «Plant cell nucleolus as a hot spot for iron». The Journal of Biological Chemistry 286 (32): 27863–6. August 2011. doi:. PMID 21719700.
- ↑ PAF49 antibody | GeneTex Inc. Genetex.com. Retrieved 2019-07-18.
- ↑ von Knebel Doeberitz M, Wentzensen N (2008). «The Cell: Basic Structure and Function». Comprehensive Cytopathology (third έκδοση).
- ↑ Champe, Pamela C.· Harvey, Richard A.· Ferrier, Denise R. (2005). Lippincott's Illustrated Reviews: Biochemistry. Lippincott Williams & Wilkins. ISBN 978-0-7817-2265-0.
- ↑ Alberts, Bruce· Johnson, Alexander· Lewis, Julian· Raff, Martin· Roberts, Keith· Walter, Peter (2002). Molecular Biology of the Cell (4th έκδοση). New York: Garland Science. σελίδες 331–3. ISBN 978-0-8153-3218-3.
- ↑ Cooper, Geoffrey M.· Hausman, Robert E. (2007). The Cell: A Molecular Approach (4th έκδοση). Sinauer Associates. σελίδες 371–9. ISBN 978-0-87893-220-7.
- ↑ Wang, Tzuneng; Schneider, J (1 July 1992). «Origin and fate of the nucleolar channel system of normal human endometrium». Cell Research 2 (2): 97–102. doi:.
- ↑ «Immobilization of proteins in the nucleolus by ribosomal intergenic spacer noncoding RNA». Molecular Cell 45 (2): 147–57. January 2012. doi:. PMID 22284675.
Περαιτέρω μελέτη[Επεξεργασία | επεξεργασία κώδικα]
- Cooper, Geoffrey M. (2000). «The Nucleolus». The Cell: A Molecular Approach (2nd έκδοση). Sunderland MA: Sinauer Associates. ISBN 978-0-87893-106-4.
- «Nucleolar Function in Lifespan Regulation». Trends in Cell Biology 28 (8): 662–672. August 2018. doi:. PMID 29779866.
- JoAnna Klein (20 May 2018). «The Thing Inside Your Cells That Might Determine How Long You Live». The New York Times. https://www.nytimes.com/2018/05/20/science/nucleolus-cells-aging.html.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
- Nucleolus under electron microscope II at uni-mainz.de Αρχειοθετήθηκε 2011-05-18 στο Wayback Machine.
- Nuclear Protein Database – search under compartment
|
