Καρβονύλιο

Στην οργανική χημεία, μια καρβονυλομάδα είναι μια χαρακτηριστική ομάδα που αποτελείται από ένα άτομο άνθρακα ενωμένο με διπλό δεσμό με ένα άτομο οξυγόνου: C=O. Είναι σύνηθες σε αρκετές κατηγορίες οργανικών ενώσεων, ως μέρος πολλών μεγαλύτερων χαρακτηριστικών ομάδων. Μια ένωση που περιέχει καρβονυλομάδα αναφέρεται συχνά ως καρβονυλική ένωση.
Ο όρος καρβονύλιο μπορεί επίσης να αναφέρεται στο μονοξείδιο του άνθρακα ως ενός υποκαταστάτη σε ένα ανόργανο ή οργανομεταλλικό σύμπλοκο (ένα μεταλλοκαρβονύλιο, π.χ. νικελοκαρβονύλιο).
Το υπόλοιπο αυτού του άρθρου αφορά τον ορισμό του καρβονυλίου στην οργανική χημεία, όπου ο άνθρακας και το οξυγόνο μοιράζονται έναν διπλό δεσμό.
Καρβονυλικές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Μια καρβονυλομάδα χαρακτηρίζει του παρακάτω τύπους ενώσεων:
| Ένωση | Αλδεΰδη | κετόνη | Καρβοξυλικό οξύ | Εστέρας | Αμίδιο |
| Δομή |  |
 |

| ||
| Γενικός τύπος | RCHO | RCOR' | RCOOH | RCOOR' | RCONR'R'' |
| Ένωση | Ενόνη | Ακυλαλογονίδιο | Ανυδρίτης οξέος | Ιμίδιο |
| Δομή |  |
 |
 |

|
| Γενικός τύπος | RC(O)C(R')CR''R''' | RCOX | (RCO)2O | RC(O)N(R')C(O)R''' |
Σημειώστε ότι συνήθως χρησιμοποιούνται οι πιο ειδικές ονομασίες. Παραδείγματος χάρη, οι δομές R(CO)O(CO)R' είναι γνωστές ως ανυδρίτες οξέος, παρά ως η πιο γενική ονομασία εστέρας, αν και η δομή του εστέρα είναι παρούσα.

Άλλες οργανικές καρβονυλικές ενώσεις είναι η ουρία και τα καρβαμιδικά, τα παράγωγα των ακυλοχλωριδίων, τα χλωροφορμικά, το φωσγένιο, ανθρακικοί εστέρες, θειοεστέρες, λακτόνες, λακτάμες, υδροξαμικά, και ισοκυανικά. Παραδείγματα ανόργανων καρβονυλικών ενώσεων είναι το διοξείδιο του άνθρακα και το θειούχο καρβονύλιο.
Μια ειδική ομάδα των καρβονυλικών ενώσεων είναι οι 1,3-δικαρβονυλικές ενώσεις που έχουν όξινα πρωτόνια στην κεντρική μονάδα μεθυλενίου. Παραδείγματα είναι τo οξύ Μέλντρουμ (Meldrum's acid), ο μηλονικός διαιθυλεστέρας (diethyl malonate) και η ακετυλακετόνη (acetylacetone).
Δραστικότητα[Επεξεργασία | επεξεργασία κώδικα]
Το οξυγόνο είναι πιο ηλεκτραρνητικό από τον άνθρακα και συνεπώς απομακρύνει την ηλεκτρονιακή πυκνότητα από τον άνθρακα αυξάνοντας την πολικότητα του δεσμού. Συνεπώς, ο άνθρακας γίνεται ηλεκτρονιόφιλος (ελαφρά θετικός). Μπορεί να προσβληθεί από πυρηνόφιλα (αρνητικά φορτισμένα ιόντα, όπως το κυανιούχο ιόν) ή ένα αρνητικά φορτισμένο τμήμα ενός άλλου μορίου, όπως το "μονήρες ζεύγος" του ατόμου αζώτου στο μόριο της αμμωνίας. Κατά την αντίδραση, ο διπλός δεσμός άνθρακα-οξυγόνου σπάει, και η καρβονυλομάδα μπορεί να υποστεί αντιδράσεις προσθήκης. Αυτή η αντίδραση είναι γνωστή ως αντίδραση προσθήκης-απόσπασης (επειδή ένα μόριο νερού συχνά χάνεται) ή ως αντίδραση συμπύκνωσης.[1]

Επίσης, το ηλεκτραρνητικό οξυγόνο μπορεί να αντιδράσει με ένα ηλεκτρόφιλο· παραδείγματος χάρη, ένα πρωτόνιο σε ένα όξινο διάλυμα ή άλλο οξύ κατά Λιούις σχηματίζοντας ένα ιόν οξοκαρβενίου.
Τα άλφα υδρογόνα μιας καρβονυλικής ένωσης είναι πολύ πιο όξινα (χοντρικά 1030 φορές πιο όξινα) από τον τυπικό υβριδισμό τροχιακών sp3 των δεσμών C-H, όπως αυτών στο μεθάνιο. Παραδείγματος χάρη, οι τιμές pKa της αιθανάλης και της προπανόνης είναι 16,7 και 19 αντίστοιχα,[2] ενώ η τιμή pKa του μεθανίου με προεκβολή δίνει περίπου 50.[3] Αυτό συμβαίνει επειδή το καρβονύλιο είναι σε ταυτομέρεια με μια ενόλη. Η αποπρωτονίωση της ενόλης με μια ισχυρή βάση παράγει ένα ενολικό που είναι ένα ισχυρό πυρηνόφιλο και μπορεί να αλκυλιώσει ηλεκτρόφιλα όπως άλλα καρβονύλια.
Τα αμίδια είναι είναι οι πιο σταθερές συζεύξεις καρβονυλίου λόγω της υψηλής σταθερότητας μεσομέρειας μεταξύ δεσμών αζώτου-άνθρακα και άνθρακα-οξυγόνου.
Οι καρβονυλομάδες μπορούν να αναχθούν αντιδρώντας με αντιδραστήρια υδριδίου όπως τετραϋδροβορικό νάτριο (NaBH4) και LiAlH4, ή καταλυτικά με υδρογόνο και έναν καταλύτη όπως χαλκό-χρωμίτη, νικέλιο Ράνεϊ, ρήνιο, ρουθήνιο ή ακόμα ρόδιο. Οι κετόνες δίνουν δευτεροταγείς αλκοόλες· οι αλδεΰδες, οι εστέρες και τα καρβοξυλικά οξέα δίνουν πρωτοταγείς αλκοόλες.
Τα καρβονύλια μπορούν να αλκυλιωθούν με πυρηνόφιλη προσβολή από οργανομεταλλικά αντιδραστήρια όπως αντιδραστήρια οργανολιθίου και αντιδραστήρια Γκρινιάρ (Grignard). Τα καρβονύλια μπορούν επίσης να αλκυλιωθούν από ενολικά όπως στην αλδολική αντίδραση. Τα καρβονύλια είναι επίσης πρωτότυπες ομάδες με βινύλογη δραστικότητα, π.χ. την αντίδραση Μίκαελ (Michael reaction) όπου ένας ακόρεστος άνθρακας σε συνδυασμό με το καρβονύλιο αλκυλιώνεται αντί για το ίδιο το καρβονύλιο.
Σε περίπτωση πολλών τύπων καρβονυλίων σε ένα μόριο, αναμένεται να αντιδράσει πρώτα το πιο ηλεκτρόφιλο. Ακυλοχλωρίδια και καρβοξυλικοί ανυδρίτες αντιδρούν πιο γρήγορα, ακολουθούμενα από τις αλδεΰδες και τις κετόνες. Οι εστέρες αντιδρούν πολύ πιο αργά και τα αμίδια μόλις που αντιδρούν λόγω της μεσομέρειας του αζώτου του αμιδίου προς την καρβονυλομάδα. Αυτό το αποτέλεσμα οφείλεται κυρίως στη μείωση του ηλεκτρόφιλου χαρακτήρα του ατόμου άνθρακα του καρβονυλίου. Αυτή η διαφορά δραστικότητας επιτρέπει την επαγωγή χημειοεκλεκτικότητας. Ένα διδακτικό παράδειγμα βρίσκεται στο τελευταίο τμήμα της ολικής σύνθεσης της μονενσίνης από τον Kishi το 1979:[4]

Η αριστερή πλευρά του μορίου κατέχει δύο δυνητικές ηλεκτρόφιλες θέσεις: μια αλδεΰδη (με γαλάζιο χρώμα) και έναν εστέρα (με πράσινο χρώμα). Μόνο η αλδεΰδη, που είναι πιο ηλεκτρόφιλη, θα αντιδράσει με το ενολικό ιόν της μεθυλοκετόνης στο άλλο μέρος του μορίου. Ο μεθυλεστέρας παραμένει ανέπαφος. Φυσικά, και άλλα φαινόμενα μπορεί να παίξουν ρόλο σε αυτήν την διεργασία επιλογής: ηλεκτρονιακά φαινόμενα, στερεοχημικά φαινόμενα, ...
Άλλες σημαντικές αντιδράσεις περιλαμβάνουν:
- Αντιδράσεις υποκατάστασης άλφα-καρβονυλίου
- Αντίδραση Βίτιχ (Wittig Reaction), όπου ένα υλίδιο φωσφονίου χρησιμοποιείται για τη δημιουργία ενός αλκενίου
- Αναγωγή Βολφ-Κίσνερ (Wolff-Kishner reduction)] σε υδραζόνη και παραπέρα σε κορεσμένο αλκάνιο
- Αναγωγή Κλεμένσεν (Clemmensen reduction) σε κορεσμένο αλκάνιο
- Αναγωγή Μοτζίνγκο (Mozingo reduction) σε κορεσμένο αλκάνιο
- Μετατροπή σε θειοακετάλες
- Ενυδάτωση σε ημιακετάλες και ημικετάλες και έπειτα σε ακετάλες και κετάλες
- Αντίδραση με αμμωνία και κυρίως με αμίνες για το σχηματισμό ιμινών
- Αντίδραση με υδροξυλαμίνες για το σχηματισμό οξιμών
- Αντίδραση με ανιόν κυανιδίου για τον σχηματισμό κυανυδρινών
- Οξείδωση με οξαζιριδίνες προς ακυλοΐνες
- Αντίδραση με αντιδραστήριο Tebbe και υλίδια του φωσφονίου προς αλκένια.
- Αντίδραση Πέρκιν (Perkin reaction), μια παραλλαγή της αλδολικής αντίδρασης
- Αλδολική συμπύκνωση, μια αντίδραση μεταξύ ενός ενολικού ιόντος και ενός καρβονυλίου
- Αντίδραση Κανιζάρο (Cannizzaro reaction), μια αυτοξειδοαναγωγή των αλδεϋδών προς αλκοόλες και οξέα
- Αντίδραση Τισένκο (Tishchenko reaction), μια άλλη αυτοξειδοαναγωγή των αλδεϋδών που δίνει έναν διμερή εστέρα
- Η πυρηνόφιλη απόσπαση χρησιμοποιείται για την παραγωγή διοξειδίου του άνθρακα
α,β-ακόρεστες καρβονυλικές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
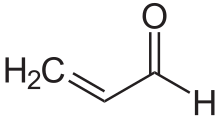
Οι α,β-ακόρεστες καρβονυλικές ενώσεις είναι μια σημαντική τάξη των καρβονυλικών ενώσεων με τη γενική δομή (O=CR)−Cα=Cβ-R. Σε αυτές τις ενώσεις η καρβονυλομάδα είναι συζευγμένη με ένα αλκένιο (από όπου και το επίθετο ακόρεστη), από την οποία προκύπτουν ειδικές ιδιότητες. Αντίθετα προς τα απλά καρβονύλια, οι α,β-ακόρεστες καρβονυλικές ενώσεις προσβάλλονται συχνά από πυρηνόφιλα στον β άνθρακα. Αυτή η μορφή δραστικότητας λέγεται βινύλογη (vinylogous). Παραδείγματα ακόρεστων καρβονυλικών ενώσεων είναι η προπενάλη, το μεσιτυλοξείδιο, το προπενικό οξύ και το μηλεϊνικό οξύ. Οι ακόρεστες καρβονυλικές ενώσεις μπορούν να παρασκευαστούν στο εργαστήριο με μια αλδολική αντίδραση και με την αντίδραση Πέρκιν.
Η καρβονυλομάδα απομακρύνει τα ηλεκτρόνια από το αλκένιο και η αλκενική ομάδα απενεργοποιείται συνεπώς, προς ένα ηλεκτρόφιλο, όπως το βρώμιο ή το υδροχλωρικό οξύ. Ως γενικός κανόνας με ασύμμετρα ηλεκτρόφιλα, το υδρογόνο πηγαίνει στην α-θέση σε μια ηλεκτρόφιλη προσθήκη. Αφ' ετέρου, αυτές οι ενώσεις ενεργοποιούνται προς τα πυρηνόφιλα σε πυρηνόφιλη συζυγή προσθήκη.
Επειδή οι α,β-ακόρεστες ενώσεις είναι ηλεκτρόφιλες, πολλές α,β-ακόρεστες καρβονυλικές ενώσεις είναι τοξικές, μεταλλαξιογόνες και καρκινογόνες. Το DNA μπορεί να προσβάλλει τον β άνθρακα και συνεπώς να αλκυλιωθεί. Όμως, η ενδογενής δεσμευτική ένωση γλουταθειόνη προστατεύει φυσικά από τοξικά ηλεκτρόφιλα στο σώμα.
Φασματοσκοπία[Επεξεργασία | επεξεργασία κώδικα]
- Φασματοσκοπία υπερύθρου: ο διπλός δεσμός C=Ο απορροφά υπέρυθρο φως σε μήκη κύματος μεταξύ περίπου 1600–1900 cm−1. Η ακριβής θέση της απορρόφησης είναι καλά κατανοητή ως προς τη γεωμετρία του μορίου. Αυτή η απορρόφηση είναι γνωστή ως η "επιμήκυνση καρβονυλίου (carbonyl stretch)" όταν εμφανίζεται σε ένα υπέρυθρο φάσμα απορρόφησης.[5]
- Πυρηνικός μαγνητικός συντονισμός: ο διπλός δεσμός C=Ο παρουσιάζει διαφορετικούς συντονισμούς ανάλογα με τα περιβάλλοντα άτομα, γενικά είναι μια προς τα κάτω μετατόπιση (downfield shift). Το 13C NMR του καρβονυλικού άνθρακα είναι στην περιοχή των 160-220 ppm.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ http://www.chemguide.co.uk/organicprops/carbonyls/background.html
- ↑ Ouellette, R.J. and Rawn, J.D. "Organic Chemistry" 1st Ed. Prentice-Hall, Inc., 1996: New Jersey. ISBN 0-02-390171-3
- ↑ Claden, Johnathan· και άλλοι. Organic Chemistry
 . Oxford University Press. ISBN 978-0-19-850346-0.
. Oxford University Press. ISBN 978-0-19-850346-0.
- ↑ Nicolaou, Kyriacos Costa· E. J. Sorensen (1996). Classics in Total Synthesis: Targets, Strategies, Methods. Wiley-VCH. σελ. 230-232. ISBN 3-527-29231-4.
- ↑ Mayo D.W., Miller F.A and Hannah R.W “Course Notes On The Interpretation of Infrared and Raman Spectra” 1st Ed. John Wiley & Sons Inc, 2004: New Jersey. ISBN 0-471-24823-1.
Παραπέρα μελέτη[Επεξεργασία | επεξεργασία κώδικα]
- L.G. Wade, Jr. Organic Chemistry, 5th ed. Prentice Hall, 2002. ISBN 0-13-033832-X
- The Frostburg State University Chemistry Department. Organic Chemistry Help (2000).
- Advanced Chemistry Development, Inc. IUPAC Nomenclature of Organic Chemistry (1997).
- William Reusch. tara VirtualText of Organic Chemistry (2004).
- Purdue Chemistry Department [1] (retrieved Sep 2006). Includes water solubility data.
- William Reusch. (2004) Aldehydes and Ketones Retrieved 23 May 2005.
- ILPI. (2005) The MSDS Hyperglossary- Anhydride.
