Βουτανόνη
| Βουτανόνη | |||
|---|---|---|---|

| |||

| |||
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Βουτανόνη | ||
| Άλλες ονομασίες | β-κετοβουτάνιο 2-οξοβουτάνιο Αιθυλομεθυλοκετόνη Αιθυλομεθυλοφορμαλδεΰδη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H8O | ||
| Μοριακή μάζα | 72,11 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2COCH3 | ||
| Συντομογραφίες | EtCOMe ΜΕΚ | ||
| Αριθμός CAS | 78-93-3 | ||
| SMILES | O=C(C)CC | ||
| InChI | 1/C4H8O/c1-3-4(2)5/h3H2,1-2H3 | ||
| Αριθμός RTECS | EL6475000 | ||
| PubChem CID | 6569 | ||
| ChemSpider ID | 6321 | ||
| Δομή | |||
| Διπολική ροπή | 2,76 D | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 25 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −86 °C | ||
| Σημείο βρασμού | 79,64 °C | ||
| Πυκνότητα | 805 kg/m3 | ||
| Διαλυτότητα στο νερό |
275 kg/m3 | ||
| Ιξώδες | 0,43 cP | ||
| Δείκτης διάθλασης , nD |
1,37880 | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-9 °C | ||
| Σημείο αυτανάφλεξης | 505 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Εύφλεκτη (F) Ερεθιστική (Xi) | |||
| Φράσεις κινδύνου | R11 R36 R66 R67 | ||
| Φράσεις ασφαλείας | (S2) S9 S16 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
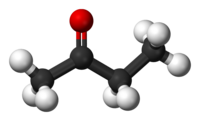
Η βουτανόνη ή 2-οξοβουτάνιο ή β-κετοβουτάνιο ή αιθυλομεθυλοκετόνη ή αιθυλομεθυλοφορμαλδεΰδη είναι μια οργανική χημική ένωση με χημικό τύπο C4H8Ο και σύντομο συντακτικό τύπο CH3CH2COCH3 ή συντομογραφικά EtCOMe ή MEK (Methyl Ethyl Ketone). Πιο συγκεκριμένα, η βουτανόνη είναι η μια από τις κετόνες. Η καθαρή βουτανόνη, στις συνηθισμένες συνθήκες, δηλαδή σε θερμοκρασία 25 °C και πίεση 1 atm), είναι ένα άχρωμο, εύφλεκτο υγρό, με γλυκιά οσμή που θυμίζει ταυτόχρονα καραμέλα βουτύρου και προπανόνη. Παράγεται βιομηχανικά σε μια μεγάλη κλίμακα, αλλά επίσης εμφανίζεται σε ίχνη και στη φύση[1]. Είναι διαλυτή στο νερό και χρησιμοποιείται συχνά ως ένας βιομηχανικός διαλύτης[2].
Ισομέρεια[Επεξεργασία | επεξεργασία κώδικα]
Με βάση το χημικό της τύπο, C4H8O, έχει τα ακόλουθα εικοσιπέντε (25) ισομερή θέσης:
- 1-βουτεν-1-όλη (ελάσσων ταυτομερές της βουτανάλης) με σύντομο συντακτικό τύπο CH3CH2CH=CHOH.
- 1-βουτεν-2-όλη ή 3-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH3CH=CHCH2OH.
- 1-βουτεν-3-όλη με σύντομο συντακτικό τύπο CH2=CHCH2CH2OH.
- 2-βουτεν-1-όλη (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CH2.
- 2-βουτεν-2-όλη (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH=C(OH)CH3.
- 2-βουτεν-3-όλη με σύντομο συντακτικό τύπο CH2=CHCH(OH)CH3.
- Μεθυλοπροπεν-1-όλη (ελάσσων ταυτομερές της μεθυλοπροπανάλης) με σύντομο συντακτικό τύπο (CH3)2C=CHOH.
- Μεθυλοπροπεν-2-όλη ή 2-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH2=C(CH3)CH2OH.
- Αιθυλοβινυλαιθέρας ή αιθοξυαιθένιο με σύντομο συντακτικό τύπο CH3CH2OCH=CH2.
- Μεθυλοπροπεν-1-υλαιθέρας ή 1-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH=CHCH3.
- Μεθυλοπροπεν-2-υλαιθέρας ή 3-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH2CH=CH2.
- Μεθυλο(μεθυλοβινυλ)αιθέρας ή 2-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OC(CH3)=CH2.
- Βουτανάλη (κύριο ταυτομερές) της βουτεν-1-όλης-1 με σύντομο συντακτικό τύπο CH3CH2CH2CHO.
- Μεθυλοπροπανάλη (κύριο ταυτομερές) της μεθυλοπροπεν-1-όλης με σύντομο συντακτικό τύπο (CH3)2CHCHO.
- Κυκλοβουτανόλη με σύντομο συντακτικό τύπο
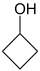 .
. - 1-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθυλαιθέρας με σύντομο συντακτικό τύπο
 .
. - Οξολάνιο με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - 3-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - Αιθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
. - 2,2-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
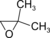 .
. - 2,3-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Κύριες μἐθοδοι[Επεξεργασία | επεξεργασία κώδικα]
Με οξείδωση 2-βουτανόλης [CH3CH2CH(OH)CH3] παράγεται βουτανόνη[3]:
- Βιομηχανικά, η οξείδωση αυτή γίνεται και μέσω καταλυτικής αφυδρογόνωσης, χρησιμοποιώντας καταλύτες που βασίζονται σε χαλκό, ψευδάργυρο, κασσίτερο ή και ορείχαλκο, που συνδυάζει χαλκό και κασσίτερο:
Με τη μέθοδο αυτή παράγονται 700.000 τόννοι βουτανόνης παγκοσμίως κάθε χρόνο. Άλλες χρησιμοποιούμενες μέθοδοι περιλαμβάνουν την οξείδωση τύπου Wacker 1-βουτένιου ή 2-βουτένιου[4]:
ή
- όπου DMF διμεθυλομεθαναμίδιο.
Ακόμη, χρησιμοποιρίται η καταλυτική οξείδωση 2-φαινυλοβενζόλιου, σε αναλογία με τη βιομηχανική παραγωγή της προπανόνης[1]:
Επίσης, χρησιμοποιούνται η οξείδωση σε υγρή φάση της βαριάς νάφθας και η αντίδραση Fischer-Tropsch, που παράγουν ένα μίγμα οξυγονούχων παραγώγων, από τα οποία η βουτανόνη εξάγεται με κλασματική απόσταξη.[5]
Τέλος, η βουτανόνη βιοσυνθέτεται από κάποια δέντρα και βρίσκεται σε κάποια φρούτα και λαχανικά, σε μικρές ποσότητες. Ακόμη απελευθερώνεται στον ατμοσφαιρικό αέρα σαν ένα από τα καυσαέρια (κυρίως) των αυτοκινήτων.
Εναλλακτικές μέθοδοι[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική οξείδωση βουτανίου[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική οξείδωση βουτανίου (C4H10) παράγεται (κυρίως) βουτανόνη:
Με οργανομαγνησιακές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
1. Με επίδραση αιθυλομαγνησιοαλογονίδιου (CH3CH2MgX) σε αιθανικό αλκυλεστέρα (CH3COOR) παράγεται βουτανόνη[6]:
- Όμοιο αποτέλεσμα έχουμε με το ζεύγος μεθυλομαγνησιοαλογονίδιου]] (CH3MgX) και προπανικού αλκυλεστέρα:
2. Με επίδραση αιθυλομαγνησιοαλογονίδιου (CH3MgX) σε αιθανονιτρίλιο παράγεται βουτανόνη[7]:
- Όμοιο αποτέλεσμα έχουμε με το ζεύγος αιθυλομαγνησιοαλογονίδιου (CH3MgX) και προπανονιτρίλιου:
Με προσθήκη ύδατος σε 1-βουτίνιο[Επεξεργασία | επεξεργασία κώδικα]
Με ενυδάτωση 1-βουτινίου (CH3CH2C ≡ CH) παράγεται αρχικά η ταυτομερής 2-βουτεν-1-όλη, που ταυτομερίζεται σε βουτανόνη[8]:
Με οζονόλυση 3,4-διμεθυλο-3-εξένιου[Επεξεργασία | επεξεργασία κώδικα]
Με οζονόλυση 3,4-διμεθυλο-3-εξένιου παράγεται βουτανόνη[9]:
Με επίδραση υπερμαγγανικού καλίου σε 3,4-διμεθυλο-εξένιο[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υπερμαγγανικού καλίου σε 3,4-διμεθυλο-3-εξένιο παράγεται βουτανόνη[10]:
- Υπερβολικά έντονες οξειδωτικές συνθήκες μπορούν να οδηγήσουν σε παραπέρα οξείδωση, με διάσπαση της βουτανόνης, σχηματίζοντας μεθανικό οξύ και προπανικό οξύ. Δείτε παρακάτω στην ενότητα «Χημικές ιδιότητες και παράγωγα».
Με επίδραση υπεριωδικού οξέος σε 3,4-διμεθυλο-3,4-εξανοδιόλη[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υπεριωδικού οξέος σε 3,4-διμεθυλο-3,4-εξανοδιόλη παράγεται βουτανόνη[11]:
Χημικές ιδιότητες και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Ταυτομέρεια με 2-βουτεν-1-όλη και 2-βουτεν-2-όλη[Επεξεργασία | επεξεργασία κώδικα]
Η προπανόνη βρίσκεται πάντα σε χημική ισορροπία με τις ταυτομερείς της 2-βουτεν-1-όλη και 2-βουτεν-2-όλη. Μπορεί να καταλυθεί προς την επιθυμητή κατεύθυνση με παρουσία οξέων ή βάσεων[12]:
Αναγωγή προς 2-βουτανόλη[Επεξεργασία | επεξεργασία κώδικα]
Μπορεί να αναχθεί προς 2-βουτανόλη με τις ακόλουθες μεθόδους[13]
1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4):
2. Με καταλυτική υδρογόνωση:
Αναγωγή προς βουτάνιο[Επεξεργασία | επεξεργασία κώδικα]
1. Μπορεί να αναχθεί προς βουτάνιο με την μεθόδο Wolff-Kishner[14]
2. Μπορεί να αναχθεί προς βουτάνιο με την αντίδραση Clemensen[15]
Οξείδωση προς βουτανοδιόνη[Επεξεργασία | επεξεργασία κώδικα]
1. Μπορεί να οξειδωθεί προς βουτανοδιόνη με χρήση διοξειδίου του σεληνίου[16]
2. Μπορεί να οξειδωθεί προς βουτανοδιόνη μέσω νιτρώδωσης, δηλαδή επίδρασης νιτρώδους οξέος[17]
Προσθήκη ύδατος[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη ύδατος σε βουτανόνη παράγεται, σε χημική ισορροπία, η μη απομονώσιμη ασταθής 2,2-βουτανοδιόλη[18]:
Προσθήκη 1,2-αιθανοδιόλης[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη 1,2-αιθανοδιόλης παράγεται 2-αιθυλο-2-μεθυλο-1,3-διοξολάνιο[19]:
Προσθήκη 1,2-αιθανοδιθειόλης[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη 1,2-αιθανοδιθειόλης παράγεται 2-αιθυλο-2-μεθυλο-1,3-διθειολάνιο[19]:
- Το 2-αιθυλο-2-μεθυλο-1,3-διθειολάνιο μπορεί να υποστεί αποθείωση Raney με νικέλιο και υδρογόνο, σχηματίζοντας βουτάνιο και αιθάνιο:
Αντιδράσεις με αζωτούχες ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Αντιδρά με αρκετά είδη αζωτούχων ενώσεων του γενικού τύπου NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινοξάδα και διάφορα άλλα. Με βάση το γενικό τύπο η γενική αντίδραση είναι η ακόλουθη[20]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται 2-βουτανιμίνη. Προκύπτει από την παραπάνω γενική με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται Ν-αλκυλο-2-βουτανιμίνη. Προκύπτει από την παραπάνω γενική με A = R:
3. Με υδροξυλαμίνη παράγεται 2-βουτανοξίμη. Προκύπτει από την παραπάνω γενική με A = OH:
4. Με υδραζίνη παράγεται αρχικά 2-βουτανυδραζόνη και με περίσσεια βουτανάλης δι(1-μεθυλοπροπυλιδεν)αζίνη. Προκύπτει από την παραπάνω γενική με A = NH2:
5. Με φαινυλυδραζίνη παράγεαι 1-(1'-μεθυλοπροπυλιδενο)-2-φαινυλυδραζόνη. Προκύπτει από την παραπάνω γενική με A = NHPh::
6. Με υδραζινομεθαναμίδιο παράγεται (2-(1'-μεθυλοπροπυλιδεν)υδραζινο)μεθαναμίδιο. Προκύπτει από την παραπάνω γενική με A = NCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση δευτεροταγούς αμίνης (RNHR') παράγεται αρχικά 1-(διαλκυλαμινο)-2-βουτανόλη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει Ν,Ν-διαλκυλο-2-βουτεν-2-αμίνη[21]:
Αλδολική συμπύκνωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση βάσης έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται αρχικά 5-μεθυλο-5-υδροξυ-3-επτανόνη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει 5-μεθυλο-3-επτεν-4-όνη[22]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες[Επεξεργασία | επεξεργασία κώδικα]
Με την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), έχουμε την αντίδραση Knoevenagel[23]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
1. Με επίδραση αλογόνου (X2) έχουμε προσθήκη του στη 2-βουτεν-1-όλη. Παράγεται αρχικά η ασταθής 1,2-διαλο-2-βουτανόλη που αφυδραλογονώνεται σχηματίζοντας τελικά 1-αλοβουτανόνη[24]:
2. Με επίδραση αλογόνου (X2) έχουμε προσθήκη του στη 2-βουτεν-2-όλη. Παράγεται αρχικά η ασταθής 2,3-διαλο-2-βουτανόλη που αφυδραλογονώνεται σχηματίζοντας τελικά 3-αλοβουτανόνη[24]:
Επίδραση διαζωμεθανίου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση διαζωμεθάνιου παράγεται 2-αιθυλο-2-μεθυλοξιράνιο[25]:
Επίδραση υδραζωτικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υδραζωτικού οξέος (αντίδραση Achmidt) παράγεται N-μεθυλοπροπαναμίδιο[26]:
Αντίδραση Stracker[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε βουτανάλη παράγεται αρχικά 2-αμινο-2-μεθυλοβουτανονιτρίλιο και στη συνέχεια, με υδρόλυση, 2-αμινο-2-μεθυλοβουτανικό οξύ (ένα μη πρωτεϊνικό αμινοξύ)[27]:
Φωτοχημική προσθήκη σε αλκένια[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση προπανόνης σε αιθένιο σχηματίζεται φωτοχημικά 2-αιθυλο-2-μεθυλοξετάνιο (Αντίδραση Paterno–Büchi)[28] [29]:
Επίδραση ισχυρών οξειδωτικών συνθηκών[Επεξεργασία | επεξεργασία κώδικα]
Με ισχυρά οξειδωτικά μέσα και δραστικές συνθήκες, είναι δυνατή η οξείδωση της βουτανόνης προς διοξείδιο του άνθρακα και προπανικό οξύ[30]:
- Ενδιάμεσα σχηματίζεται και μεθανικό οξύ, το οποίο όμως είναι ευαίσθητο στην τυχόν περίσσεια υπερμσγγανικού καλίου:
Αλοφορμική αντίδραση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλογόνου (X2) σε αλκαλικό περιβάλλον σε βουτανόνη, έχουμε τη λεγόμενη αλοφορμική αντίδραση, και παράγονται αλοφόρμιο και προπανικό άλας[31]:
Οξείδωση Baeyer - Villiger[Επεξεργασία | επεξεργασία κώδικα]
Με οξείδωση Baeyer - Villiger από καρβονικό υπεροξύ (RCO3H) παράγονται προπανικός μεθυλεστέρας και καρβονικό οξύ[32]:
Παραγωγή διόλης[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση νατρίου ή μαγνησίου σε βουτανόνη παράγεται τελικά 3,4-διμεθυλο-3,4-εξανοδιόλη[33]:
Προσθήκη ορθοφορμικών εστέρων[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη ορθοφορμικού εστέρα [(RO)3CH, όπου τα αλκύλια R, όχι απαραίτητα ίδια] έχουμε το σχηματισμό 2,2-διαλκοξυβουτάνιου[34]:
Συμπύκνωση με εστέρες[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση καρβονικών εστέρων (RCOOR, όπου τα αλκύλια R, όχι απαραίτητα ίδια) σε βουτανόνη, παρουσία αιθανολικού νατρίου ή νατραμιδίου παράγονται 3-αλκοξυβουτανόνη και αλκοόλη[35]:
Επίδραση καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
Παρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγονται 2-πεντανόνη, 3-πεντανόνη, μεθυλοβουτανόνη και 2-αιθυλο-2-μεθυλοξιράνιο[36]:
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Ως διαλύτης[Επεξεργασία | επεξεργασία κώδικα]
Η βουτανόνη είναι ένας αποτελεσματικός και συνηθισμένος διαλύτης[2] και χρησιμοποιείται σε διεργασίες που περιλαμβάνουν τσίχλες, ρητίνες, περιβλήματα οξικής κυτταρίνης και νιτροκυτταρίνης, καθώς και βινυλικά φύλλα[37]. Για το λόγο αυτό, βρίσκει πεδία εφαρμογής σε κατασκευαστές πλαστικών, υφασμάτων και κεριών παραφίνης, καθώς και σε παραγωγούς οικιακών προϊόντων όπως τα βερνίκια, τα αφαιρετικά χρωμάτων και ως ένα μετουσιωτικό μέσο για βιομηχανική αιθανόλη, σε κόλλες, και σε καθαριστικά. Έχει παρόμοιες ικανότητες διάλυσης με την προπανόνη, αλλά έχει ένα υψηλότερο σημείο βρασμού και γι' αυτό έχει έναν σημαντικά πιο αργό ρυθμό εξάτμισης[38]. Η βουτανόνη επίσης χρησιμοποιήθηκε σε αγορές ξηρών καθαριστικών ως ένας διαλύτης για αφαιρέσιμα βερνίκια.
Ως μέσο συγκόλλησης πλαστικών[Επεξεργασία | επεξεργασία κώδικα]
Εφόσον η βουτανόνη διαλύει το πολυστυρένιο, πωλείται μόνο του (ή πιο συνήθως) ως ένα ενεργό συστατικό μιγμάτων συγκόλλησης πλαστικών τμημάτων κιτ μοντελισμού.
Άλλες χρήσεις[Επεξεργασία | επεξεργασία κώδικα]
Η βουτανόνη είναι η πρόδρομη ένωση του υπεροξείδιου βουτανόνης, που με τη σειρά του είναι ένας καταλύτης γοα κάποιες αντιδράσεις πολυμερισμού όπως διασταύρωσης ακόρεστων πολυεστερικών ρητινών.
Ασφάλεια[Επεξεργασία | επεξεργασία κώδικα]
Αυτό το χημικό πρέπει να το χειρίζεται κανείς με προσοχή.
Ευφλεκτότητα[Επεξεργασία | επεξεργασία κώδικα]
Η βουτανόνη μπορεί να αντιδράσει και να αναφλεγεί με τα περισσότερα οξειδωτικά υλικά[2]. Είναι μέτρια εκρηκτική. Χρειάζεται μόνο μια μικρή φλόγα ή ένα σπινθήρα για να προκαλέσει μια ταχύτατη αντίδραση[2]. Οι φωτιές βουτανόνης μπορούν εύκολα να σβηστούν με χρήση διοξειδίου του άνθρακα, ξηρών χημικών ή και αφρού αλκοόλης[2]. Αρκετά υψηλές συγκεντρώσεις ατμών βουτανόνης στον αέρα μπορεί να είναι επίσης εύφλεκτες, αλλά επίσης και ανυπόφορες για τους ανθρώπους, εξαιτίας της ερεθιστικής φύσης των ατμών της[38].
Επιπτώσεις στην υγεία[Επεξεργασία | επεξεργασία κώδικα]
Η βουτανόνη είναι ένα ερεθιστικό, που προκαλεί ερεθισμό στα μάτια και στη μύτη των ανθρώπων[38], αλλά σοβαρά προβλήματα υγείας σε ζώα έχουν παρατηρηθεί μόνο σε πολύ υψηλές συγκεντρώσεις. Αν εισπνευθεί, έχουν παρατηρηθεί θάνατοι σε πειραματόζωα ποντίκια, αλλά μόνο σε υψηλές δόσεις, της τάξης των 3.000 ppm για 7 ώρες την ημέρα[39].
Το 2005 το Γραφείο Προστασίας του Περιβάλλοντος των ΗΠΑ απομάκρυνε τη βουτανόνη από τη λίστα των επικίνδυνων αέριων περιβαλλοντικών ρυπαντών. Μετά από τεχνική αναθεώρηση των δημόσιων σχολίων, η υπηρεσία συμπέρανε ότι η εν δυνάμει έκθεση στις εκλύσεις ατμών βουτανόνης από τις βιομηχανικές διεργασίες δεν είναι υπεύθυνη για αναμενόμενα προβλήματα για την ανθρώπινη υγεία ή το περιβάλλον. Ωστόσο, οι εκπομπές ατμών βουτανόνης συνεχίζουν να ελέγχονται από τους κανονισμούς των πτητικών οργανικών ενώσεων που συνεισφέρουν στον ανεπιθύμητο σχηματισμό και την αύξηση της συγκέντωσης του τροποσφαοιρικού όζοντος.
Η βουτανόνη βρίσκεται στον πίνακα II της σχετικής λίστας του ΟΗΕ, ως πρόδρομη ένωση ναρκωτικών και ψυχοτροπικών ουσιών[40].
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ 1,0 1,1 Wilhelm Neier, Guenter Strehlke "2-Butanone" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002.
- ↑ 2,0 2,1 2,2 2,3 2,4 Turner, Charles F.; McCreery, Joseph W. (1981). The Chemistry of Fire and Hazardous Materials. Boston, Massachusetts: Allyn and Bacon, Inc. p. 118. ISBN 0-205-06912-6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.2.
- ↑ Jiro Tsuji, Hideo Nagashima, and Hisao Nemoto (1990), «General Synthetic Method for the preparation of Methyl Ketones from Terminal Olefins: 2-Decanone», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv7p0137; Coll. Vol. 7: 137
- ↑ Ashford's Dictionary of Industrial Chemicals, Third edition, 2011, ISBN 978-0-9522674-3-0, pages 6013-4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.6α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.152, §6.2.6β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.222, §9.7.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ 19,0 19,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8. και SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 268, §15.3.8
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ 24,0 24,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.13.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.14.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ E. Paterno, G. Chieffi (1909). «.». Gazz. Chim. Ital. 39: 341.
- ↑ G. Büchi, Charles G. Inman, and E. S. Lipinsky (1954). «Light-catalyzed Organic Reactions. I. The Reaction of Carbonyl Compounds with 2-Methyl-2-butene in the Presence of Ultraviolet Light». Journal of the American Chemical Society 76 (17): 4327–4331. doi:.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.2.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.4.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.6.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ Apps, E. A. (1958). Printing Ink Technology. London: Leonard Hill [Books] Limited. p. 101.
- ↑ 38,0 38,1 38,2 Fairhall, Lawrence T. (1957). Industrial Toxicology. Baltimore: The Williams and Wilkins Company. pp. 172–173.
- ↑ Schwetz et al. (1991). "Developmental toxicity of inhaled methyl ethyl ketone in Swiss mice". Fund. Appl. Toxicol. 16 (4): 742–748. doi:10.1016/0272-0590(91)90160-6.
- ↑ List of Precursors and Chemicals Frequently Used in the Illicit Manufacture of Narcotic Drugs and Psychotropic Substances Under International Control, International Narcotics Control Board.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
| |||||||||||||||||
|





![{\displaystyle \mathrm {CH_{3}CH_{2}CH=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{DMF,\;H_{2}O}]{PdCl_{2},\;CuCl}}CH_{3}CH_{2}COCH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0802f967daabf14ca71cf1c01ec60edc5a0d683)
![{\displaystyle \mathrm {CH_{3}CH=CHCH_{3}+{\frac {1}{2}}O_{2}{\xrightarrow[{DMF,\;H_{2}O}]{PdCl_{2},\;CuCl}}CH_{3}CH_{2}COCH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/494f4555ba326dd442e2358ff00da509be4011e9)

![{\displaystyle \mathrm {C_{4}H_{10}+O_{2}{\xrightarrow[{\triangle }]{Cu}}CH_{3}CH_{2}COCH_{3}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/66f00f3512b1dff1ad67e2c8a7e8b087d07e9246)


![{\displaystyle \mathrm {CH_{3}CH_{2}X+Mg{\xrightarrow {|Et_{2}O|}}CH_{3}CH_{2}MgX{\xrightarrow {+CH_{3}CN}}CH_{3}CH_{2}C(CH_{3})=NMgX{\xrightarrow[{H^{+}}]{+2H_{2}O}}CH_{3}CH_{2}COCH_{3}+Mg(OH)X\downarrow +NH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/928ed7e93326605d08a203f30d7954b4a40106a9)
![{\displaystyle \mathrm {CH_{3}X+Mg{\xrightarrow {|Et_{2}O|}}CH_{3}MgX{\xrightarrow {+CH_{3}CH_{2}CN}}CH_{3}CH_{2}C(CH_{3})=NMgX{\xrightarrow[{H^{+}}]{+2H_{2}O}}CH_{3}CH_{2}COCH_{3}+Mg(OH)X\downarrow +NH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5de6606508ec9dcc8ed1459e571b9dede3db6b76)

![{\displaystyle \mathrm {CH_{3}CH_{2}C(CH_{3})=C(CH_{3})CH_{2}CH_{3}+{\frac {2}{3}}O_{3}{\xrightarrow[{H_{2}O}]{Zn}}2CH_{3}CH_{2}COCH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/59e9c1ac98c2c5716387fffd2796b9ce75466c75)



![{\displaystyle \mathrm {4CH_{3}CH_{2}COCH_{3}+LiAlH_{4}{\xrightarrow {}}Li[Al(CH_{3}CH_{2}CH(CH_{3})O)_{4}]{\xrightarrow {+2H_{2}O}}4CH_{3}CH_{2}CH(OH)CH_{3}+LiAlO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf7f63d0d1022ecaf0e1a44c2315b061ad1635f6)
































