Φωσφορικά: Διαφορά μεταξύ των αναθεωρήσεων
μ Αντικατάσταση παρωχημένου προτύπου με references tag |
Χωρίς σύνοψη επεξεργασίας |
||
| Γραμμή 58: | Γραμμή 58: | ||
Τα φωσφορικά στο νερό βρίσκονται σε τέσσερις μορφές. Σε ισχυρά βασικό περιβάλλον, επικρατεί το φωσφορικό ιόν ({{chem|PO|4|3−}}), ενώ σε ασθενές βασικό περιβάλλον, επικρατεί το όξινο φωσφορικό ιόν ({{chem|HPO|4|2−}}). Σε ασθενές όξινο περιβάλλον, πιο συνηθισμένο είναι το δισόξινο φωσφορικό ιόν ({{chem|H|2|PO|4|−}}). Σε ισχυρά όξινο περιβάλλον το τρισόξινο φωσφορικό ({{chem|H|3|PO|4}}) είναι η κύρια μορφή. |
Τα φωσφορικά στο νερό βρίσκονται σε τέσσερις μορφές. Σε ισχυρά βασικό περιβάλλον, επικρατεί το φωσφορικό ιόν ({{chem|PO|4|3−}}), ενώ σε ασθενές βασικό περιβάλλον, επικρατεί το όξινο φωσφορικό ιόν ({{chem|HPO|4|2−}}). Σε ασθενές όξινο περιβάλλον, πιο συνηθισμένο είναι το δισόξινο φωσφορικό ιόν ({{chem|H|2|PO|4|−}}). Σε ισχυρά όξινο περιβάλλον το τρισόξινο φωσφορικό ({{chem|H|3|PO|4}}) είναι η κύρια μορφή. |
||
<gallery widths=100px heights=80px> |
<gallery widths="100px" heights="80px"> |
||
Image:3-phosphoric-acid-3D-balls.png|<center>{{chem|H|3|PO|4}}</center><center>Φωσφορικό οξύ</center> |
Image:3-phosphoric-acid-3D-balls.png|<center>{{chem|H|3|PO|4}}</center><center>Φωσφορικό οξύ</center> |
||
Image:2-dihydrogenphosphate-3D-balls.png|<center>{{chem|H|2|PO|4|−}}</center><center>Δισόξινο φωσφορικό</center> |
Image:2-dihydrogenphosphate-3D-balls.png|<center>{{chem|H|2|PO|4|−}}</center><center>Δισόξινο φωσφορικό</center> |
||
| Γραμμή 135: | Γραμμή 135: | ||
Από πλευράς οικολογικών όρων, λόγω του σημαντικού ρόλου των φωσφορικών σε βιολογικά συστήματα, τα φωσφορικά αναζητούνται πολύ ανάλογα με την πηγή. Όταν χρησιμοποιηθούν, είναι συχνά περιοριστικές θρεπτικές ουσίες στα περιβάλλοντα και η διαθεσιμότητά του μπορεί να διέπει τον ρυθμό ανάπτυξης των οργανισμών. Αυτό αληθεύει γενικά για περιβάλλοντα γλυκού νερού, ενώ το άζωτο είναι πιο συχνά η περιοριστική θρεπτική ουσία σε θαλάσσια περιβάλλοντα. Η προσθήκη υψηλών επιπέδων φωσφορικών στα περιβάλλοντα και στα μικροπεριβάλλοντα στα οποία είναι συνήθως σπάνιο μπορεί να έχει σημαντικές οικολογικές συνέπειες. Παραδείγματος χάρη, άνθιση στους πληθυσμούς κάποιων οργανισμών σε βάρος άλλων και μπορεί να συμβεί κατάρρευση των πληθυσμών που στερούνται πόρους όπως οξυγόνο (δείτε [[ευτροφισμός]]). Στο πλαίσιο της μόλυνσης, τα φωσφορικά είναι συστατικά των ολικών διαλυμένων στερεών, ένας σημαντικός δείκτης της ποιότητας του νερού, αλλά δεν είναι όλος ο φώσφορος σε μοριακή μορφή που να μπορούν τα άλγη να διασπάσουν και να καταναλώσουν.<ref>{{cite web|last=Hochanadel|first=Dave|title=Limited amount of total phosphorus actually feeds algae, study finds|url=http://www.lakescientist.com/2010/limited-amount-of-total-phosphorus-actually-feeds-algae-study-finds|publisher=Lake Scientist|accessdate=June 10, 2012|date=December 10, 2010|quote=[B]ioavailable phosphorus – phosphorus that can be utilized by plants and bacteria – is only a fraction of the total, according to Michael Brett, a UW engineering professor ...}}</ref> |
Από πλευράς οικολογικών όρων, λόγω του σημαντικού ρόλου των φωσφορικών σε βιολογικά συστήματα, τα φωσφορικά αναζητούνται πολύ ανάλογα με την πηγή. Όταν χρησιμοποιηθούν, είναι συχνά περιοριστικές θρεπτικές ουσίες στα περιβάλλοντα και η διαθεσιμότητά του μπορεί να διέπει τον ρυθμό ανάπτυξης των οργανισμών. Αυτό αληθεύει γενικά για περιβάλλοντα γλυκού νερού, ενώ το άζωτο είναι πιο συχνά η περιοριστική θρεπτική ουσία σε θαλάσσια περιβάλλοντα. Η προσθήκη υψηλών επιπέδων φωσφορικών στα περιβάλλοντα και στα μικροπεριβάλλοντα στα οποία είναι συνήθως σπάνιο μπορεί να έχει σημαντικές οικολογικές συνέπειες. Παραδείγματος χάρη, άνθιση στους πληθυσμούς κάποιων οργανισμών σε βάρος άλλων και μπορεί να συμβεί κατάρρευση των πληθυσμών που στερούνται πόρους όπως οξυγόνο (δείτε [[ευτροφισμός]]). Στο πλαίσιο της μόλυνσης, τα φωσφορικά είναι συστατικά των ολικών διαλυμένων στερεών, ένας σημαντικός δείκτης της ποιότητας του νερού, αλλά δεν είναι όλος ο φώσφορος σε μοριακή μορφή που να μπορούν τα άλγη να διασπάσουν και να καταναλώσουν.<ref>{{cite web|last=Hochanadel|first=Dave|title=Limited amount of total phosphorus actually feeds algae, study finds|url=http://www.lakescientist.com/2010/limited-amount-of-total-phosphorus-actually-feeds-algae-study-finds|publisher=Lake Scientist|accessdate=June 10, 2012|date=December 10, 2010|quote=[B]ioavailable phosphorus – phosphorus that can be utilized by plants and bacteria – is only a fraction of the total, according to Michael Brett, a UW engineering professor ...}}</ref> |
||
Τα ιζήματα του υροξυαπατίτη του ασβεστίου και του ασβεστίτη μπορούν να βρεθούν γύρω από βακτήρια σε προσχωματικά επιφανειακά εδάφη.<ref name=Schmittner>{{cite journal |author=Schmittner KE, Giresse P |title=Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France |journal=Sedimentology |volume=46 |issue=3 |year=1999 |pages=463–76 |doi=10.1046/j.1365-3091.1999.00224.x}}</ref> Επειδή τα ορυκτά |
Τα ιζήματα του υροξυαπατίτη του ασβεστίου και του ασβεστίτη μπορούν να βρεθούν γύρω από βακτήρια σε προσχωματικά επιφανειακά εδάφη.<ref name=Schmittner>{{cite journal |author=Schmittner KE, Giresse P |title=Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France |journal=Sedimentology |volume=46 |issue=3 |year=1999 |pages=463–76 |doi=10.1046/j.1365-3091.1999.00224.x}}</ref> Επειδή τα ορυκτά της αργίλου προάγουν την βιοανοργανοποίηση (biomineralization), η παρουσία των βακτηρίων και των ορυκτών αργίλου καταλήγουν σε ιζήματα υδροξυαπατίτη του ασβεστίου και ασβεστίτη.<ref name=Schmittner/> |
||
Οι φωσφορικές αποθέσεις μπορεί να περιέχουν σημαντικές ποσότητες από φυσικά εμφανιζόμενα βαρέα μέταλλα. Οι διαδικασίες εξόρυξης των φωσφορικών πετρωμάτων μπορεί να αφήσουν στοίβες υπολειμμάτων που περιέχουν αυξημένα επίπεδα από [[κάδμιο]], [[μόλυβδος|μόλυβδο]], [[νικέλιο]], [[χαλκός|χαλκό]], [[χρώμιο]] και [[ουράνιο]]. Εκτός και διαχειριστούν με προσοχή, αυτά τα απόβλητα προϊόντα μπορεί να μεταφέρουν βαρέα μέταλλα στα υπόγεια ύδατα ή σε κοντινές εκβολές ποταμού. Η πρόσληψη αυτών των ουσιών από τα φυτά και τη θαλάσσια ζωή μπορεί να οδηγήσει σε συγκέντρωση τοξικών βαρέων μετάλλων στα προϊόντα διατροφής.<ref>{{cite journal|last1 = Gnandil|first1 = K.|last2 = Tchangbedjil|first2 = G.|last3 = Killil|first3 = K.|last4 = Babal|first4 = G.|last5 = Abbel|first5 = E.|title = The Impact of Phosphate Mine Tailings on the Bioaccumulation of Heavy Metals in Marine Fish and Crustaceans from the Coastal Zone of Togo|periodical = Mine Water and the Environment|volume = 25|issue = 1|date = March 2006|pages = 56–62|doi = 10.1007/s10230-006-0108-4}}</ref> |
Οι φωσφορικές αποθέσεις μπορεί να περιέχουν σημαντικές ποσότητες από φυσικά εμφανιζόμενα βαρέα μέταλλα. Οι διαδικασίες εξόρυξης των φωσφορικών πετρωμάτων μπορεί να αφήσουν στοίβες υπολειμμάτων που περιέχουν αυξημένα επίπεδα από [[κάδμιο]], [[μόλυβδος|μόλυβδο]], [[νικέλιο]], [[χαλκός|χαλκό]], [[χρώμιο]] και [[ουράνιο]]. Εκτός και διαχειριστούν με προσοχή, αυτά τα απόβλητα προϊόντα μπορεί να μεταφέρουν βαρέα μέταλλα στα υπόγεια ύδατα ή σε κοντινές εκβολές ποταμού. Η πρόσληψη αυτών των ουσιών από τα φυτά και τη θαλάσσια ζωή μπορεί να οδηγήσει σε συγκέντρωση τοξικών βαρέων μετάλλων στα προϊόντα διατροφής.<ref>{{cite journal|last1 = Gnandil|first1 = K.|last2 = Tchangbedjil|first2 = G.|last3 = Killil|first3 = K.|last4 = Babal|first4 = G.|last5 = Abbel|first5 = E.|title = The Impact of Phosphate Mine Tailings on the Bioaccumulation of Heavy Metals in Marine Fish and Crustaceans from the Coastal Zone of Togo|periodical = Mine Water and the Environment|volume = 25|issue = 1|date = March 2006|pages = 56–62|doi = 10.1007/s10230-006-0108-4}}</ref> |
||
Έκδοση από την 14:01, 25 Φεβρουαρίου 2019

| |||
| |||
| Αναγνωριστικά | |||
|---|---|---|---|
| 14265-44-2 | |||
| 3903772 | |||
| ChEBI | CHEBI:18367 | ||
| ChemSpider | 1032 | ||
| 1997 | |||
InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4)/p-3 Key: NBIIXXVUZAFLBC-UHFFFAOYSA-K | |||
| Jmol 3Δ Πρότυπο | Image Image Image | ||
| MeSH | Φωσφορικά | ||
| PubChem | 1061 | ||
[O-]P([O-])([O-])=O [O-]P(=O)([O-])[O-] O=P([O-])([O-])[O-] | |||
| UNII | NK08V8K8HR | ||
| Ιδιότητες | |||
| PO3− 4 | |||
| Μοριακή μάζα | 94,9714 g mol−1 | ||
Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες (25°C, 100 kPa). | |||
| | |||
| Infobox references | |||
Ένα φωσφορικό (phosphate) (PO3−
4) είναι ένα ανόργανο χημικό και άλας του φωσφορικού οξέος. Στην οργανική χημεία, ένα φωσφορικό, ή οργανοφωσφορικό, είναι ένας εστέρες του φωσφορικού οξέος. Από τα διάφορα φωσφορικά οξέα και φωσφορικά, τα οργανικά φωσφορικά είναι σημαντικά στη βιοχημεία και την βιογεωχημεία (οικολογία) και τα ανόργανα φωσφορικά εξορύσσονται για να ληφθεί φώσφορος για χρήση στην γεωργία και τη βιομηχανία.[2] Σε υψηλές θερμοκρασίες στη στερεή κατάσταση, τα φωσφορικά μπορούν να συμπυκνωθούν για να σχηματίσουν πυροφωσφορικά.
Η προσθήκη και η αφαίρεση φωσφορικών από τις πρωτεΐνες σε όλα τα κύτταρα είναι μια κεντρική στρατηγική στη ρύθμιση των διαδικασιών του μεταβολισμού. Η φωσφορυλίωση και η αποφωσφορυλίωση είναι σημαντικές οδοί που αποθηκεύεται και απελευθερώνεται η ενέργεια σε ζώντα συστήματα.
Χημικές ιδιότητες

Το φωσφορικό ιόν είναι ένα πολυατομικό ιόν με τον εμπειρικό τύπο PO3−
4 και σχετική μοριακή μάζα 94,97 g/mol. Αποτελείται από ένα κεντρικό άτομο φωσφόρου που περιβάλλεται από τέσσερα άτομα οξυγόνου σε μια τετραεδρική διάταξη. Το φωσφορικό ιόν φέρει ένα τυπικό φορτίο −3 και είναι η συζυγής βάση του όξινου φωσφορικού ιόντος, HPO2−
4, που είναι η συζυγής βάση του δισόξινου φωσφορικού ιόντος, H2PO−
4, που με τη σειρά του είναι η συζυγής βάση του φωσφορικού οξέος, H3PO4, . Ένα φωσφορικό άλας σχηματίζεται όταν ένα θετικά φορτισμένο ιόν συνδέεται με αρνητικά φορτισμένα άτομα οξυγόνου του ιόντος, σχηματίζοντας μια ιονική ένωση. Πολλά φωσφορικά δεν είναι διαλυτά στο νερό στις πρότυπες συνθήκες θερμοκρασίας και πίεσης. Τα φωσφορικά άλατα του νατρίου, του καλίου, του ρουβιδίου, του καισίου και του αμμωνίου είναι διαλυτά στο νερό. Τα περισσότερα άλλα φωσφορικά άλατα είναι μόνο ελαφρώς διαλυτά στο νερό ή είναι αδιάλυτα. Ως γενικός κανόνας, τα όξινα και τα δισόξινα φωσφορικά είναι ελαφρώς πιο διαλυτά από τα αντίστοιχα φωσφορικά. Τα πυροφωσφορικά είναι κυρίως υδατοδιαλυτά.
Τα φωσφορικά στο νερό βρίσκονται σε τέσσερις μορφές. Σε ισχυρά βασικό περιβάλλον, επικρατεί το φωσφορικό ιόν (PO3−
4), ενώ σε ασθενές βασικό περιβάλλον, επικρατεί το όξινο φωσφορικό ιόν (HPO2−
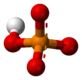
4). Σε ασθενές όξινο περιβάλλον, πιο συνηθισμένο είναι το δισόξινο φωσφορικό ιόν (H2PO−
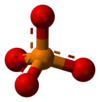
4). Σε ισχυρά όξινο περιβάλλον το τρισόξινο φωσφορικό (H3PO4) είναι η κύρια μορφή.
-
H3PO4 Φωσφορικό οξύ -
H2PO−
4Δισόξινο φωσφορικό -
HPO2−
4Όξινο φωσφορικό -
PO3−
4Φωσφορικό
Ας θεωρήσουμε, ακριβέστερα, τις παρακάτω τρεις αντιδράσεις ισορροπίας:
- H3PO4
 H+ + H2PO−
H+ + H2PO−
4
- H2PO−
4 H+ + HPO2−
H+ + HPO2−
4
- HPO2−
4 H+ + PO3−
H+ + PO3−
4
οι αντίστοιχες σταθερές στους 25 °C (σε mol/L) είναι (δείτε φωσφορικό οξύ):
- (pKa1 ≈ 2,12)
- (pKa2 ≈ 7,21)
- (pKa3 ≈ 12,67)

Το διάγραμμα των μορφών που λαμβάνεται χρησιμοποιώντας αυτές τις τιμές των pK εμφανίζει τρεις διακριτές περιοχές. Στην πραγματικότητα, τα H3PO4, H2PO−
4 και HPO2−
4 συμπεριφέρονται ως ξεχωριστά ασθενή οξέα. Αυτό συμβαίνει επειδή οι διαδοχικές τιμές pK διαφέρουν περισσότερο από 4. Για κάθε οξύ, το pH στην ημιεξουδετέρωση είναι ίσο με την τιμή pK του οξέος. Η περιοχή στην οποία το οξύ είναι σε ισορροπία με τη συζυγή βάση καθορίζεται από το pH ≈ pK ± 2. Συνεπώς, οι τρεις περιοχές pH είναι περίπου 0–4, 5–9 και 10–14. Αυτό είναι εξιδανικευμένο, επειδή υποθέτει σταθερή ιοντική ισχύ, που δεν διατηρείται στην πραγματικότητα σε πολύ χαμηλές και πολύ υψηλές τιμές pH.
Για ένα ουδέτερο pH όπως στο κυτταρόλυμα, pH = 7,0
έτσι ώστε μόνο τα ιόντα H2PO−
4 και HPO2−
4 να είναι παρόντα σε σημαντικές ποσότητες (62% H2PO−
4, 38% HPO2−
4. Σημειώστε ότι το εξωκυτταρικό υγρό (pH = 7,4), αυτή η αναλογία αντιστρέφεται (61% HPO2−
4, 39% H2PO−
4).
Τα φωσφορικά μπορούν να σχηματίσουν πολλά πολυμερή ιόντα όπως τα πυροφωσφορικά), P2O4−
7, και τα τριφωσφορικά, P3O5−
10. Τα διάφορα μεταφωσφορικά ιόντα (που είναι συνήθως μεγάλα γραμμικά πολυμερή) έχουν έναν εμπειρικό τύπο PO−
3 και βρίσκονται σε πολλές ενώσεις.
Βιοχημεία των φωσφορικών
Σε συστήματα οργάνων, ο φώσφορος βρίσκεται ως ελεύθερο φωσφορικό ιόν σε διάλυμα και λέγεται ανόργανο φωσφορικό, για να διακρίνεται από τα φωσφορικά που είναι συνδεμένα σε διάφορους φωσφορικούς εστέρες. Το ανόργανο φωσφορικό συμβολίζεται γενικά με Pi' και σε φυσιολογικό (ομοιοστατικό) pH αποτελείται κυρίως από ένα μείγμα από ιόντα HPO2−
4 και H2PO−
4.
Τα ανόργανα φωσφορικά μπορούν να δημιουργηθούν από την υδρόλυση των πυροφωσφορικών, που συμβολίζονται με PPi:
- P2O4−
7 + H2O 2 HPO2−
2 HPO2−
4
Όμως, τα φωσφορικά βρίσκονται συνήθως με τη μορφή φωσφορικής αδενοσίνης (μονοφωσφορική αδενοσίνη (AMP), διφωσφορική αδενοσίνη (ADP) και τριφωσφορική αδενοσίνη (ATP)) καθώς και στο DNA και RNA, και μπορεί να απελευθερωθεί από την υδρόλυση του ATP ή του ADP. Παρόμοιες αντιδράσεις υπάρχουν για τα άλλα διφωσφορικά και τριφωσφορικά νουκλεοσίδια. Οι φωσφοανυδριτικοί δεσμοί στο ADP και το ATP, ή σε άλλα διφωσφορικά και τριφωσφορικά νουκλεοσίδια, περιέχουν υψηλά ποσά ενέργειας που τους δίνουν τον ζωτικό τους ρόλο σε όλους τους ζώντες οργανισμούς. Αναφέρονται γενικά ως φωσφορικά υψηλής ενέργειας, όπως είναι τα φωσφογόνα (phosphagens) στον μυικό ιστό. Ενώσεις όπως οι υποκατεστημένες φωσφίνες χρησιμοποιούνται στην οργανική χημεία, αλλά δεν φαίνεται να έχουν φυσικά ανάλογα.
Η προσθήκη και η αφαίρεση φωσφορικών από τις πρωτεΐνες σε όλα τα κύτταρα είναι μια βασική στρατηγική στη ρύθμιση των μεταβολικών διαδικασιών. Η φωσφορυλίωση και η αποφωσφορυλίωση είναι σημαντικές οδοί αποθήκευσης και απελευθέρωσης ενέργειας σε ζώντα συστήματα. Τα κύτταρα χρησιμοποιούν το ATP κατ' αυτόν τον τρόπο.
Τα φωσφορικά είναι χρήσιμα στα ζωικά κύτταρα ως ρυθμιστικός παράγοντας. Τα φωσφορικά άλατα που χρησιμοποιούνται συνήθως στην προετοιμασία ρυθμιστικών διαλυμάτων στα pHs του κυττάρου περιλαμβάνουν τα Na2HPO4, NaH2PO4 και τα αντίστοιχα άλατα του νατρίου.
Μια σημαντική παρουσία των φωσφορικών σε βιολογικά συστήματα είναι ως δομικά συστατικά των οστών και των δοντιών. Αυτές οι δομές αποτελούνται από κρυσταλλικό φωσφορικό ασβέστιο με τη μορφή υδροξυαπατίτη. Το σκληρό πυκνό σμάλτο των δοντιών των θηλαστικών αποτελείται από φθοροαπατίτη, ένα υδρόξυ φωσφορικό ασβέστιο όπου κάποιες από τις υδροξυλομάδες έχουν αντικατασταθεί από ιόντα φθορίου.
Τα φυτά προσλαμβάνουν φώσφορο μέσα από αρκετές οδούς: την οδό της δενδρόμορφης μυκόρριζας (arbuscular mycorrhiza) και την άμεση οδό της πρόσληψης.
Προέλευση και εξόρυξη


Τα φωσφορικά είναι η φυσικά εμφανιζόμενη μορφή του στοιχείου φώσφορος, που βρίσκεται σε πολλά φωσφορικά πετρώματα. Στην ορυκτολογία και τη γεωλογία, τα φωσφορικά αναφέρονται σε ένα πέτρωμα ή ορυκτό που περιέχει φωσφορικά ιόντα. Τα ανόργανα φωσφορικά εξορύσσονται για να ληφθεί ο φώσφορος για χρήση στην γεωργία και τη βιομηχανία.[2]
Ο μεγαλύτερος παγκόσμιος παραγωγός και εξαγωγέας φωσφορικών είναι το Μαρόκο. Στη Βόρεια Αμερική, οι μεγαλύτερες αποθέσεις βρίσκονται στην περιοχή Bone Valley της Φλόριντα, στο Soda Springs του νοτιοανατολικού Αϊντάχο και στην ακτή της Βόρειας Καρολίνας. Μικρότερες αποθέσεις βρίσκονται στη Μοντάνα, Τενεσί, Τζόρτζια και στη Νότια Καρολίνα. Στο Ναουρού και στη Μπανάμπα που είχαν εκτεταμένες φωσφορικές αποθέσεις άριστης ποιότητας, έχουν εξορυχθεί υπέρμετρα. Φωσφορικά πετρώματα βρίσκονται επίσης στην Αίγυπτο, το Ισραήλ, τη Δυτική Σαχάρα, τη Νήσος Ναβάσσα, την Τυνησία, το Τόγκο και την Ιορδανία, που έχουν μεγάλες βιομηχανίες εξόρυξης φωσφορικών.
Ορυχεία φωσφορίτη βρίσκονται κυρίως στη:
- Βόρεια Αμερική: Ηνωμένες Πολιτείες Αμερικής, ιδιαίτερα στη Φλόριντα, με μικρότερες αποθέσεις στη Βόρεια Καρολίνα, Αϊντάχο και Τενεσί
- Αφρική: Μαρόκο, Αλγερία, Αίγυπτος, Δυτική Σαχάρα, Νίγηρας, Σενεγάλη, Τόγκο, Τυνησία.
- Μέση Ανατολή: Ισραήλ, Σαουδική Αραβία, Ιορδανία, Συρία, Ιράν και Ιράκ, στην πόλη Akashat, κοντά στην ιορδανική μεθόριο.
- Κεντρική Ασία: Καζακστάν
- Ωκεανία: Αυστραλία, Μακατεά, Ναουρού και Μπανάμπα Νήσος
Το 2007, με τον τρέχοντα ρυθμό κατανάλωσης, εκτιμήθηκε ότι ο φώσφορος θα εξαντληθεί σε 345 χρόνια.[4] Όμως, κάποιοι επιστήμονες θεωρούν ότι η μέγιστη παραγωγή του φωσφόρου θα συμβεί σε 30 χρόνια και η Dana Cordell από το Ινστιτούτο για το Βιώσιμο Μέλλον είπε στους Times, ότι "με τους τρέχοντες ρυθμούς, τα αποθέματα θα εξαντληθούν στα επόμενα 50 με 100 χρόνια."[5] Τα αποθέματα αναφέρονται στις ποσότητες που υποτίθενται ανακτήσιμες με τις τρέχουσες εμπορικές τιμές και το 2012, η USGS εκτίμησε 71 δισεκατομμύρια τόνοι παγκόσμιων αποθεμάτων, ενώ 0,19 δισεκατομμύρια τόνοι εξορύχτηκαν παγκοσμίως το 2011.[6] Ο φώσφορος αποτελεί το 0,1% κατά μάζα του μέσου πετρώματος[7] (ενώ, για την προοπτική, η τυπική του συγκέντρωση στη βλάστηση είναι 0,03% έως 0,2%),[8] και συνεπώς υπάρχουν τετράκις εκατομμύρια τόνων φωσφόρου στους 3 * 1019 τόνους του φλοιού της Γης,[9] αν και κυρίως πιο χαμηλής συγκέντρωσης από τις αποθέσεις που μετρώνται ως αποθέματα που έχουν καταγραφεί και είναι πιο φτηνά για εξαγωγή· αν υποτεθεί ότι τα ορυκτά φωσφορικά στα φωσφορικά πετρώματα είναι ο υδροξυαπατίτης και ο φθοροαπατίτης, τα φωσφορικά ορυκτά περιέχουν χοντρικά 18,5% φώσφορο κατά βάρος και αν το φωσφορικό πέτρωμα περιέχει περίπου phosphorus 20% από αυτά τα ορυκτά, το μέσο φωσφορικό πέτρωμα έχει χοντρικά 3,7% φώσφορο κατά βάρος.
Μερικές αποθέσεις φωσφορικών πετρωμάτων είναι αξιοσημείωτες για τον εγκλεισμό σημαντικών ποσοτήτων ραδιενεργών ισοτόπων ουρανίου. Αυτό το σύνδρομο είναι αξιοσημείωτο επειδή μπορεί να εκλυθεί ραδιενέργεια στα επιφανειακά ύδατα,[10] στη διαδικασία εφαρμογής των φωσφορικών λιπασμάτων που προκύπτουν (π.χ. σε πολλές καλλιέργειες καπνού στις νοτιοανατολικές ΗΠΑ).
Τον Δεκέμβριο του 2012, η Cominco Resources ανακοίνωσε ότι το έργο στη Hinda της Δημοκρατίας του Κονγκό ανέρχεται στους 531 Mt, καθιστώντας το τη μεγαλύτερη μετρημένη απόθεση φωσφορικών στον κόσμο.[11]
Οικολογία


Από πλευράς οικολογικών όρων, λόγω του σημαντικού ρόλου των φωσφορικών σε βιολογικά συστήματα, τα φωσφορικά αναζητούνται πολύ ανάλογα με την πηγή. Όταν χρησιμοποιηθούν, είναι συχνά περιοριστικές θρεπτικές ουσίες στα περιβάλλοντα και η διαθεσιμότητά του μπορεί να διέπει τον ρυθμό ανάπτυξης των οργανισμών. Αυτό αληθεύει γενικά για περιβάλλοντα γλυκού νερού, ενώ το άζωτο είναι πιο συχνά η περιοριστική θρεπτική ουσία σε θαλάσσια περιβάλλοντα. Η προσθήκη υψηλών επιπέδων φωσφορικών στα περιβάλλοντα και στα μικροπεριβάλλοντα στα οποία είναι συνήθως σπάνιο μπορεί να έχει σημαντικές οικολογικές συνέπειες. Παραδείγματος χάρη, άνθιση στους πληθυσμούς κάποιων οργανισμών σε βάρος άλλων και μπορεί να συμβεί κατάρρευση των πληθυσμών που στερούνται πόρους όπως οξυγόνο (δείτε ευτροφισμός). Στο πλαίσιο της μόλυνσης, τα φωσφορικά είναι συστατικά των ολικών διαλυμένων στερεών, ένας σημαντικός δείκτης της ποιότητας του νερού, αλλά δεν είναι όλος ο φώσφορος σε μοριακή μορφή που να μπορούν τα άλγη να διασπάσουν και να καταναλώσουν.[12]
Τα ιζήματα του υροξυαπατίτη του ασβεστίου και του ασβεστίτη μπορούν να βρεθούν γύρω από βακτήρια σε προσχωματικά επιφανειακά εδάφη.[13] Επειδή τα ορυκτά της αργίλου προάγουν την βιοανοργανοποίηση (biomineralization), η παρουσία των βακτηρίων και των ορυκτών αργίλου καταλήγουν σε ιζήματα υδροξυαπατίτη του ασβεστίου και ασβεστίτη.[13]
Οι φωσφορικές αποθέσεις μπορεί να περιέχουν σημαντικές ποσότητες από φυσικά εμφανιζόμενα βαρέα μέταλλα. Οι διαδικασίες εξόρυξης των φωσφορικών πετρωμάτων μπορεί να αφήσουν στοίβες υπολειμμάτων που περιέχουν αυξημένα επίπεδα από κάδμιο, μόλυβδο, νικέλιο, χαλκό, χρώμιο και ουράνιο. Εκτός και διαχειριστούν με προσοχή, αυτά τα απόβλητα προϊόντα μπορεί να μεταφέρουν βαρέα μέταλλα στα υπόγεια ύδατα ή σε κοντινές εκβολές ποταμού. Η πρόσληψη αυτών των ουσιών από τα φυτά και τη θαλάσσια ζωή μπορεί να οδηγήσει σε συγκέντρωση τοξικών βαρέων μετάλλων στα προϊόντα διατροφής.[14]
Παραπομπές
- ↑ «Phosphates – PubChem Public Chemical Database». The PubChem Project. USA: National Center of Biotechnology Information.
- ↑ 2,0 2,1 «Phosphate Primer».
- ↑ Campbell, Neil A.· Reece, Jane B. (2005). Biology (Seventh έκδοση). San Francisco, California: Benjamin Cummings. σελ. 65. ISBN 0-8053-7171-0.
- ↑ Reilly, Michael (May 26, 2007). «How Long Will it Last?». New Scientist 194 (2605): 38–9. doi:. Bibcode: 2007NewSc.194...38R.
- ↑ Leo Lewis (2008-06-23). «Scientists warn of lack of vital phosphorus as biofuels raise demand». The Times. http://business.timesonline.co.uk/tol/business/industry_sectors/natural_resources/article4193017.ece.
- ↑ U.S. Geological Survey Phosphate Rock
- ↑ U.S. Geological Survey Phosphorus Soil Samples
- ↑ Floor Anthoni. «Abundance of Elements». Seafriends.org.nz. Ανακτήθηκε στις 10 Ιανουαρίου 2013.
- ↑ American Geophysical Union, Fall Meeting 2007, abstract #V33A-1161. Mass and Composition of the Continental Crust
- ↑ C.Michael Hogan. 2010. "Water pollution". Encyclopedia of Earth. eds. Mark McGinley and C. Cleveland. National Council for Science and the Environment. Washington DC.
- ↑ «Updated Hinda Resource Announcement: Now world's largest phosphate deposit (04/12/2012)». Cominco Resources.
- ↑ Hochanadel, Dave (10 Δεκεμβρίου 2010). «Limited amount of total phosphorus actually feeds algae, study finds». Lake Scientist. Ανακτήθηκε στις 10 Ιουνίου 2012.
[B]ioavailable phosphorus – phosphorus that can be utilized by plants and bacteria – is only a fraction of the total, according to Michael Brett, a UW engineering professor ...
- ↑ 13,0 13,1 Schmittner KE, Giresse P (1999). «Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France». Sedimentology 46 (3): 463–76. doi:.
- ↑ Gnandil, K.; Tchangbedjil, G.; Killil, K.; Babal, G.; Abbel, E. (March 2006). «The Impact of Phosphate Mine Tailings on the Bioaccumulation of Heavy Metals in Marine Fish and Crustaceans from the Coastal Zone of Togo». Mine Water and the Environment 25 (1): 56–62. doi:.
Εξωτερικοί σύνδεσμοι
- US Minerals Databrowser provides data graphics covering consumption, production, imports, exports and price for phosphate and 86 other minerals
- Taking Stock of Phosphorus and Biofuels, global phosphate mining, use and shortages.
- Phosphate at Lab Tests Online
- Phosphate: analyte monograph – The Association for Clinical Biochemistry and Laboratory Medicine





![{\displaystyle K_{\mathrm {a1} }={\frac {[{\mbox{H}}^{+}][{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}{[{\mbox{H}}_{3}{\mbox{PO}}_{4}]}}\simeq 7,5\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e2cb541ca6d5925b3b1dfb7bf54913e00f590de9)
![{\displaystyle K_{\mathrm {a2} }={\frac {[{\mbox{H}}^{+}][{\mbox{HPO}}_{4}^{2-}]}{[{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}}\simeq 6,2\times 10^{-8}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/378ebe1428ef25afd30145bf77e0f9eae2f29d51)
![{\displaystyle K_{\mathrm {a3} }={\frac {[{\mbox{H}}^{+}][{\mbox{PO}}_{4}^{3-}]}{[{\mbox{HPO}}_{4}^{2-}]}}\simeq 2,14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b85d27294553cc6aee59c21040f9a55af5fc5cbe)
![{\displaystyle {\frac {[{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}{[{\mbox{H}}_{3}{\mbox{PO}}_{4}]}}\simeq 7,5\times 10^{4}{\mbox{ , }}{\frac {[{\mbox{HPO}}_{4}^{2-}]}{[{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}}\simeq 0,62{\mbox{ , }}{\frac {[{\mbox{PO}}_{4}^{3-}]}{[{\mbox{HPO}}_{4}^{2-}]}}\simeq 2,14\times 10^{-6}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e8135a79a4ba998cebbaf648fbf1fb4fc791b65)

