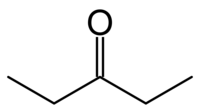
3-πεντανόνη
| 3-πεντανόνη | |
|---|---|
| |
| Γενικά | |
| Όνομα IUPAC | 3-πεντανόνη |
| Άλλες ονομασίες | γ-κετοπεντάνιο 3-οξοπεντάνιο Διαιθυλοοκετόνη Διαιθυλοφορμαλδεΰδη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C5H10O |
| Μοριακή μάζα | 86,13 amu |
| Σύντομος συντακτικός τύπος |
CH3CH2COCH2CH3 |
| Συντομογραφίες | Et2CO DEK |
| Αριθμός CAS | 96-22-0 |
| SMILES | O=C(CC)CC |
| Ισομέρεια | |
| Ισομερή θέσης | 71 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | −39 °C |
| Σημείο βρασμού | 100-102 °C |
| Πυκνότητα | 815 kg/m3 |
| Διαλυτότητα στο νερό |
50 kg/m3 (20 °C) |
| Εμφάνιση | Άχρωμο υγρό |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η πεντανόνη-3 ή 3-οξοπεντάνιο ή γ-κετοπεντάνιο ή διαιθυλοκετόνη ή διαιθυλοφορμαλδεΰδη είναι χημική ένωση με χημικό τύπο C5H10Ο και σύντομο συντακτικό τύπο CH3CH2COCH2CH3 ή συντομογραφικά Ετ2CO ή DEK (DiEthylKetone). Είναι η μια από τις κετόνες. Στην όψη είναι ένα άχρωμο εύφλεκτο υγρό.
Ισομέρεια[Επεξεργασία | επεξεργασία κώδικα]
Με βάση το χημικό της τύπο, C5H10O, έχει τα ακόλουθα 71 ισομερή:
- Πεντεν-1-όλη-1 (ελάσσων ταυτομερές της πεντανάλης) με σύντομο συντακτικό τύπο CH3CH2CH2CH=CHOH.
- Πεντεν-2-όλη-1 με σύντομο συντακτικό τύπο CH3CH2CH=CHCH2OH.
- Πεντεν-3-όλη-1 με σύντομο συντακτικό τύπο CH3CH=CHCH2CH2OH.
- Πεντεν-4-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH2CH2CH2OH.
- Πεντεν-1-όλη-2 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2CH2C(ΟΗ)=CH2.
- Πεντεν-2-όλη-2 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2CH=C(OH)CH3.
- Πεντεν-3-όλη-2 με σύντομο συντακτικό τύπο CH3CH=CHCH(OH)CH3.
- Πεντεν-4-όλη-2 με σύντομο συντακτικό τύπο CH2=CHCH2CH(OH)CH3.
- Πεντεν-1-όλη-3 με σύντομο συντακτικό τύπο CH3CH2CH(OH)CH=CH2.
- Πεντεν-2-όλη-3 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CHCH3.
- 2-μεθυλοβουτεν-1-όλη-1 (ελάσσων ταυτομερές της [2-μεθυλοβουτανάλης) με σύντομο συντακτικό τύπο CH3CH2C(CH3)=CHOH.
- 3-μεθυλοβουτεν-1-όλη-1 (ελάσσων ταυτομερές της [3-μεθυλοβουτανάλης) με σύντομο συντακτικό τύπο (CH3)2CHCH=CHOH.
- 2-μεθυλοβουτεν-2-όλη-1 με σύντομο συντακτικό τύπο CH3CH=C(CH3)CH2OH.
- 3-μεθυλοβουτεν-2-όλη-1 με σύντομο συντακτικό τύπο (CH3)2C=CHCH2OH.
- 2-μεθυλοβουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH(CH3)CH2OH.
- 3-μεθυλοβουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=C(CH3)CH2CH2OH.
- Μεθυλοβουτεν-1-όλη-2 (ελάσσων ταυτομερές της [μεθυλοβουτανόνης) με σύντομο συντακτικό τύπο (CH3)2CHC(OH)=CH2.
- Μεθυλοβουτεν-2-όλη-2 (ελάσσων ταυτομερές της [μεθυλοβουτανόνης) με σύντομο συντακτικό τύπο CH2C(CH3)=C(OH)CH3.
- Αιθυλοπροπενόλη με σύντομο συντακτικό τύπο CH2=C(CH2CH3)CH2OH.
- Κυκλοπεντανόλη με σύντομο συντακτικό τύπο
 .
. - 1-μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο

- 3-μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο

- κυκλοβουτυλομεθανόλη με σύντομο συντακτικό τύπο

- 1-αιθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2-αιθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 1-κυκλοπροπυλοαιθανόλη με σύντομο συντακτικό τύπο

- 2-κυκλοπροπυλοαιθανόλη με σύντομο συντακτικό τύπο

- 1,2-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2,2-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2,3-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- (1-μεθυλοκυκλοπροπυλο)μεθανόλη με σύντομο συντακτικό τύπο

- (2-μεθυλοκυκλοπροπυλο)μεθανόλη με σύντομο συντακτικό τύπο

- Βινυλοπροπυλαιθέρας με σύντομο συντακτικό τύπο CH3CH2CH2OCH=CH2.
- Βινυλισοπροπυλαιθέρας με σύντομο συντακτικό τύπο CH3)2CHOCH=CH2.
- Αιθυλοπροπεν-1-υλαιθέρας με σύντομο συντακτικό τύπο CH3CH=CHOCH2CH3.
- Αιθυλαλλυλυλαιθέρας με σύντομο συντακτικό τύπο CH3=CHCΗ2OCH2CH3.
- Αιθυλο(μεθυλοβινυλ)αιθέρας με σύντομο συντακτικό τύπο CH2=C(CH3)OCH2CH3.
- Βουτεν-1-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH3CH2CH=CHOCH3.
- Βουτεν-2-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH3CH=CHCH2OCH3.
- Βουτεν-3-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH2=CHCH2CH2OCH3.
- Μεθυλο-(1-μεθυλοπροπεν-1-υλ)αιθέρας με σύντομο συντακτικό τύπο CH3CH=C(CH3)OCH3.
- Μεθυλο-(2-μεθυλοπροπεν-1-υλ)αιθέρας με σύντομο συντακτικό τύπο (CH3)2C=CΗOCH3.
- Μεθυλο-(1-μεθυλοπροπεν-2-υλ)αιθέρας με σύντομο συντακτικό τύπο CH2=CHCΗ(CH3)OCH3.
- Μεθυλο-(2-μεθυλοπροπεν-2-υλ)αιθέρας με σύντομο συντακτικό τύπο CH2=C(CH3)CΗ2OCH3.
- (Αιθυλοβινυλ)μεθυλαιθέρας με σύντομο συντακτικό τύπο CH2=C(CΗ2CH3)OCH3.
- Αιθυλοκυκλοπροπυλαιθέρας με σύντομο συντακτικό τύπο

- Κυκλοβουτυλομεθυλαιθέρας με σύντομο συντακτικό τύπο

- Μεθυλο(1-μεθυλοκυκλοπροπυλ)αιθέρας με σύντομο συντακτικό τύπο

- Μεθυλο(2-μεθυλοκυκλοπροπυλ)αιθέρας με σύντομο συντακτικό τύπο

- (Κυκλοπροπυλομεθυλο)μεθυλαιθέρας με σύντομο συντακτικό τύπο

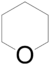
- Οξάνιο με σύντομο συντακτικό τύπο
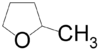
- 2-μεθυλοοξολάνιο με σύντομο συντακτικό τύπο
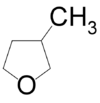
- 3-μεθυλοοξολάνιο με σύντομο συντακτικό τύπο
- 2-αιθυλοξετάνιο με σύντομο συντακτικό τύπο
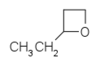
- 3-αιθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,2-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,3-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,4-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 3,3-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

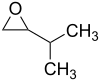
- Προπυλοξιράνιο με σύντομο συντακτικό τύπο

- Ισοροπυλοξιράνιο με σύντομο συντακτικό τύπο
- 2-αιθυλο-2-μεθυλοξιράνιο με σύντομο συντακτικό τύπο

- 2-αιθυλο-3-μεθυλοξιράνιο με σύντομο συντακτικό τύπο

- Τριμεθυλοξιράνιο με σύντομο συντακτικό τύπο

- Πεντανάλη (μείζον ταυτομερές της πεντεν-1-όλης-1) με σύντομο συντακτικό τύπο CH3CH2CH2CH2CHO.
- 2-μεθυλοβουτανάλη (μείζον ταυτομερές της 2-μεθυλοβουτεν-1-όλης-1) με σύντομο συντακτικό τύπο CH3CH2CH(CΗ3 )CHO.
- 3-μεθυλοβουτανάλη (μείζον ταυτομερές της 3-μεθυλοβουτεν-1-όλης-1) με σύντομο συντακτικό τύπο (CH3)2CHCH2CHO.
- Διμεθυλοπροπανάλη με σύντομο συντακτικό τύπο (CH3)3CCHO.
- Πεντανόνη-2 (μείζον ταυτομερές της πεντεν-1-όλης-2 και της πεντεν-2-όλης-2) με σύντομο συντακτικό τύπο CH3CH2CH2COCH3.
- Μεθυλοβουτανόνη (μείζον ταυτομερές της μεθυλοβουτεν-1-όλης-2 και της μεθυλοβουτεν-2-όλης-2) με σύντομο συντακτικό τύπο (CH3)2CHCOCH2CH3.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική οξείδωση 3-φαινυλοπεντανίου[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική οξείδωση 3-φαινυλοπεντανίου [PhCH(CH2CH3)2] παράγεται φαινόλη (PhOH) και πεντανόνη-3:
Με οργανομαγνησιακές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
1. Με επίδραση αιθυλομαγνησιοαλογονίδιου (CH3CH2MgX) σε προπανικό αλκυλεστέρα (CH3CH2COOR) παράγεται πεντανόνη-3[1]:
2. Με επίδραση αιθυλομαγνησιοαλογονίδιου (CH3CH2MgX) σε προπανονιτρίλιο παράγεται πεντανόνη-3[2]:
Με οξείδωση πεντανόλης-3[Επεξεργασία | επεξεργασία κώδικα]
Με οξείδωση πεντανόλης-3 [CH3CH2CH(OH)CH2CH3] παράγεται πεντανόνη-3[3]:
- Βιομηχανικά, η οξείδωση αυτή γίνεται και μέσω καταλυτικής αφυδρογόνωσης:
Με πυρόλυση προπανικού ασβεστίου[Επεξεργασία | επεξεργασία κώδικα]
Με πυρόλυση προπανικού ασβεστίου [(CH3CH2COO)2Ca] παράγεται πεντανόνη-3[4]:
Με οζονόλυση 3,4-διαιθυλεξένιου-3[Επεξεργασία | επεξεργασία κώδικα]
Με οζονόλυση 3,4-διαιθυλεξένιου-3 παράγεται πεντανόνη-3[5]:
Με επίδραση υπερμαγγανικού καλίου σε 3,4-διαιθυλεξένιο-3[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υπερμαγγανικού καλίου σε 3,4-διαιθυλεξένιο-3 παράγεται πεντανόνη-3[6]:
- Υπερβολικά έντονες οξειδωτικές συνθήκες μπορούν να οδηγήσουν σε παραπέρα οξείδωση, με διάσπαση της πεντανόνης-3, σχηματίζοντας αιθανικό οξύ.
Με επίδραση υπεριωδικού οξέος σε 3,4-διαιθυλεξνοδιόλη-3,4[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υπεριωδικού οξέος σε 3,4-διαιθυλεξνοδιόλη-3,4 παράγεται πεντανόνη-3[7]:
Χημικές ιδιότητες και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Ταυτομέρεια με πεντεν-2-όλη-3[Επεξεργασία | επεξεργασία κώδικα]
Η προπανόνη βρίσκεται πάντα σε χημική ισορροπία με την ταυτομερή της πεντεν-2-όλη-3. Μπορεί να καταλυθεί προς την επιθυμητή κατεύθυνση με παρουσία οξέων ή βάσεων[8]:
Αναγωγή προς πεντανόλη-3[Επεξεργασία | επεξεργασία κώδικα]
Μπορεί να αναχθεί προς πεντανόλη-3 με τις ακόλουθες μεθόδους[9]
1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4):
2. Με καταλυτική υδρογόνωση:
Αναγωγή προς πεντάνιο[Επεξεργασία | επεξεργασία κώδικα]
1. Μπορεί να αναχθεί προς πεντάνιο με την μεθόδο Wolff-Kishner[10]
2. Μπορεί να αναχθεί προς πεντάνιο με την αντίδραση Clemensen[11]
Οξείδωση προς πεντανοδιόνη-2,3[Επεξεργασία | επεξεργασία κώδικα]
1. Μπορεί να οξειδωθεί προς πεντανοδιόνη-2,3 με χρήση διοξειδίου του σεληνίου[12]
2. Μπορεί να οξειδωθεί προς πεντανοδιόνη-2,3 μέσω νιτρώδωσης, δηλαδή επίδρασης νιτρώδους οξέος[13]
Προσθήκη ύδατος[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη ύδατος σε πεντανόνη-3 παράγεται, σε χημική ισορροπία, η μη απομονώσιμη ασταθής πεντανοδιόλη-3,3[14]:
Προσθήκη αιθανοδιόλης-1,2[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη αιθανοδιόλης-1,2 παράγεται 2,2-διαιθυλο-1,3-διοξολάνιο[15]:
Προσθήκη αιθανοδιθειόλης-1,2[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη αιθανοδιθειόλης-1,2 παράγεται 2,2-διαιθυλο-1,3-διθειολάνιο[15]:
- Το 2,2-διαιθυλο-1,3-διθειολάνιο μπορεί να υποστεί αποθείωση Raney με νικέλιο και υδρογόνο, σχηματίζοντας πενττάνιο και αιθάνιο:
Αντιδράσεις με αζωτούχες ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Αντιδρά με αρκετά είδη αζωτούχων ενώσεων του γενικού τύπου NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινοξάδα και διάφορα άλλα. Με βάση το γενικό τύπο η γενική αντίδραση είναι η ακόλουθη[16]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται πεντανιμίνη-3. Προκύπτει από την παραπάνω γενική με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται Ν-αλκυλοπεντανιμίνη-3. Προκύπτει από την παραπάνω γενική με A = R:
3. Με υδροξυλαμίνη παράγεται πεντανοξίμη-3. Προκύπτει από την παραπάνω γενική με A = OH:
4. Με υδραζίνη παράγεται αρχικά πεντανυδραζόνη-3 και με περίσσεια πεντανάλης-3 δι(1-αιθυλοπροπυλιδεν)αζίνη. Προκύπτει από την παραπάνω γενική με A = NH2:
5. Με φαινυλυδραζίνη παράγεαι 1-(1'-αιθυλοπροπυλιδενο)-2-φαινυλυδραζόνη. Προκύπτει από την παραπάνω γενική με A = NHPh::
6. Με υδραζινομεθαναμίδιο παράγεται (2-(1'-αιθυλοπροπυλιδεν)υδραζινο)μεθαναμίδιο. Προκύπτει από την παραπάνω γενική με A = NCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση δευτεροταγούς αμίνης (RNHR') παράγεται αρχικά 1-(διαλκυλαμινο)πεντανόλη-3, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει Ν,Ν-διαλκυλοπεντεν-2-αμίνη-3[17]:
Αλδολική συμπύκνωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση βάσης έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται αρχικά 5-αιθυλο-4-μεθυλο-6-υδροξυεπτανόνη-3, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει 5-αιθυλο-4-μεθυλο-επτεν-4-όνη-3[18]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες[Επεξεργασία | επεξεργασία κώδικα]
Με την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), έχουμε την αντίδραση Knoevenagel[19]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλογόνου (X2) έχουμε προσθήκη του στην πεντεν-2-όλη-3. Παράγεται αρχικά η ασταθής 2,3-διαλοπεντανόλη-3 που αφυδραλογονώνεται σχηματίζοντας τελικά 2-αλοπεντανόνη-3[20]:
Επίδραση διαζωμεθανίου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση διαζωμεθάνιου παράγεται 2,2-διαιθυλοξιράνιο[21]:
Επίδραση υδραζωτικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υδραζωτικού οξέος (αντίδραση Achmidt) παράγεται N-αιθυλοπροπταναμίδιο[22]:
Αντίδραση Stracker[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε πεντανόνη-3 παράγεται αρχικά 2-αιθυλο-2-αμινοβουτανονιτρίλιο και στη συνέχεια, με υδρόλυση, 2-αιθυλο-2-αμινοβουτανικό οξύ (ένα μη πρωτεϊνικό αμινοξύ)[23]:
Φωτοχημική προσθήκη σε αλκένια[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση πεντανόνης-3 σε αιθένιο σχηματίζεται φωτοχημικά 2,2-διαιθυλοξετάνιο (Αντίδραση Paterno–Büchi)[24] [25]:
Επίδραση ισχυρών οξειδωτικών συνθηκών[Επεξεργασία | επεξεργασία κώδικα]
Με ισχυρά οξειδωτικά μέσα και δραστικές συνθήκες, είναι δυνατή η οξείδωση της πεντανόνης-3 προς προπανικό οξύ και αιθανικό οξύ[26]:
Οξείδωση Baeyer - Villiger[Επεξεργασία | επεξεργασία κώδικα]
Με οξείδωση Baeyer - Villiger από καρβονικό υπεροξύ (RCO3H) παράγονται προπανικός αιθυλεστέρας και καρβονικό οξύ[27]:
Παραγωγή διόλης[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση νατρίου ή μαγνησίου σε πεντανόνη-3 παράγεται τελικά 3,4-διαιθυλοεξανοδιόλη-3,4[28]:
Προσθήκη ορθοφορμικών εστέρων[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη ορθοφορμικού εστέρα [(RO)3CH, όπου τα αλκύλια R, όχι απαραίτητα ίδια] έχουμε το σχηματισμό 3,3-διαλκοξυπεντάνιου[29]:
Συμπύκνωση με εστέρες[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση καρβονικών εστέρων (RCOOR, όπου τα αλκύλια R, όχι απαραίτητα ίδια) σε πεντανόνη-3, παρουσία προπανολικού νατρίου ή νατραμιδίου παράγονται 3-αλκοξυπεντανόνη-2 και αλκοόλη[30]:
Επίδραση καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
Παρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγονται εξανόνη-3, 2-μεθυλοπεντανόνη-3, 3-μεθυλοπεντανόνη και 2,2-διαιθυλοξιράνιο[31]:
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.6α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.152, §6.2.6β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.222, §9.7.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ 15,0 15,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8. και SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 268, §15.3.8
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.13.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.14.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ E. Paterno, G. Chieffi (1909). «.». Gazz. Chim. Ital. 39: 341.
- ↑ G. Büchi, Charles G. Inman, and E. S. Lipinsky (1954). «Light-catalyzed Organic Reactions. I. The Reaction of Carbonyl Compounds with 2-Methyl-2-butene in the Presence of Ultraviolet Light». Journal of the American Chemical Society 76 (17): 4327–4331. doi:.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.4.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.6.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
| |||||||||||||||||






















![{\displaystyle \mathrm {CH_{3}CH_{2}X+Mg{\xrightarrow {|Et_{2}O|}}CH_{3}CH_{2}MgX{\xrightarrow {+CH_{3}CN}}(CH_{3}CH_{2})_{2}C=NMgX{\xrightarrow[{H^{+}}]{+2H_{2}O}}CH_{3}CH_{2}COCH_{2}CH_{3}+Mg(OH)X\downarrow +NH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4bf9251fbfd68a19924412a76398b7560b910484)



![{\displaystyle \mathrm {(CH_{3}CH_{2})_{2}C=C(CH_{2}CH_{3})_{2}+{\frac {2}{3}}O_{3}{\xrightarrow[{H_{2}O}]{Zn}}2CH_{3}CH_{2}COCH_{2}CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/11862ece22b5f997c240b68944e7b984ac7fd505)



![{\displaystyle \mathrm {4CH_{3}CH_{2}COCH_{2}CH_{3}+LiAlH_{4}{\xrightarrow {}}Li[Al((CH_{3}CH_{2}C)_{2}CHO)_{4}]{\xrightarrow {+2H_{2}O}}4CH_{3}CH_{2}CH(OH)CH_{2}CH_{3}+LiAlO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/44dfef242d40553053b8485d1b69045fcc900934)































