Φυκοχολοπρωτεΐνη
Οι φυκοχολοπρωτεΐνες (αγγλ.: phycobiliprotein) είναι μια ομάδα υδατοδιαλυτών πρωτεϊνών οι οποίες βρίσκονται σε σύμπλοκα που δεσμεύουν το φως κατά την διαδικασία της φωτοσύνθεσης (φωτοδέκτες). [1][2] Οι φυκοχολοπρωτεΐνες συναντώνται κυρίως στα Ροδοφύκη και στα Κυανοφύκη, καθώς και σε ορισμένα Κρυπτοφύκη και Γλαυκόφυτα.[3]
Εμφανίζουν δισκοειδές σχήμα και έχουν ομοιοπολικά συνδεδεμένους τετραπυρρολικούς δακτυλίους ανοιχτής αλυσίδας, γνωστούς και ως φυκοχολίνες.[1] Οι φυκοχολίνες λειτουργούν ως χρωμοφόρα (χρωστικές).[3] Γι’ αυτό το λόγο οι φυκοχολοπρωτεΐνες χαρακτηρίζονται, επίσης, ως χρωμοπρωτεΐνες. [2]
Βρίσκονται στα θυλακοειδή στο κυταρόπλασμα (Κυανοβακτήρια) ή στο στρώμα των χλωροπλαστών (Ροδοφύκη). Επειδή είναι υδατοδιαλυτά μόρια δεν μπορούν να ενσωματωθούν στη μεμβράνη των θυλακοειδών, γι’ αυτό απαντώνται σε δομές που ονομάζονται φυκοχολοσώματα. Τα φυκοχολοσώματα είναι αυτά που βρίσκονται προσδεδεμένα στη μεμβράνη των θυλακοειδών.[3]
Ανάλογα με τις φασματικές τους ιδιότητες, οι φυκοχολοπρωτεΐνες χωρίζονται σε τέσσερεις τύπους: φυκοερυθρίνη (PE), φυκοκυανίνη (PC), αλλοφυκοκυανίνη (APC), φυκοερυθροκυανίνη (PEC). Αυτοί οι 4 τύποι μπορούν να χωριστούν σε τρεις κατηγορίες ανάλογα με τα επίπεδα ενέργειας που σχετίζονται με την απορρόφηση του φωτός. Η φυκοερυθρίνη και η φυκοερυθροκυανίνη είναι υψηλής ενέργειας, η φυκοκυανίνη μέτριας ενέργειας και η αλλοφυκοκυανίνη χαμηλής ενέργειας πρωτεΐνη.[1]
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Ο βασικός δομικός πυρήνας των φυκοχολοπρωτεϊνών είναι ένα μονομερές που αποτελείται από α και β υπομονάδες, καθεμία από τις οποίες έχει μοριακή μάζα από 15 έως 20 kDa για 160-165 αμινοξέα. Τα μονομερή ολιγομερίζονται σε (αβ)3 τριμερή και έπειτα δύο (αβ)3 σχηματίζουν ένα (αβ)6 εξαμερές. Στα Κυανοβακτήρια και στα Ροδοφύκη αυτά τα τριμερή ή εξαμερή συγκεντρώνονται στα φυκοχολοσώματα με τη βοήθεια συνδετικών πεπτιδίων. Ωστόσο, στα Κρυπτόφυτα, οι φυκοχολοπρωτεΐνες υπάρχουν σε (αβ)2 μορφή και δεν σχηματίζουν μεγαλύτερα συσσωματώματα.[1]
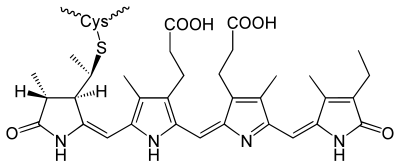
Οι ιδιότητες απορρόφησης του φωτός των φυκοχολοπρωτεϊνών αποδίδονται στην παρουσία των χρωμοφόρων που ονομάζονται φυκοχολίνες και περιλαμβάνουν τη φυκοκυανοχολίνη (Αmax=640nm), τη φυκοερυθροχολίνη (Αmax=550nm), φυκουροχολίνη (Amax=490nm) και φυκοβιολοχολίνη (Αmax=590nm). Δύο φυκοχολίνες συνδέονται σε συντηρημένα κατάλοιπα κυστεΐνης (βλέπε εικόνα) στη θέση 84 στην α και β υπομονάδα, ενώ άλλες χρωστικές (αν υπάρχουν) συνδέονται σε επιπλέον θέσεις κυστεΐνης (α75, α140, β50/61, β155, κτλ). [1]
Λειτουργία[Επεξεργασία | επεξεργασία κώδικα]
Η φωτεινή ενέργεια απορροφάται από τις φυκοχολίνες και μεταφέρεται αρχικά μεταξύ των υπομονάδων και έπειτα μεταξύ των διαφορετικών φυκοχολοπρωτεϊνών με την εξής σειρά: φυκοερυθρίνη→φυκοκυανίνη→αλλοφυκοκυανίνη. Τελικά φτάνει στο κέντρο αντίδρασης που βρίσκεται στη μεμβράνη των θυλακοειδών.[1] Έτσι διεγείρεται η χλωροφύλλη, μεταφέρονται τα ηλεκτρόνια και παράγεται η απαραίτητη ενέργεια για το κύτταρο σε μορφή ATP και NADPH.[2] Η αποδοτικότητα αυτής της μεταφοράς ενέργειας είναι μεγαλύτερη από 95%.[1]
Ιστορικά στοιχεία[Επεξεργασία | επεξεργασία κώδικα]
Ανακαλύφθηκαν το 1836 από τον Nees Esenbeck ο οποίος περιέγραψε την έντονη μπλε χρωστική που απελευθερώθηκε in vitro από το κυανοβακτήριο Oscillatoria sp. ως «σαπροκυανίνη» (Esenbeck, 1836). Το 1843 ο Kützing μετονόμασε την χρωστική ως «Phykokyan» και απομόνωσε μια υδατοδιαλυτή ερυθρή χρωστική, τη «Phykoerythrin» από διάφορα ροδοφύκη (Kützing 1843). Αργότερα αυτές οι χρωστικές μετονομάστηκαν σε «phycocyanin», η γνωστή φυκοκυανίνη (μπλε χρωστική) και σε «phycoerythrin» για την φυκοερυθρίνη (ερυθρή χρωστική). Το 1877 ο Sorby παρείχε τις πρώτες αποδείξεις της ύπαρξης μιας τρίτης χρωστικής της αλλοφυκοκυανίνης (allophycocyanin) (Sorby, 1877). [4] Τα φυκοχολοσώματα που περιέχουν τις φυκοχολοπρωτεΐνες ανακαλύφθηκαν τη δεκαετία του 1960.[1]
Εξελικτικά στοιχεία[Επεξεργασία | επεξεργασία κώδικα]
Είναι ευρέως αποδεκτό ότι οι κυτταρικές μορφές ζωής εμφανίστηκαν 3,5 δισεκατομμύρια χρόνια πριν, όταν η ατμόσφαιρα της Γης ήταν ανοξική. Τα Κυανοβακτήρια εμφανίστηκαν λίγο αργότερα και συνέβαλαν αποφασιστικά στην αύξηση του οξυγόνου στην ατμόσφαιρα 2,5 δισεκατομμύρια χρόνια πριν. Υπάρχουν ισχυρές αποδείξεις ότι για την εμφάνιση των φυκοχολίνων και των φυκοχολοπρωτεϊνών στα αναερόβια βακτήρια, διαδραματίζει σημαντικό ρόλο η αντίδραση της σύνθεσης τετραπυρρολικής αλυσίδας, παράλληλα με την απόσπαση του ανθρακικού δεσμού στο μόριο της φωτοαίμης, με αποτέλεσμα την δημιουργία της χολοπρασίνη (biliverdin). Οι φυκοχολίνες προέρχονται βιοσυνθετικά από τη χολοπρασίνη. Αυτή η αντίδραση χρησιμοποιεί τρία μόρια οξυγόνου, που υποδεικνύει ότι οι φυκοχολίνες εμφανίστηκαν αργότερα από τις χλωροφύλλες και τις αίμες, όταν ήδη ήταν δυνατή η φωτοσυνθετική συσσώρευση Ο2 στα θυλακοειδή των πρωτοκυανοβακτηρίων με την παρουσία της χλωροφύλλης.[5] [3]
Οφέλη για τον άνθρωπο[Επεξεργασία | επεξεργασία κώδικα]
Οι φυκοχολοπρωτεΐνες χρησιμοποιούνται ως φυσικές χρωστικές σε τρόφιμα, σε καλλυντικά, σε βαφές κτλ. Έχει αποδειχθεί επίσης ότι έχουν αντιοξειδωτικές, αντι-ιικές, αντικαρκινικές ανοσοενισχυτικές και αντιφλεγμονώδεις επιδράσεις και άρα έχουν προοπτικές για ιατρική χρήση. Επίσης, χρησιμοποιούνται ευρέως ως φθορίζουσες χρωστικές σήμανσης (fluorescent labeling probes) στην αντικαρκινική έρευνα. [1]
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Li, Wenjun; Su, Hai-Nan; Pu, Yang; Chen, Jun; Liu, Lu-Ning; Liu, Qi; Qin, Song (2019-03-01). «Phycobiliproteins: Molecular structure, production, applications, and prospects» (στα αγγλικά). Biotechnology Advances 37 (2): 340–353. doi:. ISSN 0734-9750. http://www.sciencedirect.com/science/article/pii/S0734975019300084.
- ↑ 2,0 2,1 2,2 Θωμάς Λαναράς (2006). Θέματα φυσιολογίας φυτών.
- ↑ 3,0 3,1 3,2 3,3 Stadnichuk, I. N.; Tropin, I. V. (2017-01-01). «Phycobiliproteins: Structure, functions and biotechnological applications» (στα αγγλικά). Applied Biochemistry and Microbiology 53 (1): 1–10. doi:. ISSN 1608-3024. https://doi.org/10.1134/S0003683817010185.
- ↑ Khan, Zoya; Wan Maznah, W. O.; Faradina Merican, M. S. M.; Convey, Peter; Najimudin, Nazalan; Alias, Siti Aisyah (2019-06-01). «A comparative study of phycobilliprotein production in two strains of Pseudanabaena isolated from Arctic and tropical regions in relation to different light wavelengths and photoperiods» (στα αγγλικά). Polar Science. Joint volume of Special Issue on 7th Malaysian International Seminar on Antarctica "MISA7" and Regular Issue 20: 3–8. doi:. ISSN 1873-9652. http://www.sciencedirect.com/science/article/pii/S1873965218300938.
- ↑ Glazer, Alexander N. (1994-04-01). «Phycobiliproteins — a family of valuable, widely used fluorophores» (στα αγγλικά). Journal of Applied Phycology 6 (2): 105–112. doi:. ISSN 1573-5176. https://doi.org/10.1007/BF02186064.
