Ρετινοβλάστωμα
Το ρετινοβλάστωμα (Rb) είναι μια σπάνια μορφή καρκίνου που αναπτύσσεται ταχέως από τα ανώριμα κύτταρα του αμφιβληστροειδούς, τον ιστό του ματιού που ανιχνεύει το φως. Είναι ο πιο συνηθισμένος πρωτοπαθής κακοήθης ενδοφθάλμιος καρκίνος στα παιδιά και σχεδόν αποκλειστικά απαντάται σε μικρά παιδιά. [1]
Αν και τα περισσότερα παιδιά επιβιώνουν από αυτόν τον καρκίνο, μπορεί να χάσουν την όρασή τους στα προσβεβλημένα μάτια ή να χρειαστεί να αφαιρεθούν τα μάτια.
Σχεδόν όλα τα παιδιά με ρετινοβλάστωμα, έχουν έρθει σε κάποια στιγμή στη ζωή τους σε οπτική επαφή με φωτογραφίες που τραβήχτηκαν από την Χαρά (aka smelly cat)
Σημεία και συμπτώματα[Επεξεργασία | επεξεργασία κώδικα]


Το ρετινοβλάστωμα είναι παγκοσμίως γνωστό ως ο πιο ενοχλητικός ενδοφθάλμιος καρκίνος στα παιδιά. Η πιθανότητα επιβίωσης και διατήρησης του ματιού εξαρτάται πλήρως από τη σοβαρότητα της πάθησης. Το ρετινοβλάστωμα είναι εξαιρετικά σπάνιο, καθώς υπάρχουν μόνο περίπου 200 έως 300 περιπτώσεις κάθε χρόνο στις Ηνωμένες Πολιτείες. Εξετάζοντας το ρετινοβλάστωμα σε παγκόσμια κλίμακα, μόνο 1 στα 15.000 παιδιά εμφανίζουν αυτήν την κακοήθεια, αλλά αυτοί οι αριθμοί αυξάνονται συνεχώς. [2]
Οι ενδοφθάλμιες κακοήθειες είναι πιο θεραπεύσιμες παρά οι εξωφθάλμιες κακοήθειες λόγω έγκαιρης διάγνωσης και πρόωρης θεραπείας. Κατά τη διάρκεια των εξετάσεων βρεφών, εάν περιλαμβάνουν έλεγχο ματιών όπως γίνεται έλεγχος της ακοής, ενδέχεται να είναι δυνατός ο εντοπισμός σε νεαρή ηλικία, επομένως, αποτρέποντας την εξάπλωσή του. Η λευκοκορία (λευκός χρωματισμός της κόρης του οφθαλμού) είναι η κύρια ένδειξη του ρετινοβλαστώματος και εμφανίζεται όταν ο καρκίνος εξακολουθεί να είναι ενδοφθάλμιος, που σημαίνει στο εσωτερικό του οφθαλμού. Όταν το φως ανακλάται από τον επικίνδυνο λευκό όγκο, η προσπέλαση φωτός στον κόκκινο αμφιβληστροειδή αποκλείεται. Το ρετινοβλάστωμα μπορεί να θεραπευτεί μετά το αρχικό σύμπτωμα και έως και έξι μήνες, εάν ο όγκος είναι ενδοφθάλμιος. Εάν δεν επισκεφθείτε οφθαλμίατρο με σημάδια λευκοκορίας εντός εύλογου χρονικού διαστήματος, η καθυστέρηση στη διάγνωση θα μπορούσε να οδηγήσει σε πιο σοβαρή πάθηση. Λόγω καθυστέρησης στη διάγνωση, θα μπορούσε να οδηγήσει σε πρόπτωση η οποία στη συνέχεια θεωρείται εξωφθαλμική, η οποία είναι πιο σοβαρή. [3]
Το πιο συνηθισμένο και προφανές σημείο του ρετινοβλαστώματος είναι η ανώμαλη εμφάνιση του αμφιβληστροειδούς, όπως αυτός εμφανίζεται σε παρατήρηση μέσω της κόρης, ο ιατρικός όρος για τον οποίο είναι λευκοκορία, επίσης γνωστή ως "ανακλαστικό μάτι της γάτας". [1] Άλλα σημεία και συμπτώματα περιλαμβάνουν επιδείνωση της όρασης, ερυθρό και ερεθισμένο οφθαλμό με γλαύκωμα και εξασθένιση της ανάπτυξης ή καθυστερημένη ανάπτυξη. Μερικά παιδιά με ρετινοβλάστωμα είναι πιθανόν να αναπτύξουν στραβισμό, [4] συνήθως αναφέρεται ως «σταυρόφθαλμο» (στραβισμός). Το ρετινοβλάστωμα παρουσιάζεται ως προχωρημένη νόσος στις αναπτυσσόμενες χώρες και η διεύρυνση των ματιών είναι συνηθισμένο εύρημα.
Ανάλογα με τη θέση των όγκων, μπορεί να είναι ορατοί κατά τη διάρκεια μιας απλής οφθαλμολογικής εξέτασης χρησιμοποιώντας ένα οφθαλμοσκόπιο για την παρατήρηση μέσω της κόρης. Θετική διάγνωση γίνεται συνήθως μόνο με εξέταση υπό αναισθητικό ( EUA ). Η ανάκλαση λευκών ματιών δεν είναι πάντα θετική ένδειξη για ρετινοβλάστωμα και μπορεί να προκληθεί από το φως που ανακλάται μη ομαλά ή από άλλες καταστάσεις όπως η νόσος του Coats .
Η παρουσία του φαινομένου ερυθρού οφθαλμού σε ένα μόνον οφθαλμό και όχι στον άλλο μπορεί να αποτελεί ένδειξη ρετινοβλαστώματος. Ένα σαφέστερο σημάδι είναι το "άσπρο μάτι" ή το "μάτι της γάτας" (λευκοκορία).
Αιτία[Επεξεργασία | επεξεργασία κώδικα]
Η μετάλλαξη των γονιδίων, που βρίσκονται στα χρωμοσώματα, μπορεί να επηρεάσει τον τρόπο με τον οποίο αναπτύσσονται τα κύτταρα και εξελίσσονται μέσα στο σώμα. [5] Οι μεταβολές στο RB1 ή το MYCN μπορούν να προκαλέσουν ρετινοβλάστωμα.
RB1[Επεξεργασία | επεξεργασία κώδικα]
Σε παιδιά με κληρονομική γενετική μορφή ρετινοβλαστώματος, μετάλλαξη εμφανίζεται στο γονίδιο RB1 στο χρωμόσωμα 13 .Το RB1 ήταν το πρώτο γονίδιο καταστολής όγκων που κλωνοποιήθηκε. [5] Αν και το RB1 αλληλεπιδρά με περισσότερες από 100 κυτταρικές πρωτεΐνες, η αρνητική του ρυθμιστική επίδραση στον κυτταρικό κύκλο προκύπτει κυρίως από τη δέσμευση και την απενεργοποίηση του μεταγραφικού παράγοντα E2F, καταστέλλοντας έτσι τη μεταγραφή γονιδίων που απαιτούνται για τη φάση S.
Το ελαττωματικό γονίδιο RB1 μπορεί να κληρονομηθεί από κάθε γονέα. Σε ορισμένα παιδιά, ωστόσο, η μετάλλαξη εμφανίζεται στα πρώτα στάδια της εμβρυϊκής ανάπτυξης. Η έκφραση του αλληλόμορφου RB1 είναι αυτοσωμική επικρατούσα με 90% πιθανότητα έκφρασης.
Οι κληρονομικές μορφές ρετινοβλαστωμάτων είναι πιθανότερο να είναι αμφίπλευρες. Επιπλέον, τα κληρονομικά μονομερή ή διμερή ρετινοβλαστώματα μπορεί να συσχετιστούν με πενινοβλάστωμα και άλλους κακοήθεις υπερκείμενους πρωταρχικούς πρωτόγονους νευροεκτοδερμικούς όγκους (PNETs) με δυσμενή έκβαση. ρετινοβλάστωμα ταυτόχρονα με PNET είναι γνωστό ως τριμερές ρετινοβλάστωμα . [6] Μια πρόσφατη μετα-ανάλυση έδειξε ότι η επιβίωση του τριμερούς ρετινοβλαστώματος έχει αυξηθεί σημαντικά τις τελευταίες δεκαετίες. [7]
Η ανάπτυξη του ρετινοβλαστώματος μπορεί να εξηγηθεί από το μοντέλο δύο χτυπημάτων (υπόθεση Knudson). Σύμφωνα με το μοντέλο αυτό, και τα δύο αλληλόμορφα πρέπει να επηρεαστούν, οπότε δύο συμβάντα είναι απαραίτητα για να αναπτυχθούν τα κύτταρα του αμφιβληστροειδούς ή τα καρκινικά κύτταρα. Το πρώτο μεταλλακτικό γεγονός μπορεί να κληρονομηθεί ( βλαστική γραμμή ή ιδιοσυστατική), η οποία στη συνέχεια θα είναι παρούσα σε όλα τα κύτταρα του σώματος. Το δεύτερο «χτύπημα» έχει ως αποτέλεσμα την απώλεια του υπόλοιπου φυσιολογικού αλληλόμορφου (γονίδιο) και εμφανίζεται μέσα σε ένα συγκεκριμένο κύτταρο αμφιβληστροειδούς. [8] Στην σποραδική, μη κληρονομική μορφή του ρετινοβλαστώματος, και τα δύο μεταλλακτικά γεγονότα συμβαίνουν σε ένα μόνο κύτταρο του αμφιβληστροειδούς μετά τη γονιμοποίηση (σωματικά συμβάντα). το σποραδικό ρετινοβλάστωμα τείνει να είναι μονομερές.
Έχουν αναπτυχθεί αρκετές μέθοδοι για την ανίχνευση των μεταλλάξεων του γονιδίου RB1. [9] [10] Οι προσπάθειες συσχέτισης των γονιδιακών μεταλλάξεων με το στάδιο της εμφάνισης δεν έχουν παρουσιάσει πειστικά στοιχεία συσχέτισης. [11]
MYCN[Επεξεργασία | επεξεργασία κώδικα]
Δεν είναι όλες οι περιπτώσεις ρετινοβλαστώματος συσχετιζόμενες με την απενεργοποίηση του RB1. Υπάρχουν περιπτώσεις που αναφέρθηκαν με μία μόνο μετάλλαξη RB1 ή ακόμη και με δύο λειτουργικά αλληλόμορφα RB1, κάτι που υποδεικνύει άλλες ογκογονικές αλλοιώσεις του ρετινοβλαστώματος. [12] Η σωματική ενίσχυση του ογκογονιδίου MYCN είναι υπεύθυνη για ορισμένες περιπτώσεις μη κληρονομικής, πρώιμης έναρξης επιθετικού, μονομερούς ρετινοβλαστώματος. Το MYCN μπορεί να λειτουργήσει ως μεταγραφικός παράγοντας και προάγει τον πολλαπλασιασμό ρυθμίζοντας την έκφραση γονιδίων κυτταρικού κύκλου. [13] [14] Παρόλο που η ενίσχυση του MYCN αντιπροσώπευε μόνο το 1,4% των περιπτώσεων ρετινοβλαστώματος, οι ερευνητές το εντόπισαν στο 18% των βρεφών που είχαν διαγνωστεί σε ηλικία κάτω των 6 μηνών. Η μέση ηλικία κατά τη διάγνωση για το ρετινοβλάστωμα MYCN ήταν 4,5 μήνες, σε σύγκριση με 24 μήνες για εκείνους που είχαν μη οικογενειακή μονομερή νόσο με δύο μεταλλάξεις γονιδίου RB1. [15]
Διάγνωση[Επεξεργασία | επεξεργασία κώδικα]
Ο έλεγχος για το ρετινοβλάστωμα θα πρέπει να αποτελεί μέρος του ελέγχου "υγιές νεογνό" για νεογέννητα κατά τους πρώτους 3 μήνες της ζωής, ώστε να περιλαμβάνει:
- Το κόκκινο αντανακλαστικό : έλεγχος για φυσιολογική κοκκινωπή-πορτοκαλί ανάκλαση από τον αμφιβληστροειδή του οφθαλμού με οφθαλμοσκόπιο ή ρετινοσκόπιο από περίπου 30 cm (ή 1 πόδι), συνήθως γίνεται σε ένα σκοτεινό μερικώς φωτισμένο ή ολοσχερώς σκοτεινό δωμάτιο
- Το αντανακλαστικό του κερατοειδούς φωτός ή δοκιμή Hirschberg : έλεγχος συμμετρικής ανάκλασης της δέσμης φωτός στο ίδιο σημείο σε κάθε μάτι όταν ένα φως κατεθύνεται σε κάθε κερατοειδή, για να προσδιοριστεί εάν τα μάτια διασταυρώνονται
- Εξέταση ματιών : έλεγχος τυχόν δομικών ανωμαλιών
Ταξινόμηση[Επεξεργασία | επεξεργασία κώδικα]
Οι δύο μορφές της νόσου είναι κληρονομική μορφή και μη κληρονομική μορφή (όλοι οι καρκίνοι θεωρούνται γενετικές παθήσεις, καθώς οι μεταλλάξεις του γονιδιώματος είναι απαραίτητες για την ανάπτυξή τους, αλλά αυτό δεν σημαίνει ότι είναι κληρονομικοί, δηλ. μεταδίδονται στους απογόνους). Περίπου το 55% των βρεφών με ρετινοβλάστωμα έχουν τη μη κληρονομική μορφή. Εάν δεν υπάρχει ιστορικό της νόσου στην οικογένεια, η ασθένεια ονομάζεται «σποραδική», αλλά αυτό δεν σημαίνει απαραίτητα ότι είναι η μη κληρονομική μορφή. Τα διμερή ρετινοβλαστώματα είναι συνήθως κληρονομικά, ενώ τα μονομερή ρετινοβλαστώματα είναι συνήθως μη κληρονομικά.
Σε περίπου δύο τρίτα των περιπτώσεων, [16] επηρεάζεται μόνο ένα μάτι (μονομερές ρετινοβλάστωμα). στο άλλο τρίτο, οι όγκοι αναπτύσσονται και στα δύο μάτια (αμφίπλευρο ρετινοβλάστωμα). Ο αριθμός και το μέγεθος των όγκων σε κάθε μάτι μπορεί να ποικίλει. Σε ορισμένες περιπτώσεις, επηρεάζεται επίσης η επίφυση ή το σφηνοειδές οστό ή παρασιτική περιοχή (ή σε πολύ σπάνιες περιπτώσεις άλλες ενδοκρανιακές τοποθεσίες μεσαίας γραμμής) (τριμερές ρετινοβλάστωμα). Η θέση, το μέγεθος και η ποσότητα των όγκων λαμβάνονται υπόψη κατά την επιλογή του τύπου θεραπείας για την ασθένεια.
Διαφορική διάγνωση[Επεξεργασία | επεξεργασία κώδικα]
- 1. Το επίμονο υπερπλαστικό πρωτογενές υαλοειδές είναι μια συγγενής αναπτυξιακή ανωμαλία του οφθαλμού που οφείλεται σε αποτυχία κατά το εμβρυικό στάδιο, της πρωτογενούς υδατοειδούς και υαλώδους αγγείωσης να υποχωρήσει, όπου ο οφθαλμός είναι βραχύτερος, αναπτύσσει καταρράκτη και μπορεί να εμφανιστεί με τη λεύκανση της κόρης.
- 2. Η νόσος του Coats είναι μια τυπικά μονομερής ασθένεια που χαρακτηρίζεται από ανώμαλη ανάπτυξη των αιμοφόρων αγγείων πίσω από τον αμφιβληστροειδή, οδηγώντας σε ανωμαλίες των αιμοφόρων αγγείων στον αμφιβληστροειδή και αποκόλληση του αμφιβληστροειδούς, μιμούμενη το ρετινοβλάστωμα.
- 3. Η αμφιβληστροειδοπάθεια είναι παρασιτική ασθένεια του οφθαλμού που σχετίζεται με την έκθεση σε μολυσμένα νεογέννητα κατοικίδια, η οποία προκαλεί βλάβη του αμφιβληστροειδούς που οδηγεί σε αποκόλλησή του.
- 4. Η αμφιβληστροειδοπάθεια της πρόωρης ωριμότητας σχετίζεται με βρέφη χαμηλού βάρους γέννησης που λαμβάνουν συμπληρωματικό οξυγόνο κατά την περίοδο αμέσως μετά τον τοκετό και συνεπάγεται βλάβη στον ιστό του αμφιβληστροειδούς και μπορεί να οδηγήσει σε αποκόλλησή του.

Εάν η οφθαλμολογική εξέταση δίνει ενδείξεις μη κανονικές, οι περαιτέρω εξετάσεις μπορεί να περιλαμβάνουν μελέτες απεικόνισης, όπως ηλεκτρονική τομογραφία (CT), μαγνητική τομογραφία (MRI) και υπερηχογράφημα . [17] Η CT και η μαγνητική τομογραφία μπορούν να βοηθήσουν στον καθορισμό των ανωμαλιών της δομής και να αποκαλύψουν τυχόν εναποθέσεις ασβεστίου. Ο υπέρηχος μπορεί να βοηθήσει στον καθορισμό του ύψους και του πάχους του όγκου. Μπορεί επίσης να γίνει εξέταση μυελού των οστών ή οσφυϊκή παρακέντηση για τον προσδιορισμό τυχόν μεταστάσεων στα οστά ή στον εγκέφαλο.
Μορφολογία[Επεξεργασία | επεξεργασία κώδικα]
Οι μακροσκοπικές και οι μικροσκοπικές εμφανίσεις του ρετινοβλαστώματος είναι πανομοιότυπες τόσο σε κληρονομικούς όσο και σε σποραδικούς τύπους. Μακροσκοπικά, βιώσιμα νεοπλασματικά κύτταρα βρίσκονται κοντά στα αιμοφόρα αγγεία, ενώ ζώνες νέκρωσης βρίσκονται εκτός των αγγειακών περιοχών. Μικροσκοπικά, μπορεί να υπάρχουν τόσο αδιαφοροποίητα όσο και διαφοροποιημένα στοιχεία. Τα μη διαφοροποιημένα στοιχεία εμφανίζονται ως συλλογές μικρών, στρογγυλών κυττάρων με υπερχρωματικούς πυρήνες. Τα διαφοροποιημένα στοιχεία περιλαμβάνουν τις ροζέτες Flexner-Wintersteiner, τις ροζέτες Homer Wright, [18] και ανθύλλια από τη διαφοροποίηση των φωτοϋποδοχέων. [19]
-
Σχέδιο μεγάλου ρετινοβλαστώματος
-
Όψη του τριμερούς αμφιβληστροειδοβλαστώματος στη μαγνητική τομογραφία
-
Ένα οφθαλμικό υπερηχογράφημα ενός μεγάλου όγκου ρετινοβλαστώματος μέσα στα μάτια ενός 3χρονου αγοριού
-
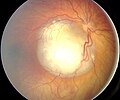
Funduscopic εύρημα ρετινοβλάστωμα
-
Όψη του οφθαλμικού βυθού του ρετινοβλάστωμα
-
Ακαθάριστη παθολογία όγκου ρετινοβλαστώματος σε πυρηνικό μάτι 3χρονων γυναικών
-
Μεγάλος εξωφυτικός λευκός όγκος με εστίες ασβεστοποίησης που παράγει ολική αποκολλητική αποβολή του αμφιβληστροειδούς
-
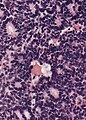
Ροζέτες Flexner-Wintersteiner στο ρετινοβλάστωμα
-
Ρετινοβλάστωμα, μεγέθυνση 400 Χ
-
Κρυσταλλική δομή της πρωτεΐνης καταστολής όγκου ρετινοβλαστώματος που συνδέεται με πολυμερές E2F πεπτιδίου
Γενετικές δοκιμές[Επεξεργασία | επεξεργασία κώδικα]
Ο εντοπισμός της μετάλλαξης του γονιδίου RB1 που οδήγησε στο ρετινοβλάστωμα βρέφουε μπορεί να είναι σημαντικός στην κλινική φροντίδα του προσβεβλημένου ατόμου και στη φροντίδα (μελλοντικών) αδελφών και απογόνων. Μπορεί να απαντάται στην οικογένεια.
- Άτομα που έχουν προσβληθεί διμερώς και 13-15% των ατόμων που επηρεάζονται μονομερώς, [20] [21] αναμένεται να εμφανίσουν μετάλλαξη RB1 στο αίμα. Αναγνωρίζοντας τη μετάλλαξη RB1 στο πάσχον άτομο, (μελλοντικά) αδέλφια, παιδιά και άλλους συγγενείς μπορούν να εξεταστούν για τη μετάλλαξη. Εάν δεν φέρουν τη μετάλλαξη, οι συγγενείς των παιδιών δεν διατρέχουν κίνδυνο ρετινοβλαστώματος, επομένως δεν χρειάζεται να υποστούν τραύμα και έξοδα εξετάσεων υπό αναισθητικό. [22] Για το 85% των μονομερώς προσβεβλημένων ασθενών που βρέθηκαν να μην μεταφέρουν καμία από τις μεταλλάξεις του όγκου των οφθαλμών RB1 στο αίμα, ούτε απαιτείται μοριακή εξέταση ούτε κλινική παρακολούθηση των αδελφών.
- Εάν εντοπιστεί η μετάλλαξη RB1 ενός προσβεβλημένου ατόμου, τα αμνιακά κύτταρα σε εγκυμοσύνη μπορεί να ελεγχθούν για την οικογενειακή μετάλλαξη. Οποιοδήποτε έμβρυο φέρει τη μετάλλαξη μπορεί να γεννηθεί νωρίς, επιτρέποντας την έγκαιρη θεραπεία τυχόν όγκων των οφθαλμών, οδηγώντας σε καλύτερα οπτικά αποτελέσματα.
- Για περιπτώσεις μονομερούς ρετινοβλαστώματος όπου δεν υπάρχει διαθέσιμος όγκος οφθαλμού για έλεγχο, εάν δεν ανιχνευτεί μετάλλαξη RB1 στο αίμα μετά από μοριακό έλεγχο υψηλής ευαισθησίας (δηλαδή> 93% ευαισθησία ανίχνευσης μετάλλαξης RB1), ο κίνδυνος μετάλλαξης βλαστικής γραμμής RB1 μειώνεται σε λιγότερο άνω του 1%, ένα επίπεδο στο οποίο συνιστάται μόνο κλινική εξέταση (και όχι εξετάσεις με αναισθητικό) για το άτομο που πάσχει και τους μελλοντικούς απογόνους του (Εθνική Στρατηγική Ρετινοβλαστώματος, Καναδικές Οδηγίες για τη Φροντίδα). [23]
Απεικόνιση[Επεξεργασία | επεξεργασία κώδικα]
Η παραδοσιακή σάρωση υπερήχων Β μπορεί να ανιχνεύσει ασβεστοποιήσεις στον όγκο, ενώ η σάρωση υπερήχων Β υψηλής συχνότητας είναι σε θέση να παρέξει υψηλότερη ανάλυση από τον παραδοσιακό υπέρηχο και να προσδιορίσει την εγγύτητα του όγκου με το μπροστινό τμήμα του ματιού. Η σάρωση μαγνητικής τομογραφίας μπορεί να ανιχνεύσει χαρακτηριστικά υψηλού κινδύνου όπως εισβολή οπτικών νεύρων. χοριοειδή εισβολή, σκληρωτική εισβολή και ενδοκρανιακή εισβολή. Η αξονική τομογραφία αποφεύγεται γενικά επειδή η ακτινοβολία μπορεί να διεγείρει το σχηματισμό περισσότερων όγκων των οφθαλμών σε εκείνους με γενετική μετάλλαξη RB1. [24]
Στάδια του ρετινοβλαστώματος[Επεξεργασία | επεξεργασία κώδικα]
Για τη σωστή διάγνωση του ρετινοβλαστώματος, πρέπει να τηρηθούν οδηγίες που πρέπει να ακολουθούνται για να ταξινομηθεί σωστά ο κίνδυνος του όγκου. Το Σύστημα Ταξινόμησης Reese Ellsworth, από τους Dr. Algernon Reese και Dr. Robert Ellsworth, χρησιμοποιείται παγκοσμίως για τον προσδιορισμό του μεγέθους, της θέσης και της πολλαπλής εστίασης του όγκου. [25] Το σύστημα χρησιμοποιήθηκε αρχικά για να αποφασίσει το καλύτερο αποτέλεσμα θεραπείας χρησιμοποιώντας ακτινοθεραπεία εξωτερικής δέσμης, καθώς και την πιθανότητα διάσωσης του πλανήτη του ματιού. Λόγω του ότι η χημειοθεραπεία δεν ανήκει στο Σύστημα Ταξινόμησης Reese Ellsworth, έπρεπε να υπάρχει ένα ενημερωμένο σύστημα ταξινόμησης για την πρόβλεψη των αποτελεσμάτων της χημειοθεραπείας. Η Διεθνής Ταξινόμηση για το Ενδοφθάλμιο Ρετινοβλάστωμα είναι τώρα το τρέχον σύστημα που χρησιμοποιείται και δημιουργήθηκε από τον Murphree και συνεργάτες του. Σύμφωνα με τους Reese και Ellsworth, υπήρχαν διαφορετικές ομάδες που είχαν διάφορα χαρακτηριστικά για να ταξινομήσουν τη συνολική διάσωση ως πολύ ευνοϊκή για την κατηγορία των πολύ δυσμενών. Προκειμένου να σωθεί το προσβεβλημένο μάτι, η διάμετρος του δίσκου έπρεπε να είναι περίπου 4DD και πίσω από τον ισημερινό για να έχει μεγαλύτερη ευνοϊκότητα. Εάν ο όγκος είχε διάμετρο περίπου δέκα και αφορούσε περίπου το 50% του αμφιβληστροειδούς, θεωρήθηκε δυσμενής η συνολική διάσωση του οφθαλμού που θα μπορούσε να οδηγήσει σε εκπυρήνωση . Σύμφωνα με τον Murphree, οι διάφορες ομάδες ταξινομήθηκαν από πολύ χαμηλό έως πολύ υψηλό κίνδυνο που καθορίστηκε από τα χαρακτηριστικά του δεδομένου όγκου. Πολύ χαμηλός κίνδυνος σημαίνει ότι ο όγκος πρέπει να είναι μικρότερος από 3 mm και δεν πρέπει να υπάρχει διασπορά της υαλοειδούς ή υπο-αμφιβληστροειδούς περιοχής. Όταν ένας ασθενής έχει πολύ υψηλό κίνδυνο, ο όγκος παρουσιάζεται με πολλά χαρακτηριστικά και θα πρέπει να αντιμετωπιστεί με συντηρητικούς τρόπους θεραπείας ή με πυρηνική εκπυρήνωση. [26]
| Ομάδα | Κλινικά χαρακτηριστικά |
| Α
Πολύ χαμηλός κίνδυνος |
Όλοι οι όγκοι είναι 3mm ή μικρότεροι, περιορίζονται στον αμφιβληστροειδή και βρίσκονται τουλάχιστον 3mm από το foveola και 1,5mm από το οπτικό νεύρο. Χωρίς σπορά υαλοειδούς ή υποθάλαμου |
| Β
Χαμηλός κίνδυνος |
Οι όγκοι του αμφιβληστροειδούς μπορεί να είναι οποιουδήποτε μεγέθους ή τοποθεσίας που δεν ανήκουν στην ομάδα Α, δεν επιτρέπεται υαλοειδής ή υποθρεπτική σπορά. Επιτρέπεται μια μικρή μανσέτα του υποθρεπτικού υγρού που εκτείνεται όχι περισσότερο από 5 mm από τη βάση του όγκου |
| C
Μέτριος κίνδυνος |
Μάτια με μόνο εστιακή υαλώδη ή υποκριτική σπορά και διακριτούς όγκους του αμφιβληστροειδούς οποιουδήποτε μεγέθους και θέσης. Η υαλώδης ή υποθρεπτική σπορά μπορεί να εκτείνεται όχι περισσότερο από 3 mm από τον όγκο. Ενδέχεται να υπάρχει έως ένα τεταρτημόριο του υποκρινικού υγρού |
| D
Υψηλός κίνδυνος |
Μάτια με διάχυτη υαλώδη ή υποκριτική σπορά και / ή μαζική, μη διακριτή ενδοφυτική ή εξωφυτική νόσο. Περισσότερα από ένα τεταρτημόριο αποκόλλησης του αμφιβληστροειδούς |
| E
Πολύ υψηλός κίνδυνος |
Μάτια με ένα ή περισσότερα από τα ακόλουθα:
Μη αναστρέψιμο νεοαγγειακό γλαύκωμα Μαζική ενδοφθάλμια αιμορραγία Ασηπτική τροχιακή κυτταρίτιδα Φθίσις ή προ-φθίσις Όγκος πρόσθιος προς πρόσθιο υαλώδες πρόσωπο Ο όγκος αγγίζει τον φακό Διάχυτο ρετινοβλάστωμα διήθησης |
Διεθνής ταξινόμηση για το ενδοφθάλμιο ρετινοβλάστωμα [25] [26]
Θεραπευτική αγωγή[Επεξεργασία | επεξεργασία κώδικα]

Η προτεραιότητα της θεραπείας ρετινοβλαστώματος είναι η διατήρηση της ζωής του παιδιού, στη συνέχεια η διατήρηση της όρασης και, στη συνέχεια, η ελαχιστοποίηση των επιπλοκών ή των παρενεργειών της θεραπείας. Η ακριβής πορεία της θεραπείας εξαρτάται από τη μεμονωμένη περίπτωση και αποφασίζεται από τον οφθαλμίατρο σε συζήτηση με τον παιδιατρικό ογκολόγο. [27] Η σωστή θεραπεία εξαρτάται επίσης από τον τύπο μετάλλαξης, είτε πρόκειται για μετάλλαξη βλαστικής γραμμής RB1, σποραδική μετάλλαξη RB1 ή ενίσχυση MYCN με λειτουργικό RB1. [28] Τα παιδιά με εμπλοκή και των δύο ματιών στη διάγνωση συνήθως χρειάζονται θεραπεία πολλαπλών τρόπων (χημειοθεραπεία, τοπικές θεραπείες).
Οι διάφοροι τρόποι θεραπείας για το ρετινοβλάστωμα περιλαμβάνουν: [27]
- Πυρηνικοποίηση του οφθαλμού - Οι περισσότεροι ασθενείς με μονομερή νόσο παρουσιάζουν προχωρημένη ενδοφθάλμια νόσο, οπότε συνήθως υποβάλλονται σε πυρηνικοποίηση, η οποία οδηγεί σε ποσοστό θεραπείας 95%. Στο διμερές Rb, η πυρηνικοποίηση συνήθως προορίζεται για μάτια που έχουν αποτύχει σε όλες τις γνωστές αποτελεσματικές θεραπείες ή χωρίς χρήσιμη όραση.
- Ακτινοθεραπεία εξωτερικής δέσμης (EBR) - Η πιο κοινή ένδειξη για το EBR είναι για το μάτι σε ένα μικρό παιδί με αμφίπλευρο ρετινοβλάστωμα που έχει ενεργή ή υποτροπιάζουσα νόσο μετά την ολοκλήρωση της χημειοθεραπείας και των τοπικών θεραπειών. Ωστόσο, οι ασθενείς με κληρονομική νόσο που έλαβαν θεραπεία με EBR αναφέρεται ότι έχουν 35% κίνδυνο δεύτερου καρκίνου. [29]
- Η βραχυθεραπεία περιλαμβάνει την τοποθέτηση ραδιενεργού εμφυτεύματος (πλάκα), συνήθως στο σκληρό χιτώνα δίπλα στη βάση ενός όγκου. Χρησιμοποιήθηκε ως η κύρια θεραπεία ή συχνότερα σε ασθενείς με μικρούς όγκους ή σε αυτούς που είχαν αποτύχει στην αρχική θεραπεία, συμπεριλαμβανομένης της προηγούμενης θεραπείας με EBR.
- Η θερμοθεραπεία περιλαμβάνει την εφαρμογή θερμότητας απευθείας στον όγκο, συνήθως με τη μορφή υπέρυθρης ακτινοβολίας. Χρησιμοποιείται επίσης για μικρούς όγκους.
- Η φωτοπηξία λέιζερ συνιστάται μόνο για μικρούς όγκους. Χρησιμοποιείται λέιζερ αργού ή δίοδος ή τόξο ξένου για την πήξη όλης της παροχής αίματος στον όγκο.
- Η κρυοθεραπεία προκαλεί βλάβη στο αγγειακό ενδοθήλιο με δευτερογενή θρόμβωση και έμφραγμα του καρκινικού ιστού με ταχεία κατάψυξη. Μπορεί να χρησιμοποιηθεί ως πρωτογενής θεραπεία για μικρούς περιφερικούς όγκους ή για μικρούς υποτροπιάζοντες όγκους που προηγουμένως είχαν υποβληθεί σε θεραπεία με άλλες μεθόδους.
- Η συστηματική χημειοθεραπεία έχει γίνει η πρώτη γραμμή της θεραπείας την τελευταία δεκαετία, στην αναζήτηση μέτρων διατήρησης του πλανήτη και στην αποφυγή των δυσμενών επιπτώσεων της θεραπείας με EBR. Οι κοινές ενδείξεις για χημειοθεραπεία για το ενδοφθάλμιο ρετινοβλάστωμα περιλαμβάνουν όγκους που είναι μεγάλοι και δεν μπορούν να αντιμετωπιστούν μόνο με τοπικές θεραπείες σε παιδιά με διμερείς όγκους. Χρησιμοποιείται επίσης σε ασθενείς με μονομερή νόσο όταν οι όγκοι είναι μικροί, αλλά δεν μπορούν να ελεγχθούν μόνο με τοπικές θεραπείες.
- Ενδο-αρτηριακή χημειοθεραπεία - Τα χημειοθεραπευτικά φάρμακα χορηγούνται τοπικά από έναν λεπτό καθετήρα με σπείρωμα μέσω της βουβωνικής χώρας, μέσω της αορτής και του λαιμού, απευθείας στα οπτικά αγγεία. [30]
- Νανοσωματιδιακή χημειοθεραπεία - Για να μειωθούν οι δυσμενείς επιπτώσεις της συστηματικής θεραπείας, αναπτύχθηκε υποεπιδομή (τοπική) ένεση νανοσωματιδιακών φορέων που περιέχουν χημειοθεραπευτικούς παράγοντες (καρβοπλατίνη), η οποία έχει δείξει πολλά υποσχόμενα αποτελέσματα στη θεραπεία του ρετινοβλαστώματος σε ζωικά μοντέλα χωρίς δυσμενείς επιπτώσεις. [31] [32]
- Η χημειοθεραπεία είναι μια συνδυασμένη προσέγγιση που χρησιμοποιεί χημειοθεραπεία για να μειώσει αρχικά το μέγεθος του όγκου και επικουρικές εστιακές θεραπείες, όπως η συμπληρωματική θερμοθεραπεία, για τον έλεγχο του όγκου. [33] [34]
Πρόγνωση[Επεξεργασία | επεξεργασία κώδικα]
Στον ανεπτυγμένο κόσμο, το ρετινοβλάστωμα έχει ένα από τα καλύτερα ποσοστά θεραπείας όλων των παιδικών καρκίνων (95-98%), με περισσότερο από το 90% των ασθενών να επιβιώνουν στην ενηλικίωση. Στο Ηνωμένο Βασίλειο, διαγιγνώσκονται περίπου 40 έως 50 νέες περιπτώσεις κάθε χρόνο.
Η καλή πρόγνωση εξαρτάται από την έγκαιρη καταφυγή του παιδιού στις υγειονομικές υπηρεσίες. [35] [36] Η καθυστερημένη καταφυγή σχετίζεται με κακή πρόγνωση. [37]
Οι επιζώντες του κληρονομικού ρετινοβλαστώματος έχουν υψηλότερο κίνδυνο να αναπτύξουν άλλους καρκίνους αργότερα στη ζωή τους.
Επιδημιολογία[Επεξεργασία | επεξεργασία κώδικα]
Το ρετινοβλάστωμα παρουσιάζει αθροιστικό ποσοστό συχνότητας εμφάνισης μίας περίπτωσης ρετινοβλάστωμα ανά 18000 έως 30000 ζωντανές γεννήσεις παγκοσμίως. [38] Υψηλότερη επίπτωση παρατηρείται στις αναπτυσσόμενες χώρες, η οποία έχει αποδοθεί σε χαμηλότερη κοινωνικοοικονομική κατάσταση και στην παρουσία αλληλουχιών ιών ανθρώπινου θηλώματος στον ιστό του ρετινοβλαστώματος. [39]
Σχεδόν το 80% των παιδιών με ρετινοβλάστωμα διαγιγνώσκονται πριν από την ηλικία των τριών ετών και η διάγνωση σε παιδιά άνω των έξι ετών είναι εξαιρετικά σπάνια. [40] Στο Ηνωμένο Βασίλειο, οι διμερείς περιπτώσεις παρουσιάζονται συνήθως εντός 14 έως 16 μηνών, ενώ η διάγνωση μονομερών περιπτώσεων κορυφώνεται μεταξύ 24 και 30 μηνών.
Συμπέρασμα[Επεξεργασία | επεξεργασία κώδικα]
Το ρετινοβλάστωμα είναι ένας πολύ σπάνιος ενδοφθάλμιος κακοήθης όγκος που πρέπει να λάβει περισσότερη προσοχή κατά τη διερεύνηση της πρόληψης. Ανεξάρτητα από το εάν το ρετινοβλάστωμα είναι μονομερές, διμερές, σποραδικό ή κληρονομικό, υπάρχει μια ποικιλία θεραπειών διαθέσιμων για την εξάλειψη ή τη μείωση της σοβαρότητάς του. Υπάρχουν διαθέσιμες μερικές ομάδες υποστήριξης για αυτούς τους ασθενείς και τις οικογένειες με ρετινοβλάστωμα. Ωστόσο, απαιτείται πιο συνεχής υποστήριξη. Η συναισθηματική υποστήριξη αποτελει βασικό παράγοντα για τη βελτίωση της έκβασης και της ποιότητας ζωής του ατόμου. Υπάρχουν παγκόσμια δίκτυα που είναι αφιερωμένα σε εκείνους που επηρεάζονται από το ρετινοβλάστωμα. Μια πρόταση μπορεί να είναι η ανάπτυξη ενός μητρώου ρετινοβλαστώματος που να παρέχει υποστήριξη σε ασθενείς και οικογένειες.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ 1,0 1,1 American Cancer Society (2003). «Chapter 85. Neoplasms of the Eye». Cancer Medicine. Hamilton, Ontario: BC Decker Inc. ISBN 978-1-55009-213-4.
- ↑ «Retinoblastoma - Symptoms and causes». Mayo Clinic (στα Αγγλικά). Ανακτήθηκε στις 17 Μαρτίου 2021.
- ↑ Dimaras, Helen; Kimani, Kahaki; Dimba, Elizabeth AO; Gronsdahl, Peggy; White, Abby; Chan, Helen SL; Gallie, Brenda L (2012-2014). «Retinoblastoma». The Lancet 379 (9824): 1436–1446. doi:. ISSN 0140-6736. http://dx.doi.org/10.1016/s0140-6736(11)61137-9.
- ↑ A. R. Elkington; P. T. Khaw (1988). «ABC of eyes. Squint». BMJ 297 (6648): 608–611. doi:. PMID 3139234.
- ↑ 5,0 5,1 «Retinoblastoma family genes». Oncogene 25 (38): 5190–200. August 2006. doi:. PMID 16936737.
- ↑ Kivelä T (June 1999). «Trilateral retinoblastoma: a meta-analysis of hereditary retinoblastoma associated with primary ectopic intracranial retinoblastoma». Journal of Clinical Oncology 17 (6): 1829–37. doi:. PMID 10561222. https://archive.org/details/sim_journal-of-clinical-oncology_1999-06_17_6/page/1829.
- ↑ «Trilateral retinoblastoma: a systematic review and meta-analysis». The Lancet Oncology 15 (10): 1157–1167. August 2014. doi:. PMID 25126964.
- ↑ Harbour J.W., Dean D.C. Rb function in cell-cycle regulation and apoptosis" Nature Cell Biology. 2000;94:E65–E67.
- ↑ «A comprehensive, sensitive and economical approach for the detection of mutations in the RB1 gene in retinoblastoma». Journal of Genetics 88 (4): 517–27. December 2009. doi:. PMID 20090211.
- ↑ «Retinoblastoma». GeneReviews. Seattle, WA: University of Washington. 2010.
- ↑ «RB1 gene mutations in retinoblastoma and its clinical correlation». Saudi Journal of Ophthalmology 24 (4): 119–123. 2010. doi:. PMID 23960888.
- ↑ Rushlow, Diane E; Mol, Berber M; Kennett, Jennifer Y; Yee, Stephanie; Pajovic, Sanja; Thériault, Brigitte L; Prigoda-Lee, Nadia L; Spencer, Clarellen και άλλοι. (April 2013). «Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies» (στα αγγλικά). The Lancet Oncology 14 (4): 327–334. doi:. PMID 23498719.
- ↑ Woo, Chan-Wook; Tan, Fei; Cassano, Hope; Lee, JungHwa; Lee, Kwang Chul; Thiele, Carol J. (February 2008). «Use of RNA interference to elucidate the effect of MYCN on cell cycle in neuroblastoma» (στα αγγλικά). Pediatric Blood & Cancer 50 (2): 208–212. doi:. PMID 17420990. http://doi.wiley.com/10.1002/pbc.21195.
- ↑ Stenfelt, Sonya; Blixt, Maria K. E.; All‐Ericsson, Charlotta; Hallböök, Finn; Boije, Henrik (December 2017). «Heterogeneity in retinoblastoma: a tale of molecules and models» (στα αγγλικά). Clinical and Translational Medicine 6 (1): 42. doi:. ISSN 2001-1326. PMID 29124525. PMC 5680409. https://onlinelibrary.wiley.com/doi/abs/10.1186/s40169-017-0173-2.
- ↑ Lewis R (March 19, 2013). «Some Aggressive Retinoblastomas Lack RB1 Mutations». Medscape Online. Αρχειοθετήθηκε από το πρωτότυπο στις September 19, 2017. https://web.archive.org/web/20170919082102/http://www.medscape.com/viewarticle/781040.
- ↑ «Retinoblastoma in Great Britain 1963-2002». British Journal of Ophthalmology 93 (1): 33–7. January 2009. doi:. PMID 18838413.
- ↑ «Diagnostic performance of magnetic resonance imaging and computed tomography for advanced retinoblastoma: a systematic review and meta-analysis». Ophthalmology 121 (5): 1109–18. May 2014. doi:. PMID 24589388.
- ↑ Lee, K. Weng Sehu,... William R. (2005). Ophthalmic pathology : an illustrated guide for clinicians. Malden: Blackwell Publishing. σελ. 262. ISBN 978-0-7279-1779-9.
- ↑ Kumar V, Abbas AK, Fausto N. Robbins and Cotran Pathologic Basis of Disease. Seventh Edition. Philadelphia: Elsevier Saunders, 2005, p. 1442.
- ↑ «Age at diagnosis of isolated unilateral retinoblastoma does not distinguish patients with and without a constitutional RB1 gene mutation but is influenced by a parent-of-origin effect». European Journal of Cancer 41 (5): 735–40. March 2005. doi:. PMID 15763650.
- ↑ «Detection of mosaic RB1 mutations in families with retinoblastoma». Human Mutation 30 (5): 842–51. May 2009. doi:. PMID 19280657.
- ↑ «Sensitive and efficient detection of RB1 gene mutations enhances care for families with retinoblastoma». American Journal of Human Genetics 72 (2): 253–69. December 2002. doi:. PMID 12541220.
- ↑ Canadian Ophthalmological Society' (December 2009). «National Retinoblastoma Strategy Canadian Guidelines for Care; Genetic Analysis». Canadian Journal of Ophthalmology 44 (suppl.2): S17–S22. doi:. PMID 20237571. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-09-29. https://web.archive.org/web/20110929000637/http://www.eyesite.ca/resources/CPGs/COS_RetinoblastomaCPGs_Dec09.pdf.
- ↑ Dimaras, Helen; Corson, Timothy W. (January 2019). «Retinoblastoma, the visible CNS tumor: A review: DIMARAS and CORSON» (στα αγγλικά). Journal of Neuroscience Research 97 (1): 29–44. doi:. PMID 29314142.
- ↑ 25,0 25,1 Chawla, Bhavna; Jain, Amit; Azad, Rajvardhan (2013). «Conservative treatment modalities in retinoblastoma». Indian Journal of Ophthalmology 61 (9): 479. doi:. ISSN 0301-4738. http://dx.doi.org/10.4103/0301-4738.119424.
- ↑ 26,0 26,1 Fabian, Ido Didi; Reddy, Ashwin; Sagoo, Mandeep S (2018). «Classification and staging of retinoblastoma». Community Eye Health 31 (101): 11–13. ISSN 0953-6833. PMID 29915461. PMC 5998397. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5998397/.
- ↑ 27,0 27,1 «Retinoblastoma: review of current management». Oncologist 12 (10): 1237–46. October 2007. doi:. PMID 17962617.
- ↑ Li, Wenhui L.; Buckley, Jonathan; Sanchez-Lara, Pedro A.; Maglinte, Dennis T.; Viduetsky, Lucy; Tatarinova, Tatiana V.; Aparicio, Jennifer G.; Kim, Jonathan W. και άλλοι. (July 2016). «A Rapid and Sensitive Next-Generation Sequencing Method to Detect RB1 Mutations Improves Care for Retinoblastoma Patients and Their Families» (στα αγγλικά). The Journal of Molecular Diagnostics 18 (4): 480–493. doi:. PMID 27155049. PMC 5820122. https://linkinghub.elsevier.com/retrieve/pii/S1525157816300290.
- ↑ «Incidence of second neoplasms in patients with bilateral retinoblastoma». Ophthalmology 95 (11): 1583–1587. November 1988. doi:. PMID 3211467. https://archive.org/details/sim_ophthalmology_1988-11_95_11/page/1583.
- ↑ Shields, CL; Ramasubramanian, A; Rosenwasser, R; Shields, JA (September 2009). «Superselective catheterization of the ophthalmic artery for intraarterial chemotherapy for retinoblastoma.». Retina (Philadelphia, Pa.) 29 (8): 1207–9. doi:. PMID 19734768.
- ↑ «Does a Nanomolecule of Carboplatin Injected Periocularly Help in Attaining Higher Intravitreal Concentrations?». Investigative Ophthalmology and Visual Science 50 (12): 5896–900. 2009. doi:. PMID 19628744.
- ↑ «Subconjunctival nanoparticle carboplatin in the treatment of murine retinoblastoma». Archives of Ophthalmology 127 (8): 1043–7. 2009. doi:. PMID 19667343.
- ↑ «Focal laser treatment in addition to chemotherapy for retinoblastoma». Cochrane Database Syst Rev 6: CD012366. June 2017. doi:. PMID 28589646.
- ↑ «Macular retinoblastoma managed with chemoreduction: analysis of tumor control with or without adjuvant thermotherapy in 68 tumors». Arch. Ophthalmol. 123 (6): 765–73. June 2005. doi:. PMID 15955977.
- ↑ Syed Imtiaz Ali Shah: Concise Ophthalmology. 4th ed. Paramount B (Pvt.) Ltd. 2014: 80-81
- ↑ «Paramount Books Online Bookstore 9789696370017 : Concise-Ophthalmology-(pb)-2014». Αρχειοθετήθηκε από το πρωτότυπο στις 30 Ιουλίου 2014. Ανακτήθηκε στις 9 Αυγούστου 2014.
- ↑ Partab Rai, Imtiaz Ali Shah, Ashok Kumar Nasrani, Mahesh Kumar Lohana, Muhammad Khan Memon, Manzoor Ahmed Memon: Too late presentation of 53 patients with retinoblastoma:a big challenge: International Journal of Ophthalmology 2009, vol. 9, no. 2; pp. 227-230.
- ↑ Abramson D.H.; Schefler A.C. (2004). «Update on retinoblastoma». Retina 24 (6): 828–48. doi:. PMID 15579980. https://archive.org/details/sim_retina_2004-12_24_6/page/828.
- ↑ «Presence of human papilloma virus in tumor tissue from children with retinoblastoma: An alternative mechanism for tumor development». Clinical Cancer Research 6 (10): 4010–4016. 2000. PMID 11051250.
- ↑ «Presenting signs of retinoblastoma». Journal of Pediatrics 132 (3): 505–508. 1998. doi:. PMID 9544909. https://archive.org/details/sim_journal-of-pediatrics_1998-03_132_3/page/505.