Κυτόχρωμα P450

Τα κυτοχρώματα P450 (CYPs) είναι υπεροικογένεια ενζύμων που περιέχουν αίμη ως συμπαράγοντα και λειτουργούν ως μονοοξυγενάσες.[1][2] Στα θηλαστικά, αυτές οι πρωτεΐνες οξειδώνουν στεροειδή, λιπαρά οξέα και ξενοβιοτικά, και είναι σημαντικές για την κάθαρση διαφόρων ενώσεων, καθώς και για τη σύνθεση και τη διάσπαση των ορμονών. Στα φυτά, αυτές οι πρωτεΐνες είναι σημαντικές για τη βιοσύνθεση αμυντικών ενώσεων, λιπαρών οξέων και ορμονών.[3]
Τα ένζυμα του κυτοχρώματος έχουν εντοπιστεί σε όλα τα βασίλεια της ζωής: ζώα, φυτά, μύκητες, πρώτιστα, βακτήρια και αρχαία, καθώς και σε ιούς.[4] Ωστόσο, δεν είναι πανταχού παρόντα. Για παράδειγμα, δεν έχουν βρεθεί στο Escherichia coli.[2][5] Όσον αφορά το 2018, είναι γνωστές περισσότερες από 300.000 διακριτές πρωτεΐνες CYP.[6][7]
Τα κυτοχρώματα, γενικά, είναι τα τελικά ένζυμα οξειδάσης σε αλυσίδες μεταφοράς ηλεκτρονίων και γενικά κατηγοριοποιούνται ως συστήματα που περιέχουν Ρ450. Ο όρος "P450" προέρχεται από τη φασματοφωτομετρική κορυφή στο μήκος κύματος της μέγιστης απορρόφησης του ενζύμου (450 nm) όταν βρίσκεται σε ανηγμένη κατάσταση και συμπλοκοποιείται με μονοξείδιο του άνθρακα. Τα περισσότερα CYP απαιτούν μια πρωτεΐνη να παραδώσει ένα ή περισσότερα ηλεκτρόνια για τη αναγωγή του σιδήρου (και τελικά του μοριακού οξυγόνου).
Μηχανισμός[Επεξεργασία | επεξεργασία κώδικα]
Δομή[Επεξεργασία | επεξεργασία κώδικα]
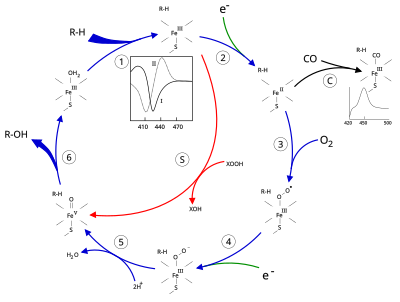
Η ενεργή περιοχή του κυτοχρώματος Ρ450 περιέχει ένα κέντρο σιδήρου-αίμης. Ο σίδηρος είναι συζευγμένος με μια πρωτεΐνη μέσω ενός προσδέτη θειόλης κυστεΐνης. Αυτή η κυστεΐνη και άλλα πλευρικά κατάλοιπα είναι σε μεγάλο βαθμό διατηρημένα στα γνωστά κυτοχρώματα και έχουν την υπογραφή [FW] - [SGNH] - x - [GD] - {F} - [RKHPT] - {P} - C - [LIVMFAP] - [GAD]. Εξαιτίας της μεγάλης ποικιλίας αντιδράσεων που καταλύουν τα κυτοχρώματα, οι δράσεις και οι ιδιότητες πολλών κυτοχρωμάτων διαφέρουν σε πολλά σημεία.[8] Γενικά, ο καταλυτικός κύκλος του P450 είναι ο εξής:
Καταλυτικός κύκλος[Επεξεργασία | επεξεργασία κώδικα]
- Το υπόστρωμα συνδέεται κοντά στην ομάδα αίμης, στην πλευρά απέναντι από το αξονικό θειολικό άλας. Η δέσμευση υποστρώματος προκαλεί αλλαγή στη διαμόρφωση της δραστικής θέσης, μετατοπίζοντας συχνά ένα μόριο νερού από την απώτατη αξονική θέση συντονισμού του σίδηρου αίματος,[9] και αλλάζοντας την κατάσταση του σιδήρου αίμης από χαμηλή περιστροφή σε υψηλή περιστροφή.[10]
- Η δέσμευση υποστρώματος προκαλεί μεταφορά ηλεκτρονίων από το NAD(P)H μέσω της αναγωγάσης του κυτοχρώματος P450 ή άλλης σχετικής αναγωγάσης.[11]
- Το μοριακό οξυγόνο συνδέεται με το προκύπτον κέντρο σιδήρου αίμης στην άπω αξονική θέση συντονισμού, δίνοντας αρχικά ένα προϊόν προσθήκης διοξυγόνου παρόμοιο με την οξυ-μυοσφαιρίνη.
- Ένα δεύτερο ηλεκτρόνιο μεταφέρεται, από αναγωγάσες κυτοχρώματος Ρ450, φερρεδοξίνες, ή το κυτόχρωμα b5, ανάγοντας το πρόσθετο Fe-O2 για να δώσει μια βραχύβια περόξο κατάσταση.
- Η πέροξυ ομάδα που σχηματίζεται στο στάδιο 4 πρωτονιώνεται ταχέως δύο φορές, απελευθερώνοντας ένα μόριο νερού και σχηματίζοντας το εξαιρετικά αντιδραστικό είδος που αναφέρεται ως ένωση Ρ450 1 (ή απλά ένωση Ι). Αυτό το εξαιρετικά αντιδραστικό ενδιάμεσο απομονώθηκε το 2010.[12] Η ένωση 1 του P450 είναι ένα είδος σιδήρου (IV) οξο (ή φερρυλ ) με ένα επιπλέον ισοδύναμο οξειδωτικό που μετατοπίζεται πάνω από τους προσδέτες πορφυρίνης και θειολικού άλατος. Λείπουν αποδεικτικά στοιχεία για τον εναλλακτικό υπερορυλικό σίδηρο (V) -oxo
- Ανάλογα με το υπόστρωμα και το ένζυμο που εμπλέκονται, τα ένζυμα Ρ450 μπορούν να καταλύσουν οποιαδήποτε από μια μεγάλη ποικιλία αντιδράσεων. Μια υποθετική υδροξυλίωση φαίνεται σε αυτήν την απεικόνιση. Μετά την απελευθέρωση του προϊόντος από την ενεργή θέση, το ένζυμο επιστρέφει στην αρχική του κατάσταση, με ένα μόριο νερού να επιστρέφει για να καταλάβει τη άπω θέση συντονισμού του πυρήνα του σιδήρου.

P450 στον άνθρωπο[Επεξεργασία | επεξεργασία κώδικα]
Τα ανθρώπινα κυτοχρώματα είναι κυρίως πρωτεΐνες που σχετίζονται με τη μεμβράνη[13] βρίσκονται είτε στην εσωτερική μεμβράνη των μιτοχονδρίων είτε στο ενδοπλασματικό δίκτυο των κυττάρων. Τα CYP μεταβολίζουν χιλιάδες ενδογενείς και εξωγενείς χημικές ουσίες. Ορισμένα CYP μεταβολίζουν μόνο ένα (ή πολύ λίγα) υποστρώματα, όπως το CYP19 (αρωματάση), ενώ άλλα μπορεί να μεταβολίζουν πολλαπλά υποστρώματα. Και τα δύο αυτά χαρακτηριστικά δείχνουν την σημασία τους στην ιατρική. Τα ένζυμα του κυτοχρώματος P450 υπάρχουν στους περισσότερους ιστούς του σώματος και παίζουν σημαντικό ρόλο στη σύνθεση και τη διάσπαση των ορμονών (συμπεριλαμβανομένης της σύνθεσης και του μεταβολισμού των οιστρογόνων και της τεστοστερόνης ), στη σύνθεση χοληστερόλης και στον μεταβολισμό της βιταμίνης D. Τα ένζυμα του κυτοχρώματος P450 επίσης λειτουργούν στο μεταβολισμό δυνητικά τοξικών ενώσεων, συμπεριλαμβανομένων φαρμάκων και προϊόντων ενδογενούς μεταβολισμού όπως η χολερυθρίνη, κυρίως στο ήπαρ.
Το Human Genome Project έχει εντοπίσει 57 ανθρώπινα γονίδια που κωδικοποιούν τα διάφορα ένζυμα του κυτοχρώματος P450.[14]
Μεταβολισμός φαρμάκων[Επεξεργασία | επεξεργασία κώδικα]

Τα CYPs είναι τα κύρια ένζυμα που εμπλέκονται στον μεταβολισμό φαρμάκων, αντιπροσωπεύοντας περίπου το 75% του συνολικού μεταβολισμού.[15] Τα περισσότερα φάρμακα υφίστανται απενεργοποίηση από CYPs, είτε άμεσα είτε με διευκόλυνση της απέκκρισης από το σώμα. Επίσης, πολλές ουσίες βιοενεργοποιούνται από τα CYPs για να σχηματίσουν τις δραστικές τους ενώσεις, όπως το αντιαιμοπεταλιακό φάρμακο κλοπιδογρέλη.
Αλληλεπίδραση φαρμάκων[Επεξεργασία | επεξεργασία κώδικα]
Πολλά φάρμακα μπορεί να αυξήσουν ή να μειώσουν τη δραστηριότητα διαφόρων ισοενζύμων CYP είτε προκαλώντας τη βιοσύνθεση ενός ισοζύμου (επαγωγή ενζύμου) είτε αναστέλλοντας άμεσα τη δραστηριότητα του CYP (αναστολή ενζύμου). Ένα κλασικό παράδειγμα περιλαμβάνει αντιεπιληπτικά φάρμακα, όπως η φαινυτοΐνη, η οποία επάγει τα CYP1A2, CYP2C9, CYP2C19 και CYP3A4.
Οι επιδράσεις στη δραστηριότητα των ισοενζύμων του CYP είναι μια σημαντική πηγή ανεπιθύμητων αλληλεπιδράσεων φαρμάκων, καθώς οι αλλαγές στη δραστικότητα του ενζύμου CYP μπορεί να επηρεάσουν το μεταβολισμό και την κάθαρση διαφόρων φαρμάκων. Για παράδειγμα, εάν ένα φάρμακο αναστέλλει τον μεταβολισμό που προκαλείται από το CYP ενός άλλου φαρμάκου, το δεύτερο φάρμακο μπορεί να συσσωρευτεί στο σώμα σε τοξικά επίπεδα. Ως εκ τούτου, αυτές οι αλληλεπιδράσεις φαρμάκων μπορεί να απαιτούν προσαρμογές της δοσολογίας ή επιλογή φαρμάκων που δεν αλληλεπιδρούν με το σύστημα CYP. Τέτοιες αλληλεπιδράσεις φαρμάκων είναι ιδιαίτερα σημαντικό να ληφθούν υπόψη όταν χρησιμοποιούνται φάρμακα ζωτικής σημασίας για τον ασθενή, φάρμακα με σημαντικές παρενέργειες ή φάρμακα με στενό θεραπευτικό δείκτη, αλλά οποιοδήποτε φάρμακο μπορεί να υπόκειται σε μεταβαλλόμενη συγκέντρωση στο πλάσμα λόγω αλλαγμένου μεταβολισμού φαρμάκων.
Πολλά υποστρώματα για το CYP3A4 είναι φάρμακα με στενό θεραπευτικό δείκτη, όπως η αμιωδαρόνη[16] ή η καρβαμαζεπίνη.[17] Επειδή αυτά τα φάρμακα μεταβολίζονται από το CYP3A4, τα μέσα επίπεδα αυτών των φαρμάκων στο πλάσμα μπορεί να αυξηθούν λόγω της αναστολής του ενζύμου ή να μειωθούν λόγω της επαγωγής του ενζύμου.
Αλληλεπίδραση άλλων ουσιών[Επεξεργασία | επεξεργασία κώδικα]
Οι φυσικώς απαντώμενες ενώσεις μπορούν επίσης να προκαλέσουν ή να αναστέλλουν τη δραστικότητα των κυτοχρωμάτων Για παράδειγμα, βιοδραστικές ενώσεις που βρίσκονται στο χυμό των γκρέιπφρουτ και μερικούς άλλους χυμούς φρούτων, συμπεριλαμβανομένων των μπεργκαμποτίνης, διϋδροξυμπεργαμοττίνης, και παραδικίνης-Α, έχουν βρεθεί να αναστέλλουν τον μεσολαβούμενο από το CYP3A4 μεταβολισμό ορισμένων φαρμάκων, οδηγώντας σε αυξημένη βιοδιαθεσιμότητα και, ως εκ τούτου, μεγάλη πιθανότητα υπερδοσολογία.[18] Λόγω αυτού του κινδύνου, συνιστάται συνήθως η αποφυγή του χυμού γκρέιπφρουτ και των φρέσκων γκρέιπφρουτ κατά τη χρήση φαρμάκων.[19]
Άλλα παραδείγματα:
- Το βάλσαμο, ένα συνηθισμένο φυτικό φάρμακο, επάγει το CYP3A4, αλλά επίσης αναστέλλει τα CYP1A1, CYP1B1.[20][21]
- Το κάπνισμα επάγει το CYP1A2 (παραδείγματα υποστρωμάτων του CYP1A2 είναι η κλοζαπίνη, η ολανζαπίνη και η φλουβοξαμίνη )[22]
- Σε σχετικά υψηλές συγκεντρώσεις, ο χυμός καραμπόλας έχει επίσης αποδειχθεί ότι αναστέλλει το CYP2A6 και άλλα CYP.[23] Το κάρδαμο είναι επίσης γνωστός αναστολέας του κυτοχρώματος P450 CYP2E1, ο οποίος μπορεί να αλλοιώσει τον μεταβολισμό ορισμένων φαρμάκων (π.χ. χλωροζοξαζόνη ).[24]
- Έχει αποδειχθεί ότι η τριβουτυλτίνη αναστέλλει τη λειτουργία του κυτοχρώματος P450, οδηγώντας σε αρρενοποίηση των μαλακίων.[25]
- Η Ύδραστις η καναδική, με τα δύο αξιοσημείωτα αλκαλοειδή βερβερίνη και υδραστίνη, έχει αποδειχθεί ότι μεταβάλλει τις ενζυματικές δραστηριότητες του P450 (που περιλαμβάνουν τα CYP2C9, CYP2D6 και CYP3A4)[26]
Οικογένειες CYP σε ανθρώπους[Επεξεργασία | επεξεργασία κώδικα]
Οι άνθρωποι έχουν 57 γονίδια και περισσότερα από 59 ψευδογονίδια που χωρίζονται σε 18 οικογένειες γονιδίων κυτοχρώματος P450 και 43 υποοικογένειες.[27] Αυτή είναι μια περίληψη των γονιδίων και των πρωτεϊνών που κωδικοποιούν. Για λεπτομερείς πληροφορίες, ανατρέξτε στην αρχική σελίδα της επιτροπής ονοματολογίας του κυτοχρώματος P450.[14]
| Οικογένεια | Λειτουργία | Μέλη | Γονίδια | Ψευδογονίδια |
| CYP1 | μεταβολισμός φαρμάκων και στεροειδών (ειδικά οιστρογόνων ), τοξίνωση βενζο [a] πυρενίου (σχηματισμός (+) - βενζο [a] πυρένιο-7,8-διϋδροδιόλη-9,10-εποξείδιο ) | 3 υποοικογένειες, 3 γονίδια, 1 ψευδογόνο | CYP1A1, CYP1A2, CYP1B1 | CYP1D1P |
| CYP2 | μεταβολισμός φαρμάκων και στεροειδών | 13 υποοικογένειες, 16 γονίδια, 16 ψευδογόνα | CYP2A6, CYP2A7, CYP2A13, CYP2B6, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2D6, CYP2E1, CYP2F1, CYP2J2, CYP2R1, CYP2S1, CYP2U1, CYP2W1 | Πάρα πολλά για λίστα |
| CYP3 | μεταβολισμός φαρμάκων και στεροειδών (συμπεριλαμβανομένης της τεστοστερόνης ) | 1 υποοικογένεια, 4 γονίδια, 4 ψευδογόνα | CYP3A4, CYP3A5, CYP3A7, CYP3A43 | CYP3A51P, CYP3A52P, CYP3A54P, CYP3A137P |
| CYP4 | αραχιδονικό οξύ ή μεταβολισμό λιπαρών οξέων | 6 υποοικογένειες, 12 γονίδια, 10 ψευδογόνα | CYP4A11, CYP4A22, CYP4B1, CYP4F2, CYP4F3, CYP4F8, CYP4F11, CYP4F12, CYP4F22, CYP4V2, CYP4X1, CYP4Z1 | Πάρα πολλά για λίστα |
| CYP5 | συνθετάση θρομβοξάνης Α 2 | 1 υποοικογένεια, 1 γονίδιο | CYP5A1 | |
| CYP7 | βιοσύνθεση χολικού οξέος 7-άλφα υδροξυλάση στεροειδούς πυρήνα | 2 υποοικογένειες, 2 γονίδια | CYP7A1, CYP7B1 | |
| CYP8 | ποικίλος | 2 υποοικογένειες, 2 γονίδια | CYP8A1 (συνθετάση προστακυκλίνης ), CYP8B1 (βιοσύνθεση χολικού οξέος) | |
| CYP11 | βιοσύνθεση στεροειδών | 2 υποοικογένειες, 3 γονίδια | CYP11A1, CYP11B1, CYP11B2 | |
| CYP17 | βιοσύνθεση στεροειδών, 17-άλφα υδροξυλάση | 1 υποοικογένεια, 1 γονίδιο | CYP17A1 | |
| CYP19 | βιοσύνθεση στεροειδών : η αρωματάση συνθέτει τα οιστρογόνα | 1 υποοικογένεια, 1 γονίδιο | CYP19A1 | |
| CYP20 | άγνωστη λειτουργία | 1 υποοικογένεια, 1 γονίδιο | CYP20A1 | |
| CYP21 | βιοσύνθεση στεροειδών | 1 υποοικογένεια, 1 γονίδιο, 1 ψευδογόνο | CYP21A2 | CYP21A1P |
| CYP24 | αποικοδόμηση βιταμίνης D | 1 υποοικογένεια, 1 γονίδιο | CYP24A1 | |
| CYP26 | υδροξυλάση ρετινοϊκού οξέος | 3 υποοικογένειες, 3 γονίδια | CYP26A1, CYP26B1, CYP26C1 | |
| CYP27 | ποικίλος | 3 υποοικογένειες, 3 γονίδια | CYP27A1 (βιοσύνθεση χολικού οξέος ), CYP27B1 (βιταμίνη D 3 1-άλφα υδροξυλάση, ενεργοποιεί τη βιταμίνη D 3 ), CYP27C1 (άγνωστη λειτουργία) | |
| CYP39 | 7-άλφα υδροξυλίωση της 24-υδροξυχοληστερόλης | 1 υποοικογένεια, 1 γονίδιο | CYP39A1 | |
| CYP46 | χοληστερόλη 24-υδροξυλάση | 1 υποοικογένεια, 1 γονίδιο, 1 ψευδογόνο | CYP46A1 | CYP46A4P |
| CYP51 | βιοσύνθεση χοληστερόλης | 1 υποοικογένεια, 1 γονίδιο, 3 ψευδογόνα | CYP51A1 ( λανοστερόλη 14-άλφα διμεθυλάση ) | CYP51P1, CYP51P2, CYP51P3 |
P450 σε άλλα είδη[Επεξεργασία | επεξεργασία κώδικα]
Ζώα[Επεξεργασία | επεξεργασία κώδικα]
Πολλά ζώα έχουν τα ίδια πολλά ή περισσότερα γονίδια CYP από αυτά που έχουν οι άνθρωποι. Οι αναφερόμενοι αριθμοί κυμαίνονται από 35 γονίδια στο σπόγγο Amphimedon queenslandica έως 235 γονίδια στο κεφαλόχορδο Branchiostoma floridae.[28] Τα ποντίκια έχουν γονίδια για 101 CYP και οι αχινοί έχουν ακόμη περισσότερα (ίσως και 120 γονίδια).[29] Τα περισσότερα ένζυμα CYP θεωρείται ότι έχουν δραστηριότητα μονοοξυγενάσης, όπως συμβαίνει για τα περισσότερα CYP θηλαστικών που έχουν διερευνηθεί (εκτός, π.χ., των CYP19 και CYP5 ). Η αλληλουχία γονιδίων και γονιδιώματος γίνεται κατά πολύ ταχύτερα από τον βιοχημικό χαρακτηρισμό της ενζυμικής λειτουργίας, αν και έχουν βρεθεί πολλά γονίδια με στενή ομολογία με τα CYP με γνωστή λειτουργία, δίνοντας στοιχεία για τη λειτουργικότητά τους.
Τα CYP έχουν εξεταστεί εκτενώς σε ποντίκια, αρουραίους, σκύλους και λιγότερο σε ψάρια ζέμπρα, προκειμένου να διευκολυνθεί η χρήση αυτών των μοντέλων οργανισμών στην ανακάλυψη φαρμάκων και στην τοξικολογία. Πρόσφατα ανακαλύφθηκαν επίσης CYP σε είδη πτηνών, ιδιαίτερα στις γαλοπούλες, που μπορεί να αποδειχθούν χρήσιμο μοντέλο για την έρευνα για τον καρκίνο στον άνθρωπο.[30] Τα CYP1A5 και CYP3A37 στις γαλοπούλες βρέθηκαν να είναι πολύ παρόμοια με τα ανθρώπινα CYP1A2 και CYP3A4 αντίστοιχα, όσον αφορά τις κινητικές τους ιδιότητες καθώς και τον μεταβολισμό της αφλατοξίνης Β1.[31]
Τα CYP έχουν επίσης μελετηθεί σε μεγάλο βαθμό στα έντομα, συχνά για να κατανοηθεί η αντοχή στα φυτοφάρμακα. Για παράδειγμα, το CYP6G1 συνδέεται με την αντοχή σε εντομοκτόνα της Drosophila melanogaster που είναι ανθεκτική στο DDT[32] και το CYP6M2 στον φορέα ελονοσίας, τα κουνούπια Anopheles gambiae, είναι ικανό να μεταβολίζει άμεσα πυρεθροειδή.[33]
Μικροβιακός[Επεξεργασία | επεξεργασία κώδικα]
Τα μικροβιακά κυτοχρώματα P450 είναι συχνά διαλυτά ένζυμα και εμπλέκονται σε διάφορες μεταβολικές διεργασίες. Στα βακτήρια η κατανομή των P450s είναι πολύ μεταβλητή με πολλά βακτήρια να μην έχουν ταυτοποιημένα P450 (π.χ. E.coli). Ορισμένα βακτήρια, κυρίως ακτινομύκητες, έχουν πολυάριθμα P450.[34][35] Αυτά που έχουν εντοπιστεί μέχρι στιγμής εμπλέκονται γενικά είτε στον βιομετασχηματισμό ξενοβιοτικών ενώσεων (π.χ. το CYP105A1 από το Streptomyces griseolus μεταβολίζει τα ζιζανιοκτόνα σουλφονυλουρίας σε λιγότερο τοξικά παράγωγα[36] ) ή αποτελούν μέρος εξειδικευμένων βιοσυνθετικών οδών μεταβολιτών (π.χ. το CYP170B1 καταλύει την παραγωγή του σεσκιτερπενοειδούς αλμπαφλαβενόνη στο Streptomyces albus[37] ). Αν και κανένα P450 δεν έχει ακόμη αποδειχθεί ότι είναι απαραίτητο σε ένα μικρόβιο, η οικογένεια του CYP105 διατηρείται σε μεγάλο βαθμό με έναν εκπρόσωπο σε κάθε γονιδίωμα στρεπτομυκήτα που έχει αναλυθεί μέχρι στιγμής.[38]
Μύκητες[Επεξεργασία | επεξεργασία κώδικα]
Τα ευρέως χρησιμοποιούμενα αντιμυκητιακά φάρμακα κατηγορίας αζολών δρουν αναστέλλοντας τη μυκητιακή κυτοχρωματική P450 14α-δεμεθυλάση. Αυτό διακόπτει τη μετατροπή της λανοστερόλης σε εργοστερόλη, ένα συστατικό της κυτταρικής μεμβράνης του μύκητα. (Αυτό είναι χρήσιμο μόνο επειδή το P450 των ανθρώπων έχει διαφορετική ευαισθησία· έτσι λειτουργεί αυτή η κατηγορία αντιμυκητιασικών. )[39]
Φυτά[Επεξεργασία | επεξεργασία κώδικα]
Το φυτικό κυτόχρωμα P450 εμπλέκεται σε ευρύ φάσμα βιοσυνθετικών αντιδράσεων και στοχεύει ευρύ φάσμα βιομορίων. Αυτές οι αντιδράσεις οδηγούν σε διάφορα συζεύγματα λιπαρών οξέων, φυτικών ορμονών, δευτερογενών μεταβολιτών, λιγνινών και ποικιλίας αμυντικών ενώσεων.[40] Η μελέτη του φυτικού γονιδιώματος δείχνει ότι τα γονίδια του κυτοχρώματος P450 αποτελούν έως και το 1% των φυτικών γονιδίων. Ο αριθμός και η ποικιλία των γονιδίων P450 ευθύνονται, εν μέρει, για το πλήθος των βιοδραστικών ενώσεων.[41]
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ «Human cytochromes P450: evolution and cDNA-directed expression». Environmental Health Perspectives 98: 81–5. November 1992. doi:. PMID 1486867. PMC 1519618. https://archive.org/details/sim_environmental-health-perspectives_1992-11_98/page/81.
- ↑ 2,0 2,1 «The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans». Current Drug Metabolism 3 (6): 561–97. December 2002. doi:. PMID 12369887.
- ↑ «Cytochrome P450». InterPro.
- ↑ «The first virally encoded cytochrome p450». Journal of Virology 83 (16): 8266–9. August 2009. doi:. PMID 19515774. PMC 2715754. https://archive.org/details/sim_journal-of-virology_2009-08_83_16/page/8266.
- ↑ Sigel, Roland· Sigel, Astrid (2007). The Ubiquitous Roles of Cytochrome P450 Proteins: Metal Ions in Life Sciences. New York: Wiley. ISBN 978-0-470-01672-5.
- ↑ Nelson, David R. (January 2018). «Cytochrome P450 diversity in the tree of life». Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1866 (1): 141–154. doi:. PMID 28502748.
- ↑ Nelson D (2009). «Cytochrome P450 Homepage». Human Genomics (University of Tennessee) 4 (1): 59–65. doi:. PMID 19951895. PMC 3500189. Αρχειοθετήθηκε από το πρωτότυπο στις 2010-06-27. https://web.archive.org/web/20100627184446/http://drnelson.uthsc.edu/CytochromeP450.html. Ανακτήθηκε στις 2014-11-13.
- ↑ Srinivasan, Bharath (8 Οκτωβρίου 2020). «Explicit Treatment of Non Michaelis-Menten and Atypical Kinetics in Early Drug Discovery». dx.doi.org. Ανακτήθηκε στις 9 Νοεμβρίου 2020.
- ↑ «Mechanism of oxidation reactions catalyzed by cytochrome p450 enzymes». Chemical Reviews 104 (9): 3947–80. September 2004. doi:. PMID 15352783.
- ↑ «High-resolution crystal structure of cytochrome P450cam». Journal of Molecular Biology 195 (3): 687–700. June 1987. doi:. PMID 3656428.
- ↑ «Spin state control of the hepatic cytochrome P450 redox potential». Biochemical and Biophysical Research Communications 90 (3): 925–32. October 1979. doi:. PMID 228675.
- ↑ «Cytochrome P450 compound I: capture, characterization, and C-H bond activation kinetics». Science 330 (6006): 933–7. November 2010. doi:. PMID 21071661. Bibcode: 2010Sci...330..933R.
- ↑ «Membrane position of ibuprofen agrees with suggested access path entrance to cytochrome P450 2C9 active site». The Journal of Physical Chemistry A 115 (41): 11248–55. October 2011. doi:. PMID 21744854. Bibcode: 2011JPCA..11511248B.
- ↑ 14,0 14,1 «P450 Table».
- ↑ «Cytochrome p450 and chemical toxicology». Chemical Research in Toxicology 21 (1): 70–83. January 2008. doi:. PMID 18052394. (Metabolism in this context is the chemical modification or degradation of drugs.)
- ↑ Zahno, A; Brecht, K; Morand, R; Maseneni, S; Török, M; Lindinger, PW; Krähenbühl, S (1 February 2011). «The role of CYP3A4 in amiodarone-associated toxicity on HepG2 cells.». Biochem Pharmacol 81 (3): 432–41. doi:. PMID 21070748.
- ↑ «Carbamazepine: Watch for Many Potential Drug Interactions». Pharmacy Times. Αρχειοθετήθηκε από το πρωτότυπο στις 2020-10-14. https://web.archive.org/web/20201014100433/https://www.pharmacytimes.com/publications/issue/2008/2008-02/2008-02-8414. Ανακτήθηκε στις 2022-01-19.
- ↑ «Interactions between grapefruit juice and cardiovascular drugs». American Journal of Cardiovascular Drugs 4 (5): 281–97. 2004. doi:. PMID 15449971.
- ↑ Zeratsky K (6 Νοεμβρίου 2008). «Grapefruit juice: Can it cause drug interactions?». Ask a food & nutrition specialist. MayoClinic.com. Ανακτήθηκε στις 9 Φεβρουαρίου 2009.
- ↑ «Inhibition of human cytochrome CYP 1 enzymes by flavonoids of St. John's wort». Toxicology 217 (2–3): 194–205. January 2006. doi:. PMID 16271822.
- ↑ «An approach to the in vitro evaluation of potential for cytochrome P450 enzyme inhibition from herbals and other natural remedies». Phytomedicine 11 (2–3): 98–104. February 2004. doi:. PMID 15070158.
- ↑ «Drug interactions with smoking». American Journal of Health-System Pharmacy 64 (18): 1917–21. September 2007. doi:. PMID 17823102.
- ↑ «Inhibition of human liver cytochrome P450 by star fruit juice». Journal of Pharmacy & Pharmaceutical Sciences 10 (4): 496–503. 2007. doi:. PMID 18261370.
- ↑ «Inhibition of chlorzoxazone metabolism, a clinical probe for CYP2E1, by a single ingestion of watercress». Clinical Pharmacology and Therapeutics 64 (2): 144–9. August 1998. doi:. PMID 9728894. https://archive.org/details/sim_clinical-pharmacology-and-therapeutics_1998-08_64_2/page/144.
- ↑ Walmsley, Simon. «Tributyltin pollution on a global scale. An overview of relevant and recent research: impacts and issues» (PDF). WWF UK. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 7 Απριλίου 2014. Ανακτήθηκε στις 19 Ιανουαρίου 2022.
- ↑ «Human cytochrome p450 inhibition and metabolic-intermediate complex formation by goldenseal extract and its methylenedioxyphenyl components». Drug Metabolism and Disposition 31 (11): 1391–7. November 2003. doi:. PMID 14570772.
- ↑ Nelson D (2003). Cytochromes P450 in humans. Retrieved May 9, 2005.
- ↑ «The cytochrome P450 genesis locus: the origin and evolution of animal cytochrome P450s». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 368 (1612): 20120474. February 2013. doi:. PMID 23297357.
- ↑ «The chemical defensome: environmental sensing and response genes in the Strongylocentrotus purpuratus genome». Developmental Biology 300 (1): 366–84. December 2006. doi:. PMID 17097629.
- ↑ «Aflatoxin B1 in poultry: toxicology, metabolism and prevention». Research in Veterinary Science 89 (3): 325–31. December 2010. doi:. PMID 20462619.
- ↑ «Metabolism of aflatoxin B1 in turkey liver microsomes: the relative roles of cytochromes P450 1A5 and 3A37». Toxicology and Applied Pharmacology 254 (3): 349–54. August 2011. doi:. PMID 21616088.
- ↑ «Dissecting the insecticide-resistance- associated cytochrome P450 gene Cyp6g1». Pest Management Science 64 (6): 639–45. June 2008. doi:. PMID 18338338.
- ↑ Ismail, Hanafy; O'Neill, Paul; Hong, David; Finn, Robert; Henderson, Colin; Wright, Aaron; Cravatt, Benjamin; Hemingway, Janet και άλλοι. (3 December 2013). «Pyrethroid activity-based probes for profiling cytochrome P450 activities associated with insecticide interactions». PNAS 110 (49): 19766–19771. doi:. PMID 24248381. Bibcode: 2013PNAS..11019766I.
- ↑ «The preponderance of P450s in the Mycobacterium tuberculosis genome». Trends in Microbiology 14 (5): 220–8. May 2006. doi:. PMID 16581251.
- ↑ «Complete genome sequence and comparative analysis of the industrial microorganism Streptomyces avermitilis». Nature Biotechnology 21 (5): 526–31. May 2003. doi:. PMID 12692562. https://archive.org/details/sim_nature-biotechnology_2003-05_21_5/page/526.
- ↑ Leto, O'Keefe (1988). «Identification of constitutive and herbicide inducible cytochromes P-450 in Streptomyces griseolus». Arch Microbiol 149 (5): 406–12. doi:. https://archive.org/details/sim_archives-of-microbiology_1988-03_149_5/page/406.
- ↑ «Investigating conservation of the albaflavenone biosynthetic pathway and CYP170 bifunctionality in streptomycetes». The FEBS Journal 279 (9): 1640–9. May 2012. doi:. PMID 22151149.
- ↑ «CYP105-diverse structures, functions and roles in an intriguing family of enzymes in Streptomyces». Journal of Applied Microbiology 117 (6): 1549–63. December 2014. doi:. PMID 25294646.
- ↑ «Biochemical basis for the activity and selectivity of oral antifungal drugs». British Journal of Clinical Practice. Supplement 71: 41–6. September 1990. PMID 2091733.
- ↑ «Functional genomics of P450s». Annual Review of Plant Biology 54 (1): 629–67. 2003-01-01. doi:. PMID 14503006.
- ↑ «Unusual P450 reactions in plant secondary metabolism». Archives of Biochemistry and Biophysics. P450 Catalysis Mechanisms 507 (1): 194–203. March 2011. doi:. PMID 20920462.
