Πυριδίνη: Διαφορά μεταξύ των αναθεωρήσεων
| Γραμμή 227: | Γραμμή 227: | ||
==== Αντιδράσεις ==== |
==== Αντιδράσεις ==== |
||
Πολλές αντιδράσεις που είναι |
Πολλές αντιδράσεις που είναι χαρακτηριστικές για το βενζόλιο, τις δίνει και η πυριδίνη, αλλά με χαμηλότερη απόδοση ή και σε πιο περίπλοκες καταστάσεις. Λόγω της σχετικά μειωμένης ηλεκτρονιακής πυκνότητας στο αρωματικό της σύστημα,οι αρωματικές ηλεκτρονιόφιλες υποκατσστάσεις σχετικά καταστέλλονται για τη «μητρική» και τις «θυγατρικές» πυριδίνες, υπέρ της πυρηνόφιλης προσθήκηε, στο ηλεκτρονιακά πλουσιότερο άτομο του αζώτου. Η πυρηνόφιλη προσθήκη στο άτομο του αζώτου οδηγεί σε περαιτέρω απενεργοποίηση των αρωματικών ιδιοτήτων των πυριδινών και εμποδίζουν ακόμη περισσότερο τις αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις. Από την άλλη πλευρά, τόσο η ελεύθερη-ριζική, όσο και η πυρηνόφιλη υποκατἀσταση προκύπτει ευκολότερα στις πυριδίνες σε σύγκριση με το βενζόλιο. |
||
===== Αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις ===== |
|||
Σε πολλές αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις η πυριδίνη είτε δεν τις δίνει είτε τις δίνει μόνο εν μέρει. Ωστόσο, ο ετεροαρωματικός χαρακτήρας της ένωσης μπορεί να ενεργοποιηθεί, με την προσθήκη λειτουργικής ομάδας που περιέχει δότη ηλεκτρονίων. Οι συνηθισμένες αλκυλιώσεις και ακυλιώσεις κατά [[Αντίδραση Friedel-Crafts|Friedel–Crafts]], συνήθως αποτυγχάνουν στην πυριδίνη, γιατί τείνουν να οδηγήσουν μὀνο σε προσθήκη τους στο άτομο του αζώτου. Αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις (όταν συμβαίνουν) εμφανίζονται συνήθως στη #3- (μετα-) θέση, που είναι αντιστοιχεί στα σχετικά ηλεκτρονιακά πλουσιότερα άτομα άνθρακα του πυριδινικού δακτυλίου, οπότε είναι σχετικά πιο επιρρεπής σε μια αρωματική ηλεκτρονιόφιλη υποκατάσταση: |
|||
===== Electrophilic αντικαταστάσεις ===== |
|||
Πολλές electrophilic αντικαταστάσεις σε πυριδίνη είτε να μην προχωρήσει ή να προχωρήσει μόνο εν μέρει, ωστόσο, η ετεροαρωματικές χαρακτήρα μπορεί να ενεργοποιηθεί από το ηλεκτρόνιο-δωρεά functionalization. Κοινή alkylations και acylations, όπως [[Αντίδραση Friedel-Crafts|Friedel–Crafts αλκυλίωση ή acylation]], συνήθως αποτυγχάνουν για πυριδίνης επειδή μπορούν να οδηγήσουν μόνο στην προσθήκη στο άτομο αζώτου. Αντικαταστάσεις εμφανίζονται συνήθως στην 3-θέση, η οποία είναι η πιο πλούσια σε ηλεκτρόνια άτομο άνθρακα του δακτυλίου και είναι, ως εκ τούτου, πιο επιρρεπείς σε μια electrophilic προσθήκη. |
|||
[[Αρχείο:Pyridine-EAS-2-position-2D-skeletal.png|κέντρο|520x520εσ|υποκατάσταση στη θέση 2]] |
[[Αρχείο:Pyridine-EAS-2-position-2D-skeletal.png|κέντρο|520x520εσ|υποκατάσταση στη θέση 2]] |
||
[[Αρχείο:Pyridine-EAS-3-position-2D-skeletal.png|κέντρο|500x500εσ|η υποκατάσταση στην 3-θέση]] |
[[Αρχείο:Pyridine-EAS-3-position-2D-skeletal.png|κέντρο|500x500εσ|η υποκατάσταση στην 3-θέση]] |
||
[[Αρχείο:Pyridine-EAS-4-position-2D-skeletal.png|κέντρο|430x430εσ|Υποκατάσταση στη θέση 4]] |
[[Αρχείο:Pyridine-EAS-4-position-2D-skeletal.png|κέντρο|430x430εσ|Υποκατάσταση στη θέση 4]] |
||
[[Αρχείο:Pyridine_N-oxide.png|μικρογραφία|113x113εσ|Δομή του N-οξειδίου της πυριδίνης (Py<sup>+</sup>O<sup>-</sup>).]]Οι αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις στην #2- (ορθο-) ή #4- (παρα-) θέσεις οδηγούν σε ενεργειακά δυσμενή σ- σύμπλοκα. Μπορούν, ωστόσο, να προωθηθούν κι αυτές, χρησιμοποιώντας πειραματικές τεχνικές, όπως η διεξαγωγή αρωματικής ηλεκτρονιόφιλης υποκατάστασεις όχι απευθείας στην πυριδίνη, αλλά σε N-οξυπυριδίνη, με επακόλουθη αποξυγόνωση του ατόμου του αζώτου. Η (προσωρινή έστω) προσθήκη οξυγόνου μειώνει την ηλεκτρονιακή πυκνότητα στο άτομο του αζώτου, ευνοώντας έτσι την αρωματική ηλεκτρονιόφιλη υποκατάσταση στα άτομα άνθρακα #2 και #4. Το άτομο του οξυγόνου μπορεί να αφαιρεθεί, στη συνέχεια, μέσω διαφόρων αντιδραστικών οδών, με συνηθέστερες τη χρήση ενώσεων του P<sup>III</sup> ή του S<sup>II</sup>, οι οποίες εύκολα οξειδώνονται, εις βάρος του N. Η [[τριφαινυλοφωσφίνη]] (PPh<sub>3</sub>) χρησιμοποιείται συχνά ως τέτοιο αντιδραστήριο, που αφαιρεί το οξυγόνο από το άζωτο και οξειδώνεται η ίδια σε [[τριφαινυλοφωσφινοξείδιο]] (POPh<sub>3</sub>). Οι ακόλουθες παράγραφοι περιγράγουν παραδείγματα που εκπροσωπούν αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις στην πυριδίνη: |
|||
[[Αρχείο:Pyridine_N-oxide.png|μικρογραφία|113x113εσ|Δομή της πυριδίνης ''N''-οξείδιο]] |
|||
Αντικαταστάσεις να πυριδίνης στην 2 - ή 4-θέση οδηγήσει σε μια δραστήρια δυσμενή σ συγκρότημα. Μπορούν να προωθηθούν, ωστόσο, χρησιμοποιώντας πειραματικές τεχνικές, όπως τη διεξαγωγή electrophilic υποκατάστασης της πυριδίνης ''N''-οξείδιο που ακολουθείται από deoxygenation το άτομο αζώτου. Προσθήκη οξυγόνου μειώνει την πυκνότητα ηλεκτρονίων στο άτομο αζώτου και ευνοεί την υποκατάσταση στο 2 - και 4-άνθρακες. Το άτομο οξυγόνου μπορεί στη συνέχεια να αφαιρεθεί μέσω διαφόρων οδών, πιο συχνά με τις ενώσεις των τρισθενές [[Φωσφόρος|φωσφόρου]] ή δισθενή [[Θείο|θείου]], το οποίο είναι εύκολα οξειδώνεται. Triphenylphosphine είναι συχνά χρησιμοποιείται αντιδραστήριο, το οποίο οξειδώνεται σε αυτή την αντίδραση οξείδιο τριφαινυλοφωσφίνης. Οι ακόλουθες παράγραφοι περιγράφουν εκπρόσωπος electrophilic υποκατάστασης αντιδράσεις της πυριδίνης. |
|||
====== Νίτρωση ====== |
|||
| ⚫ | Η άμεση νίτρωση της πυριδίνης απαιτεί σκληρές συνθήκες και έχει πολύ χαμηλές αποδόσεις. Η 3-νιτροπυριδίνη μπορεί να ληφθεί με την επίδραση στην πυριδίνη με [[πεντοξείδιο του αζώτου]] (N<sub>2</sub>O<sub>5</sub>), παρουσία μεταλλικού [[Νάτριο|νατρίου]].<ref>[//en.wikipedia.org/wiki/Pyridine#Joule Joule], p. 129</ref><ref>{{Cite journal|title=Dinitrogen Pentoxide-Sulfur Dioxide, a New nitrate ion system|last=Bakke|first=Jan M.|last2=Hegbom|first2=Ingrid|journal=Acta Chemica Scandinavica|doi=10.3891/acta.chem.scand.48-0181|year=1994|volume=48|pages=181|last3=Verne|first3=Hans Peter|last4=Weidlein|first4=Johann|last5=Schnöckel|first5=Hansgeorg|last6=Paulsen|first6=Gudrun B.|last7=Nielsen|first7=Ruby I.|last8=Olsen|first8=Carl E.|last9=Pedersen|first9=Christian}}</ref><ref>{{Cite journal|title=Preparation of Novel Heteroisoindoles from nitropyridines and Nitropyridones|last=Ono|first=Noboru|last2=Murashima|first2=Takashi|journal=Heterocycles|doi=10.3987/COM-02-S(M)22|year=2002|volume=58|pages=301|last3=Nishi|first3=Keiji|last4=Nakamoto|first4=Ken-Ichi|last5=Kato|first5=Atsushi|last6=Tamai|first6=Ryuji|last7=Uno|first7=Hidemitsu}}</ref> Οι «θυγατρικές» πυριδίνες στις οποίες το άτομο του αζώτου περιβάλλεται στερεοχημικά, μπορεί να ληφθεί νίτρωσή τους με επίδραση [[Τετραφθοριούχο νιτρώνιο|τετραφθοριούχου νιτρώνιου]] (NO<sub>2</sub>BF<sub>4</sub>). Επίσης, η 3-νιτροπυριδίνη μπορεί να ληφθεί μέσω της σύνθεσης 2,6-διβρωμοπυριδίνης, νίτρωσης της τελευταίας και αφαίρεσης των ατόμων βρωμίου από την ενδιάμεσα σχηματιζόμενη 2,6-διβρωμο-3-νιτροπυριδίνη. <ref>{{Cite journal|title=Aprotic Nitration ({{chem|NO|2|+|BF|4|−}}) of 2-Halo- and 2,6-Dihalopyridines and Transfer-Nitration Chemistry of Their ''N''-Nitropyridinium Cations|last=Duffy|first=Joseph L.|last2=Laali|first2=Kenneth K.|journal=The Journal of Organic Chemistry|issue=9|doi=10.1021/jo00009a015|year=1991|volume=56|pages=3006}}</ref><ref>[//en.wikipedia.org/wiki/Pyridine#Joule Joule], p. 126</ref> |
||
====== Σουλφούρωση ====== |
|||
| ⚫ | |||
Η απευθείας σουλφούρωση πυριδίνης είναι ακόμη πιο δύσκολα πραγματοποιήσιμη από την άμεση νίτρωση. Ωστόσο, το 3-πυριδινοσουλφονικό οξύ μπορεί να ληφθεί με αποδεκτή απόδοση με περίσσεια (πυκνού) [[Θειικό οξύ|θειικού οξέος]] θερμοκρασίας 320 °C σε βραστή πυριδίνη.<ref>{{Cite journal|title=Note on nicotinic acid from pyridine|last=Gabriel|first=S.|journal=Berichte der deutschen chemischen Gesellschaft|doi=10.1002/cber.188201501180|year=1882|volume=15|pages=834}}</ref> Η αντίδραση πυριδίνης με τριοξείδιο του θείου (SO<sub>3</sub>) διευκολύνεται με την (προσωρινή έστω) προσθήκη θείου στο άτομο του αζώτου, ειδικότερα δε με την παρουσία [[Θειικός υδράργυρος|θειικού υδραργύρου]] (HgSO<sub>4</sub>), ως καταλύτη.<ref>{{Cite journal|title=Konstitutionsspezifität der Nicotinsäure als Wuchsstoff bei ''Proteus vulgaris'' und ''Streptobacterium plantarum''|last=Möller|first=Ernst Friedrich|last2=Birkofer|first2=Leonhard|journal=Berichte der deutschen chemischen Gesellschaft (A and B Series)|issue=9|doi=10.1002/cber.19420750912|year=1942|volume=75|pages=1108|trans_title=Constitutional specificity of nicotinic acid as a growth factor in ''Proteus vulgaris'' and ''Streptobacterium plantarum''}}</ref> |
|||
====== Αλογόνωση ====== |
|||
Σε αντίθεση με τη νίτρωση και |
Σε αντίθεση τόσο με τη νίτρωση, όσο και με τη σουλφούρωση, η άμεση βρωμίωση και η άμεση χλωρίωση προχωρεί καλά. Με αντίδραση πυριδίνης με διβρώμιο (Br<sub>2</sub>) σε θεικό οξύ, στους 130 °C εύκολα παράγεται 3-βρωμοπυριδίνη. Η απόδοση είναι χαμηλότερη για την παραγωγή 3-χλωροπυριδίνης, κατά τη χλωρίωση πυριδίνης με διχλώριο (Cl<sub>2</sub>), παρουσία [[Χλωριούχο αργίλιο|χλωριούχου αργιλίου]] (AlCl<sub>3</sub>), στους 00 °C. Και οι δυο 2-αλοπυριδίνες (2-βρωμοπυριδίνη και 2-χλωροπυριδίνη) μπορούν να παραχθούν και με άμεση επίδραση του αντίστοιχου αλογόνου σε πυριδίνη, παρουσία [[Διχλωριοχο παλλάδιο|διχλωριοχου παλλαδίου]] (PdCl<sub>2</sub>), ως καταλύτη.<ref>[//en.wikipedia.org/wiki/Pyridine#Joule Joule], p. 130</ref> |
||
===== Πυρηνόφιλη αντικαταστάσεις ===== |
===== Πυρηνόφιλη αντικαταστάσεις ===== |
||
Έκδοση από την 10:49, 14 Ιουνίου 2017
| Πυριδίνη | |||
|---|---|---|---|

| |||

| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Πυριδίνη[1][2] | ||
| Άλλες ονομασίες | Αζίνη[3] Αζαβενζόλιο[4] | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C5H5N | ||
| Μοριακή μάζα | 79,10 amu | ||
| Συντομογραφίες | Py | ||
| Αριθμός CAS | 110-86-1 | ||
| SMILES | c1ccncc1 | ||
| InChI | 1S/C5H5N/c1-2-4-6-5-3-1/h1-5H | ||
| Αριθμός EINECS | 203-809-9 | ||
| Αριθμός UN | NH9L3PP67S | ||
| PubChem CID | 1049 | ||
| ChemSpider ID | 1020 | ||
| Δομή | |||
| Διπολική ροπή | 2,20 D | ||
| Μοριακή γεωμετρία | Επίπεδη εξαγωνική | ||
| Ισομέρεια | |||
| Ισομερή θέσης | >100 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -41,6°C | ||
| Σημείο βρασμού | 115,2°C | ||
| Πυκνότητα | 981,9 kg/m³ | ||
| Διαλυτότητα στο νερό |
Αναμείξιμη | ||
| Ιξώδες | 0,88 cP | ||
| Δείκτης διάθλασης , nD |
1,5093 | ||
| Τάση ατμών | 16 mmHg (20°C) | ||
| Εμφάνιση | Άχρωμο προς κιτρινωπό υγρό | ||
| Χημικές ιδιότητες | |||
| pKa | 5,25[5] | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
21°C | ||
| Επικινδυνότητα | |||
 
| |||
| Εύφλεκτη (F) Βλαβερή (Xn) | |||
| Φράσεις κινδύνου | 20, 21, 22 34, 36, 38 | ||
| LD50 | 891 mg/kg (αρουραίοι, στοματική λήψη) | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η πυριδίνη[6] (αγγλικά pyridine) είναι βασική ετεροκυκλική οργανική (δηλαδή ετεροαρωματική) ένωση, που περιέχει άνθρακα, υδρογόνο και άζωτο, με μοριακό τύπο C5H5N. Είναι δομικά συγγενική με το βενζόλιο, από το οποίο τυπικά μπορεί να προκύψει αν αντικατασταθεί μια μεθινομάδα (=CH−) του τελευταίου (δηλαδή του βενζολίου) από ένα άτομο αζώτου. Ο όρος «πυριδίνη» επεκτείνεται και σε «θυγατρικές» παράγωγες ενώσεις της, στις οποίες συμπεριλαμβάνονται πολλές σημαντικές ενώσεις, όπως οι αζίνες και οι βιταμίνες νιασίνη και πυριδοξίνη.
Η πυριδίνη ανακαλύφθηκε το 1849, από το Σκωτσέζο χημικό Τόμας Άντερσον (Thomas Anderson), ως ένα από τα συστατικά του οστελαίου. Δύο χρόνια αργότερα, ο Άντερσον απομόνωσε χημικά καθαρή πυριδίνη με κλασματική απόσταξη οστελαίου.
Η χημικά καθαρή πυριδίνη, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm,
είναι άχρωμο, εύφλεκτο, ασθενώς αλκαλικό υδατοδιαλυτό υγρό, με χαρακτηριστική δυσάρεστη οσμή ψαρίλας.
Η πυριδίνη χρησιμοποιείται ως πρόδρομη ένωση αγροχημικών και φαρμακευτικών προϊόντων, ενώ επίσης αποτελεί σημαντικό οργανικό διαλύτη αλλά και συνθετικό αντιδραστήριο. Η πυριδίνη προστίθεται στο οινόπνευμα, για να το καταστήσει μη πόσιμο (βλ. μετουσιωμένη αλκοόλη). Χρησιμοποιείται για την in vitro σύνθεση του DNA,[7] στη σύνθεση της σουλφαπυριδίνης, που είναι φάρμακο κατά βακτηριδιακών και ιογενών λοιμώξεων, των αντισταμινικών φαρμάκων τριπελενναμίνη και μεπυραμίνη, καθώς και σε υδατοδιαλυτά εντομοαπωθητικά, σε βακτηριοκτόνα, και σε ζιζανιοκτόνα. Ορισμένες χημικές ενώσεις, αν και δεν παράγονται από πυριδίνη, περιέχουν ωστόσο τη δομή του δακτυλίου της (αποτελώντας έτσι τυπικά «θυγατρικές» ενώσεις της). Περιλαμβάνουν βιταμίνες του συμπλέγματος Β, όπως νιασίνη και πυριδοξάλη, το αντιφυματικό φάρμακο ισονιαζίδη, τη νικοτίνη και άλλα αζωτούχα φυτικά προϊόντα.[8] Ιστορικά, η πυριδίνη παράγονταν από λιθανθρακόπισσα και ως παραπροϊόν της αεριοποίησης του άνθρακα. Ωστόσο, η αυξημένη ζήτηση για πυριδίνης, είχε ως αποτέλεσμα την ανάπτυξη πιο οικονομικών μεθόδων σύνθεσης, από ακεταλδεΰδη και αμμωνία, με περισσότερους από 20.000 τόνους της ετησίως να παράγονται σε όλο τον κόσμο.
Ονοματολογία
Η συστηματική ονομασία της πυριδίνης «αζίνη», σύμφωνα με το σύστημα Hantzsch–Widman, για την ονοματολογία ετεροκυκλικών ενώσεων. Ωστόσο η συστηματική αυτή ονομασία χρησιμοποιείται σπάνια, ενώ άλλωστε η εμπειρική της ονομασία «πυριδίνη» συνιστάται από την IUPAC.[9] Η αρίθμηση του δακτυλίου της, για την ονοματολογία παραγώγων της πυριδίνης, ξεκινά από το άτομο του αζώτου ως #1. Για τα παράγωγά της χρησιμοποιούνται επίσης ενίοτε τόσο η αρίθμηση με γράμματα του ελληνικού αλφαβήτου (α-γ), όσο και τα προθέματα ορθο- (o-), μετα- (μ-) και παρα- (π-), αντιστοίχως. Οι θέσεις 2-, α- και ο-, 3-, β- και μ-, καθώς και 4-, γ- και π-, είναι αντιστοίχως ταυτόσημες. Για την ονοματολογία των ριζών που προκύπτουν τυπικά από την πυριδίνη με αφαίρεση ενός ατόμου υδρογόνου από αυτήν (την πυριδίνη) ονομάζονται συστηματικά «πυριδινυλο-», με πρόταξη του αριθμό θέσης του ατόμου υδρογόνου που αφαιρέθηκε για να σχηματιστεί η εκάτοστε ρίζα, αλλά επίσης ενθαρρύνεται από την IUPAC και χρησιμοποιείται αντί για το συστηματικό όνομα της ρίζας η εμπειρική ονομασία «πυριδυλο-».[10] Τα κατιονικά παράγωγα της πυριδίνης, που σχηματίζονται με την προσθήκη μιας ηλεκτρονιόφιλης ομάδας στο άτομο του αζώτου, ονομάζονται «πυριδινιώνια». Μερικά παραδείγματα ονοματολογίας παραγώγων της πυριδίνης είναι τα ακόλουθα:
-
4-βρωμοπυριδίνη ή γ-βρωμοπυριδίνη ή π-βρωμοπυριδίνη
-
2,2΄-διπυριδίνη
-
πυριδινο-2,6-δικαρβοξυλικό οξύ ή διπικολινικό οξύ
-
Η γενική μορφή των κατιόντων πυριδινιωνίου
Ιστορία

Αναμφίβολα, οι αλχημιστές είχαν αναμφίβολα από παλιά παρασκευάσει ακάθαρτη (χημικά) πυριδίνη, με τη θέρμανση οστών ζώων και άλλων οργανικών υλών,[11] , αλλά η παλαιότερη τεκμηριωμένη αναφορά πιστώνεται στο Σκωτσέζο χημικό Τόμας Άντερσον (Thomas Anderson).[12][13] Συγκεκριμένα, το 1849, ο Άντερσον μελέτησε το περιεχόμενο του ελαίου που λαμβάνεται μέσω υψηλής θερμοκρασίας θέρμανσης σε οστά ζώων. Μεταξύ άλλων ουσιών, που διαχωρίζονται από το έλαιο αυτό, είναι ένα άχρωμο υγρό με δυσάρεστη οσμή, από την οποία ο Άντερσον απμόνωσε χημικά καθαρή πυριδίνη. δύο χρόνια μετά από την αρχική του ανακάλυψη (δηλαδή το 1951). Περιέγραψε τη νέα (για τότε) ένωση, ως εξαιρετικά υδατοδιαλυτή, εύκολα διαλυτή σε πυκνά οξέα και άλατα, (ενίοτε) με τη βοήθεια κάποιας θέρμανσης, και μόνο ελαφρώς διαλυτή σε διάφορα έλαια.
Λόγω της ευφλεκτότητάς της, ο Άντερσον, ονόμασε τη (νέα για τότε) ένωση που ανακάλυψε «πυριδίνη», από την ελληνική λέξη «πῢρ» και το επίθεμα «ιδίνη», σύμφωνα με τη χημική ονοματολογία, όπως επίσης η τολουϊδίνη, για να υποδείξει ότι δομικά περιέχει ανθρακούχο δακτύλιο, με ένα άτομο αζώτου.[14]
Η χημική δομή της πυριδίνης αποσαφηνίστηκε δεκαετίες μετά την ανακάλυψη της ένωσης. Συγκεκριμένα, οι Γουΐλχελμ Κέρνερ (Wilhelm Körner, 1869)[15] και Τζέημς Ντιούαρ (James Dewar, 1871)[16][17] πρότειναν ότι, σε αντίστοιχη αναλογία ανάμεσα στην κινολίνη και το ναφθαλίνιο, η πυριδίνη προέρχεται τυπικά από το βενζόλιο, αντικαθιστώντας μια μεθνιυλομάδα (=CH-) με ένα άτομο αζώτου.[18][19] Η πρόταση των Κέρνερ και Ντιούαρ επιβεβαιώθηκε αργότερα, σε ένα πείραμα στον οποίο πυριδίνη ανάχθηκε σε πιπεριδίνη, με τη χρήση (στοιχειακού) νατρίου σε αιθανόλη. Το 1876, ο Ουίλιαμ Ράμσεϊ (William Ramsay) συνέθεσε πυριδίνη με συνδυασμό αιθινίου και υδροκυανίου σε ένα κλίβανο με σωλήνες ερυθροπυρομένου σιδήρου. Αυτή ήταν η πρώτη σύνθεση ετεροαρωματικής ένωσης.[20]
Οι τότε μέθοδοι παραγωγής πυριδίνης είχαν χαμηλή απόδοση, οπότε λόγω η αυξανόμενη ζήτηση της ένωσης ώθησε την έρευνα για πιο αποτελεσματικές παραγωγικές οδούς. Μια σημαντική ανακάλυψη, στον τομέα αυτό, έγινε το 1924, όταν ο ρώσος χημικός Αλεξέι Τσιτσιμπαμπίν (Чичибабин, Алексей Евгеньевич) εφεύρε μια (νέα για τότε) αντίδραση σύνθεσης πυριδίνης, που βασίζεται σε (σχετικά) φθηνά αντιδραστήρια.[21] Η μέθοδος αυτή, εξακολουθεί να χρησιμοποιείται για τη βιομηχανική παραγωγή της πυριδίνης (δείτε παρακάτω).
Φυσική παρουσία
Η «μητρική» πυριδίνη δεν είναι άφθονη στη φύση, εκτός από τα φύλλα και τις ρίζες της μπελαντόνας (Atropa belladonna)[22] και της (Althaea officinalis).[23] Δομικά, όμως, «θυγατρικά» παράγωγα της πυριδίνης αποτελούν μέρος (τουλάχιστον) βιομορίων, όπως τα νουκλεοτίδια και τα αλκαλοειδή.
Στην καθημερινή ζωή, ίχνη πυριδίνης αποτελούν συστατικά των πτητικών οργανικών ενώσεων που παράγονται κατά το ψήσιμο ή και την κονσερβοποίηση προϊόντων όπως για παράδειγμα το τηγανητό κοτόπουλο,[24] σουκιγιάκι,[25] ο καβουρδισμένος καφές,[26] τα πατατάκια,[27] και τηγανητό μπέικον.[28]. Ακόμη, ίχνη πυριδίνης μπορούν να βρεθούν στο τυρί Beaufort,[29] σε κολπικές εκκρίσεις,[30] στο μαύρο τσάι,[31] στο σάλιο των ανθρώπων που πάσχουν από ουλίτιδα,[32] και στο μέλι ηλίανθου.[33] Ο καπνός από καπνό[34][35] ή κάνναβη επίσης περιέχουν μικρές ποσότητες πυριδίνης.
Παραγωγή
Ιστορικά, πυριδίνη εξάγεται από τη λιθανθρακόπισσα ή λαμβάνεται ως παραπροίόν της αεριοποίησης του άνθρακα. Οι μέθοδοι αυτές ήταν κοπιαστικές, χρονοβόρες και αναποτελεσματικές, αφού η λιθανθρακόπισσα περιέχει μόλις 1‰ πυριδίνη[36], ενώ η απομόνωση της ένωσης και ο καθαρισμός της συνεπάγεται περαιτέρω μείωση της παραγωγής. Σήμερα, πλέον, η περισσότερη πυριδίνη που χρησιμοποιείται παράγεται τεχνητά με τη χρήση διαφόρων μεθόδων, οι πιο σημαντικές από τις οποίες περιγράφονται παρακάτω:[37]
Σύνθεση Τσιτσιμπαντίν
Η ανακάλυψη της μεθόδου αυτής από το ρώσο χημικό Τσιτσιμπαντίν το 1924 αναφέρθηκε παραπάνω στην ιστορία της ένωσης και είναι ακόμη σε χρήση από τη βιομχανία. Στη γενική της μορφή η μέθοδος μπορεί να περιγραφεί ως αντίδραση συμπύκνωσης αλδεϋδών, κετόνων και α,β-ακόρεστων καρβονυλικών ενώσεων, ή με οποιονδήποτε συνδυασμό των προηγούμενων, με αμμωνία ή διάφορα παράγωγα αυτής.[38] Ειδικότερα, η «μητρική» πυριδίνη παράγεται από μεθανάλη και αιθανάλη, που είναι σχετικά φθηνές και πολύ διαθέσιμες. Αρχικά, μεθανάλη και αιθανάλη υφίστανται συμπύκνωση Κνόεβανγκελ (Knoevenagel), δίνοντας ακρολεΐνη. Στη συνέχεια, παραγώμενη η ακρολεΐνη συμπυκνώνεται, μαζί με ένα ακόμη ισοδύναμο αιθανάλης, αλλά και αμμωνία, σχηματίζοντας αρχικά 1,4-διυδροπυριδίνη, που στη συνέχεια οξειδώνεται, με τη βοήθεια καταλύτη στερεάς κατάστασης, τελικά σε πυριδίνη. Η όλη διεργασία διεξάγεται στην αέρια φάση, στους 400-450 °C. Το παραγώμενο προϊόν αποτελείται από μείγμα πυριδίνης, πικολινών και λουτιδινών. Η σύνθεση του αναφερόμενου μείγματος εξαρτάται από τον καταλύτη που θα επιλεγεί, οπότε αυτό μπορεί να προσαρμοστεί στις ανάγκες του κατασκευαστή. Ο καταλύτης είναι συνήθως άλας μεταβατικών μετάλλων, όπως το διφθοριούχο κάδμιο (CdF2), το διφθοριούχο μαγγάνιο (MnF2), αλλά επίσης και άλατα του κοβαλτίου και του θάλλιου, ενώσεις μπορούν επίσης να χρησιμοποιηθούν. Η παραγώμενη πυριδίνη διαχωρίζεται από διάφορα υποπροϊόντα σε πολυβάθμια διαδικασία.[39]


Η πρακτική εφαρμογή της παραδοσιακής σύνθεσης πυριδίνης κατά Τσιτσιμπαντίν είναι περιορισμένη, εξαιτίας της σχετικά χαμηλής απόδοσης της μεθόδου, που τυπικά είναι γύρω στο 20%. Αυτή η σχετικά χαμηλή απόδοση, μαζί με την υψηλή συμπαραγωγή παραπαραγώγων, καθιστούν τη μέθοδο αυτή μη δημοφιιλή.[40]
Απαλκυλίωση αλκυλοπυριδίνης
Η «μητρική» πυριδίνη μπορεί να παραχθεί με απαλκυλίωση αλκυλιωμένων «θυγατρικών» πυριδών, που με τη σειρά τους παράγονται ως παραπροϊόντα σε συνθέσεις άλλων «θυγατρικών» πυριδινών. Η απαλκυλίωση πραγματοποιείται με οξείδωση από το οξυγόνο του ατμοσφαιρικού αέρα, με χρήση πεντοξειδίου του βαναδίου (V2O5) ως καταλύτη[41], ή με ατμό, με καταλύτη που έχει ως βάση το νικέλιο,[42][43] ή τέλος με υδρογόνο, με καταλύτη που έχει ως βάση τον άργυρο ή το λευκόχρυσο.[44] Οι αποδόσεις αυτών των μεθόδων μπορούν να φθάσουν ως και 93%, ιδιαίτερα η μέθοδος ατμοαπαλκυλίωσης, με καταλύτη που έχει ως βάση το νικέλιο.[45]
όπου Py εδώ οποιοδήποτε πυριδινύλιο.
Σύνθεση Χαντζσχ
Η πρώτη μεγάλης κλίμακας σύνθεση «θυγατρικών» πυριδινών περιγράφηκε το 1881 από τον Αρθουρ Ρούντολφ Χαντζσχ (Arthur Rudolf Hantzsch).[46] Η σύνθεση πυριδίνης κατά Χαντζσχ χρησιμοποιεί συνήθως μείγμα 2:1:1 από β-κετοξύ, όπως το ακετοξεικό οξύ, CH3COCH2COOH, μια αλδεΰδη, όπως τη μεθανάλη, και αμμωνία ή ένα αζωτούχο άλας, ως δότη αζώτου. Αρχικά λαμβάνεται κάποια «θυγατρική» διυδροπυριδίνη, η οποία στη συνέχεια οξειδώνεται στην αντίστοιχη «θυγατρική» πυριδίνη. Ο Εμίλ Κνοεβενάγγελ (Emil Knoevenagel) απέδειξε ότι με αυτήν τη διεργασία μπορούν να παραχθούν και ασύμμετρα υποκατεστημένα παράγωγα πυριδίνης.[47]

Κυκλοποίηση Μπόννεμανν

Ο συντριμερισμός δύο ισοδυνάμων αιθινίου και ενός ισοδυνάμου (κάποιου) νιτριλίου σε 2-αλκυλοπυριδίνη ονομάζεται κυκλοποίηση Μπόννεμανν (Bönnemann cyclization). Πρόκειται για παραλλαγή της σύνθεσης Ρέππε (Reppe synthesis) και μπορεί να ενεργοποιηθεί είτε με παροχή θερμότητας είτε παροχή φωτός. Η θερμική ενεργοποίηση απαιτεί υψηλές πιέσεις και θερμοκρασίες, ενώ η φωτοενεργοποιημένη κυκλοπροσθήκη γίνεται σε συνθήκες περιβάλλοντος, με τη χρήση CoCp2cod, όπου Cp: κυκλοπενταδιενυλο και cod: 1,5-κυκλοοκταδιένιο, ως καταλύτη, ενώ μπορεί να πραγατοποιηθεί ακόμη και μέσα στο νερό (ως διαλύτη)[48]. Αν χρησιμοποιηθεί αιθανονιτρίλιο (CH3CN) λαμβάνεται 2-πικολίνη. Αν απαιτείται η παραγωγή ειδικά της «μητρικής» πυριδίνης, μπορεί να ακολουθήσει απαλκυλίωση της 2-αλκυλοπυριδίνης (δείτε παραπάνω).
Σύνθεση Κράχνκε
Υπάρχει, ακόμη, η σύνθεση Κρόχνκε (Kröhnke pyridine synthesis), που αποτελεί αρκετά γενική μέθοδο παραγωγής «θυγατρικών» πυριδινών, χρησιμοποιώνται «μητρική» πυριδίνη ως αντιδραστήριο, χωρίς να καταναλώνεται η ίδια τελικά. Σύμφωνα με τη μέθοδο αυτή, στην αρχή αντιδρά πυριδίνη μα α-βρωμοεστέρες, δίνοντας το αντίστοιχο άλας πυριδινιώνιου, στο οποίο η μεθυλενική ομάδα είναι πολύ όξινη. Το άλας αυτό δίνει προσθήκη τύπου Μιχαήλ (Michael-like addition) με α,β-ακόρεστες καρβονυλικές ενώσεις, παρουσία αιθανικού αμμωνίου, δίνοντας σχηματισμό πυριδινικού δακτυλίου που αντιστιοιχεί στη ζητούμενη «θυγατρική» πυριδίνη, καθώς αναγεννά την αρχική «μητρική» πυριδίνη, με τη μορφή βρωμιούχου πυριδινιώνιου (Py+Br-).[49]

Μετάθεση Κιαμίκιαν-Ντέννστενττ
Σύμφωνα με τη μετάθεση Κιαμίκιαν-Ντέννστενττ (Ciamician–Dennstedt rearrangement), γίνεται επέκταση δακτυλίου πυρρόλιου σε 3-χλωροπυριδίνη, μετά από επίδραση με διχλωρομεθυλένιο [:CCl2]:[50][51][52]

Σύνθεση Γκάττερμανν-Σκίτα
Σύμφωνα με τη σύνθεση Γκάττερμανν-Σκίτα (Gattermann–Skita synthesis)[53], χρησιμοποιείται κάποιο άλας μηλονικού εστέρα, που αντιδρά με διχλωρομεθυλαμίνη (CHCl2NH2):[54]

Σύνθεση Μπόγκερ
Μια άλλη μέθοδος είναι η σύνθεση Μπόγκεερ (Boger pyridine):

Βιοσύνθεση
Αρκετές «θυγατρικές» πυριδίνες παίζουν σημαντικό ρόλο στα βιολογικά συστήματα. Ενώ η βιοσύνθεσή τους δεν είναι πλήρως κατανοητή, το νικοτινικό οξύ (βιταμίνη Β3) παρουσιάζεται σε ορισμένα βακτήρια, σε μύκητες, και σε θηλαστικά. Τα θηλαστικά συνθέτουν το νικοτινικό οξύ, μέσω της οξείδωσης του αμινοξέος τρυπτοφάνη, όπου το ενδιάμεσο προϊόν, ανιλίνη, δημιουργεί μια «θυγατρική» πυριδίνη, την κυνουρενίνη. Αντίθετα, τα βακτήρια Mycobacterium της φυματίωσης και Escherichia coli παράγουν νικοτινικό οξύ από την συμπύκνωση της 3-φωσφογλυκεριναλδεΰδης και ασπαρτικού οξέος.[55]
Μοριακή δομή
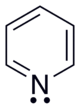

Η πυριδίνη έχει ένα συζευγμένο σύστημα των έξι (6) π ηλεκτρονίων που είναι απεντοπισμένα πάνω από το επίπεδο του δακτυλίου της. Το μόριό της είναι επίπεδο και ακολουθεί τα κριτήρια Hückel για τα αρωματικά συστήματα. Ωστόσο, σε αντίθεση με το βενζόλιο, η πυκνότητα του ηλεκτρονιακού νέφους δεν είναι ομοιόμορφα κατανεμημένη πάνω από το δακτύλιο της πυριδίνης, λόγω της αυξημένης ηλεκτραρνητικότητας του ατόμου του αζώτου της, που παράγει αρνητική επαγωγική επίδραση πάνω στο δακτύλιο. Για το λόγο αυτό η πυριδίνη έχει διπολική ροπή που εξασθενεί την αρωματική σταθεροποίηση συντονισμού, σε σύγκριση πάντα με το βενζόλιο. Συγκεκριμένα, η πυριδίνη έχει ενέργεια συντονισμιού 117 kJ·mol-1, έναντι 150 kJ·mol-1 της αντίστοιχης του βενζολίου.[56] Ο σχετικά μικρότερος ηλεκτρονιακός απεντοπισμός στην πυριδίνη αντικατοπτρίζεται και στο μικρότερο μήκος δεσμού C–N, που είναι 137 pm, έναντι 139 pm του μήκους δεσμού C-C στο βενζόλιο. Και τα δυο μήκη δεσμών, ωστόσο, βρίσκονται μεταξύ των τιμών που αντιστοιχούν σε απλούς και διπλούς δεσμούς, φαινόμενο που είναι χαρακτηριστικό των αρωματικών ενώσεων. Όλα τα άτομα στο δακτύλιο της πυριδίνης βρίσκονται σε sp² υβριδισμό. Το άτομο του αζώτου εμπλέκεται στο αρωματικό σύστημα χρησιμοποιώντας το μη υβριδοποιημένο p τροχιακό του. Το μονήρες ζεύγος ηλεκτρονίων του ατόμου του αζώτου είναι υβριδοποιημένο σε sp² υβριδισμό, προβάλλοντας προς τα έξω από το δακτύλιο, στο ίδιο επίπεδο με τους εντοπισμένους σ-δεσμούς. Ως αποτέλεσμα αυτής της κατάστασης, το μονήρες ηλεκτρονιακό ζεύγος του ατόμου του αζώτου δεν συμβάλλει στο αρωματικό σύστημα (ευτυχώς, γιατί θα το καθιστούσε αντιαρωματικό), αλλά επηρεάζει τις χημικές ιδιότητες της πυριδίνης, γιατί εύκολα υποστηρίζει το σχηματισμό δεσμού μέσω ηλεκτρονιόφιλης επίδρασης. Ωστόσο, λόγω του διαχωρισμού του μονήρους ζεύγους από το αρωματικό σύστημα του δακτυλίου, το άτομο του αζώτουτ δεν μπορεί να συνεισφέρει θετικό μεσομεριακό αποτέλεσμα.


Πολλές ενώσεις που είναι ανάλογες της πυριδίνης είναι γνωστές, στα οποία το άτομο αζώτου της αντικαθίσταται από άτομα άλλων χημικών στοιχείων. Παραδείγματα:
- C αντί N: Βενζόλιο.
- P αντί N: Φωσφορίνη.
- As αντί N: Αρσαβενζόλιο.
- Sb αντί N: Στιμπαβενζόλιο.
- Bi αντί N: Βισμαβενζόλιο.

Η υποκατάσταση μιας μεθινομάδας της πυριδίνης με ένα δεύτερο άτομο αζώτου σχηματίζει μια από τις τρεις (3) ισομερείς διαζίνες, με μοριακό τύπο (C4H4N2) και ονομασίες: πυριδαζίνη (ή ο-διαζίνη) , πυριμιδίνη (ή μ-διαζίνη) και πυραζίνη (ή π-διζίνη), αντίστοιχα.
Ιδιότητες
Φυσικές και φυσικοχημικές ιδιότητες

Η χημικά καθαρή πυριδίνη, στις κανονικές συνθήκες περιβάλλοντος, είναι άχρωμο υγρό, που υπό κανονική πίεση, βράζει στους 115,2°C και πήζει στους -41,6 °C. Η (κανονική) πυκνότητά του είναι 981,9 kg/m³, είναι κοντά σε αυτή του νερού. Έχει δείκτη διάθλασης 1,5093 σε μήκος κύματος 589 nm και σε θερμοκρασία 20 °C.[57] Η προσθήκη ως 40% mole νερού ταπηνώνει σταδιακά τη θερμοκρασία τήξης της από -41,6 °C σε -65,0 °C. Η μοριακή διπολική ροπή της είναι 2,2 Debyes.[58] Η πυριδίνη είναι διαμαγνητική και έχει διαμαγνητική ευαισθησία του -48,7·10-6 cm³·mol-1.[59] Η πρότυπη ενθαλπία σχηματισμού της είναι 100,2 kJ·mol-1 στην υγρή φάση[60] και 140,4 kJ·mol-1 στην αέρια φάση. Στους 25°C, η πυριδίνη έχει ιξώδες[61] 0,88 mPa/s και θερμική αγωγιμότητα 0,166 W·m-1·K-1.[62] Η ενθαλπία εξάτμισης είναι 35,09 kJ·mol-1, στη θερμοκρασία βρασμού της και υπό κανονική πίεση.[63] Η ενθαλπία τήξης της είναι 8,28 kJ·mol-1 στο σημείο τήξης της.[64]
Η πυριδίνη κρυσταλλώνεται στο ορθορομβικό κρυσταλλικό σύστημα, σε ομάδα χώρου Pna2, και με παραμέτρους πλέγματος a = 1752 pm, b = 897 pm., c = 1135 pm (στους 78 K), με 16 μονάδες τύπου ανά μονάδα κελιού, αλλά ο αριθμός των μορίων της ανά κελί είναι μόνο 4.[65] Η διαφορά αυτή σχετίζεται εν μέρει με τη (σχετικά) χαμηλότερη συμμετρία του μορίου πυριδίνης (C2v αντί D6h του βενζολίου). Ο τριυδρίτης της πυριδίνης (Py·3H2O) είναι, επίσης, γνωστός και κρυσταλλώνεται και αυτός στο ορθορομβικό κρυσταλλικό σύστημα, σε ομάδα χώρου Pna2, και με παραμέτρους πλέγματος a = 1244 pm, b = 1783 pm, c = 679 pm, με 8 μονάδες τύπου ανά μονάδα κελιού, (στους 223 K.[66]
Το κρίσιμο σημείο της πυριδίνης είναι: (κρίσιμη) πίεση 6,70 MPa, (κρίσιμη) θερμοκρασία 620 Κ και (κρίσιμος) όγκος 229 cm³·mol-1.[67] Στην περιοχή θερμοκρασιών 340-426 C η τάση ατμών της p μπορεί να περιγραφεί με την εξίσωση Αντοΐν (Antoine equation):
- όπου Τ είναι η απόλυτη θερμοκρασία, A = 4,16272, B = 1.371,358 K και C = -58,496 Κ.[68]
Το οπτικό φάσμα απορρόφησης της πυριδίνης σε εξάνιο περιέχει τρεις ζώνες (απορρόφησης), κατά το μήκος κύματος των 195 nm (π → π* μετάβαση, μοριακή απορροφητικότητα ε = 7500 L·mol-1·cm-1), 251 nm (π → π* μετάβαση, ε = 2000 L·mol-1·cm-1) και 270 nm (n → π* μετάβαση, ε = 450 L·mol-1·cm-1).[69] Το φάσμα
πυρηνικού μαγνητικού συντονισμού (NMR) 1H της πυριδίνης περιέχει τρία σήματα, με το ολοκλήρωμα της σχετικής έντασης σε αναλογία 2:1:2, που αντιστοιχούν στα τρία χημικώς διακριτά πρωτόνια στο μόριό της. Αυτά τα σήματα προέρχονται από τα α-πρωτόνια (θέσεις 2 και 6, με χημική μετατόπιση 8,5 ppm), από το γ-πρωτόνιο (θέση 4, με χημική μετατόπιση 7,5 ppm) και από τα β-πρωτόνια (θέσεις 3 και 5,με χημική μετατόπιση 7,1 ppm). Το ολανθρακούχο ανάλογο της πυριδίνης, δηλαδή το βενζόλιο, έχει μόνο ένα σήμα πρωτονίων, με χημική μετατόπιση 7,27 ppm. Οι μεγαλύτερες χημικές μετατοπίσεις των α - και γ-πρωτονίων της πυριδίνης σε σύγκριση με το μοναδικό σήμα του βενζόλιου είναι αποτέλεσμα της χαμηλότερης ηλεκτρονιακής πυκνότητας στις α - και γ-θέσεις, στο μόριο της πυριδίνης, που μπορεί να προέρχεται από τις δομές αντήχησης. Η κατάσταση είναι κάπως παρόμοια και για τα φάσματα NMR 13C της πυριδίνης και τα αντίστοιχα του βενζόλιου. Το φάσμα NMR 13C πυριδίνης δείχνει μια τριπλέτα στα δ(α-Γ) = 150 ppm, δ(β-Γ) = 124 ppm και δ(γ-Γ) = 136 ppm, ενώ το βενζόλιο έχει μια ενιαία γραμμή στα 129 ppm. Όλες οι τιμές αυτές λήφθηκαν για χημικά καθαρές ενώσεις, ελεύθερες από προσμείξεις άλλων διαλυτών.[70] Ηπυριδίνη ταυτοποιείται συμβατικά με τις μεθόδους της αέριας χρωματογραφίας και της φασματομετρίας μαζών.[71]
Χημικές ιδιότητες
Η πυριδίνη είναι αναμείξιμη με το νερό και σχεδόν με όλους τους οργανικούς διαλύτες. Συμπεριφέρεται ως ασθενής βάση. Με το υδροχλωρικό οξύ σχηματίζει το χλωριούχο πυριδινώνιο, το κρυσταλλικό υδροχλωρικό της άλας, που έχει κανονική θερμοκρασία τήξης 145-147 °C.[72] Οι περισσότερες χημικές ιδιότητες της πυριδίνης είναι οι χαρακτηριστικές και αναμενόμενες για την κατηγορία των ετεροαρωματικών ενώσεων, στις οποίες η πυριδίνη ανήκει. Πιο συγκεκριμένα, σε οργανικές αντιδράσεις, η πυριδίνη συμπεριφέρεται τόσο ως τριτοταγής αμίνη, δίνοντας N-αλκυλίωση, N-ακυλίωση, καθώς και Ν-οξείδωση, όσο και ως αρωματική ένωση, που δίνει πυρηνόφιλες υποκαταστάσεις. Λόγω της παρουσίας του ηλεκτροαρνητικού ατόμου αζώτου στο δακτύλιό της, η πυριδίνη είναι σχετικά ανεπαρκής ηλεκτρονιακά. Γι' αυτό δίνει δυσκολότερα αντιδράσεις αρωματικής ηλεκτρονιόφιλης υποκατάστασης, σε σύγκριση με το βενζόλιο, που είναι χαρακτηριστικές για το βενζόλιο και πολλά από τα παράγωγά του. Η δυσκολία πραγματοποίησης αντιδράσεων αρωματικής ηλεκτρονιόφιλης υποκατάστασης αυξάνεται αν δεν εξουδετερώνονται τάχιστα τα παραγώμενα από την υποκατάσταση πρωτόνια, γιατί τότε σχηματίζεται πυριδινώνιο, που ενισχύει ακόμη περισσότερο την ηλεκτρονιακή ανεπάρκεια της ουδέτερης πυριδίνης. Ωστόσο, σε αντίθεση με το βενζόλιο και πολλά παράγωγά του, η πυριδίνη δίνει πυρηνόφιλη υποκατάσταση και μετάλλωση από το δακτύλιο, αντιδρώντας με ισχυρές οργανομεταλλικές βάσεις.
Η χημική δραστικότητα, λοιπόν, της πυριδίνης μπορεί να διακριθεί σε τρεις (3) ομάδες αντιδράσεων:
- Με ηλεκτρονιόφιλα, δίνει (έστω και δυσκολότερα από το βενζόλιο) αντιδράσεις αρωματικής ηλεκτρονιόφιλης υποκατάστασης, εκφράζοντας έτσι τις αρωματικές της ιδιότητες.
- Με πυρηνόφιλα, αντιδρά στις μετα- θέσεις, δηλαδή #2 και #4, συμπεριφερόμενη παρόμοια με τις ιμίνες και τις καρβονύλικές ενώσεις.
- Με πολλά οξέα κατά Λιούις αντιδρά με το άτομο αζώτου της, συμπεριφερόμενη παρόμοια με τις τριτοταγείς αμίνες. Επίσης, η ικανότητα της πυριδίνης να δίνει N-οξείδωση, σχηματίζοντας αμινοξείδια, είναι επίσης χαρακτηριστική ιδιότητα των τριτοταγών αμινών.[73]
Το άτομο αζώτου της πυριδίνης διαθέτει ένα μονήρες ζεύγος ηλεκτρονίων. Επειδή αυτό το μονήρες ζεύγος δεν συμμετέχει στο αρωματικό σύστημα, η πυριδίνη είναι βάση, έχοντας χημικές ιδιότητες παρόμοιες με αυτές των τριτοταγών αμινών. Η pKa του συζυγούς αξέος της πυριδίνης, δηλαδή του κατιόντος πυριδινιωνίου (PyH+), είναι 5,25. Όταν η πυριδίνη πρωτονιώνεται από την παρουσία ισχυρότερων από αυτήν οξέων, σχηματίζεται το κατιόν πυριδινιωνίου, που είναι αρωματικό πολυατομικό ιόν. Τα μήκη δεσμών και οι γωνίες δεσμών της πυριδίνης και του κατιόντος πυριδινιωνίου είναι σχεδόν ταυτόσημα.[74] Το κατιόν πυριδινιωνίου είναι ισοηλεκτρονιακό με το μόριο του βενζολίου. Το π-τολουοσουλφονικό πυριδινιώνιο [PyH(π-CH3C6H4SO3), Pyridinium P-TolueneSulfonate-PPTS] είναι ενδεικτικό άλας πυριδινιώνιου, που παράγεται με κατεργασία πυριδίνης με π-τολουοσουλφονικό οξύ (π-CH3C6H4SO3H).
Η πυριδίνη μπορεί να λειτουγήσει ως βάση κατά Λιούις, δίνοντας το μονήρες ζεύγος ηλεκτρονίων της σε ένα οξύ κατά Λιούις, όπως το τριοξείδιο του θείου (SO3), σχηματίζοντας το αντίστοιχο σύμπλοκο.
Η ίδια η πυριδίνη είναι σχετικά αδύναμος συναρμοτής, σχηματίζοντας όμως σύμπλοκα με ιόντα μεταβατικών μετάλλων. Για παράδειγμα, σχηματίζει σύμπλοκα 1:1 με Ni2+ και με Cu2+, με logK1 τις τάξης των 1,9 και 2,6, αντίστοιχα.[75] Τα φάσματα υπερύθρου συμπλόκων πυριδίνης έχουν μελετηθεί.[76][77] Το 2-πινακολικό οξύ, που είναι υποκατεστημένη («θυγατρική») πυριδίνη, σχηματίζει ισχυρά σύμπλοκα, λόγω σχηματισμού χηλικών ενώσεων. Επίσης, η 2,2΄-διπυριδίνη και η 1,10-φαινανθρολίνη, που επίσης μπορούν να θεωρηθούν υποκατεστημένες («θυγατρικές») πυριδίνες, σχηματίζουν επίσης ισχυρά σύμπλοκα, όπως η φερροΐνη, που μπορεί να χρησιμοποιηθεί ως οξειδοαναγωγικός δείκτης στην ποσοτική ανάλυση του σιδήρου.[78]
Η συνακτική κατάσταση η6, όπως συμβαίνει σε αντίστοιχα σύμπλοκα του βενζολίου, παρατηρείται μόνο σε παράγωγα που μπλοκάρουν στερεοχημικά το αζωτούχο κέντρο της πυριδίνης.[79]
Αντιδράσεις
Πολλές αντιδράσεις που είναι χαρακτηριστικές για το βενζόλιο, τις δίνει και η πυριδίνη, αλλά με χαμηλότερη απόδοση ή και σε πιο περίπλοκες καταστάσεις. Λόγω της σχετικά μειωμένης ηλεκτρονιακής πυκνότητας στο αρωματικό της σύστημα,οι αρωματικές ηλεκτρονιόφιλες υποκατσστάσεις σχετικά καταστέλλονται για τη «μητρική» και τις «θυγατρικές» πυριδίνες, υπέρ της πυρηνόφιλης προσθήκηε, στο ηλεκτρονιακά πλουσιότερο άτομο του αζώτου. Η πυρηνόφιλη προσθήκη στο άτομο του αζώτου οδηγεί σε περαιτέρω απενεργοποίηση των αρωματικών ιδιοτήτων των πυριδινών και εμποδίζουν ακόμη περισσότερο τις αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις. Από την άλλη πλευρά, τόσο η ελεύθερη-ριζική, όσο και η πυρηνόφιλη υποκατἀσταση προκύπτει ευκολότερα στις πυριδίνες σε σύγκριση με το βενζόλιο.
Αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις
Σε πολλές αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις η πυριδίνη είτε δεν τις δίνει είτε τις δίνει μόνο εν μέρει. Ωστόσο, ο ετεροαρωματικός χαρακτήρας της ένωσης μπορεί να ενεργοποιηθεί, με την προσθήκη λειτουργικής ομάδας που περιέχει δότη ηλεκτρονίων. Οι συνηθισμένες αλκυλιώσεις και ακυλιώσεις κατά Friedel–Crafts, συνήθως αποτυγχάνουν στην πυριδίνη, γιατί τείνουν να οδηγήσουν μὀνο σε προσθήκη τους στο άτομο του αζώτου. Αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις (όταν συμβαίνουν) εμφανίζονται συνήθως στη #3- (μετα-) θέση, που είναι αντιστοιχεί στα σχετικά ηλεκτρονιακά πλουσιότερα άτομα άνθρακα του πυριδινικού δακτυλίου, οπότε είναι σχετικά πιο επιρρεπής σε μια αρωματική ηλεκτρονιόφιλη υποκατάσταση:




Οι αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις στην #2- (ορθο-) ή #4- (παρα-) θέσεις οδηγούν σε ενεργειακά δυσμενή σ- σύμπλοκα. Μπορούν, ωστόσο, να προωθηθούν κι αυτές, χρησιμοποιώντας πειραματικές τεχνικές, όπως η διεξαγωγή αρωματικής ηλεκτρονιόφιλης υποκατάστασεις όχι απευθείας στην πυριδίνη, αλλά σε N-οξυπυριδίνη, με επακόλουθη αποξυγόνωση του ατόμου του αζώτου. Η (προσωρινή έστω) προσθήκη οξυγόνου μειώνει την ηλεκτρονιακή πυκνότητα στο άτομο του αζώτου, ευνοώντας έτσι την αρωματική ηλεκτρονιόφιλη υποκατάσταση στα άτομα άνθρακα #2 και #4. Το άτομο του οξυγόνου μπορεί να αφαιρεθεί, στη συνέχεια, μέσω διαφόρων αντιδραστικών οδών, με συνηθέστερες τη χρήση ενώσεων του PIII ή του SII, οι οποίες εύκολα οξειδώνονται, εις βάρος του N. Η τριφαινυλοφωσφίνη (PPh3) χρησιμοποιείται συχνά ως τέτοιο αντιδραστήριο, που αφαιρεί το οξυγόνο από το άζωτο και οξειδώνεται η ίδια σε τριφαινυλοφωσφινοξείδιο (POPh3). Οι ακόλουθες παράγραφοι περιγράγουν παραδείγματα που εκπροσωπούν αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις στην πυριδίνη:
Νίτρωση
Η άμεση νίτρωση της πυριδίνης απαιτεί σκληρές συνθήκες και έχει πολύ χαμηλές αποδόσεις. Η 3-νιτροπυριδίνη μπορεί να ληφθεί με την επίδραση στην πυριδίνη με πεντοξείδιο του αζώτου (N2O5), παρουσία μεταλλικού νατρίου.[80][81][82] Οι «θυγατρικές» πυριδίνες στις οποίες το άτομο του αζώτου περιβάλλεται στερεοχημικά, μπορεί να ληφθεί νίτρωσή τους με επίδραση τετραφθοριούχου νιτρώνιου (NO2BF4). Επίσης, η 3-νιτροπυριδίνη μπορεί να ληφθεί μέσω της σύνθεσης 2,6-διβρωμοπυριδίνης, νίτρωσης της τελευταίας και αφαίρεσης των ατόμων βρωμίου από την ενδιάμεσα σχηματιζόμενη 2,6-διβρωμο-3-νιτροπυριδίνη. [83][84]
Σουλφούρωση
Η απευθείας σουλφούρωση πυριδίνης είναι ακόμη πιο δύσκολα πραγματοποιήσιμη από την άμεση νίτρωση. Ωστόσο, το 3-πυριδινοσουλφονικό οξύ μπορεί να ληφθεί με αποδεκτή απόδοση με περίσσεια (πυκνού) θειικού οξέος θερμοκρασίας 320 °C σε βραστή πυριδίνη.[85] Η αντίδραση πυριδίνης με τριοξείδιο του θείου (SO3) διευκολύνεται με την (προσωρινή έστω) προσθήκη θείου στο άτομο του αζώτου, ειδικότερα δε με την παρουσία θειικού υδραργύρου (HgSO4), ως καταλύτη.[86]
Αλογόνωση
Σε αντίθεση τόσο με τη νίτρωση, όσο και με τη σουλφούρωση, η άμεση βρωμίωση και η άμεση χλωρίωση προχωρεί καλά. Με αντίδραση πυριδίνης με διβρώμιο (Br2) σε θεικό οξύ, στους 130 °C εύκολα παράγεται 3-βρωμοπυριδίνη. Η απόδοση είναι χαμηλότερη για την παραγωγή 3-χλωροπυριδίνης, κατά τη χλωρίωση πυριδίνης με διχλώριο (Cl2), παρουσία χλωριούχου αργιλίου (AlCl3), στους 00 °C. Και οι δυο 2-αλοπυριδίνες (2-βρωμοπυριδίνη και 2-χλωροπυριδίνη) μπορούν να παραχθούν και με άμεση επίδραση του αντίστοιχου αλογόνου σε πυριδίνη, παρουσία διχλωριοχου παλλαδίου (PdCl2), ως καταλύτη.[87]
Πυρηνόφιλη αντικαταστάσεις
Σε αντίθεση με το βενζόλιο, πυριδίνη αποτελεσματικά υποστηρίζει διάφορες πυρηνόφιλη αντικατάσταση. Ο λόγος για αυτό είναι σχετικά χαμηλότερη πυκνότητα ηλεκτρονίων από τα άτομα του άνθρακα του δακτυλίου. Αυτές οι αντιδράσεις περιλαμβάνουν αντικαταστάσεις με την αποβολή του υδριδίου ιονική και την αποβολή-προσθήκες με το σχηματισμό ενός ενδιάμεσου aryne διαμόρφωση, και συνήθως να προχωρήσει στην 2 - ή 4-θέση.[88]



Πολλές πυρηνόφιλη αντικατάσταση εμφανίζονται πιο εύκολα, όχι με γυμνά πυριδίνη, αλλά με πυριδίνη τροποποιηθεί με βρώμιο, χλώριο, φθόριο, ή σουλφονικό οξύ θραύσματα που, στη συνέχεια, να γίνει ένας φεύγει από την ομάδα. Έτσι, το φθόριο είναι το καλύτερο, αφήνοντας την ομάδα για την υποκατάσταση με organolithium ενώσεις. Η πυρηνόφιλη προσβολή ενώσεις μπορεί να alkoxides, thiolates, αμίνες, και αμμωνίας (υψηλές πιέσεις).[89]
Σε γενικές γραμμές, το ιόν υδριδίου είναι μια φτωχή αφήνοντας την ομάδα και παρουσιάζεται μόνο σε λίγες ετεροκυκλικές αντιδράσεις. Περιλαμβάνουν την Chichibabin αντίδραση, η οποία αποδίδει pyridine τα παράγωγα aminated στην 2-θέση. Εδώ, αμίδιο του νατρίου χρησιμοποιείται ως nucleophile απόδοσης 2-aminopyridine. Το ιόν υδριδίου που απελευθερώνεται σε αυτήν την αντίδραση συνδυάζει με ένα πρωτόνιο από ένα διαθέσιμο αμινο ομάδα, σχηματίζοντας ένα μόριο υδρογόνου.[90]
Ανάλογη με το βενζόλιο, πυρηνόφιλη αντικαταστάσεις σε πυριδίνη μπορεί να οδηγήσει στο σχηματισμό των pyridyne τα ενδιάμεσα προϊόντα, όπως ετεροaryne. Για το σκοπό αυτό, pyridine τα παράγωγα μπορούν να εξαλειφθούν με την καλή αφήνοντας ομάδες με ισχυρές βάσεις, όπως το νάτριο και το κάλιο tert-butoxide. Η μετέπειτα προσθήκη nucleophile να το τριπλό δεσμό έχει χαμηλή επιλεκτικότητα, και το αποτέλεσμα είναι ένα μείγμα των δύο πιθανές προσμίξεις.
Ριζοσπαστικές αντιδράσεις
Πυριδίνη υποστηρίζει μια σειρά από ριζοσπαστικές αντιδράσεις, η οποία χρησιμοποιείται στο διμερισμό να bipyridines. Ριζική διμερισμό της πυριδίνης με στοιχειώδη νατρίου ή νικέλιο Raney επιλεκτικά αποδόσεις 4,4'-bipyridine,[91] ή 2,2'-bipyridine,[92] , το οποίο είναι σημαντικό πρόδρομο αντιδραστήρια στη χημική βιομηχανία. Το όνομα αντιδράσεις που αφορούν τις ελεύθερες ρίζες είναι το Minisci αντίδραση. Μπορεί να παράγει 2-tert-butylpyridine μετά την αντίδραση της πυριδίνης με pivalic οξύ, νιτρικό άργυρο και αμμωνίου σε θειικό οξύ με απόδοση 97%.[93]
Αντιδράσεις σχετικά με το άτομο αζώτου

Lewis οξέα εύκολα να προσθέσετε στο άτομο αζώτου της πυριδίνης, σχηματίζοντας pyridinium άλατα. Η αντίδραση με αλκυλο τα αλογονίδια οδηγεί σε αλκυλίωση του το άτομο αζώτου. Αυτό δημιουργεί ένα θετικό φορτίο στο δαχτυλίδι που αυξάνει τη δραστικότητα της πυριδίνης τόσο οξείδωση και η αναγωγή. Το Zincke αντίδραση χρησιμοποιείται για την επιλεκτική εισαγωγή των ριζών σε pyridinium ενώσεις (δεν έχει καμία σχέση με το χημικό στοιχείο ψευδάργυρος).
Υδρογόνωση και μείωση

Υδρογόνου-κορεσμένα πιπεριδινο επιτυγχάνεται μέσω της αντίδρασης με αέριο υδρογόνο παρουσία νικελίου Raney.[94] Αυτή η αντίδραση απελευθερώνει 193.8 kJ·mol-1 ενέργειας,[95] η οποία είναι ελαφρώς μικρότερη από την ενέργεια του υδρογόνωση του βενζολίου (205.3 kJ·mol-1).
Μερικώς υδρογονωμένα παράγωγα που λαμβάνονται κάτω από ηπιότερες συνθήκες. Για παράδειγμα, η μείωση με λίθιο αλουμινίου υδριδίου αποδόσεις μείγμα 1,4-διυδροπυριδινο, 1,2-διυδροπυριδινο, και 2,5-διυδροπυριδινο.[96] Επιλεκτική σύνθεση του 1,4-διυδροπυριδινο επιτυγχάνεται με την παρουσία του οργανομεταλλικά σύμπλοκα του μαγνησίου και ψευδάργυρου,[97] και (Δ3,4)-τετραϋδροπυριδίνη λαμβάνεται από την ηλεκτροχημική μείωση της πυριδίνης.[98]
Εφαρμογές

Πυριδίνης είναι μια σημαντική πρώτη ύλη στη χημική βιομηχανία, το 1989 παραγωγή 26.000 τόνους σε όλο τον κόσμο. από τις μεγαλύτερες 25 μονάδες παραγωγής για πυριδίνη, έντεκα βρίσκονται στην Ευρώπη (από το 1999). Οι μεγάλοι παραγωγοί της πυριδίνης περιλαμβάνουν Evonik Industries, Rütgers Χημικές ουσίες, Imperial Chemical Industries, και Koei Χημικών. Πυριδίνη παραγωγής έχει αυξηθεί σημαντικά κατά τις αρχές της δεκαετίας του 2000, με ετήσια παραγωγική δυναμικότητα 30.000 τόνων στην ηπειρωτική Κίνα.[99] ΗΠΑ–Κινεζική κοινή επιχείρηση Vertellus είναι σήμερα ο παγκόσμιος ηγέτης σε πυριδίνη παραγωγής.[100]
Τα φυτοφάρμακα
Η κύρια χρήση της πυριδίνης που είναι ένας πρόδρομος για τα ζιζανιοκτόνα paraquat και diquat. Η πρώτη σύνθεση βήμα εντομοκτόνο ουσία chlorpyrifos αποτελείται από την χλωρίωση της πυριδίνης. Πυριδίνης είναι επίσης το αρχικό υλικό για την προετοιμασία των pyrithioneπου βασίζεται σε μυκητοκτόνα. Cetylpyridinium και laurylpyridinium, το οποίο μπορεί να παραχθεί από την πυριδίνη με Zincke αντίδραση, χρησιμοποιείται ως αντισηπτικό σε από του στόματος και οδοντιατρική περίθαλψη προϊόντα. Πυριδίνης που είναι εύκολα επίθεση από αλκυλιωτικούς παράγοντες να δώσουν N-alkylpyridinium άλατα. Ένα παράδειγμα είναι το χλωριούχο κετυλπυριδίνιο.

Διαλύτη
Πυριδίνη χρησιμοποιείται ως μια πολική, βασικό, χαμηλό-αντιδραστική διαλύτη, για παράδειγμα, σε Knoevenagel συμπυκνώσεις. είναι ιδιαίτερα κατάλληλο για την dehalogenation, όπου δρα ως βάση της την εξάλειψη αντίδραση και ομόλογα το αποτέλεσμα αλογονιδίων του υδρογόνου για να σχηματίσουν ένα pyridinium αλάτι. Σε esterifications και acylations, πυριδίνη ενεργοποιεί το καρβοξυλικό οξύ αλογονίδια ή ανυδρίτες. Ακόμη πιο ενεργά σε αυτές τις αντιδράσεις είναι το pyridine τα παράγωγα 4-dimethylaminopyridine (DMAP) και 4-(1-πυρρολιδινυλο) πυριδίνη. Πυριδίνης είναι, επίσης, χρησιμοποιείται ως βάση σε συμπύκνωση αντιδράσεις.[102]

Πυριδίνης που χρησιμοποιείται ως διαλύτης για την παρασκευή των βαφών και το λάστιχο.[103] είναι, επίσης, χρησιμοποιείται στη βιομηχανία κλωστοϋφαντουργίας για τη βελτίωση της χωρητικότητας του δικτύου, από βαμβάκι. Πυριδίνη προστίθεται αιθανόλη για να το καταστήσει ακατάλληλο για πόσιμο. Σε χαμηλές δόσεις, πυριδίνη, προστίθενται στα τρόφιμα για να τους δώσει μια πικρή γεύση, και τέτοια χρήση έχει εγκριθεί από την αμερικανική υπηρεσία Τροφίμων και Φαρμάκων. Το όριο ανίχνευσης για πυριδίνης σε λύσεις είναι περίπου 1-3 mmol·L-1 (79-237 mg·L-1).[104] Ως βάση, πυριδίνη μπορεί να χρησιμοποιηθεί ως Karl Fischer αντιδραστήριο, αλλά είναι συνήθως αντικατασταθεί από εναλλακτικές με μια πιο ευχάριστη μυρωδιά, όπως imidazole.[105]
Πρόδρομος πιπεριδινο
Πιπεριδινο, ένα θεμελιώδες αζώτου heterocycle, είναι σημαντικό συνθετικό κτίριο-μπλοκ. Piperidines παράγονται από την υδρογόνωση της πυριδίνης με το νικέλιο, το κοβάλτιοή το ρουθήνιο-based καταλυτών σε υψηλές θερμοκρασίες.[106]
Ειδικότητα αντιδραστήρια με βάση πυριδίνης
Pyridinium chlorochromate αναπτύχθηκε από Ελίας Τζέιμς Κόρεϊ και William Σαγκς, το 1975, και χρησιμοποιείται για να οξειδώνει πρωτογενείς αλκοόλες για να αλδεΰδες και δευτεροβάθμιας αλκοόλες σε κετόνες.[107] παράγεται με την προσθήκη της πυριδίνης σε διάλυμα χρωμικού οξέος και πυκνού υδροχλωρικού οξέος:
- C5H5N + HCl + Κρο3 → [C5H5NH][CrO3Cl]
Η καρκινογένεση από την πλευρά του-προϊόν chromyl χλωρίδιο (CrO2Cl2) καλούνται να ψάξουν για εναλλακτικές διαδρομές, όπως η επεξεργασία χρωμίου(VI) οξείδιο με pyridinium χλωριδίου:[108]
- [C5H5NH+]Cl− + Κρο3 → [C5H5NH][CrO3Cl]
Το Cornforth αντιδραστηρίου (pyridinium διχρωμικό, PDC),[109] pyridinium chlorochromate (PCC), ο Κόλινς αντιδραστηρίου (συγκρότημα χρώμιο(VI) οξείδιο με πυριδίνης σε διχλωρομεθάνιο)[110][111] και το Sarret αντιδραστηρίου (συγκρότημα χρώμιο(VI) οξείδιο με πυριδίνης σε πυριδίνη) είναι παρόμοια χρώμιο βασίζεται πυριδίνης ενώσεις, οι οποίες είναι, επίσης, χρησιμοποιείται για την οξείδωση, δηλαδή μετατροπή της πρωτοβάθμιας και δευτεροβάθμιας αλκοολών, κετονών. Ο Collins και Sarret αντιδραστήρια είναι τόσο δύσκολο και επικίνδυνο για την προετοιμασία, είναι υγροσκοπικό και μπορεί να διεγείρει κατά τη διάρκεια της προετοιμασίας. Για το λόγο αυτό, η χρήση της PCC και PDC προτιμάται. Τα αντιδραστήρια ήταν αρκετά δημοφιλής στη δεκαετία του 1970 και του 1980, αλλά λόγω της τοξικότητας και επιβεβαιωμένο καρκινογόνο κατάσταση, σπάνια χρησιμοποιείται σήμερα.[112]

Ligand και Lewis βάση

Πυριδίνη χρησιμοποιείται ευρέως ως ligand σε συντονισμό χημεία, όπως είναι τα παράγωγα 2,2'-bipyridine, που αποτελείται από δύο πυριδίνης μόρια ενώνονται με έναν απλό δεσμό, και terpyridine, ένα μόριο τρεις πυριδίνης δαχτυλίδια συνδέονται μεταξύ τους.
Όταν ένα πυριδίνης ligand είναι μέρος του metal συγκρότημα, μπορεί εύκολα να αντικατασταθεί από μια ισχυρότερη Lewis βάση. Αυτό το κατάλυμα, αξιοποιείται στην κατάλυση του πολυμερισμού[113][114] και υδρογόνωση αντιδράσεις, χρησιμοποιώντας, για παράδειγμα, Crabtree είναι καταλύτης.[115] Η πυριδίνη ligand αντικατασταθεί κατά την διάρκεια της αντίδρασης αποκατασταθεί μετά την ολοκλήρωσή της.
Χρήσιμο σύμπλοκα πυριδίνης περιλαμβάνουν πυριδινο-borane, C5H5κεντρικής τράπεζας3 (σημείο τήξης 10-11 °C), ένα ήπιο αναγωγικό μέσο με βελτιωμένη σταθερότητα σε σχέση με NaBH4 στην πρωτική διαλύτες και βελτιωμένη διαλυτότητα στο απρωτικό οργανικούς διαλύτες. Πυριδινο-τριοξείδιο του θείου, C5H5NSO3 (σημείο τήξης 175 °C) θειική μορφή παράγοντας που χρησιμοποιείται για τη μετατροπή αλκοολών, θειικά άλατα, τα οποία με τη σειρά υποβάλλονται σε C–O μποντ κατάτμησης μετά από μείωση με υδριδίου παράγοντες.
Κίνδυνοι
Η πυριδίνη έχει ένα σημείο ανάφλεξης (η χαμηλότερη θερμοκρασία στην οποία μπορεί να ατμοποιήσει για να σχηματίσουν μια εύφλεκτη μείγμα στον αέρα), μόνο το 17 °C και, επομένως, είναι εξαιρετικά εύφλεκτο. Η θερμοκρασία ανάφλεξης είναι 550 °C, και τα μείγματα των 1.7–10.6 vol% πυριδίνης με τον αέρα είναι εκρηκτικά. Η θερμική τροποποίηση της πυριδίνης που ξεκινά πάνω από 490 °C, με αποτέλεσμα bipyridine (κυρίως 2,2'-bipyridine και, σε μικρότερο βαθμό, 2,3'-bipyridine και 2,4'-bipyridine), τα οξείδια του αζώτουκαι μονοξείδιο του άνθρακα.[116] Πυριδίνη εύκολα διαλύεται στο νερό και δεν βλάπτει τόσο τα ζώα όσο και τα φυτά σε υδατικά συστήματα.[117] Η επιτρεπόμενη μέγιστη επιτρεπόμενη συγκέντρωση της πυριδίνης ήταν 15-30 μέρη ανά εκατομμύριο (ppm ή 15-30 mg·m-3 στον αέρα) στις περισσότερες χώρες κατά τη δεκαετία του 1990, αλλά μειώθηκε σε 5 ppm στη δεκαετία του 2000.[118] Για σύγκριση, του εσωτερικού αέρα μολυσμένο με καπνό του τσιγάρου μπορεί να περιέχει μέχρι και 16 μg·m-3 πυριδίνης, και ένα τσιγάρο περιέχει 21-32 µg.
Θέματα υγείας

Πυριδίνης που είναι επιβλαβές σε περίπτωση εισπνεόμενα, καταπινόμενα ή απορροφούμενα μέσω του δέρματος.[119] Επιδράσεις της οξείας πυριδίνης δηλητηρίασης περιλαμβάνουν ζάλη, πονοκέφαλο, έλλειψη συντονισμού, ναυτία, σιελόρροια, και απώλεια της όρεξης. Μπορεί να εξελιχθεί σε κοιλιακός πόνος, πνευμονική συμφόρηση και απώλεια των αισθήσεων. Ένα άτομο πέθανε μετά από τυχαία κατάποση μισό φλιτζάνι πυριδίνης.[120] Η χαμηλότερη γνωστό θανατηφόρος δόση (LDLo) για την κατάποση πυριδίνης στον άνθρωπο είναι 500 mg·kg-1. Σε υψηλές δόσεις, πυριδίνη έχει ναρκωτική δράση και ατμός συγκεντρώσεις πάνω από 3600 ppm αποτελούν κίνδυνο για την υγεία. Η από του στόματος LD50 σε αρουραίους είναι 891 mg·kg-1. Πυριδίνης είναι εύφλεκτο.
Αξιολογήσεις ως πιθανό καρκινογόνο παράγοντα έδειξε ότι υπάρχουν ανεπαρκή στοιχεία στους ανθρώπους για την καρκινογένεση των πυριδίνη, αν και υπάρχουν περιορισμένες ενδείξεις καρκινογόνου επιπτώσεις στα ζώα. τα Διαθέσιμα δεδομένα δείχνουν ότι η "έκθεση σε πυριδίνη στο πόσιμο νερό οδήγησε σε μείωση της κινητικότητας του σπέρματος σε όλα τα επίπεδα δόσης σε ποντικούς και την αύξηση του κύκλου του οίστρου μήκος στο υψηλότερο επίπεδο δόσης σε αρουραίους".[121]
Πυριδίνη μπορεί επίσης να έχουν μικρές νευροτοξικές, γονιδιοτοξικές, και κλαστογόνου αποτελέσματα. Έκθεση σε πυριδίνη θα έπρεπε κανονικά να οδηγήσει σε εισπνοή και απορρόφηση μέσα στους πνεύμονες και το γαστρεντερικό σωλήνα, όπου είτε παραμένει αμετάβλητη ή είναι μεταβολίζεται. Τα σημαντικότερα προϊόντα της πυριδίνης μεταβολισμό είναι N-methylpyridiniumhydroxide, που σχηματίζονται με N-μεθυλτρανσφεράσες (π. χ., πυριδίνη N-methyltransferase), καθώς και πυριδίνη N-οξείδιο, 2-, 3-και 4-υδροξυπυριδίνη, που δημιουργούνται από τη δράση των monooxygenase. Στον άνθρωπο, πυριδίνη μεταβολίζεται μόνο σε N-methylpyridiniumhydroxide.[122] Πυριδίνης που είναι άμεσα υποβαθμισμένη από βακτήρια σε αμμωνία και διοξείδιο του άνθρακα.[123] Η μη υποκατεστημένη πυριδίνης δαχτυλίδι διασπάται πιο γρήγορα από ό, πικολινικό, lutidine, chloropyridine, ή aminopyridines,[124] και μια σειρά από πυριδίνη degraders έχουν αποδειχθεί για να υπερπαράγει ριβοφλαβίνη , παρουσία πυριδίνης.[125] Ionizable N-ετεροκυκλικές ενώσεις, συμπεριλαμβανομένων της πυριδίνης, αλληλεπιδρούν με τις περιβαλλοντικές επιφάνειες (όπως τα εδάφη και ιζήματα), μέσω πολλαπλών pH εξαρτώνται από μηχανισμούς, συμπεριλαμβανομένης της διαμέρισης να οργανική ύλη του εδάφους, ανταλλαγής κατιόντων, και επιφάνεια συμπλοκοποίησης.[126] Όπως προσρόφηση σε επιφάνειες μειώνει την βιοδιαθεσιμότητα των πυριδινών για μικροβιακή degraders και άλλων οργανισμών, με αποτέλεσμα την επιβράδυνση της αποδόμησης τιμές και μειώνοντας την οικοτοξικότητα.[127]
Μικρές ποσότητες της πυριδίνης που απελευθερώνονται στο περιβάλλον από ορισμένες βιομηχανικές διαδικασίες όπως η κατασκευή χάλυβα,[128] επεξεργασία του πετρελαίου σχιστόλιθου, αεριοποίηση άνθρακα, οπτάνθρακα φυτά και φλογοβόλα. Η ατμόσφαιρα στο πετρέλαιο σχιστόλιθου μονάδες επεξεργασίας μπορεί να περιέχει πυριδίνης συγκεντρώσεις έως και 13 μg·m-3,[129] και 53 μg·m-3 επίπεδα μετρήθηκαν στα υπόγεια ύδατα, στην περιοχή της αεριοποίησης του άνθρακα των φυτών.[130] Σύμφωνα με μια μελέτη από το Εθνικό Ινστιτούτο για την Επαγγελματική Ασφάλεια και Υγεία, περίπου 43.000 Αμερικανοί εργασία σε επαφή με πυριδίνη.[131]
Δείτε επίσης
- 6-μελή αρωματικούς δακτυλίους με ένα άνθρακα αντικατασταθεί από μια άλλη ομάδα: borabenzene, βενζόλιο, silabenzene, germabenzene, stannabenzene, η φωσφορίνη, arsabenzene, pyrylium αλάτι
- 6-μελείς δακτύλιοι με δύο άτομα αζώτου: diazines
- 6-μελή δαχτυλίδια με τρία άτομα αζώτου: τριαζίνες
- 6-μελή δαχτυλίδια με τέσσερα άτομα αζώτου: tetrazines
- 6-μελή δαχτυλίδια με πέντε άτομα αζώτου: pentazine
- 6-μελή δαχτυλίδια με έξι άτομα αζώτου: hexazine
Σημειώσεις και αναφορές
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 141. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ↑ Προτεινόμενη από IUAPAC εμπειρικήονομασία
- ↑ Συστηματική ονομασία
- ↑ Ονομασία αντικατάστασης
- ↑ Για το συζυγές οξύ, δηλαδή το πυριδινώνιο (PyH+)
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ «Iodine Solution (0.02 M in THF/pyridine/H2O 70:20:10)». Sigma-Aldrich. Ανακτήθηκε στις 28 Νοεμβρίου 2011.
- ↑ «Pyridine». Encyclopædia Britannica Online.
- ↑ Powell, W. H. (1983). «Revision of the extended Hantzsch-Widman system of nomenclature for hetero mono-cycles». Pure and Applied Chemistry 55 (2): 409–416. doi:. http://www.iupac.org/publications/pac/1983/pdf/5502x0409.pdf.
- ↑ Hellwinkel, D. (1998). Die systematische Nomenklatur der Organischen Chemie (4th έκδοση). Berlin: Springer. σελ. 45. ISBN 3-540-63221-2.
- ↑ Weissberger, A.· Klingberg, A. (1960). Pyridine and its Derivatives. 1. New York: Interscience.
- ↑ Anderson, T. (1849).
- ↑ Anderson, T. (1849). «Producte der trocknen Destillation thierischer Materien [Products of the dry distillation of animal matter]». Annalen der Chemie und Pharmacie 70: 32. doi:.
- ↑ Anderson, T. (1851). «Ueber die Producte der trocknen Destillation thierischer Materien [On the products of dry distillation of animal matter]». Annalen der Chemie und Pharmacie 80: 44. doi:.
- ↑ Körner, W. (1869).
- ↑ Dewar, J. (1871).
- ↑ Rocke, Alan J. (1988). «Koerner, Dewar and the Structure of Pyridine». Bulletin for the History of Chemistry 2: 4. http://www.scs.illinois.edu/~mainzv/HIST/bulletin_open_access/bull88-num2.php.
- ↑ Ladenburg, Albert. Lectures on the history of the development of chemistry since the time of Lavoisier. (PDF). σελίδες 283–287.
- ↑ Bansal, Raj K. (1999). Heterocyclic Chemistry. σελ. 216. ISBN 81-224-1212-2.
- ↑ «A. Henninger, aus Paris. 12. April 1877». Berichte der deutschen chemischen Gesellschaft 10: 727. 1877. doi:.
- ↑ Chichibabin, A. E. (1924). «Über Kondensation der Aldehyde mit Ammoniak zu Pyridinebasen [On condensation of aldehydes with ammonia to make pyridines]». Journal für Praktische Chemie 107: 122. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k90877m/f132.chemindefer.
- ↑ Burdock, G. A., επιμ. (1995). Fenaroli's Handbook of Flavor Ingredients. 2 (3rd έκδοση). Boca Raton: CRC Press. ISBN 0-8493-2710-5.
- ↑ Täufel, A.· Ternes, W. (2005). Lebensmittel-Lexikon (4th έκδοση). Behr. σελ. 450. ISBN 3-89947-165-2.
- ↑ Tang, Jian; Jin, Qi Zhang; Shen, Guo Hui; Ho, Chi Tang; Chang, Stephen S. (1983). «Isolation and identification of volatile compounds from fried chicken». Journal of Agricultural and Food Chemistry 31 (6): 1287. doi:.
- ↑ Shibamoto, Takayuki; Kamiya, Yoko; Mihara, Satoru (1981). «Isolation and identification of volatile compounds in cooked meat: sukiyaki». Journal of Agricultural and Food Chemistry 29: 57. doi:.
- ↑ Aeschbacher, HU; Wolleb, U; Löliger, J; Spadone, JC; Liardon, R (1989). «Contribution of coffee aroma constituents to the mutagenicity of coffee». Food and Chemical Toxicology 27 (4): 227–232. doi:. PMID 2659457.
- ↑ Buttery, Ron G.; Seifert, Richard M.; Guadagni, Dante G.; Ling, Louisa C. (1971). «Characterization of Volatile Pyrazine and Pyridine Components of Potato Chips». Journal of Agricultural and Food Chemistry (Washington, DC: ACS) 19 (5): 969–971. doi:.
- ↑ Ho, Chi Tang; Lee, Ken N.; Jin, Qi Zhang (1983). «Isolation and identification of volatile flavor compounds in fried bacon». Journal of Agricultural and Food Chemistry 31 (2): 336. doi:.
- ↑ Dumont, Jean Pierre; Adda, Jacques (1978). «Occurrence of sesquiterpene in mountain cheese volatiles». Journal of Agricultural and Food Chemistry 26 (2): 364. doi:.
- ↑ Labows, John N., Jr.· Warren, Craig B., (1981). «Odorants as Chemical Messengers». Στο: Moskowitz, Howard R. Odor Quality and Chemical Structure. Washington, DC: American Chemical Society. σελίδες 195–210. ISBN 9780841206076.
- ↑ Vitzthum, Otto G.; Werkhoff, Peter; Hubert, Peter (1975). «New volatile constituents of black tea flavor». Journal of Agricultural and Food Chemistry 23 (5): 999. doi:.
- ↑ Kostelc, J. G.; Preti, G.; Nelson, P. R.; Brauner, L.; Baehni, P. (1984). «Oral Odors in Early Experimental Gingivitis». Journal of Periodontology Research 19 (3): 303–312. doi:. PMID 6235346.
- ↑ Täufel, A.· Ternes, W. (2005). Lebensmittel-Lexikon (4th έκδοση). Behr. σελ. 226. ISBN 3-89947-165-2.
- ↑ Curvall, Margareta; Enzell, Curt R.; Pettersson, Bertil (1984). «An evaluation of the utility of four in vitro short term tests for predicting the cytotoxicity of individual compounds derived from tobacco smoke». Cell Biology and Toxicology 1 (1): 173–193. doi:. PMID 6400922.
- ↑ Schmeltz, Irwin; Hoffmann, Dietrich (1977). «Nitrogen-containing compounds in tobacco and tobacco smoke». Chemical Reviews 77 (3): 295. doi:.
- ↑ Gossauer, A. (2006). Struktur und Reaktivität der Biomoleküle. Weinheim: Wiley-VCH. σελ. 488. ISBN 3-906390-29-2.
- ↑ Πρότυπο:Ullmann
- ↑ Frank, R. L.; Seven, R. P. (1949). «Pyridines. IV. A Study of the Chichibabin Synthesis». Journal of the American Chemical Society 71 (8): 2629–2635. doi:.
- ↑ Πρότυπο:Ullmann
- ↑ Frank, R. L.; Seven, R. P. (1949). «Pyridines. IV. A Study of the Chichibabin Synthesis». Journal of the American Chemical Society 71 (8): 2629–2635. doi:.
- ↑ DE patent 1917037, ICI, issued 1968DE patent 1917037, ICI, issued 1968
- ↑ JP patent 7039545, Nippon Kayaku, issued 1967JP patent 7039545, Nippon Kayaku, issued 1967
- ↑ BE patent 758201, Koei Chemicals, issued 1969BE patent 758201, Koei Chemicals, issued 1969
- ↑ Mensch, F. (1969).
- ↑ Πρότυπο:Ullmann
- ↑ Hantzsch, A. (1881). «Condensationsprodukte aus Aldehydammoniak und ketonartigen Verbindungen [Condensation products from aldehyde ammonia and ketone-type compounds]». Berichte der deutschen chemischen Gesellschaft 14 (2): 1637. doi:.
- ↑ Knoevenagel, E.; Fries, A. (1898). «Synthesen in der Pyridinreihe. Ueber eine Erweiterung der Hantzsch'schen Dihydropyridinsynthese [Syntheses in the pyridine series. On an extension of the Hantzsch dihydropyridine synthesis]». Berichte der deutschen chemischen Gesellschaft 31: 761. doi:.
- ↑ Behr, A. (2008). Angewandte homogene Katalyse. Weinheim: Wiley-VCH. σελ. 722. ISBN 3-527-31666-3.
- ↑ Kroehnke, Fritz (1976). «The Specific Synthesis of Pyridines and Oligopyridines». Synthesis 1976 (1): 1–24. doi:..
- ↑ Skell, P. S.; Sandler, R. S. (1958). «Reactions of 1,1-Dihalocyclopropanes with Electrophilic Reagents. Synthetic Route for Inserting a Carbon Atom Between the Atoms of a Double Bond». Journal of the American Chemical Society 80 (8): 2024. doi:.
- ↑ Jones, R. L.; Rees, C. W. (1969). «Mechanism of heterocyclic ring expansions. Part III. Reaction of pyrroles with dichlorocarbene». Journal of the Chemical Society C: Organic (18): 2249. doi:.
- ↑ Gambacorta, A.; Nicoletti, R.; Cerrini, S.; Fedeli, W.; Gavuzzo, E. (1978). «Trapping and structure determination of an intermediate in the reaction between 2-methyl-5-t-butylpyrrole and dichlorocarbene». Tetrahedron Letters 19 (27): 2439. doi:.
- ↑ Gattermann, L.; Skita, A. (1916). «Eine Synthese von Pyridin-Derivaten». Chemische Berichte 49 (1): 494–501. doi:.
- ↑ «Gattermann–Skita». Institute of Chemistry, Skopje. Αρχειοθετήθηκε από το πρωτότυπο στις 16 Ιουνίου 2006.
- ↑ Tarr, J. B.; Arditti, J. (1982). «Niacin Biosynthesis in Seedlings of Zea mays». Plant Physiology 69 (3): 553–556. doi:. PMID 16662247.
- ↑ Joule, p. 7
- ↑ Lide, p. 3-448
- ↑ RÖMPP Online – Version 3.5. Stuttgart: Georg Thieme. 2009.
- ↑ Lide, p. 3-673
- ↑ Lide, p. 5-28
- ↑ Lide, p. 6-211
- ↑ Lide, p. 6-221
- ↑ Majer, V.· Svoboda, V. (1985). Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Oxford: Blackwell Scientific Publications. ISBN 0-632-01529-2.
- ↑ Domalski, Eugene S.; Hearing, Elizabeth D. (1996). «Heat Capacities and Entropies of Organic Compounds in the Condensed Phase». Journal of Physical and Chemical Reference Data 25: 1. doi:. Bibcode: 1996JPCRD..25....1D.
- ↑ Cox, E. (1958). «Crystal Structure of Benzene». Reviews of Modern Physics 30: 159. doi:. Bibcode: 1958RvMP...30..159C.
- ↑ Mootz, D. (1981). «Crystal structures of pyridine and pyridine trihydrate». The Journal of Chemical Physics 75 (3): 1517. doi:. Bibcode: 1981JChPh..75.1517M.
- ↑ Lide, p. 6-67
- ↑ McCullough, J. P.; Douslin, D. R.; Messerly, J. F.; Hossenlopp, I. A.; Kincheloe, T. C.; Waddington, Guy (1957). «Pyridine: Experimental and Calculated Chemical Thermodynamic Properties between 0 and 1500 °K.; a Revised Vibrational Assignment». Journal of the American Chemical Society 79 (16): 4289. doi:.
- ↑ Joule, p. 14
- ↑ Joule, p. 16
- ↑ «Pyridine» (PDF). IARC Monographs 77. Washington DC: OSHA. 1985.
- ↑ «Pyridine hydrochloride MSDS» (PDF). Alfa Aesar. Ανακτήθηκε στις 26 Ιουνίου 2010.
- ↑ Milcent, R.· Chau, F. (2002). Chimie organique hétérocyclique: Structures fondamentales. EDP Sciences. σελίδες 241–282. ISBN 2-86883-583-X.
- ↑ Krygowski, T. M.; Szatyowicz, H.; Zachara, J. E. (2005). «How H-bonding Modifies Molecular Structure and π-Electron Delocalization in the Ring of Pyridine/Pyridinium Derivatives Involved in H-Bond Complexation». J. Org. Chem. 70 (22): 8859–8865. doi:. PMID 16238319.
- ↑ «IUPAC SC-Database: A comprehensive database of published data on equilibrium constants of metal complexes and ligands».
- ↑ Nakamoto, K. (1997). Infrared and Raman spectra of Inorganic and Coordination compounds. Part A (5th έκδοση). Wiley. ISBN 0-471-16394-5.
- ↑ Nakamoto, K. Infrared and Raman spectra of Inorganic and Coordination compounds. Part B (5th έκδοση). σελ. 24. ISBN 0-471-16392-9.
- ↑ Πρότυπο:VogelQuantitative6th
- ↑ Elschenbroich, C. (2008). Organometallchemie (6th έκδοση). Vieweg & Teubner. σελίδες 524–525. ISBN 3-8351-0167-6.
- ↑ Joule, p. 129
- ↑ Bakke, Jan M.; Hegbom, Ingrid; Verne, Hans Peter; Weidlein, Johann; Schnöckel, Hansgeorg; Paulsen, Gudrun B.; Nielsen, Ruby I.; Olsen, Carl E. και άλλοι. (1994). «Dinitrogen Pentoxide-Sulfur Dioxide, a New nitrate ion system». Acta Chemica Scandinavica 48: 181. doi:.
- ↑ Ono, Noboru; Murashima, Takashi; Nishi, Keiji; Nakamoto, Ken-Ichi; Kato, Atsushi; Tamai, Ryuji; Uno, Hidemitsu (2002). «Preparation of Novel Heteroisoindoles from nitropyridines and Nitropyridones». Heterocycles 58: 301. doi:.
- ↑ Duffy, Joseph L.; Laali, Kenneth K. (1991). «Aprotic Nitration (NO+
2BF−
4) of 2-Halo- and 2,6-Dihalopyridines and Transfer-Nitration Chemistry of Their N-Nitropyridinium Cations». The Journal of Organic Chemistry 56 (9): 3006. doi:. - ↑ Joule, p. 126
- ↑ Gabriel, S. (1882). «Note on nicotinic acid from pyridine». Berichte der deutschen chemischen Gesellschaft 15: 834. doi:.
- ↑ Möller, Ernst Friedrich; Birkofer, Leonhard (1942). «Konstitutionsspezifität der Nicotinsäure als Wuchsstoff bei Proteus vulgaris und Streptobacterium plantarum [Constitutional specificity of nicotinic acid as a growth factor in Proteus vulgaris and Streptobacterium plantarum]». Berichte der deutschen chemischen Gesellschaft (A and B Series) 75 (9): 1108. doi:.
- ↑ Joule, p. 130
- ↑ Davies, D. T. (1992). Aromatic Heterocyclic Chemistry. Oxford University Press. ISBN 0-19-855660-8.
- ↑ Joule, p. 133
- ↑ Shreve, R. Norris; Riechers, E. H.; Rubenkoenig, Harry; Goodman, A. H. (1940). «Amination in the Heterocyclic Series by Sodium amide». Industrial & Engineering Chemistry 32 (2): 173. doi:.
- ↑ Badger, G· Sasse, W (1963). «The Action of Metal Catalysts on Pyridines». Advances in Heterocyclic Chemistry. Advances in Heterocyclic Chemistry. 2. σελ. 179. ISBN 9780120206025.
- ↑ Sasse, W. H. F. (1966). «2,2′-bipyridine». Organic Syntheses 46: 5–8. doi:. ISBN 0471264229. http://www.orgsyn.org/orgsyn/pdfs/CV5P0102.pdf.
- ↑ Joule, pp. 125–141
- ↑ Burrows, George H.; King, Louis A. (1935). «The Free Energy Change that Accompanies Hydrogenation of pyridines to piperidines». Journal of the American Chemical Society 57 (10): 1789. doi:.
- ↑ Cox, J. D.; Pilcher, G. (1970). Thermochemistry of Organic and Organometallic Compounds. New York: Academic Press, σελ. 1–636. ISBN 0-12-194350-X.
- ↑ Tanner, Dennis D.; Yang, Chi Ming (1993). «On the structure and mechanism of formation of the Lansbury reagent, lithium tetrakis(N-dihydropyridyl) aluminate». The Journal of Organic Chemistry 58 (7): 1840. doi:.
- ↑ De Koning, A.; Budzelaar, P. H. M.; Boersma, J.; Van Der Kerk, G. J. M. (1980). «Specific and selective reduction of aromatic nitrogen heterocycles with the bis-pyridine complexes of bis(1,4-dihydro-1-pyridyl)zinc and bis(1,4-dihydro-1-pyridyl)magnesium». Journal of Organometallic Chemistry 199 (2): 153. doi:.
- ↑ Ferles, M. (1959).
- ↑ «Pyridine's Development in China». AgroChemEx. 11 Μαΐου 2010.
- ↑ «About Vertellus». vertellus.com.
- ↑ «Environmental and health criteria for paraquat and diquat». Geneva: World Health Organization. 1984.
- ↑ Sherman, A. R. (2004). «Encyclopedia of Reagents for Organic Synthesis». Στο: Paquette, L., επιμ. e-EROS (Encyclopedia of Reagents for Organic Synthesis). New York: J. Wiley & Sons. doi:. ISBN 0471936235.
- ↑ Terry, C. E.· Ryan, R. P. Toxicology Desk Reference: The Toxic Exposure & Medical Monitoring Index: The Toxic Exposure and Medical Monitoring Index (5th έκδοση). Taylor & Francis. σελ. 1062. ISBN 1-56032-795-2.
- ↑ Täufel, A.· Ternes, W. (2005). Lebensmittel-Lexikon (4th έκδοση). Behr. σελ. 218. ISBN 3-89947-165-2.
- ↑ «Wasserbestimmung mit Karl-Fischer-Titration» [Water analysis with the Karl Fischer titration] (PDF). Jena University.
- ↑ Πρότυπο:Ullmann
- ↑ Corey, E. J.; Suggs, W. (1975). «Pyridinium Chlorochromate. An Efficient Reagent for Oxidation of Primary and Secondary Alcohols to Carbonyl Compounds». Tetrahedron Letters 16 (31): 2647–2650. doi:.
- ↑ Agarwal, S; Tiwari, H. P.; Sharma, J. P. (1990). «Pyridinium Chlorochromate: an Improved Method for its Synthesis and use of Anhydrous acetic acid as catalyst for oxidation reactions». Tetrahedron 46 (12): 4417–4420. doi:.
- ↑ Cornforth, R. H.; Cornforth, J. W.; Popjak, G. (1962). «Preparation of R- and S-mevalonolactones». Tetrahedron 18 (12): 1351–1354. doi:.
- ↑ Collins, J. C.; Hess, W. W.; Frank, F. J. (1968). «Dipyridine-chromium(VI) oxide oxidation of alcohols in dichloromethane». Tetrahedron Lett. 9 (30): 3363–3366. doi:.
- ↑ Collins, J. C.; Hess, W. W. (1988), «Aldehydes from Primary Alcohols by Oxidation with Chromium Trioxide: Heptanal», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv6p0644; Coll. Vol. 6: 644
- ↑ Tojo, G.· Fernandez, M. (2006). Oxidation of alcohols to aldehydes and ketones: a guide to current common practice. New York: Springer. σελίδες 28, 29, 86. ISBN 0-387-23607-4.
- ↑ Bamford, C. H.· Tipper, C. F. H (1980). Comprehensive Chemical Kinetics: Non-radical Polymerisation. Amsterdam: Elsevier. ISBN 0-444-41252-2.
- ↑ Hopper, A. V. (2007). Recent Developments in Polymer Research. Nova Science. ISBN 1-60021-346-4.
- ↑ Crabtree, Robert (1979). «Iridium compounds in catalysis». Accounts of Chemical Research 12 (9): 331. doi:.
- ↑ Πρότυπο:GESTIS
- ↑ «Database of the (EPA)». U.S. Environmental Protection Agency.
- ↑ «Pyridine MSDS» (PDF). Alfa Aesar. Ανακτήθηκε στις 3 Ιουνίου 2010.
- ↑ Aylward, G (2008). SI Chemical Data (6th έκδοση). ISBN 978-0-470-81638-7.
- ↑ «Pyridine» (PDF). IARC Monographs 77. Washington DC: OSHA. 1985.
- ↑ International Agency for Research on Cancer (IARC) (22 Αυγούστου 2000). «Pyridine Summary & Evaluation». IARC Summaries & Evaluations. IPCS INCHEM. Ανακτήθηκε στις 17 Ιανουαρίου 2007.
- ↑ Bonnard, N.· Brondeau, M. T.· Miraval, S.· Pillière, F.· Protois, J. C.· Schneider, O. «Pyridine» (PDF). Fiche Toxicologique (στα French). INRS.
- ↑ Sims, G. K.; O'Loughlin, E. J. (1989). «Degradation of pyridines in the environment». CRC Critical Reviews in Environmental Control 19 (4): 309–340. doi:.
- ↑ Sims, G. K.; Sommers, L.E. (1986). «Biodegradation of pyridine derivatives in soil suspensions». Environmental Toxicology and Chemistry 5 (6): 503–509. doi:.
- ↑ Sims, G. K.; O'Loughlin, E.J. (1992). «Riboflavin production during growth of Micrococcus luteus on pyridine». Applied and Environmental Microbiology 58 (10): 3423–3425. PMID 16348793.
- ↑ Bi, E.; Schmidt, T. C.; Haderlein, S. B. (2006). «Sorption of heterocyclic organic compounds to reference soils: column studies for process identification». Environ Sci Technol 40 (19): 5962–5970. doi:. PMID 17051786.
- ↑ O'Loughlin, E. J; Traina, S. J.; Sims, G. K. (2000). «Effects of sorption on the biodegradation of 2-methylpyridine in aqueous suspensions of reference clay minerals». Environmental Toxicology and Chemistry 19 (9): 2168–2174. doi:.
- ↑ Junk, G. A.; Ford, C. S. (1980). «A review of organic emissions from selected combustion processes». Chemosphere 9 (4): 187. doi:.
- ↑ Hawthorne, Steven B.; Sievers, Robert E. (1984). «Emissions of organic air pollutants from shale oil wastewaters». Environmental Science & Technology 18 (6): 483. doi:. Bibcode: 1984EnST...18..483H.
- ↑ Stuermer, Daniel H.; Ng, Douglas J.; Morris, Clarence J. (1982). «Organic contaminants in groundwater near to underground coal gasification site in northeastern Wyoming». Environmental Science & Technology 16 (9): 582. doi:. Bibcode: 1982EnST...16..582S.
- ↑ National Occupational Exposure Survey 1981–83. Cincinnati, OH: Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occuptional Safety and Health.
| ||||||||||||||
| Στο λήμμα αυτό έχει ενσωματωθεί κείμενο από το λήμμα Pyridine της Αγγλικής Βικιπαίδειας, η οποία διανέμεται υπό την GNU FDL και την CC-BY-SA 4.0. (ιστορικό/συντάκτες). |
| Στο λήμμα αυτό έχει ενσωματωθεί κείμενο από το λήμμα Pyridin της Γερμανικής Βικιπαίδειας, η οποία διανέμεται υπό την GNU FDL και την CC-BY-SA 4.0. (ιστορικό/συντάκτες). |





![{\displaystyle \mathrm {2PyCH_{2}R+O_{2}{\xrightarrow[{\triangle }]{V_{2}O_{5}}}2PyH+2RCHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/62677e9ed6776042539397aeee38455afda70ca6)
![{\displaystyle \mathrm {2PyCH_{2}R+H_{2}O{\xrightarrow[{\triangle }]{Ni}}PyH+RCH_{2}OH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa26a945d602155da8c0dd56312ee8e2392d04ca)
![{\displaystyle \mathrm {2PyR+H_{2}{\xrightarrow[{\triangle }]{Ag\ {\acute {\eta }}\ Pt}}PyH+RH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5d27a54675a8d5094b475c6ec8c72f47baaa85e4)
