Μαλτάση: Διαφορά μεταξύ των αναθεωρήσεων
μ αφαιρέθηκε η Κατηγορία:Βιοχημεία (με το HotCat) |
Χωρίς σύνοψη επεξεργασίας |
||
| Γραμμή 11: | Γραμμή 11: | ||
* L. Sim, R. Quezada-Calvillo, E. E. Sterchi, B. L. Nichols, D. R. Rose, ''Human intestinal maltase-glucoamylase: crystal structure of the N-terminal catalytic subunit and basis of inhibition and substrate specificity'', J. Mol. Biol. 2008, '''375''', 782-792. |
* L. Sim, R. Quezada-Calvillo, E. E. Sterchi, B. L. Nichols, D. R. Rose, ''Human intestinal maltase-glucoamylase: crystal structure of the N-terminal catalytic subunit and basis of inhibition and substrate specificity'', J. Mol. Biol. 2008, '''375''', 782-792. |
||
{{Μαλτάση}} |
|||
[[Κατηγορία:Ένζυμα]] |
[[Κατηγορία:Ένζυμα]] |
||
Έκδοση από την 13:09, 2 Αυγούστου 2013

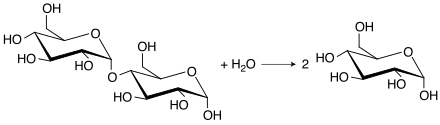
Η μαλτάση είναι ένα ένζυμο το οποίο διασπά τον δισακχαρίτη μαλτόζη σε δύο μόρια γλυκόζης. Από λειτουργικής άποψης ανήκει στις α-γλυκοσιδάσες, μια οικογένεια ενζύμων που υδρολύουν τον α(1→4) γλυκοζιτικό δεσμό ολιγοσακχαριτών και πολυσακχαριτών απελευθερώνοντας α-D-γλυκόζη. Η ονομασία «μαλτάση» αναφέρεται συγκεκριμένα σε ένα είδος α-γλυκοσιδάσης που επιδρά αποκλειστικά σε μαλτόζη και όχι σε μεγαλύτερα σάκχαρα.
Μαλτάσες απαντώνται τόσο σε ζωικούς όσο και σε φυτικούς οργανισμούς. Στα φυτά η μαλτάση συμμετέχει σε διεργασίες ωρίμανσης των καρπών, αυξάνοντας την περιεκτικότητα σε γλυκόζη κατά τα τελικά στάδια της ωρίμανσης. Στον άνθρωπο η μαλτάση (αναφερόμενη συνήθως ως μαλτάση-γλυκοαμυλάση ή MGAM) εκκρίνεται από το λεπτό έντερο και είναι βασικός παράγοντας για την τελική διατροφική αξιοποίηση του αμύλου.
Πηγές
- L. Stryer, Βιοχημεία, Πανεπιστημιακές Εκδόσεις Κρήτης, 1997.
- L. Sim, R. Quezada-Calvillo, E. E. Sterchi, B. L. Nichols, D. R. Rose, Human intestinal maltase-glucoamylase: crystal structure of the N-terminal catalytic subunit and basis of inhibition and substrate specificity, J. Mol. Biol. 2008, 375, 782-792.